脂质的膜内/膜间转运
缩写列表
- ABC ATP 结合盒
- BMP 双(单酰基甘油)磷酸盐
- Cer 神经酰胺
- cER 皮质内质网
- CERT 神经酰胺转运蛋白
- DAG 二酰基甘油
- ER 内质网FFAT 酸性束中的两种苯丙氨酸
- GSL 糖鞘脂
- LD 脂滴
- LE 晚期内体
- LTP 脂质转移蛋白
- MCS 膜接触位点
- OSBP 氧固醇结合蛋白
- PA 磷脂酸
- PC 磷脂酰胆碱
- PE 磷脂酰乙醇胺
- PH 普列克底物同源物
- PI 磷脂酰肌醇
- PIPs磷脂酰肌醇多磷酸盐
- PM 质膜
- PS 磷脂酰丝氨酸
- SM 鞘磷脂
- StAR 类固醇生成急性调节蛋白
- TAG 三酰甘油
- TGN 反式高尔基网络
1. 简介
脂质的非极性脂肪酰基链在水溶液中表现出强烈的自缔合倾向,从而形成超分子结构,例如膜,形成阻挡极性溶质的屏障(见第 1 章)。封闭膜环境的进化使得早期的原核细胞能够将其内部内容与外部环境隔离开来,从而形成一个适合进行生化过程(如核酸复制和代谢反应)的隔间。真核细胞中也存在同样的原理,将必需的亚细胞功能划分为膜结合细胞器 [1,2]。
真核细胞膜组装所需的脂质在内质网 (ER) 中合成,并从那里运输到适当的细胞器目的地。由于这些生物合成和运输途径,每个细胞器都有独特的脂质组成,以最佳地支持其功能。例如,高等真核细胞的质膜 (PM) 富含胆固醇,这对生物物理特性和PM 的屏障、运输和信号转导功能。此外,PM 表现出高度的跨双层不对称性。内膜小叶富含磷脂酰乙醇胺 (PE) 和带负电荷的磷脂酰丝氨酸 (PS),它们在蛋白质靶向 PM 中起着至关重要的作用,当暴露在外膜小叶上时,会发出血液凝固 (在血小板中) 或用于清除凋亡细胞。相反,PM 的外层富含磷脂酰胆碱 (PC)、鞘脂和胆固醇。晚期内体 (LE) 的内膜富 bis(monoacylglycero) phosphate (BMP),又称lyso-bisphosphatidic acid,是一种促进 LE/溶酶体水解功能的脂质。另一个例子是,线粒体内膜 (MIM) 含有丰富的心磷脂,在氧化能量代谢中起着关键作用。总而言之,脂质在细胞中分布不对称,既存在于不同的细胞器之间,也存在于生物膜的两个小叶之间,这对于细胞功能和生存至关重要。
真核细胞内脂质的不对称分布是如何产生的,是细胞生物学的一个关键课题。原则上,膜脂不对称可以通过两种机制产生:(i)在特定区室或膜小叶中合成脂质,然后将其运输到适当的靶细胞器或膜小叶;(ii)局部合成或酶促修饰脂质在细胞器或膜小叶中富集。已知这两种原理在维持细胞器膜的独特脂质组成方面发挥着至关重要的作用。
细胞器间脂质运输可以通过四种不同的机制进行(图 14.1): 1. 囊泡或管状膜载体结构;2.供体和受体膜的瞬时融合或半融合; 3. 载体膜间和膜内脂质运输蛋白质(脂质转移蛋白,LTP)在疏水腔内结合来自供体的脂质底物膜并将结合的脂质输送到受体细胞器;4. 通过水空间自发扩散。
在细胞器间脂质运输的背景下,过去十年中得到广泛认可的一个重要概念是膜接触位点( membrane contact sites,MCS) ,此时两个细胞器限制膜紧密接触彼此无需进行融合或半融合。MCS 处两个膜的紧密接近极大地促进了 LTP 介导的脂质转移,也促进了脂质的自发扩散。
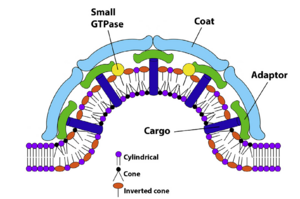
为了通过囊泡或管状载体结构从一个细胞器选择性地运输到另一个细胞器,需要对适当的脂质货物进行分类以便在供体隔室中运输。从供体膜产生此类载体涉及形成富含要运输的货物分子的芽。当发出的载体囊泡与其特定目标隔室融合时,它们会将其相关的蛋白质和脂质货物运送到受体膜 [3]。脂质分选的机械原理已得到广泛研究。在某些情况下,蛋白质脂质相互作用可以驱动脂质的分类,而另一种主要机制涉及脂质之间的生物物理力:形成芽的曲率可以根据其头部基团和酰基链几何形状(锥形或倒锥形;图 14.2)有利于某些类型的脂质。
图 14.2 囊泡形成中的脂质形状和膜曲率。倒锥形脂质,如溶血脂质(橙色),优先容纳在正曲率区域,即囊泡芽的细胞质小叶和正在形成的囊泡颈部的腔小叶中。锥形脂质,如 PE 和 DAG(黑色),集中在囊泡芽的腔小叶和囊泡颈部区域的细胞质小叶中的负曲率区域。囊泡形成由小 GTPase、外壳蛋白复合物和与货物分子相互作用的适配器控制。
此外,某些类型的脂质相互聚集,例如胆固醇和具有饱和脂肪酰基链的鞘脂,可以促进横向组织的脂质域的形成,这在脂质分类中发挥作用。此类域似乎是纳米级的(脂质纳米域)和动态(毫秒级)。细胞持续参与强大的胞外和胞吞囊泡运输,大量脂质通过这些膜通量从一个细胞器移动到另一个细胞器(图 14.3)。一个关键问题是分泌和内吞途径细胞器如何维持其脂质组成仍然不同,尽管管状运输载体进行广泛的脂质通量。
在细胞中,可以发现细胞器之间的脂质浓度梯度 [1]。胆固醇和鞘脂的浓度从 ER 逐渐增加到高尔基体,再到 PM,其中胆固醇通常占总脂质的 30-40 mol%。这是由于 LTP 介导的胆固醇从其在 ER 中的合成位点到高尔基体的运输,其在分泌途径运输囊泡中的富集以及其在 PM 中的保留。鞘脂的梯度主要来自将鞘脂前体神经酰胺 (Cer) 转化为鞘磷脂 (SM) 和复合糖鞘脂 (GSL) 的酶的特定亚细胞分布(见第 9 章)。早期和循环内体都富含 PS、胆固醇和 SM,其脂质组成与 PM 相似,而 LE 在其内膜中显示出 BMP 的富集,这对其水解功能至关重要。 BMP 刺激胆固醇从内膜流出,从而降低其侧压【lateral pressure??】并使其更容易降解。此外,BMP 在溶酶体的酸性 pH 下带负电荷,这些负电荷促进可溶的带正电荷的水解酶和脂质激活蛋白的粘附,使它们能够降解溶酶体内膜的脂质 [4]。
LE 和溶酶体在水解作为内吞小泡一部分内化的 PM 脂质和从细胞表面内吞的脂蛋白脂质方面发挥重要作用。内化的膜脂质大部分通过内吞循环途径循环到细胞表面,而要降解的货物则进入晚期内吞区(图 14.3)。胆固醇酯(CE)、三酰甘油(TAG)、鞘脂和甘油磷脂水解后,释放出的胆固醇、脂肪酸和其他水解产物需要运输出LE/溶酶体,以便进一步利用e 由细胞产生。最近的观察表明,不仅运输囊泡,而且 LE/溶酶体与 ER、线粒体和过氧化物酶体形成的 MCS 也在这些细胞器之间的脂质流动中发挥关键作用。
脂质在确定细胞器的功能特性方面起着关键作用。在这种情况下,最重要的脂质类别之一是磷脂酰肌醇多磷酸盐 (PIP),其中有七个亚类(见第 7 章)。这些脂质由磷脂酰肌醇 (PI) 的特定激酶合成,磷脂酰肌醇从其在 ER 中的合成位点运输到其他膜 [5]。PI 激酶显示细胞器特异性定位,导致产生的 PIP 在细胞器中分布特定。例如,磷脂酰肌醇 4,5-二磷酸酯,PI(4,5)P2,在 PM 中含量最丰富,磷脂酰肌醇 4-磷酸酯 (PI4P) 存在于高尔基体中,磷脂酰肌醇 3-磷酸酯 (PI3P) 存在于早期内体中,磷脂酰肌醇 3,5-二磷酸酯 (PI(3,5)
P2) 存在于 LE 中。PIP 可作为酶、LTP、介导囊泡运输的蛋白质和对细胞器功能至关重要的信号传导成分的结合标签。
此外,PM 中的 PI(4,5)P2 是许多信号级联中第二信使的前体,包括肌醇 3,4,5-三磷酸 (IP3) 和二酰甘油 (DAG),以及 PM 中一种关键信号脂质 PI(3,4,5)P3。一旦 PIP 物种发挥其功能或由于 LTP 或囊泡运输而在细胞器中积累,它们就会通过特异性磷酸酶水解去除。此外,细胞器特异性 PIP 合成、运输和水解为其他脂质在 MCS 上的定向运输提供能量。 2. 细胞内脂质运输方式
2.1 脂质的囊泡运输
亚细胞器之间蛋白质运输的主要部分是通过囊泡或管状载体结构进行的,这些结构从供体隔室中萌发,沿着细胞骨架轨道穿过细胞质,并与靶细胞或受体细胞器融合。这些运输载体是膜状载体,根据定义,它们携带大量脂质。不同类型的脂质通常富集在形成的囊泡中,并在将蛋白质货物分类到囊泡中、募集囊泡运输机制的细胞质蛋白质以及修改膜曲率以产生囊泡芽方面发挥积极作用[3,6e8]。此外,脂质横向分离到不同的域中介导蛋白质和脂质都分类到形成的囊泡中[9,10]。囊泡运输的主要细胞途径是 (i) 从 ER 到高尔基体再到 PM 的分泌途径,以及从高尔基体到内体的分支,以及 (ii) 从 PM 到早期内体、LE 和溶酶体的内吞途径,以及从内体到高尔基体的分支(图 14.3)。对于囊泡运输分子机制和细胞器膜脂质成分的回收,在分泌途径和内吞途径中都有回收途径。
囊泡运输路线上的脂质流量很好地说明了脂质从 PM 内化的 t1/2 为 5e10 分钟,大约一半的内化脂质被回收回 PM,t1/2 为 1.5 分钟 [11]。这有助于保持 PM 独特的脂质组成,尽管细胞表面成分被大量内吞吸收。在分泌途径中,ER 形成入口站,大多数细胞脂质在此合成,包括甘油磷脂、
Cer、固醇、固醇酯和 TAG。与反高尔基体和 PM 脂质双层相比,ER 膜相对较薄且
流动性强,由于从 ER 运输的胆固醇的积累以及鞘脂的合成和富集,反高尔基体和 PM 脂质双层更厚且更坚硬。
为什么从高尔基体到 ER 的主动回收/逆向运输(图 14.3)不会消除这些隔室中膜脂质组成的差异?在哺乳动物细胞中,逆向高尔基体到 ER 的膜间和膜内脂质运输第 | 14 463 被 COPI 蛋白复合物包裹的运输囊泡所含的胆固醇和鞘脂明显少于高尔基膜 [12],这有助于维持细胞内胆固醇/鞘脂浓度梯度。相反,对酵母 ER 至高尔基 COPII 囊泡的脂质组分析表明,主要甘油磷脂 PC、PE 和 PI 的浓度与 ER 中的浓度相似,表明这些脂质在 ER 中形成的运输囊泡中以非选择性大量流动 [8]。ER 是酵母和哺乳动物细胞中这些脂质的合成位点,而 Cer 和固醇的浓度在 ER 中仍然很低,这反映了有效、选择性地从 ER 输出。重要的是,脂质从 ER 输出通过囊泡和非囊泡机制进行。在哺乳动物中,非囊泡途径在 Cer 和胆固醇的 ER 输出中占主导地位 [13,14],从而协助大量囊泡脂质流动以维持胆固醇/鞘脂梯度。
2.2 非囊泡脂质运输
众所周知,非囊泡机制在脂质的细胞器间运输中起主要作用 [3]。解释这种脂质运输模式的机制是:(i)供体和受体膜的瞬时融合或半融合;(ii)LTP 要么在疏水腔内结合脂质底物并将结合的脂质运送到受体细胞器,要么在膜之间架桥并介导脂质通过疏水沟或隧道转移;(iii)通过水性胞质溶胶的自发扩散(图 14.1)。重要的是,供体膜和受体膜的紧密贴合大大加速了 LTP 介导的转移和脂质的自发扩散,使 MCS 成为非囊泡脂质转移位点的主要候选者。非囊泡脂质转移的关键作用最初是通过采用遗传或药理学方法来特异性抑制囊泡运输的实验证明的,这些实验仅部分抑制了甘油磷脂、Cer 或固醇的运输 [15e19]。值得注意的是,准确评估囊泡和非囊泡机制对特定脂质运输过程的相对贡献具有挑战性,因为抑制一种运输方式可能会刺激另一种运输方式。目前,脂质运输中瞬时膜半融合或融合的证据很少。神经元中,突触囊泡与膜未完全融合时,瞬时融合孔就会打开,而“闪烁”融合孔经常先于运输囊泡与其目标膜完全融合。
此外,有证据表明,涉及脂质混合的双层半融合不仅在突触囊泡循环中作为中间步骤发生,而且在其他膜重塑过程(如病毒膜融合)中也发生 [20]。
然而,这些融合过程对细胞器间脂质运输的净贡献仍不清楚。
464
2.3 脂质的自发扩散
膜间脂质的自发扩散受到供体膜上脂质解吸速率的限制。因此,对于含有长链脂肪酸的物种,这种转移方式的重要性可能可以忽略不计。另一方面,有报告显示,细胞器间脂质转移系统地依赖于脂肪酰基部分的长度和饱和度;链较短且不饱和度较高的物种在膜间移动的速度比链较长且饱和度较高的物种更快。该主题在 PS 向线粒体的运输中得到了最广泛的研究,其中每个额外的双键都会使 PS 转移速率提高 w5 倍 [21,22]。这些观察结果支持以下观点:自发扩散可能提供细胞内脂质转移的机制,特别是在 PS 从 ER 转移到线粒体时,其 t1/2 为数小时 [23]。然而,更高的脂质从膜上解吸速率也可能促进它们进入 LTP 的脂质结合口袋,正如细胞内脂质转移蛋白非特异性 LTP/固醇载体蛋白 2 (nsLTP/SCP2) [24] 和细胞外磷脂转移蛋白 (PLTP) [25] 所显示的那样。这些 LTP 对脂质转移的增强作用在具有更高自发膜解吸速率的脂质中成比例地更大。在大多数情况下,自发扩散在脂质转移中的贡献仍然是一个未解之谜。
2.4 脂质转移蛋白
目前,已在不同的分类群中鉴定出 27 个假定的 LTP 家族;
人类基因组编码 19 个 LTP 家族,由 150 多个成员组成
[26]。相比之下,人类 Rab GTPases 家族协调囊泡运输,拥有 66 个成员 [27,28]。传统上,LTP 被定义为脂质载体蛋白,其含有疏水口袋,能够容纳脂质分子并将其从一个细胞器膜转移到另一个细胞器膜。LTP 的脂质结合口袋通常被柔性盖子覆盖,该盖子将结合配体与水环境隔离开来(图 14.1)。盖子还可以改变构象,以允许脂质配体在遇到特定膜表面时进入和退出。含有口袋的 LTP 家族的例子有氧固醇结合蛋白 (OSBP) 及其同源物,称为 OSBP 相关 (ORP) 或 OSBP 样 (OSBPL) 蛋白 [29,30]、类固醇生成急性调节蛋白样 (StARkin) 超家族 [26] 和磷脂酰肌醇转移蛋白 (PITP) [31,32]。除了脂质箱除了口袋之外,OSBP/ORP 家族蛋白还含有酸性束 (FFAT) 基序中的两个苯丙氨酸,该基序介导与 VAMP 相关蛋白 (VAP) 的相互作用,VAP 是 ER 的 II 型跨膜蛋白,可将许多 LTP 锚定在 MCS [33,34]。OSBP/ORP 家族成员还含有 pleckstrin 同源性 (PH) 结构域,可结合靶细胞器上的 PIP。这种膜结合基序的组合允许 OSBP/ORP 逆浓度梯度转移胆固醇或 PS,方法是采用 PIP 的“逆流”转移,这一过程通常发生在 MCS 上(详情见第 2.5 节)。然而,OSBP/ORP 家族在人类中由 12 个成员组成,并且尚未鉴定出所有成员的脂质配体。因此,它们可能比上面提到的具有更多的底物。
StARkin 蛋白包含一个由 15 个成员组成的大家族,它们结合各种脂质配体,包括胆固醇、神经酰胺、PC、PS 和磷脂酸 (PA),它们以特定的方式在细胞器膜之间转移,并且对于几个家族成员而言,它们还跨 MCS 转移。除其他外,StARkin 超家族包含神经酰胺转移蛋白 (CERT),它将 Cer 从 ER 转移到反高尔基体以合成 SM (图 14.4)、下面讨论的 PITP、在以下方面发挥关键作用的 StARD1
图 14.4 膜小叶特异性鞘脂合成和运输。
神经酰胺 (Cer) 在内质网 (ER) 中从头合成,通过 SMases 水解鞘磷脂 (SM) 或通过补救途径合成,在该途径中,鞘脂分解时释放的鞘氨醇被重新酰化以形成 Cer(未在图像中显示)。Cer 通过囊泡载体运输到顺式高尔基体,在那里通过 UDP-葡萄糖神经酰胺葡萄糖基转移酶 (UGCG) 转化为葡萄糖神经酰胺 (GlcCer)。GlcCer 需要跨双层运动进入管腔小叶,才能转化为乳糖神经酰胺 (LacCer),并进一步转化为高尔基体管腔小叶中的神经节苷脂 (GSL-Ga)。四磷酸盐衔接蛋白 2 (FAPP2) 是一种 LTP,可将 GlcCer 在高尔基体中转移到位点,在此将其转化为球形 (GSL-Gl) 和脱唾液酸 (GSL-asial) 系列糖鞘脂。值得注意的是,Cer 还通过神经酰胺转运蛋白 (CERT) 直接从 ER 跨膜接触位点运输到 TGN,然后由 SM 合酶 1 (SMS1) 转化为 SM,随后由 PM 中的 SMS2 转化为 SM。胆固醇转运到 MIM 进行类固醇激素合成 [35],据报道,StARD3 介导胆固醇从 ER 经 MCS 转运到内体 [36] 以及最近发现的属于 LAM/GramD/Aster 家族的固醇转运蛋白 [37,38]。 PITP 对细胞器特异性 PI
激酶合成 PIP 至关重要,因此对建立细胞器身份、脂质转运活性和
信号传导至关重要。其中,I 类 PITP、PITPa (PITPNA) 和 PITPb (PITPNB)
将 PI 从 ER 转移到高尔基体和 PM,或将 PI 呈递给位于这些隔室中的 PI
激酶 [32]。PITP 结合 PI 时极性头部基团朝向配体结合口袋的底部,这与经典 LTP 的方向相反,后者结合脂质时头部基团位于疏水口袋的口部。值得注意的是,哺乳动物 II 类 PITP、Nir2 (PITPNM1) 和 Nir3 (PITPNM2) 以及 CERT 具有 FFAT
结构域,可促进与 ER 中的 VAP 结合。有趣的是,通过囊泡或 LTP 介导途径的脂质运输可能导致不同的代谢结果。GlcCer 通过囊泡途径在高尔基体中转运会导致其转化为 LacCer 和神经节系列 GSL,而 GlcCer 通过 LTP FAPP2(属于糖脂转移蛋白家族,GLTP)在高尔基体内的转移会产生球状和脱唾液酸系列 GSL [39] (图 14.4)。
除了上面描述的袋状配体腔外,一些 LTP 还具有疏水凹槽或接缝,脂质的疏水部分可以沿着该凹槽或接缝滑动,或者可以引导脂质流动的通道(图 14.5)。这些
图 14.5 革兰氏阴性细菌的脂多糖 (LPS) 转运 (Lpt) 复合物。 Lpt 操纵子 (LptA-G) 编码的蛋白质标记为 A 到 G。LPS 通过周质空间从细菌内膜运输到外膜,其机制涉及由二聚体 LptB 的 ATP 水解驱动从内膜初步提取 LPS。然后,LPS 的疏水脂肪酰基链沿着由 LptC、A 和 D/E 形成的疏水凹槽滑动,直到沉积在外膜中。
膜间和膜内脂质运输第 14 章 467
后一种类型的 LTP 被认为是物理连接两个膜,从而允许脂质从一个膜流到另一个膜。在原核生物中发现了这些桥接 LTP 功能的最有力证据。在革兰氏阴性细菌中,脂多糖 (LPS) 转运 (Lpt) 操纵子编码一组蛋白质,这些蛋白质形成横跨细菌内膜和外膜之间周质空间 (15e33 nm) 的桥梁 [40]。在亚基中,LptA 在内部疏水表面上有一个 U 形折叠,当 LPS 的脂质尾从内膜转移到外膜时,它显然可以保护它们 (图 14.5)。在真核生物中,管状脂质结合结构域 (TULIP) 蛋白被认为形成多聚体、桥状复合物,具有疏水通道或沟槽,脂质可以沿着该通道在膜之间移动。大型 TULIP 蛋白家族的成员存在于细胞内和细胞外。细胞内成员包括在 ER-线粒体接触处起作用的酵母 ER-线粒体相遇结构 (ERMES) 成分和 Tricalbins 1e3 (Tcb1-3),在哺乳动物中被称为延伸突触结合蛋白 (E-Syt),它在 ER 和 PM 之间转移一系列甘油脂 [26]。ERMES 和 E-Syt 蛋白的特点是具有脂质结合结构域,称为突触结合蛋白样线粒体脂质结合蛋白 (SMP) 结构域。然而,缺乏这些蛋白质桥状功能模式的有力证据,它们也可能通过穿梭机制起作用。最近的证据表明,酵母和人类的液泡蛋白分选 13 (VPS13) 蛋白也采用棒状结构,并含有具有转移脂质能力的管状氨基末端结构域。人类 VPS13 蛋白与 ER 结合并将其与线粒体、LE/溶酶体和脂滴 (LD) 连接,表明其在这些亚细胞区室之间脂质运输中发挥作用 [41]。
2.5 膜接触位点
MCS 被定义为两个紧密相邻的细胞器限制膜,通常为 10e30 纳米。由于存在维持接触的特定系链蛋白组件,这些位点显示出膜之间的均匀间距 [42]。ER 是最大的内膜系统,参与大多数 MCS,与高尔基体、线粒体、PM、内体和过氧化物酶体形成直接接触(图 14.3)。 MCS 也存在于非内质网细胞器之间,例如酵母液泡和线粒体之间(液泡和线粒体贴片或 vCLAMP)或过氧化物酶体和液泡/溶酶体之间。此外,还有三种细胞器相互作用的三向 MCS,如酵母中的 ER、LD 和液泡所示 [43]。MCS 也可以发生在同一细胞器的两个区域之间(细胞器内 MCS)或同一细胞器内的两种膜之间,例如线粒体和叶绿体的内膜和外膜。第一个被表征的 MCS 是 ER-线粒体接触,最初被称为线粒体相关膜 (MAM),它在脂质合成和向线粒体的转移以及 Ca2+ 离子从 ER 到线粒体的传导中起关键作用 [44,45]。另一种与脂质运输相关的 MCS 是酵母 PM 相关膜,代表皮质 ER (cER),其中定位了多种脂质合成酶和 LTP [46]。虽然一些 MCS 是相对稳定的结构,例如酵母中的 cER-PM 接触以及在肌细胞的一生中持续存在的三联体和二联体 ER-PM 连接,但其他 MCS 是高度动态的,持续时间不到 1 秒 [42]。 MCS 大大增加了 LTP 介导的脂质转移速度,因为它缩短了 LTPelipid 复合物到达受体膜所需的扩散距离。事实上,越来越多的证据表明,一些 LTP 同时锚定在 MCS 的两个膜隔室上,这种特性被称为“双膜靶向”,而它们的脂质结合域则经历脂质结合和通过 MCS 裂隙转移的循环(图 14.6)。这种作用模式的主要例子是 OSBP,它通过 OSBP 转移 图 14.6 胆固醇和 PI4P 在 ER-TGN 接触位点之间的逆流运输。OSBP 通过其 FFAT 基序 (F) 与内质网 (ER) 中的 VAP 结合,并通过其 pleckstrin 同源性 (PH) 域与 TGN 中的 PI4P 结合。 OSBP 的 OSBP 相关结构域
(ORD) 结合 ER 中的胆固醇并将其转移到 TGN,在那里它被交换为 PI4P,PI4P 以相反的方向转移。TGN 中的 PI4P 由 PI 4-激酶
(PI4K) 产生,并在 ER 中被磷酸酶 SAC1 水解。PI4P 合成和水解的循环
提供了胆固醇逆浓度梯度移动所需的能量。从 TGN 中去除
PI4P 提供了一种调节机制,因为 PI4P 过度转运到 ER
会抑制 OSBP 的高尔基靶向性。
膜间和膜内脂质转运第章r | 14 469 胆固醇通过 MCS 从 ER 转移到高尔基体网络 (TGN),以交换 PI4P [14],以及神经酰胺转运蛋白 CERT,后者将 Cer 从 ER 转移到高尔基体 [13]。这些蛋白质通过与 VAP 蛋白(酵母中的 Scs2p 和 Scs22p)和高尔基膜相互作用,通过结合 PI4P 的 PH 结构域靶向 ER。值得注意的是,越来越多的案例表明,两种不同的脂质在 MCS 上以相反方向转移,称为“逆流运输”,是激发一种脂质逆细胞内梯度定向运输的机制。例如,OSBP 转移 TGN 中产生的 PI4P,以驱动胆固醇从浓度低的 ER 运输到浓度高的 TGN [47](图 14.6)。从 TGN 中,胆固醇显然
通过囊泡载体移动到 PM 或被隔离在富含 SM 的区域。
PI4P 在 TGN 中的合成及其在 ER 中的运输后水解
由 PI4P 磷酸酶 SAC1 充当驱动胆固醇向前运输的“能量泵”。类似的逆流运输机制
为 PS 从 ER 到 PM 的转移提供能量,该过程由
ORP5 和 ORP8 介导,它们可以使用 PI4P,也可以使用其他 PIP,例如 PI(4,5)
P2,作为逆流货物 [48,49]。此外,将 PI 从
ER 转移到 PM 的 Nir2 可能会将 PA 转移到相反的方向 [50]。
MCS 功能的一个重要方面是引导脂质在受体区室的酶促反应中立即消耗,
我们将其称为“转移以进行代谢转化”。这一原理的例子有:胆固醇通过类固醇生成急性调节蛋白 (StARD1) 转移到线粒体,再转化为类固醇激素 [35];Cer 通过 CERT 从 ER 转运到反式高尔基膜中的 SM [13,51];PS 在 MAM 处合成,并被引导到线粒体,再转化为 PE [52];PI 从 ER-PM 接触处(在此合成)引导到 PM,再被 PI 激酶转化为 PIP [32]。MCS 在脂质代谢中的另一个功能是提供膜相关酶反式酶促修饰脂质的位点。这发生在 ER 驻留的 SAC1 中,它能够水解 PM 和反高尔基体中的 PI4P [53,54],以及酵母 Opi3p,一种 ER 膜中的磷脂酰乙醇胺 N-甲基转移酶,它能够催化 PE 在 PM 转化为磷脂酰胆碱 [55]。
2.6 通过囊泡和 LTP 进行的脂质运输的合作
低密度脂蛋白 (LDL) 胆固醇进入细胞的途径提供了囊泡和 LTP 介导的脂质运输如何合作的一个例子。通过内吞作用内化后,LDL 衍生的胆固醇酯在 LE/Lys 中的溶酶体酸性脂肪酶 (LAL) 水解为未酯化的胆固醇和脂肪酸(见第 18 章)。未酯化的胆固醇从 LE/Lys 内膜中释放出来,是由内膜脂质 BMP [4] 促成的,之后胆固醇通过两种 NiemannePick C 型 (NPC) 蛋白(管腔 NPC2 和限制膜整合蛋白 NPC1)转运到限制膜。编码这些蛋白质的基因突变会导致致命的常染色体隐性神经内脏疾病,即 NPC 疾病,其特征是未酯化的胆固醇和鞘脂在溶酶体中积累。NPC2 结合胆固醇并将其交给 NPC1 的氨基末端管腔胆固醇结合域。NPC1 被认为通过覆盖溶酶体内表面的糖萼形成通道,结合的胆固醇通过该通道被输送到 LE/Lys 的限制膜 [56]。然而,胆固醇转运到其他亚细胞膜的下一步还不完全清楚 [57,58]。大量文献提供了证据表明,LE/Lys 胆固醇首先到达 PM e 以补充 PM 胆固醇池 e,然后被运输到 ER,负责细胞固醇稳态的固醇传感机制(见第 10 章)和酯化过量胆固醇以储存和解毒为胆固醇脂肪酸酯的酶位于 ER。除了通过 PM 的运输途径外,有证据表明 LDL 胆固醇到 ER 的运输可以通过从 LE 到 TGN 的逆行膜运输介导。胆固醇也可以从 LE/Lys 直接输送到 ER 或通过过氧化物酶体间接输送。重要的是,据报道直接和过氧化物酶体介导的运输途径是通过 MCS 发生的。事实上,有报道称 NPC1 能将 LE/Lys 束缚在 ER 膜上,从而在两个隔室之间形成接触,MCS LTP 通过这种接触转移胆固醇 [59]。ORP1L 是OSBP/ORP LTP 家族中研究最多的成员。
它通过与小 GTPase Rab7 相互作用而靶向 LE,并通过与 VAP 结合而靶向 ER。ORP1L 与 Rab7 和 Rab7 相互作用溶酶体蛋白 (RILP) 形成三部分复合物,后者在 LE/溶酶体上募集动力蛋白动力蛋白复合物,以驱动这些细胞器的微管 () 末端定向运动 [60]。ORP1L 与 VAP 的相互作用对固醇敏感,导致胆固醇耗竭细胞中 ER-LE 或 ER-自噬体接触增加,并依赖固醇调节自噬通量以及 LE 和自噬体定位 [61,62]。
有令人信服的证据表明,ORP1L 也能将胆固醇从 ER 转运到 LE [63,64],当外源性胆固醇供应量较低时,这一功能对于 LE 腔内囊泡的生成非常重要。
另一方面,ORP1L 也被认为能介导胆固醇从 LE 向 ER 的反方向运输 [65,66]。因此,ORP1L 介导的 ER 和 LE 之间胆固醇转移的方向存在争议,实际上可能是双向的,这取决于细胞脂质状态或其他生理条件。值得注意的是,ORP1L ORD 还结合 PI(4,5)P2 和 PI(3,4)P2,它们变构增强了 ORP1L 介导的胆固醇转运。然而,ORP1L 似乎无法转运这些磷酸肌醇 [67],也没有证据表明它作为胆固醇 ePIP 逆流转运体发挥作用。
膜间和膜内脂质运输 第 14 章 471
3. 细胞器相关酶的脂质局部合成及其底物的细胞器间运输
除了选择性的脂质细胞器间运输外,另一种可以维持不同细胞器脂质组成的机制是 ER 以外的细胞器中的局部脂质合成。这方面的例子包括位于高尔基复合体和 PM 的酶合成 SM 和 GSL、LE 中 BMP 的合成以及线粒体中 PE 和心磷脂的合成。此外,不同细胞器膜中 PIP 的局部合成对于生成在细胞信号传导、囊泡运输和细胞脂质代谢中起关键作用的“细胞器身份标签”至关重要。除了细胞器特异性的脂质合成或脂质修饰酶之外,此背景下的其他关键方面包括 (i) 将前体分子或底物脂质运输到酶作用位点和 (ii) 酶活性位点的跨双层定位。例如,如果脂质位于膜的胞质小叶或胞质中,则只有活性位点位于胞质小叶或膜胞质表面的酶才能接触到该脂质。在某些情况下,脂质生物合成途径中的顺序反应发生在膜的不同小叶中,因此需要跨双层膜进行脂质中间体的膜内转移(见第 4 节)。此外,在某些情况下,酶整体锚定在某个膜区室上,但可以跨 MCS 反式作用于位于不同细胞器中的底物(见第 2.5 节)。在本节中,我们将根据四个示例回顾这些机制。
3.1 鞘磷脂和鞘糖脂的细胞器特异性合成
Cer 由棕榈酸和丝氨酸在内质网膜中发生的一系列反应中合成(图 14.4)。尽管如此,酵母和哺乳动物细胞内质网中的 Cer 浓度仍然很低,反映了 Cer 通过囊泡或非囊泡机制从内质网高效输出。在哺乳动物中,非囊泡输出占主导地位 [13]。Cer 由 StARkin 超家族蛋白 CERT 通过 ER-TGN MCS 从内质网转移到 TGN,在那里,它被鞘磷脂合酶 1(SMS1,由 SGMS1 编码)转化为 SM,后者将磷酸胆碱头部基团从 PC 转移到 Cer 的羟基残基上(图 14.4)。这种反应也可以在分泌途径的下游发生,即 PM,它含有另一种 SM 合成酶 SMS2 [68]。GSL 是根据类似的原理从 Cer 合成的:负责将碳水化合物部分从糖核苷酸载体逐步添加到 Cer 或正在生长的 Cer-碳水化合物链的非还原端的酶位于高尔基体和 PM,大部分 GSL 都位于此处 [69]。GSL 的聚糖链最多有 20 个残基,具有各种不同的线性和分支结构(脊椎动物中有 >400 个)(参见第 9 章)。通过囊泡运输从内质网进入顺式高尔基体的 Cer 主要被高尔基体酶 UDP-葡萄糖:神经酰胺葡萄糖基转移酶 (UGCG 或 GLCT1) 转化为简单的 GSL 葡萄糖神经酰胺 (GlcCer)。GlcCer 是更复杂的 GSL 的前体,其中大多数具有乳糖神经酰胺 (葡萄糖半乳糖二糖)其核心结构为 GlcCer 的 β-半乳糖苷酶(附着在 Cer 上的 β-半乳糖苷酶) 。值得注意的是,GlcCer 的合成发生在顺式高尔基体膜的细胞质小叶中,而向 GSL 中添加额外聚糖残基的酶的活性位点位于腔侧。因此,GlcCer 需要通过一种尚不清楚的机制跨膜转位或“翻转”才能合成复杂的 GSL。
3.2 线粒体中 PE 的合成
PE 在细胞中通过两种主要途径合成:(i) 通过 MIM 中的磷脂酰丝氨酸脱羧酶 (PSD) 将 PS 脱羧为 PE,以及 (ii) 通过 Kennedy 途径从头合成(见第 7 章)。后者涉及将乙醇胺磷酸化为磷酸乙醇胺,然后与 CTP 缩合形成 CDP-乙醇胺并与 DAG 反应形成 PE。线粒体途径由 MAM 处 PS 的合成启动,之后 PS 进入线粒体并转移到内膜,在那里通过 PSD 转化为 PE [70]。这种 PE 合成模式对于线粒体功能是必需的,因为部分 PE 仍然是线粒体膜的组成部分。然而,部分线粒体 PE 通过未知机制输出并用于其他细胞膜。值得注意的是,酵母细胞有两种 PSD 亚型,其中一种 (Psd1p) 是线粒体的,而另一种 (Psd2p) 位于高尔基复合体中。因此,细胞 PE 稳态需要 PS 从 ER 到线粒体的运输以及 PE 从线粒体到其他亚细胞膜的转移。这些运输事件最有可能发生在 MAM,但尚未确定所涉及的 LTP。 3.3 PI4P 和 PI(4,5)P2 的合成和分解代谢 PI4P 在高尔基体合成,PI 从 PI 的合成位点输出到 PM(图 14.7)。有四种 PI 激酶 (PI4K) 负责不同亚细胞位置的 PI 磷酸化:PI4KIIa 在 TGN、内体和 PM 中;PI4KIIb 主要在 PM 和网格蛋白包被的囊泡中;PI4KIIIa 在 PM 中,它合成 PI4P 的主要池;PI4KIIIb 在 TGN 中 [71]。PI 从 ER 到高尔基体和 PM 的运输是通过 PI 转移蛋白进行的,其中 PITPa 和 PITPb 属于 StARkin 超家族,可运输 PI 和 PC。第三个 PITP,
膜间和膜内脂质转运 第 14 章 473
图 14.7 磷脂酰肌醇 (PI) 的合成和转运,用于生成
磷脂酰肌醇多磷酸酯 (PIP)。PI 在 ER 中由磷脂酸
(PA) 合成,后者通过 CDP-DAG 合酶 (CDS) 转化为 CDP-二酰甘油 (CDP-DAG)。PI 合酶 (PIS) 产生的 PI 通过 I 类和 II 类 PI
PITP 转运到质膜 (PM),其中至少有一些被假定在 MCS 中发挥作用。在 PM,PI 被 III 型 PI 4-激酶 (PI4KA) 磷酸化为 PI4P。 PI4P 被 PI4P 5-激酶 (PIP5K) 转化为最丰富的 PM PIP,即 PI(4,5)P2。PI(4,5)P2 可被磷脂酶 C (PLC) 水解,生成第二信使二酰甘油 DAG 和 IP3,或进一步磷酸化为关键信号脂质 PI(3,4,5)P3。PI(3,4,5)P3 可被磷酸酶和张力蛋白同源物 (PTEN) 或含有 Src 同源性 2 结构域的肌醇多磷酸 5-磷酸酶 (SHIP) 转化。PLC 产生的 DAG 被 DAG 激酶 (DGK) 磷酸化,生成 PA,PA 被 II 类 PITP Nir2 转运到 ER。在 ER 中,PA 被转化为 CDP-DAG,后者与来自 IP3 的肌醇一起产生 PI,从而完成循环。由 PITPNM1 编码的 Nir2 将 PI 从 ER 转移到 MCS 上的高尔基体和 PM,并被认为以逆流配体的形式将 PA 反向转移 [50]。PI4P 可作为蛋白质与膜结合的标签或作为脂质在 MCS 上运输的逆流货物。重要的是,它还被 PM 中的 PI4P 激酶转化为关键信号脂质 PI(4,5)P2。PI(4,5)P2 还充当介导 F-肌动蛋白动力学和内吞作用的蛋白质机制的标签,或被磷脂酶 C 切割为第二信使 IP3 和 DAG [72]。此外,PI(4,5)P2 被四种不同的 PI 3-激酶进一步磷酸化为 PI(3,4,5)P3,后者是几个信号级联的中心介质。来自 PI 的 PIP 仅位于细胞器膜的细胞质小叶中,催化其合成的激酶的活性位点位于细胞质表面。PI 的头部基团带有负电荷,额外的磷酸化会进一步增加负电荷,从而使 PIP 的自发跨双层运动在热力学上不利。PIP 可以沿着内吞途径运输到细胞内区室,或作为非囊泡脂质运输的逆流底物。PI4P通过后一种机制进入内质网的 PI(4,5)P2 被内质网磷酸酶 SAC1(酵母中的 Sac1p)去除,该酶由 SACM1L 编码,而进入内体和高尔基体区的 PI(4,5)P2 被肌醇多磷酸 5-磷酸酶去磷酸化(见第 7 章)。这些酶在哺乳动物中有 10 种,在下调信号级联和去除过量的 5-磷酸化 PIP 方面发挥着重要作用。它们的重要性因以下事实而凸显:OCRL/INPP5F 的基因缺陷会导致多器官疾病 Lowe 眼脑肾综合征,而另一种 5-磷酸酶 SHIP1/INPP5D 的活性紊乱与自身免疫性疾病和癌症有关 [73]。值得注意的是,PI(3,4,5)P3 3-磷酸酶和张力蛋白同源物 (PTEN) 的缺陷具有致癌性,并且与多种癌症的病因有关 [74]。这些例子强调了细胞器特异性运输、合成和去除 PIP 的关键生理重要性(图 14.7)。
3.4 内质网中中性脂质的合成及其在脂滴中的沉积
脂滴的生物发生是内质网膜内中性脂质合成和产物通道的独特例子。脂滴是在细胞中产生的用于储存非极性中性脂质的细胞器(见第 11 章)。
最丰富的中性脂质是 TAG 和胆固醇酯 (CE),产生它们的酰基转移酶 (DGAT1/2 和 ACAT1/2) 是内质网膜蛋白。这些蛋白质属于膜结合 O-酰基转移酶超家族,具有一个通向细胞质和膜内区域的膜内催化室,分别接收可溶性和疏水性底物 [75,76]。就 DGAT1 活性位点而言,脂肪酰基辅酶 A 通过细胞质通道进入,DAG 通过膜内开口进入。形成的 TAG 分子从侧面进入双层膜内部(图 14.8)。不同的 DGAT 和 ACAT 酶可以介导特定 TAG 或 CE 脂质池的合成。例如,ACAT2 酯化肠细胞中的膳食胆固醇,而 DGAT2 位于 LD 表面,可能有助于直接掺入 TAG。有趣的是,DGAT2 还可以将脂肪酸添加到神经酰胺中,生成储存在 LD 中的酰基神经酰胺 [77]。当中性脂质的浓度在 ER 双层内部达到临界水平时,它们会自发凝结成脂质透镜,这一过程称为 LD 成核 [78]。 Seipin 是一种完整的 ER 膜蛋白,在确定 LD 开始生长的位置方面起着关键作用(见
膜间和膜内脂质转运第 14 章 475
图 14.8 ER 中的 TAG 合成及其进入脂滴的通道。ER 膜蛋白 DGAT1 催化 DAG 和酰基辅酶 A 合成 TAG。TAG 在 ER 双层中可扩散,seipin 寡聚体促进 TAG 聚集,增强其凝聚并捕获在其透镜状结构中。Seipin 可以确定脂滴形成的位点以维持 LD 生长。LD 表面被磷脂单层(和相关蛋白,未显示)覆盖。Seipin 可能在膜弯曲和 LD 生长过程中发生的其他重组过程中发生构象变化,但这些变化仍有待表征。
第 11 章)。 Seipin 稳定地定位在 ER-LD 连接处,保持 ER 和正在生长的 LD 之间的功能连接,并促进 TAG 流向 LD(图 14.8)。该蛋白质具有面向 ER 腔的环状结构,由 10e12 个单体(取决于生物体)形成,每个单体都含有与双层接触的疏水螺旋和两个具有潜在脂质结合能力的 β 片层。疏水螺旋可以聚集 TAG,β 夹层折叠可以结合阴离子磷脂(如 PA),以局部调节磷脂和中性脂质的合成,从而为 TAG 的形成提供有利的环境 [79]。seipin 的生理重要性因功能丧失突变而凸显,这种突变会导致人类最严重的脂肪营养不良(缺乏脂肪组织)。 4. 跨双层脂质不对称和膜内运输 具有小极性部分的脂质(胆固醇、DAG、Cer)在膜的双层小叶之间自发且快速地转移(T1/2 为毫秒至分钟)。然而,具有大极性或带电头部基团的磷脂和鞘脂的自发横向扩散在能量上不利,因此非常缓慢(T1/2 为数小时至数天)。主要的抑制因素是将甘油磷脂或鞘脂的极性头部基团转移到膜的疏水内部的能量成本。 476 膜内或跨双层脂质运输是细胞中的一项基本功能。例如,许多脂质生物合成途径的顺序步骤发生在相对的膜小叶上,因此需要脂质中间体的跨双层转移。例如,GlcCer 在高尔基膜的细胞质小叶中合成,然后通过位于腔小叶中的酶将其转化为复合 GSL,以及到达反高尔基膜的细胞质小叶的 Cer 在腔小叶中转化为 SM(参见第 3.1 节)。在其他情况下,需要主动将脂质或一组脂质保持在一个小叶中,例如 PS 和 PE 定位在 PM 的细胞质小叶中的情况。脂质从膜的外表面/腔内小叶转移到细胞质小叶的过程由称为翻转酶的蛋白质介导,而向腔内/外表面小叶的反向运动则由翻转酶驱动。此外,翻转酶的活性是使膜小叶上的脂质分布随机化或平衡化,从而有效消除膜脂质不对称。这三种类型的脂质转移过程及其介导的蛋白质因子总结如下。小叶间偶联的概念被定义为相对双层小叶中脂质疏水部分的相互作用,也可能影响跨双层脂质运动。根据目前的想法,一个小叶中横向组织的脂质域的形成与相对小叶中的脂质组织相偶联,这种相互依赖性对于膜的结构和跨膜信息传递都很重要 [80]。 4.1 翻转酶
翻转酶是消耗 ATP 的泵,其中大多数属于 P4-ATPase 家族,尽管也存在 ATP 结合盒 (ABC) 家族翻转酶。大多数 P4-ATPase 是由催化亚基和属于 CDC50/TMEM30 家族的辅助亚基组成的异二聚体。P4-ATPase 通常有 10 个跨膜片段,其中 6 个形成核心运输域,可结合要转运的脂质配体(图 14.9)。在哺乳动物中,14 个成员的 P4-ATPase 家族被指定为 ATP8A1-ATP11C,而在酵母中有 5 个直系同源物(Drs2p、Neo1p、Dfn1p、Dfn2p 和 Dfn3p)[81,82]。翻转酶存在于 PM、高尔基体和内体中。它们的特征功能是单向、膜内
跨膜转移脂质底物,从而产生
磷脂膜不对称。虽然
哺乳动物翻转酶的底物特异性尚未得到彻底研究,但已知其中几种
可将 PS、PE 或 PC 从膜的外表面转移到细胞质小叶。研究最深入的是氨基磷脂翻转酶,它们将 PS
和 PE 转移到 PM 的细胞质小叶。改变这些脂质的双层分布会导致外表面小叶和脂质的包装缺陷应力
膜间和膜内脂质运输第 14 章 477
图 14.9 磷脂翻转酶的机制。P4-ATPase 对 ATP 的水解
驱动 PS 从 PM 的外质小叶到细胞质小叶的运输。
细胞质小叶拥挤,以及负电荷在 PM 细胞质表面积累。
翻转酶的活性会导致膜发生许多影响细胞生理的生物物理和生物化学变化。跨膜磷脂梯度影响离子通道和转运蛋白的活性,以及许多可溶性信号和囊泡转运蛋白成分附着到 PM 内表面。它还有利于其他脂质(如胆固醇、Cer 和 DAG)转移到外表面小叶 [83]。翻转酶活性的另一个重要结果是它对膜曲率的影响:脂质转移到细胞质小叶会诱导负曲率,从而导致膜向内出芽 [84]。翻转酶与囊泡外壳蛋白、小 GTP 酶和 Bin/Amphiphysin/Rvs (BAR) 结构域蛋白的活性相结合,促进运输囊泡/小管的生物发生。有证据表明,囊泡外壳的组装可能无法提供足够的能量将膜弯曲成芽和囊泡,除非翻转酶活性通过促进膜弯曲进一步促进这一过程 [85,86]。
4.2 Floppases
Floppases 将脂质从细胞质转移到膜的外表面小叶,完全属于 ABC 转运蛋白超家族 [87,88]。它们是多面体膜蛋白,具有 12 个跨膜跨度和两个 ATP 结合/水解活性位点,将 ATP 水解与底物通过膜的转运偶联(图 14.10)。 ABC 转运蛋白
由两个“半转运蛋白”组成,每个蛋白有六个跨膜
片段和一个 ATP 结合位点,或由一个“全转运蛋白”组成
478
图 14.10 转运蛋白的转运机制f 磷脂转运酶。转运酶,在本例中为 ATP 结合盒式转运蛋白 A1 (ABCA1),水解 ATP 以催化磷脂从 PM 的细胞质转移到外质小叶。这导致外小叶局部膨胀,从而促进无脂质载脂蛋白 A-1 (apoA-1) 对磷脂和胆固醇的吸附以及新生盘状高密度脂蛋白 (HDL) 的形成。此过程对于循环 HDL 的生物合成至关重要。蛋白质。人类基因组编码 48 种 ABC 转运蛋白,分为 7 个亚家族 (A-G),具有广泛的底物,其中许多是脂质。研究最深入的翻转酶包括固醇转运蛋白 ABCA1 和 ABCG1,它们对抗动脉粥样硬化反向胆固醇转运过程至关重要 [89]。ABCA1 将胆固醇和磷脂翻转至外表面 PM 小叶,在那里,它们通过一种不太了解的机制与脂质缺乏的载脂蛋白 A-I 受体相互作用,形成盘状高密度脂蛋白 (HDL)(图 14.10)。ABCA1 是一种全转运蛋白,而 ABCG1 是一种半转运蛋白,有利于将胆固醇和磷脂转移到更大的球形 HDL。值得注意的是,ABCA1 基因突变会导致罕见的遗传性疾病丹吉尔病,其特征是循环 HDL 胆固醇水平极低、肝脾肿大、神经病变、橙色扁桃体、角膜混浊,在某些情况下还会出现过早动脉粥样硬化 [90](见第 15 章)。ABC 转运蛋白家族的另一个重要成员是 ABCB1,也称为 P-糖蛋白或多药耐药蛋白 1 (MDR1)。除了非特异性磷脂转运活性外,这种蛋白质还能够从细胞中去除多种药物和外来生物,从而降低其功效。ABC 转运蛋白也在原核生物中广泛表达,其中一些发挥脂质转运蛋白的作用。其中之一是
MsbA,一种大肠杆菌内膜蛋白,可将 LPS 脂质 A 核心输出到
革兰氏阴性细菌的外膜 [91,92]。
膜间和膜内脂质运输 第 14 章 479
4.3 Scramblases
与消耗 ATP 来驱动磷脂定向跨双层运动的翻转酶和翻转酶相反,scramblases 介导非特异性、双向磷脂运动(通常称为脂质翻转),而无需
外部能量要求 [93]。虽然 ATP 依赖性翻转酶和翻转酶介导的脂质转移过程相对较慢,约为 10e100
脂质/秒,但由 scramblases 介导的速率为 >10,000 脂质/秒。
Scramblase 活性负责消除 PM 中的高度脂质不对称。已鉴定出两类 PM 扰乱酶:跨膜成员 16 (TMEM16) 和 Xk 相关 (Xkr) 家族整合膜蛋白。这些蛋白质的激活导致 PM 脂质不对称性迅速消散,最严重的后果是 PS 从细胞质小叶暴露在 PM 外小叶上。这发生在凋亡细胞中,是由于 caspase 蛋白酶裂解和 Xkr 激活 [94]。相反,TMEM16 家族蛋白质被升高的细胞质 Ca2+ 激活,导致细胞表面 PS 暴露,这对于血液凝固和骨矿化时的血小板活化至关重要 [95]。TMEM16F/ANO6 中的基因缺陷始终会导致出血性疾病 Scott 综合征,其中血小板表面的 PS 暴露减弱。在视网膜感光细胞中还发现了一种有趣的扰乱酶活性。感光盘具有磷脂爬行酶活性,负责该活性的蛋白质是感光受体视紫红质,它属于 G 蛋白偶联受体家族 [96,97]。
内质网中新合成的磷脂被插入细胞质小叶,但也必须转移到外表面/腔小叶,以使两个双层小叶均匀扩张。值得注意的是,负责此活性的爬行酶尚不清楚,但已提出潜在候选者。例如,G 蛋白偶联受体在体外被掺入脂质囊泡时表现出强的爬行酶活性。虽然这些受体在 PM 中不充当爬行酶,可能是由于独特的脂质环境,但有人提出它们可能在粗糙内质网膜中合成后在内质网中执行此功能 [98]。
爬行酶活性的机制是什么?真菌 Nectria haematococca 中的 TMEM16 的 X 射线晶体结构已被解析,该结构可作为 Ca2+ 激活的脂质爬行酶发挥作用,并为其机制提供线索 [99]。同型二聚体蛋白质的每个亚基含有 10 个跨膜螺旋和一个暴露在脂质双层内部的亲水膜横穿凹槽(图 14.11)。亲水凹槽可能屏蔽磷脂头部基团在从一个小叶转移到另一个小叶的过程中发生移动,而疏水性脂肪酰基链则与双层的疏水性内部保持连接。磷脂头部基团被拉过 scramblase 表面的凹槽的模型被称为“信用卡模型”,因为它类似于将信用卡刷过读卡器。
480
图 14.11 脂质 scramblase 的拟议机制。Scramblase 是多跨度、跨膜蛋白,介导生物膜两个小叶之间脂质的混乱。这被认为是通过“信用卡模型”机制进行的。在这里,脂质头部基团被拉过 scramblase 中的极性凹槽(模型中以黄色表示),类似于将信用卡拉过读卡器。因此,在转移过程中,只有脂质的疏水脂肪酰基链与双层的疏水核心直接接触。右侧描绘了一种爬行酶 Nectria haematococca TMEM16 的结构。
5. 结论和未来展望
尽管过去几年细胞脂质运输领域取得了重大进展,但仍有几个基本问题有待解决。例如,膜内脂质运输和膜组织可能受到小叶间偶联的强烈影响,但跨双层脂质交错的基本原理和脂质域对相反小叶的影响仍然难以捉摸。当谈到膜间脂质运输时,MCS 已被确立为脂质转移的热点,并且已确定了几个相关的 LTP,但在许多情况下,需要建立它们的时空调节和相互合作。另一方面,对脂滴的研究日益增多,强调了生理上重要的过程,而这些过程存在知识上的空白,例如脂滴中的脂质如何转移到构成肝细胞主要胞吐脂质货物的新生极低密度脂蛋白中。
我们现在正处于利用新的强大技术来揭示细胞内脂质运输和组织的原理的阶段。首先,通过质谱法对不同脂质种类进行灵敏检测有助于揭示特定脂质蛋白质相互作用背后的原理以及脂质多样性的相关性。其次,关于膜蛋白的结构信息越来越多,尤其是低温电子显微镜的快速进展,将开启越来越复杂的机制见解,了解单个蛋白质和蛋白质复合物如何发挥其脂质运输活动。这反过来又将刺激对潜在物理化学原理的研究,既通过使用体外重建,也通过计算机模拟实验进行预测。在未来,扩大计算能力肯定有助于设计新的
膜内和膜间脂质转运第 14 481 章
实验方法。最后,由于许多膜内和膜间脂质转运过程的本质和进化保守性,先进的基因编辑策略(包括使用遗传上可适应的模型生物)将有助于推动该领域的发展。
致谢
我们向本章未引用其原始研究的作者表示歉意,因为
认识到值得引用的论文数量过多。由于引用数量的限制,我们经常参考评论文章,通过这些文章可以访问原始文献。感谢 Pentti Somerharju 博士对手稿的批判性阅读以及 Mikko Olkkonen 准备图表。