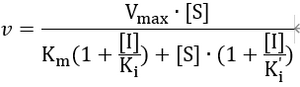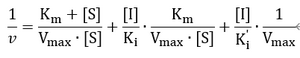酶动力学作图
酶动力学
Michaelis-Menten方程一般推导及意义解读
假设理想酶促反应E+S⇌ES→E+P正向第一步反应的反应速率常数为k1, 逆向反应速率常数为k-1 ,第二步反应速率常数为k2. 通常情况下,有k2<<k1, 从而可得该反应的化学平衡常数Km=k-1/k1=[E][S]/[ES] ①
同时,做出如下假设:
1.底物过量,即[S]>>[E]
2.k-2→0,且第二步反应是决速步骤(因其不可逆)
3.体系达到稳态
酶的总浓度[Et]是不变的,[Et]=[E]+[ES] ②
与①式联立,变形可得[Et]=[E](1+[S]/Km)
[E]=[Et]/(1+[S]/Km) ③
由假设2,υ=k2[ES]=k2[E][S]/Km
再与③式联立解得
υ=k2[Et][S]/(Km+[S])
注意到Vmax=k2[ES]max=k2[Et]
所以,
υ=Vmax[S]/(Km+[S]).
上式被称为米氏方程
在米氏酶中,记kcat=k2
那么不难得出Vmax=kcat[Et]
即kcat的物理学意义是每单位浓度的酶总量下酶促反应的最大速率,单位是s-1
可以将kcat理解成单个酶分子在一秒内转化底物的数量,或者单个酶分子转换一个底物分子所需的时间
因此,称kcat为转化数.
令[S]=Km(米氏常数), 不难得出, 此时υ=Vmax/2, 可知Km越大,酶促反应越难达到其最大速率的一半,也就是说,Km衡量了酶与底物的亲和力,且Km与亲和力负相关。
从而,我们可以通过计算kcat/Km来衡量一个酶的“完美”程度。
已知“完美”程度较高的一种酶为磷酸丙糖异构酶TIM
抑制剂存在情况下的米氏方程推导
见图(图有点小,可以点开看)
竞争性抑制↓

非竞争性抑制↓

反竞争性抑制↓

动力学作图
-双倒数作图
抑制剂作用的图像
竞争:交点在纵轴(因为Vmax没变,纵截距没变)
非竞争:交点在横轴(Km没变,横截距没变)
反竞争:相互平行,没有交点(Km,Vmax同时除以1+I/Ki,比值(斜率)没变)
混合型(非+竞争混合型):交点在第二象限
非+反混合型:交点在第三象限
多底物的图像
乒乓机制:以1/底物A浓度为横轴,1/V为纵轴,不同B浓度做出的直线:
- 乒乓机制:直线之间平行
- 序列机制:交于第二象限
-双倒数作图
将方程两侧取倒数,得到方程式
1/v=Km/Vmax·1/[S]+1/Vmax
1/V-1/[S],纵截距:1/Vmax;横截距:-1/Km
-Eadie-Hofstee作图
将米氏方程改写为
v=Vmax-Km·v/[S]
V-V/[S]。纵截距:Vmax,斜率:-Km
-Hanes-Woolf作图
双倒数作图法左右两边同时乘[S]
[S]/V-[S],横截距:-Km,斜率:1/Vmax
-Eisenthal&Cornish-Bowden作图
由Eadie-Hofstee作图中的公式移项可得
Vmax=v+Km·v/[S]
在横轴上找到某浓度对应点,在纵轴上找到该浓度下速度对应点,连出一条直线;多组数据直线应当通过一点,此点坐标即是(Km , Vmax)。
- 总结:考题可能会给你一个图,只标注了横坐标和纵坐标的含义。
- 如果只有一条线且不是常见的双倒数作图,根据横纵轴量纲判断截距的含义:若纵轴是速度,纵截距就是Vmax,斜率相应的是Km;若横轴是浓度,横截距就是Km,斜率相应的代表Vmax;注意量纲和正负是否合适。
- 如果有多条线,那么交点坐标是(Km,Vmax)
-Dixon作图
Dixon作图可以用于求得抑制剂的抑制常数Ki。
具体过程如下:
针对较为通常的含抑制剂的米氏方程:
其可以被转换为:
因此其表现为[S]一定时,1/v关于[I]的线性函数。
当[S]不同时,联立方程可解[I]=-Ki。
Dixon作图以抑制剂浓度I为横轴,1/V为纵轴。
对于非竞争抑制剂,Ki=Ki',故不同底物浓度的直线交于一点(-Ki,0)。
对于竞争性抑制剂,消去(2)右侧最后一项,可解得交于同一点(-Ki,1/Vmax)。
对于反竞争抑制剂,消去(2)右侧第二项,可解得直线间相互平行,不可计算。