第二十一章 肺和胸壁的静态力学:修订间差异
自动添加《BERNE & LEVY 生理学 第八版》章节导航 |
自动添加 Sofia 模板和分类 |
||
| 第222行: | 第222行: | ||
{{:BERNE & LEVY 生理学 第八版}} | {{:BERNE & LEVY 生理学 第八版}} | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 17:23的最新版本
学习目标
完成本章学习后,学生应能回答以下问题:
- 肺泡压(alveolar pressure)与胸膜压(pleural pressure)有何不同?
- 跨胸膜压力梯度(transpleural pressure gradient)是如何形成的?
- 肺容积(lung volume)与肺容量(lung capacity)有何区别?如何通过肺活量测定法(spirometry)测量肺活量(vital capacity)?为何残气量(residual volume)无法通过肺活量测定法测量?
- 为什么肺静态力学特性的改变会导致肺容积测量值的显著变化?
- 什么是肺顺应性(lung compliance)?
- 什么是肺表面活性物质(pulmonary surfactant),它如何帮助维持肺顺应性?
为实现气体交换的主要功能,空气必须进出肺部。肺与胸壁的力学特性决定了这种大量气体运动的难易程度。肺力学是研究肺和胸壁(包括膈肌、腹腔和前腹壁肌肉)力学特性的学科。理解肺力学对认识正常肺功能及疾病如何破坏这种正常功能至关重要。大多数肺部疾病会影响肺、胸壁或两者的力学特性。此外,肺部疾病导致的死亡几乎总是源于呼吸肌疲劳,这是由于呼吸肌无法克服肺、胸壁或两者力学特性的改变所致。肺力学包括静态力学(肺容积不随时间变化的力学特性)和动态力学(肺容积随时间变化的特性)。肺与胸壁的动态力学将在第22章讨论。
呼吸系统内的压力
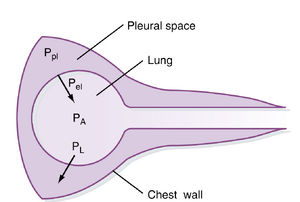
在健康人群中,肺和胸壁作为一个整体协同运动。这些结构之间存在胸膜腔(pleural space),在正常情况下最好将其视为潜在腔隙。由于肺和胸壁协同运动,吸气与呼气时它们的容积变化是相等的。肺和胸壁的容积变化由周围压力的变化驱动。根据惯例,肺和胸壁内部的压力以大气压为参照(大气压被视为0)。因此,胸膜腔内的负压是指低于大气压的压力。
此外,根据惯例,跨越肺或胸壁等表面的压力被定义为表面内部压力与外部压力之差。跨越肺和胸壁的压力差被称为跨壁压(transmural pressure,即跨越壁或表面的压力)。对于肺而言,这种跨壁压称为跨肺压(transpulmonary pressure或translung pressure,PL),其定义为气腔(肺泡压[alveolar pressure,PA])与肺周围压力(胸膜压[pleural pressure,Ppl])之差:
公式 21.1:PL=PA-Ppl
跨越胸壁的跨壁压(Pw)是胸膜压(内部压力,Ppl)与胸壁周围压力(Pb,即大气压或体表外部压力)之差:
公式 21.2:Pw=Ppl-Pb
呼吸系统的跨壁压(Prs)是肺的跨壁压与胸壁的跨壁压之和:
公式 21.3:Prs=PL+Pw=(PA-Ppl)+(Ppl-Pb)=PA-Pb
压力梯度如何形成
空气从高压区域流向低压区域,从而进出肺部。若无压力梯度,则无气流。因此,在吸气末和呼气末(无气流的时间段),肺泡压(PA)与大气压(Pb)相等,此时无压力梯度(Pb-PA=0)。然而,此时的胸膜压并非0。在吸气开始前,正常个体的胸膜压约为−3至−5 cm H₂O。因此,胸膜腔内的压力相对于大气压为负压。这种负压由肺的内向弹性回缩压(inward elastic recoil pressure)产生,其作用是“将肺拉离”胸壁。然而,由于肺与胸壁作为整体协同运动,肺无法真正脱离胸壁。因此,肺的内向弹性回缩压与胸壁的外向回缩压(outward recoil)相互平衡。
吸气开始时,膈肌和胸壁肌肉收缩,导致膈肌向下运动、胸廓向外向上运动。因此,胸膜压(pleural pressure)在吸气过程中降低。这种负压通过肺组织传递,导致肺泡压(alveolar pressure)下降。当肺泡压降至低于0时(即从大气压降至低于大气压),声门开放使气体进入气道。随着气体沿气道流向肺泡,气道内的压力梯度逐渐减小;当肺泡与大气之间不再存在压力梯度时,气流停止。
呼气时,膈肌上抬入胸腔,胸膜压升高(即负值减小),肺泡压转为正值,声门开放使气体再次从高压(肺泡)流向低压(大气)。肺泡内呼气的驱动力是肺弹性回缩力(elastic recoil)与胸膜压的总和(见第22章)。图21.2展示了吸气和呼气过程中压力变化、气流变化与容积变化的关系。正常个体平静呼吸时,吸气初期的肺泡压下降幅度较小(1-3cmH2O)。对于存在气道阻塞的个体,由于阻塞气道两侧产生更大的压力差,该下降幅度会显著增大。当肺泡压与大气压相等导致压力梯度消失时,气流即停止。
肺容积及其测量
肺容积( Lung volumes,图21.3)及其决定因素是肺力学的重要组成部分。各种疾病可能改变特定肺容积,导致呼吸功增加(见第22章)。所有肺容积都是总肺容量(total lung capacity,TLC)的细分,TLC指最大吸气时肺内所含气体的总量。TLC由四个独立肺容积组成:补吸气量(IRV)、潮气量(Vt)、补呼气量(ERV)和残气量(RV)。潮气量(Tidal Volume, Vt)指每次平静呼吸时进出肺部的气体量。补吸气量(Inspiratory Reserve Volume, IRV)指正常潮气呼吸后能额外吸入的气体量,这部分气体储备用于通气需求增加时(如运动或疾病)。补呼气量(Expiratory Reserve Volume, ERV)指正常潮气呼吸后能额外呼出的气体量,与IRV类似,在呼吸努力增强时使用。残气量(Residual Volume, RV)指完全呼气后仍"滞留"于肺内的气体量。
肺容量(lung capacity)被定义为两个或多个上述肺容积的总和。肺活量(Vital Capacity, VC)是Vt、IRV和ERV的总和,表示从最大吸气到最大呼气能排出的气体总量。TLC则是VC与RV的总和。
多数肺容积和容量可通过肺活量计(spirometer)测量。患者通过该装置呼吸时,气流运动被记录。通过平静呼吸可测得潮气量。随后患者进行最大吸气(确定IRV)并用力呼气至无法继续呼出,此时呼出的气体量即为VC。ERV可通过从VC中减去IRV和Vt计算得出。RV无法通过肺活量计直接测量,需采用更复杂的测试方法。
临床应用
肺功能测试常用于诊断肺功能异常及评估肺部疾病的进展。它们可区分两种主要的肺病理生理过程:阻塞性肺疾病和限制性肺疾病。例如,在正常个体中,残气量(RV)与肺总量(TLC)的比值小于0.25。健康个体呼气末约有25%的气体总量残留在肺内("被截留")。在阻塞性肺疾病中,RV/TLC比值可能因RV增加超出TLC的任何增加比例而继发性升高。胸部影像学检查中,由于截留气体量增加,肺部可能呈现"过度充气"表现。相反,在限制性肺疾病中,胸廓无法扩张至正常预期程度,因此TLC下降导致RV/TLC比值升高。
肺容积与肺容量
RV和TLC可通过两种方法测量:氦气稀释法和体容积描记法。这两种方法均用于临床,可提供有关肺功能和肺部疾病的重要信息。氦气稀释法是较传统且简单的方法,但其准确性通常低于需要精密昂贵设备的体容积描记法。
在正常个体中,通过氦气稀释法测量的功能残气量(FRC)与体容积描记法测得的FRC相同(表21.1)。但肺部疾病患者的情况则不同。氦气稀释法测得的FRC是与气道相通的气体容积,而体容积描记法测得的FRC是呼气末肺内气体总容积。若有大量气体被截留于肺内(因气道过早闭合;见第22章),体容积描记法测得的FRC将显著高于氦气稀释法结果。
肺容积
功能性残气量:2.4L
肺总量TLC:6L
潮气量:0.5L
呼吸频率:12/分
静态参数
胸膜压Ppl:-5cmH2O
功能残气量时胸壁顺应性:0.2L/cmH2O
功能残气量时肺顺应性:0.2L/cmH2O
临床视角
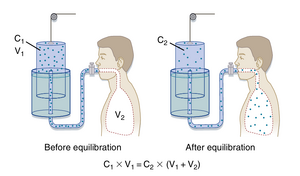
氦气稀释法的操作原理是:向已知容积(V1)的密闭容器内注入已知浓度(C1)的惰性气体(如氦气),随后将该容器连接至待测的未知容积(V2)(即待测肺容积)。待惰性气体充分分布后,测量其新浓度(C2)。通过惰性气体浓度的变化即可计算其分布的总容积(图21.4)。具体公式为:
C1×V1=C2(V1+V2)
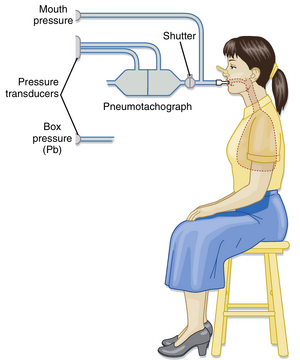
当使用体描计(body plethysmograph,body box,身体容积描记箱)测量肺容积时,波义耳气体定律——压力与体积的乘积为常数(在恒温条件下)——被用于计算肺容积。患者坐在一个气密箱中(图21.5),通过连接气流传感器(流速仪,pneumotach)的咬嘴进行呼吸。随后患者对着关闭的咬嘴进行急促呼吸动作。在此操作的呼气阶段,肺内气体被压缩,肺容积减少,而箱内压力因箱内气体体积增加而下降。已知箱体容积和口腔处箱压变化后,即可计算肺容积变化量(Δ V):
P1×V=P2(V-ΔV)
其中P1、P2为口腔压力,V表示功能残气量(FRC)。通过FRC测量,吸气量可记录为高于FRC的吸入气体体积,补呼气量(ERV)可确定为从FRC呼出的气体体积。这些测量值随后可用于计算其他肺容积参数。
肺容积的决定因素
是什么决定了肺总量(TLC)或残气量(RV)时的肺内气体体积?答案在于肺实质的特性以及肺与胸廓的相互作用。在健康个体中,肺和胸廓始终作为一个整体协同运动。肺内含有弹性纤维,其具有以下功能:(1)在应力作用下伸展,导致肺容积增加;(2)应力解除后被动回缩,导致肺容积减少。肺实质的弹性回缩力非常强。若无外力作用(如胸廓产生的力),肺将几乎不含气体(约为TLC的10%)。同理,当呼吸肌伸展时胸廓容积可增大,呼吸肌长度缩短时则减小。在理论上去除肺实质的情况下,胸廓的静息容积会增大至约TLC的60%。
肺容积由肺的弹性特性与胸壁肌肉特性之间的平衡决定。肺和胸壁内所含空气的最大容积(即总肺容量,TLC)由吸气肌控制(参见第20章)。随着肺容积增大,胸壁肌肉逐渐拉长。肌肉拉长时,其产生力的能力随之下降。当吸气肌无法产生进一步扩张肺和胸壁所需的额外力量时,即达到TLC。
同理,肺内空气的最小容积(即残气量,RV)由呼气肌力量控制。肺容积减小时,呼气肌缩短,导致肌肉力量下降。肺容积减小还伴随胸壁向外回缩压的增强。当呼气肌力量不足以进一步缩小胸壁容积时,即达到RV。
功能残气量(FRC)指正常呼气末的肺容积,由肺实质为缩小体积产生的弹性回缩压(向内回缩)与胸壁为扩大体积产生的压力(向外回缩)之间的平衡决定。当胸壁肌力薄弱时,FRC会降低(肺弹性回缩压>胸壁肌力)。存在气道阻塞时,由于气道过早闭合导致气体滞留,FRC会升高(参见第22章)。
压力-容积关系
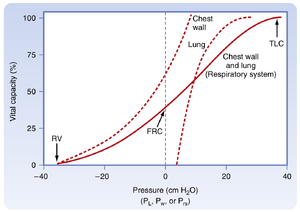
通过分析肺、胸壁和呼吸系统的压力-容积曲线(图21.6),可得出若干重要结论:
- 在肺的静息容积(FRC)状态下,肺的弹性回缩力使肺容积减小,但这种向内回缩力被胸壁的向外回缩力所抵消
- 在FRC时,这两种力量大小相等、方向相反,此时肌肉处于松弛状态
- 因此FRC状态下的呼吸系统跨壁压Prs为0
- 在TLC状态下,肺压和胸壁压均为正压,均需要正跨壁扩张压
无肺组织存在时,胸壁的静息容积是其跨壁压为0时的容积,约为TLC的60%。当容积超过TLC的60%时,胸壁向内回缩需要正跨壁压;当容积低于TLC的60%时,胸壁倾向于向外回缩。
当跨肺压(transpulmonary pressure)为0时,肺的容积最小。然而,由于表面活性物质(surfactant)降低表面张力的特性(见"表面活性物质"章节),当跨肺压为0时肺内并非完全无气。单独的肺在跨壁压(transmural pressure)超过20cmH2O时趋于平坦,因为此时已达到肺的弹性极限。因此,跨壁压的进一步增加几乎不会引起容积变化,顺应性(compliance)(见"肺顺应性"章节)降低。肺的进一步扩张受限于其结缔组织(胶原蛋白、弹性蛋白)。若施加更大压力,靠近肺表面的肺泡可能破裂,空气可逸入胸膜腔,这种现象称为气胸(pneumothorax)。气胸可分为自发性(肺泡破裂)、创伤性(穿透性胸壁损伤)或某些侵入性胸部操作后的并发症。气胸发生时,肺与胸壁不再作为整体运作:肺回缩直至跨肺压为0;胸壁则扩张直至跨胸壁压(trans chest wall pressure)为0。
跨肺压与胸膜腔压、肺泡压及弹性回缩压的关系见图21.7。肺泡压是胸膜腔压与肺弹性回缩压Pel之和:
公式21.4:PA=Ppl+Pel
由于跨肺压(PL)=PA-Ppl,可得:
公式21.5:PL=(Pel+Ppl)-Ppl=Pel
通常,PL是使肺扩张的压力,而Pel是促使肺塌陷的压力。肺弹性回缩力随肺充气量的增加而增强。
肺顺应性(Lung Compliance)
肺顺应性(compliance,CL)反映肺的弹性特性,表示肺被扩张的难易程度。其定义为:在扩张压改变1 cm H2O时引起的肺容积变化量。顺应性单位为毫升(或升)/厘米水柱。当肺顺应性高时,肺容易扩张;当顺应性低(肺"僵硬")时,肺难以扩张。肺顺应性CL可表示为:
公式21.6:CL=ΔV/ΔP
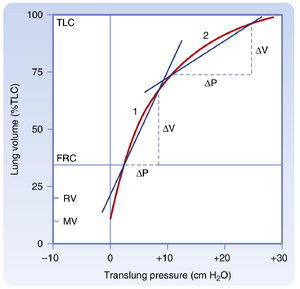
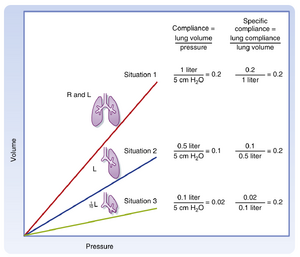
其中,ΔV 表示容积变化,ΔP 表示压力变化。图示上,肺顺应性(lung compliance)是压力-容积环(pressure-volume loop)呼气支上任意两点连线的斜率(图21.8)。正常人肺顺应性约为0.2升/厘米水柱(L/cm H₂O),但会随肺容积变化。值得注意的是,肺在高肺容积时扩张性较低。因此,顺应性需根据测量时的肺容积进行校正(比顺应性(specific compliance);图21.9)。临床实践中很少测量顺应性,因为这需要放置食管气囊(esophageal balloon)。该气囊通过压力传感器连接,作为胸膜压(pleural pressure)的替代指标——直接测量胸膜压非常困难。胸膜压变化(Pₚₗ)是肺容积变化的函数,即Cₗ=ΔV/ΔPₚₗ 或 ΔPₚₗ=ΔCₗ。
临床知识
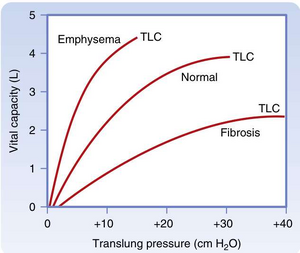
肺顺应性受多种呼吸系统疾病影响。在肺气肿(emphysema)(一种与肺泡间隔破坏相关的阻塞性肺疾病)中,由于弹性回缩力丧失,肺顺应性增加;即压力每增加1 cm H2O,容积增量大于正常肺(见图21.1)。相反,在肺纤维化(pulmonary fibrosis)(一种与间质胶原纤维沉积增加相关的限制性肺疾病)中,肺顺应性降低;即压力每改变1 cm H2O,容积变化量更小。这些顺应性变化具有临床意义,因为低顺应性肺("僵硬肺")需要更大的胸膜压力变化才能改变肺容积,导致个体每次呼吸的代谢做功增加。
表面张力与表面活性物质
表面张力
除了肺的弹性特性外,肺顺应性的另一个主要决定因素是表面活性物质(surfactant)及其对表面张力(surface tension)的影响。表面张力由气-液界面处水分子之间的吸引力引起。这种作用倾向于通过使肺泡塌陷来最小化表面积,从而导致肺顺应性下降。因此,肺的膨胀变得更加困难,需要呼吸肌消耗更多能量。通过比较盐水填充肺(无气-液界面)和空气填充肺的容积-压力曲线,可以实验性地展示表面张力对肺膨胀的影响。由于空气填充肺的表面张力高于盐水填充肺,完全膨胀空气填充肺需要比盐水填充肺更高的压力。表面张力是衡量材料表面分子每单位长度附着力的指标,其单位为每单位长度所施加的力。
对于球体(如肺泡),球内压力(Ps)与壁张力的关系由拉普拉斯定律描述:
公式21.7 Ps=2T/r
其中T为壁张力(单位:达因/厘米),r为球体半径。
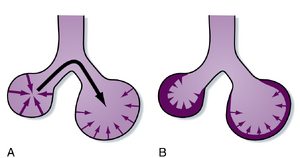
肺泡内衬主要由一种称为表面活性物质(surfactant)的脂质基物质构成。肺表面活性物质具有多种生理功能,包括:(1) 通过降低表面张力来减少呼吸做功;(2) 防止呼气时肺泡塌陷和粘连;(3) 稳定肺泡,特别是那些在低表面张力下容易萎缩的肺泡。若无表面活性物质,气-液界面的表面张力将保持恒定,当肺泡容积减小时,维持该容积所需的肺泡跨壁压(transalveolar pressure)会更高(图21.10A)。因此,在低肺容积状态下,需要更高的肺泡跨壁压才能实现与高肺容积状态下相同的肺泡容积增量。表面活性物质通过使表面张力随肺泡扩张而增加,从而稳定肺泡的膨胀(见图21.10B)。其结果是,维持肺泡膨胀所需的肺泡跨壁压会随肺容积和跨肺压(transpulmonary pressure)的增加而增加,并随肺容积的减小而降低。在表面活性物质存在时,高肺容积状态下的表面张力会增加,而低肺容积状态下的表面张力会降低。这使得肺能在多种不同容积下维持肺泡的稳定。否则,小肺泡中的气体会排入大肺泡。
表面活性物质
肺表面活性物质由II型肺泡细胞合成,储存于细胞内的板层小体(lamellar bodies)中,并以前体形式(tubular myelin)分泌至肺泡腔。随后其扩散至整个肺泡表面,获得降低表面张力的能力。表面活性物质含85%至90%的脂质(以磷脂为主)和10%至15%的蛋白质(表21.2)。主要磷脂成分为磷脂酰胆碱(phosphatidylcholine),其中约75%以二棕榈酰磷脂酰胆碱(DPPC)形式存在。DPPC可降低表面张力,是表面活性物质中主要的表面活性成分。第二丰富的磷脂是磷脂酰甘油(phosphatidylglycerol),占总表面活性物质的1%至10%。这些脂质对肺泡-空气界面单分子层的形成至关重要,其中磷脂酰甘油对表面活性物质在大面积表面的铺展起重要作用。研究最深入的表面活性蛋白A(surfactant protein A)在II型肺泡细胞中表达,参与表面活性物质的代谢调节、肺内免疫调节及管状髓磷脂的形成。
表面活性物质通过组成性和调节性机制,经板层小体的胞吐作用分泌至气道。包括β-肾上腺素能激动剂、蛋白激酶C激活剂、白三烯和嘌呤能激动剂在内的多种物质均可刺激表面活性物质的胞吐。肺内表面活性物质的主要清除途径包括:II型细胞再摄取、淋巴管吸收以及肺泡巨噬细胞清除。当病理过程导致蛋白质类物质进入胸膜腔时(如感染、肺水肿液和血浆蛋白渗漏至气腔),表面活性物质会迅速失活。失活后肺泡表面张力升高,肺顺应性下降,呼吸做功增加。
除表面活性物质外,另一种机制——相互依赖机制(interdependence)也有助于维持肺泡稳定性。除胸膜表面的肺泡外,其他肺泡均被其他肺泡包围。单个肺泡的塌陷趋势会受到周围肺泡施加的牵拉力对抗。因此,单个肺泡的塌陷会引起周围肺泡的拉伸和变形,而这些肺泡又与其他肺泡相连。肺泡壁上的小孔(Kohn孔,pores of Kohn)连接相邻肺泡,而Lambert管(canals of Lambert)连接终末气道与邻近肺泡。Kohn孔和Lambert管提供侧支通气,防止肺泡塌陷(肺不张,atelectasis)。
| 成分 | 组成百分比 | 功能 |
|---|---|---|
| 磷脂(Phospholipids) | 80-85 | |
| 磷脂酰胆碱 | 70-80 | 降低表面张力(Decrease surface tension) |
| 磷脂酰甘油 | 1-10 | 铺展能力(Spreading ability) |
| 磷脂酰乙醇胺 | 1-2 | 不明(Unclear) |
| 磷脂酰丝氨酸 | 1-2 | 不明(Unclear) |
| 磷脂酰肌醇 | 1-2 | 不明(Unclear) |
| 中性脂类(Neutral Lipids) | 5-10 | |
| 胆固醇 | 3-5 | 稳定作用(Stabilization) |
| 胆固醇酯 | 1-3 | 稳定作用(Stabilization) |
| 游离脂肪酸 | 1-3 | |
| 蛋白质(Proteins) | 2-5 | |
| 表面活性物质蛋白A | 2-4 | 代谢更新、免疫调节、管状髓磷脂形成(Tubular myelin formation) |
| 表面活性物质蛋白B | 2-4 | 降低表面张力、铺展能力 |
| 表面活性物质蛋白C | 2-4 | 降低表面张力、铺展能力、脂质层形成(Lipid layering) |
| 表面活性物质蛋白D | 1-2 | 未知(Unknown) |
临床关联
1959年,Avery和Mead发现死于透明膜病(hyaline membrane disease, HMD)的早产儿肺部存在表面活性物质(surfactant)缺乏。HMD又称新生儿呼吸窘迫综合征,其特征是肺单位进行性不张(去气化)、呼吸衰竭和(严重时)死亡。这是新生儿期发病和死亡的主要原因。早产儿表面活性物质缺乏的主要成分是磷脂酰甘油(phosphatidylglycerol)不足。一般而言,随着羊水中磷脂酰甘油水平的升高,婴儿死亡率会降低。该领域的研究最终成功实现了通过表面活性物质替代疗法治疗早产儿HMD。目前,表面活性物质替代疗法已成为早产儿的标准化治疗方案。此外,分娩前会对产妇使用倍他米松(betamethasone)等类固醇药物以加速胎儿肺成熟。类固醇可穿过胎盘进入胎儿肺部,与II型肺泡细胞(type II pneumocytes)内表面活性物质DNA序列上游的固醇调节结构域结合,从而增加表面活性物质RNA转录和表面活性物质蛋白的生成。
关键要点
- 气体从高压区域流向低压区域。需要正的跨肺压(transpulmonary pressure)来增加肺容积。在无气流时(吸气末和呼气末),呼吸系统的跨系统压差为0。在功能残气量(functional residual capacity, FRC)时,呼吸系统的跨系统压差为0,此时使肺容积减小的肺弹性回缩压(lung elastic recoil pressure)与胸壁为扩大容积产生的压力处于等值反向状态。
- 呼吸系统的压力梯度由呼吸肌的主动收缩及随后的舒张所形成。
- 肺容积由肺的弹性回缩特性与胸壁肌肉及结缔组织特性之间的平衡决定。
