第三十九章 能量代谢的激素调节:修订间差异
无编辑摘要 |
自动添加 Sofia 模板和分类 |
||
| (未显示同一用户的1个中间版本) | |||
| 第312行: | 第312行: | ||
# 控制不良的糖尿病的长期并发症是由于细胞内葡萄糖过多(葡萄糖毒性),尤其是在视网膜、肾脏和周围神经中。这导致视网膜病变、肾病和神经病变。 | # 控制不良的糖尿病的长期并发症是由于细胞内葡萄糖过多(葡萄糖毒性),尤其是在视网膜、肾脏和周围神经中。这导致视网膜病变、肾病和神经病变。 | ||
# 脂肪组织具有内分泌功能,特别是在能量稳态方面。脂肪组织产生的激素包括瘦素和脂联素。瘦素作用于下丘脑以促进饱腹感。 | # 脂肪组织具有内分泌功能,特别是在能量稳态方面。脂肪组织产生的激素包括瘦素和脂联素。瘦素作用于下丘脑以促进饱腹感。 | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 17:23的最新版本
学习目标
完成本章学习后,学生应能够回答以下问题:
- 解释消化期与非消化期及禁食期不同细胞对燃料的需求和利用的差异。
- 将胰岛素的结构、合成和分泌与循环燃料水平(尤其是葡萄糖)整合起来。
- 利用胰岛素调节的不同信号传导途径,将胰岛素与其在分子水平上的细胞效应联系起来。
- 将胰高血糖素的结构、合成和分泌与循环燃料、胰岛素和儿茶酚胺的水平整合起来。
- 绘制并整合消化期胰岛素对肝细胞、骨骼肌和脂肪细胞利用和储存葡萄糖、游离脂肪酸(FFAs)和氨基酸(AAs)的作用。
- 绘制并整合非消化期和禁食期反调节激素(胰高血糖素、儿茶酚胺)对肝细胞、骨骼肌和脂肪细胞利用葡萄糖、节约葡萄糖以及利用FFAs和AAs的作用。
- 整合非消化期和禁食期肝细胞燃料利用和激素信号传导的变化,这些变化促进和允许肝糖生成和酮体生成。
- 比较通过下丘脑具有促进食欲和抑制食欲作用的信号传导途径。
- 将几种与代谢相关的病理学联系起来,特别是由胰岛素绝对或相对缺乏以及肥胖引起的病理学。
持续的能量供应与需求:挑战
据估计,人体内有约40万亿个细胞,不包括构成人类微生物组的约40万亿个非人类细胞。所有这些细胞都必须持续工作以维持生命。这些工作包括维持细胞组成和结构完整性,以及大分子和细胞器的综合合成和分解(即周转)。这些工作还涉及细胞在整个人体中的功能(例如,膈肌纤维的收缩)。当人体从事各种活动时,细胞还需要额外的工作,包括(但不限于)体力劳动、锻炼和户外活动;青春期身体生长突增和生殖系统的成熟;怀孕和哺乳;对抗感染或癌症;以及受损组织/器官的愈合(例如,手术后的愈合)。平均而言,一个放松、清醒、静止、健康的成年人的静息代谢率约占其每日总能量消耗的70%(图39.1)。
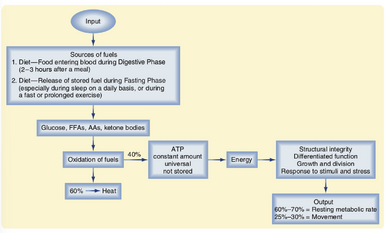
为了完成这项工作,细胞需要燃料,以及将燃料转化为以三磷酸腺苷(ATP)形式存在的潜在化学能量的能力。然后,细胞将ATP中的能量转化为化学和机械功(见图39.1)。这意味着对ATP的需求是即时且持续的,因此所有活细胞都必须不断合成ATP。事实上,人类每天产生的ATP量大约相当于他们的体重。这对身体提出了要求,即必须持续以某种形式向所有细胞供应燃料。所有燃料都来源于饮食,但人类并不会全天不间断地进食。因此,细胞对燃料的持续需求以制造ATP并完成工作,与间歇性的燃料摄入相匹配。饮食来源的燃料被氧化以产生ATP,但为了在一段时间不进食(例如睡眠期间)时维持ATP的产生,一些燃料会被储存以备将来使用。
在理解能量代谢时,重要的是围绕以下几点组织思路:
- 燃料(图39.1)。我们的饮食包括以下单体和聚合形式(后者在消化和吸收过程中转化为单体形式):(1) 单糖,包括葡萄糖、果糖和半乳糖;(2) 长链游离脂肪酸(在本章中简称为FFAs);以及(3) 氨基酸(AAs)。第四种常见的燃料是酮体(KBs),它们在饮食中基本不存在。相反,KBs是由肝细胞通过酮生成(图39.3B中的反应14)产生的,使用的是FFAs和生酮氨基酸,这两者在禁食阶段都会变得丰富。饮食中还包括其他燃料,如乙醇。
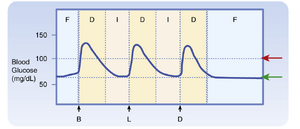
- 代谢阶段。代谢阶段指的是燃料使用和能量代谢在每小时和每天中的差异,这些差异主要由某些燃料的丰富或稀缺决定,并由特定阶段的激素协调。一般来说,有三个代谢阶段(图39.2):(1) 消化或吸收阶段,发生在消化一餐所需的2到3小时内;(2) 消化间期或吸收后阶段,通常发生在两餐之间;以及(3) 禁食阶段,最常见于睡前最后一顿零食和早餐之间。(事实上,医生将血液值称为“空腹”,例如“空腹血糖”,如果患者在午夜后禁食并在大约上午8点抽血;长时间的禁食和饥饿是更极端的禁食形式。)体力活动,由于其增加了能量需求,是另一种代谢阶段,对某些人来说会以一定的频率和规律发生。本章主要比较消化阶段和禁食阶段之间的代谢差异,以及不同激素如何协调这些代谢差异。
- 肝细胞(hepatocytes)、脂肪细胞(adipocytes)和骨骼肌细胞(skeletal myocytes)的代谢作用。所有细胞都参与能量代谢,但这三种细胞类型对全身代谢有深远影响。在消化期(Digestive Phase),肝细胞、骨骼肌细胞和脂肪细胞的功能在很大程度上是相互独立的。相比之下,在空腹期(Fasting Phase),这三种细胞类型的作用高度整合,以维持足够的血糖水平,同时为每种细胞类型提供替代能量底物。关于这三种细胞类型代谢的关键特征列于表39.1中。
- 血糖水平。没有或仅有极少数线粒体的细胞(例如红细胞、眼睛的晶状体细胞)绝对依赖葡萄糖作为能量来源。此外,中枢神经系统(CNS)在正常情况下只能使用葡萄糖来产生ATP。因此,在餐间期(Interdigestive Phase)和空腹期(Fasting Phase),维持血糖高于某个最低阈值是绝对必要的,以避免由低血糖激活的自主神经反应引起的中枢神经系统相关症状(例如恶心、出汗、心律失常)。如果血糖继续下降,可能会进展为由神经低血糖(neuroglycopenia)引起的症状(例如认知功能障碍、协调运动功能丧失,最终甚至昏迷和死亡)。这意味着在餐间期和空腹期,全身代谢必须应对将血糖维持在60mg/dL以上的挑战(见图39.2,绿色箭头)。相反,血糖水平必须保持在某个上限阈值以下(见图39.2,红色箭头)。这是因为葡萄糖是一种相当活泼的分子。高血糖会导致许多细胞内的葡萄糖水平升高,进而非酶促地与蛋白质和其他分子共价结合,从而破坏它们的构型、半衰期和功能(参见临床部分——微血管内的葡萄糖毒性)。
- 胰岛素和反调节激素。消化期的代谢几乎完全由胰岛素调控。在禁食期,胰岛素水平降至低水平,仅此一点就允许了禁食期的一些代谢适应。此外,胰高血糖素和儿茶酚胺(肾上腺素、去甲肾上腺素)刺激代谢途径,整合身体对缺乏摄入和吸收燃料的反应。这些激素因其与胰岛素的作用相反而被称为反调节激素(counterregulatory hormones)。生长激素(见第41章)和皮质醇(见第43章)也在一定程度上参与了禁食期的代谢。
能量代谢的综合概述
消化期(Digestive Phase)的基本目标包括(见表39.1):
- 葡萄糖利用,以防止长时间的高血糖(图39.2;红色箭头)。
- 合成和储存燃料聚合物(糖原、甘油三酯、蛋白质),这些聚合物可以在禁食期被用作燃料。
- 整体的合成代谢以维持细胞的分子完整性。
实现这些目标的代谢途径由胰岛素驱动,胰岛素是消化期的主要激素。
消化期
在消化期,吸收的燃料被分配并用于不同的目的。葡萄糖是消化期用于能量(即ATP产生)的主要燃料(参见图39.3A的酶促途径)。葡萄糖被认为是一种通用燃料,因为大多数细胞可以执行以下操作:
- 通过双向GLUT转运蛋白(G1、G2、G3和G4)导入葡萄糖。
- 通过一种或多种己糖激酶的活性将葡萄糖转化为葡萄糖-6-磷酸(G6P),从而“捕获”和“激活”导入的葡萄糖(途径1)。G6P无法通过GLUT转运蛋白(“捕获”),并且成为了几种酶促途径的底物(“激活”)。
- 通过糖酵解途径将G6P代谢为丙酮酸,该途径在不需线粒体或O2的情况下产生少量ATP(途径2)。没有线粒体的细胞将丙酮酸发酵为乳酸(途径3)并将乳酸输出到细胞外液(ECF)。相比之下,大多数细胞将丙酮酸导入线粒体,通过丙酮酸脱氢酶将其转化为乙酰辅酶A,然后将乙酰辅酶A与草酰乙酸缩合形成柠檬酸。柠檬酸通过三羧酸循环(TCA循环)循环回到草酰乙酸(途径4)。通过TCA循环代谢丙酮酸会释放CO2作为废物,并生成三磷酸鸟苷(GTP)以及黄素腺嘌呤二核苷酸氢化物FADH2)和烟酰胺腺嘌呤二核苷酸氢化物(NADH)。FADH2和NADH被电子传递系统和氧化磷酸化利用,最终通过一个绝对依赖O2的过程生成相对大量的ATP(途径5)。
临床相关
微血管中的葡萄糖毒性
肾脏和视网膜的微血管内皮,以及自主神经系统神经血管的内皮,对高血糖特别敏感。长期高血糖会导致这些内皮细胞内葡萄糖水平病理性升高,从而导致蛋白质和脂质结构的改变、氧化应激以及信号通路的改变。这些损害统称为葡萄糖毒性,会导致细胞内和膜成分以及分泌分子的病理变化,这些分子要么是信号分子,要么是构成细胞外基质的成分。事实上,葡萄糖毒性是糖尿病控制不佳时发生的肾病、视网膜病变和周围神经病变的根本原因。因此,所有代谢阶段的全身代谢都必须应对与进食相关的血糖升高的幅度和持续时间的挑战,并且必须在其他所有时间将血糖维持在安全的最大阈值100mg/dL以下。空腹血糖在100至124mg/dL之间表明葡萄糖耐量受损,而125mg/dL及以上的值则是糖尿病的证据。
在所有代谢阶段,红细胞和大脑持续消耗葡萄糖。相比之下,肝细胞、骨骼肌细胞和脂肪细胞主要在消化期使用葡萄糖。胰岛素刺激糖酵解和丙酮酸(糖酵解的终产物)进入三羧酸循环和氧化磷酸化,以在肝细胞、骨骼肌细胞和脂肪细胞中产生ATP(见表39.1)。
肝细胞表达葡萄糖转运蛋白的GLUT2亚型,该亚型在插入细胞膜时不受胰岛素调控。相比之下,骨骼肌细胞和脂肪细胞表达GLUT4亚型。新合成的GLUT4以细胞内无活性状态存在于GLUT4储存囊泡中(图39.3B中的G4-i)。胰岛素诱导这些富含GLUT4的囊泡转运并插入细胞膜,在此处GLUT4可以作为活性葡萄糖转运蛋白发挥作用(图39.3A中的G4-m)。
在葡萄糖被葡萄糖激酶磷酸化为G6P后,肝细胞在消化期(Digestive Phase)将部分摄入的葡萄糖转化为储存形式——糖原(图39.3A,途径6)。同样,骨骼肌也将部分从摄入的葡萄糖中产生的G6P转化为糖原。肝细胞只能储存有限量的葡萄糖作为糖原。肝细胞还通过新生脂肪生成(de novo lipogenesis, DNL;途径7)将多余的葡萄糖转化为游离脂肪酸(FFAs)。这些FFAs通常与3-磷酸甘油(G3P)酯化形成甘油三酯(TG;途径8),在消化期以肝内TG的形式积累。正如后面讨论的胰岛素信号传导,肝内TG的过度积累(即脂肪肝、肝脂肪变性)可能导致胰岛素抵抗。
在消化期,氨基酸(AAs)被用于多种合成代谢途径,以再生降解的分子,包括其他氨基酸、蛋白质、核苷酸和核酸、谷胱甘肽以及复杂脂质。
就每单位燃料碳产生的ATP分子数而言,FFAs是最有效的燃料类型。然而,FFAs的利用与线粒体中的葡萄糖利用存在竞争。消化期的高FFA水平会促进葡萄糖激增的幅度和持续时间,从而导致高血糖。因此,普通膳食中的大部分FFAs通过重新酯化为TG并在肠上皮细胞内包装成乳糜微粒而被阻止进入循环。乳糜微粒被分泌后进入淋巴管,然后进入血液,为脂肪细胞提供FFAs,这些FFAs以TG的形式储存,供禁食期使用(稍后将详细讨论)。
禁食期
禁食期的基本目标包括:
- 葡萄糖生成,维持血糖水平高于正常下限(图39.2;绿色箭头)。葡萄糖生成通过肝细胞和肾脏中的糖原分解和糖异生实现(见表39.1)。
- 葡萄糖节约,涉及细胞(尤其是骨骼肌)对葡萄糖摄取的整体减少,以及大多数细胞利用FFAs、AAs和酮体(KBs)而非葡萄糖来产生ATP。这也有助于在禁食期维持足够的血糖水平(图39.2;绿色箭头)。
- 整体的分解代谢,将聚合物分解为替代燃料形式。实现这些目标的代谢途径由胰高血糖素(肝脏、脂肪组织)、儿茶酚胺和细胞内代谢信号(如增加的\mathrm{Ca}^{2+}、增加的AMP/ATP比值)驱动。还需注意的是,合成代谢的减少降低了细胞的ATP需求。
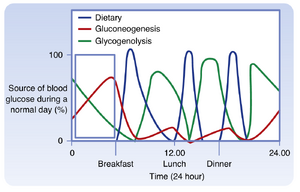
肝脏葡萄糖生成基于两种代谢途径(参见图39.3B)。第一种是糖原分解(Pathway 9)的快速分解代谢过程。肝细胞表达葡萄糖-6-磷酸酶(G6Pase)(Pathway 11),使它们能够将G6P转化回葡萄糖,然后通过双向GLUT2转运体离开细胞。由于肝脏糖原供应在大约8小时后耗尽,糖原分解产生的葡萄糖释放相对短暂。在禁食阶段,肝脏葡萄糖生成的第二种代谢贡献是糖异生(Pathway 10)的逐渐途径。禁食期间糖异生的启动比糖原分解慢,但糖异生在整个禁食阶段基本上持续不断(图39.4)。糖异生需要3碳前体,尤其是乳酸、“糖异生”氨基酸和甘油。这些前体在禁食阶段是如何供应的?乳酸由红细胞持续产生。乳酸也由糖酵解骨骼肌纤维在运动期间产生(运动往往在消化间期和禁食阶段更频繁地发生,而不是“饱腹”时),尽管大部分乳酸在运动期间被有氧骨骼肌和心肌利用。但此外,消化阶段的整体合成代谢在禁食阶段转变为一般分解代谢(参见图39.3B)。脂肪细胞内的甘油三酯(TGs)经历脂解生成游离脂肪酸(FFAs)和甘油(Pathway 12),并且在禁食状态下,尤其是从肌肉中释放氨基酸(Pathway 13),存在一般的净蛋白分解。甘油和糖异生氨基酸从细胞中释放并循环到肝脏,随后用于糖异生(Pathway 10)。因此,糖异生需要脂肪细胞和骨骼肌细胞的分解代谢途径与肝细胞的合成代谢糖异生的整合。糖异生最终取代糖原分解,并且只要前体流入肝脏,就可以继续。
葡萄糖节约是另一种在禁食阶段有助于维持足够血糖水平的一般过程。葡萄糖节约意味着在大多数细胞类型中,尤其是骨骼肌中,燃料利用从葡萄糖转向非糖异生燃料,骨骼肌是潜在的单一最大葡萄糖消耗者。首先,骨骼肌和脂肪细胞的葡萄糖摄取大大减少,因为GLUT4转运体亚型存在于细胞内囊泡中,并且在禁食阶段处于非活性状态(图39.3B中的G4-i)。因此,需要向骨骼肌和脂肪细胞提供替代燃料。
非糖异生燃料(即不能被肝脏用于糖异生)是游离脂肪酸(FFAs)和酮体(KBs)。FFAs主要从脂肪细胞中释放(途径12),但在肝细胞将肝内甘油三酯(TGs)包装成极低密度脂蛋白(VLDLs)后也会释放(稍后讨论)。FFAs随后通过多轮\upbeta\mathbf{\cdot}-氧化(途径16)转化为乙酰辅酶A(acetyl CoA)。KBs通过肝细胞中的酮生成(途径14)从乙酰辅酶A产生,而乙酰辅酶A主要来源于FFAs和生酮氨基酸(AAs),这两者在禁食阶段都会变得丰富。KBs在非肝细胞类型中通过酮解(途径15)转化回乙酰辅酶A。因此,葡萄糖节约依赖于分解代谢的脂肪细胞代谢,这导致储存的TGs的脂解和FFAs的释放。FFAs被肝细胞摄取,肝细胞利用FFAs产生乙酰辅酶A。骨骼肌和其他组织中的蛋白质降解也使某些AAs可用于酮生成。肝细胞中线粒体内高水平的乙酰辅酶A不仅为ATP合成提供了充足的碳源,还起到以下作用:(1)抑制丙酮酸转化为乙酰辅酶A,(2)促进丙酮酸转化为草酰乙酸以进行糖异生,(3)促进KBs的合成(见图39.3B)。禁食几天后,中枢神经系统(CNS)可以开始使用KBs作为能量来源,从而进一步节约葡萄糖供红细胞使用。许多其他具有线粒体的细胞类型使用KBs和FFAs来产生ATP,尤其是骨骼肌。但需要注意的是,肝细胞只进行酮生成,而不进行酮解,因为这将形成一个无效循环。
在禁食阶段,驱动糖原分解、糖异生、脂肪生成、肝酮生成以及肝脏产生VLDL的激素是胰高血糖素和儿茶酚胺。在低血糖的情况下,胰岛素水平下降,这消除了胰岛素对另一种胰腺激素——胰高血糖素分泌的抑制。因此,血糖降低导致循环中胰高血糖素与胰岛素的比例上升。肝细胞是胰高血糖素的主要靶器官,胰高血糖素直接驱动糖原分解(途径9)、糖异生(途径10)、酮生成(途径14)和FFA氧化(途径16)。肝细胞还表达β2-和{\bf{\upalpha}}_{1}-肾上腺素能受体,因此来自交感神经的去甲肾上腺素和来自肾上腺髓质的肾上腺素(见第43章)可以增强胰高血糖素的作用。脂肪细胞也表达胰高血糖素受体,以及β2-和{\upbeta}_{3}-肾上腺素能受体,这些受体在低血糖、运动或某些应激情况下对儿茶酚胺作出反应。骨骼肌不是胰高血糖素的靶标,但通过β2-肾上腺素能受体对儿茶酚胺的刺激作出反应。骨骼肌对细胞内信号非常敏感,例如在体力活动/运动期间增加的Ca++,以及激活AMP激酶的单磷酸腺苷(AMP):ATP比率的增加。
最后,重要的是要理解,在空腹阶段(Fasting Phase)上调的代谢途径与在消化阶段(Digestive Phase)最为活跃的胰岛素依赖途径是相互对立的(稍后讨论)。因此,胰岛素信号的减弱也有助于肝细胞、骨骼肌细胞和脂肪细胞对空腹阶段的代谢挑战表现出整合反应。
不同代谢阶段中参与代谢稳态的胰腺激素
胰岛(islets of Langerhans)构成了内分泌胰腺(endocrine pancreas)(图39.5A)。大约100万个胰岛散布在外分泌胰腺中,占胰腺质量的1%到2%(见第27章)。胰岛由几种细胞类型组成,每种细胞产生不同的激素。β细胞(Beta cells)约占胰岛细胞的四分之三,并产生胰岛素(insulin)(见图39.5B)。α细胞(Alpha cells)约占胰岛细胞的10%,分泌胰高血糖素(glucagon)(见图39.5C)。胰岛内还存在其他内分泌细胞类型,但它们各自的激素产物重要性较低或不明确,因此不再进一步讨论。
• 图39.5 大鼠的胰岛(内分泌胰腺)。A,胰腺组织学显示外分泌腺泡(exocrine acini),其中产生消化酶并通过胰管输送到十二指肠,以及内分泌胰岛(endocrine islet),其中产生胰岛素和胰高血糖素,并通过丰富的毛细血管床摄取后输送到循环系统。B,胰岛中β细胞的胰岛素染色;这些细胞数量最多,主要位于胰岛的中心。C,胰岛中α细胞的胰高血糖素染色;这些细胞数量远少于β细胞,主要位于胰岛的外围。
胰岛的血流与周围外分泌胰腺组织的血流有一定的自主性。胰岛的血流从主要位于胰岛中心的β细胞流向主要位于外围的α细胞和δ细胞(见图38.5B-C)。因此,最先受到循环胰岛素影响的细胞是α细胞,胰岛素在其中抑制胰高血糖素的分泌。
胰岛素
胰岛素是消化期代谢调节的主要合成代谢激素。胰岛素是一种蛋白质激素,属于包括胰岛素样生长因子I和II(IGF-I、IGF-II)以及松弛素在内的基因家族。胰岛素以胰岛素原前体(preproinsulin)的形式合成,当激素进入内质网时,胰岛素原前体被转化为胰岛素原(proinsulin)。胰岛素原在高尔基体中被包装成膜结合的分泌颗粒。胰岛素原包含胰岛素的氨基酸序列以及C肽(连接肽)。切割胰岛素原的蛋白酶(前蛋白转化酶)与胰岛素原一起包装在分泌囊泡中。蛋白水解过程剪除C肽并生成成熟的激素,该激素由两条链组成,即\upalpha链和\upbeta链,通过两个二硫键连接(图39.6)。第三个二硫键位于\upalpha链内。胰岛素以锌结合晶体的形式储存在分泌颗粒中。在受到刺激时,颗粒内容物通过胞吐作用释放到细胞外。等摩尔量的成熟胰岛素和C肽被释放,同时还有少量的胰岛素原。C肽没有已知的生物活性,但在评估内源性胰岛素生成时非常有用。C肽在血液中比胰岛素更稳定(使其更容易检测),并有助于区分内源性胰岛素生成与注射的胰岛素,因为后者已从C肽中纯化出来。
• 图39.6 胰岛素原通过激素原转化酶加工成成熟的胰岛素分子,该分子由两条通过氢键连接的肽链和一个C肽组成。两者以等摩尔比例分泌。(摘自White BA, Porterfield SP [eds]. Endocrine and Reproductive Physiology. 4th ed. Philadelphia: Mosby/Elsevier; 2013.)
胰岛素的半衰期很短,约为5分钟,并迅速从循环中清除。它在肝脏、肾脏和其他组织中被胰岛素降解酶(IDE;也称为胰岛素酶)降解。由于胰岛素被分泌到肝门静脉中,它在进入外周循环之前会暴露于肝脏的IDE。大约一半的胰岛素在离开肝脏之前被降解。因此,外周组织暴露的血清胰岛素浓度显著低于肝脏。现在已有具有不同起效速度、作用持续时间和峰值活性的重组人胰岛素和胰岛素类似物。血清胰岛素水平通常在摄入食物后10分钟内开始上升,并在30至45分钟内达到峰值。较高的血清胰岛素水平迅速将血糖降低至基线值。
葡萄糖是胰岛素分泌的主要刺激物(下文讨论中提到的葡萄糖刺激胰岛素分泌(GSIS)的“步骤”参见图39.7)。葡萄糖通过GLUT2转运蛋白(步骤1)进入β细胞。一旦葡萄糖进入β细胞,它就会被低亲和力的己糖激酶葡萄糖激酶(步骤2)磷酸化为G6P。葡萄糖激酶被称为β细胞的“葡萄糖传感器”,因为葡萄糖进入的速率与葡萄糖磷酸化的速率相关,而后者又与胰岛素分泌直接相关。通过糖酵解、TCA循环和β细胞的氧化磷酸化代谢G6P会增加细胞内ATP:ADP的比率(步骤3),并关闭ATP敏感的\mathbf{K}^{+}通道(步骤4)。这导致β细胞膜去极化(步骤5),从而打开电压门控的Ca++通道(步骤6)。细胞内\left[\mathrm{Ca^{++}}\right]的增加激活了微管介导的含有胰岛素/胰岛素原的分泌颗粒的胞吐作用(步骤7)。
摄入的葡萄糖对胰岛素分泌的影响比注射的葡萄糖更大。这种现象被称为肠促胰岛素效应,是由于葡萄糖刺激胃肠道释放的肠促胰岛素激素所致。一种临床上相关的肠促胰岛素激素是胰高血糖素样肽1(GLP-1),它由回肠的L细胞在回肠腔内的葡萄糖刺激下释放(图39.7)。作为一种激素,GLP-1进入循环系统,最终与β细胞上的Gs偶联的GLP1受体(GLP1R)结合。这个GLP1R/Gs/腺苷酸环化酶/蛋白激酶A(PKA)信号通路放大了\mathrm{Ca^{++}}对胰岛素分泌的细胞内效应。GLP-1在循环中被二肽基肽酶4(DPP-4)迅速降解。
几种氨基酸(AAs)和通过毒蕈碱受体3(MR3)的迷走神经(副交感神经)胆碱能神经支配也通过增加细胞内\left[\mathrm{Ca^{++}}\right]来刺激胰岛素分泌(图39.8)。胰岛素分泌主要通过交感神经自主调节通过{\bf{\alpha}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}} -肾上腺素能受体来抑制。去甲肾上腺素或肾上腺素与相对丰富的{\bf{\alpha}}_{{\bf{\alpha}}}{\bf{\alpha}}_{{\bf{\alpha}}}{\bf{\alpha}}_{{\bf{\alpha}}}{\bf{\alpha}}_{{\bf{\alpha}}}_{{\bf{\alpha}}}{\bf{\alpha}}_{{\bf{\alpha}}}_{{\bf{\alpha}}}_{{\bf{\alpha}}} -肾上腺素能受体的结合会降低环磷酸腺苷(cAMP),从而抑制胰岛素分泌(见图39.8)。肾上腺素能对胰岛素的抑制有助于防止低血糖,尤其是在运动期间。β细胞也表达低水平的Gs偶联的β2 -肾上腺素能受体,通常在促进胰岛素分泌中起次要作用(图39.8)。
• 图39.7 葡萄糖是胰岛素分泌的主要刺激物,并且通过磺脲类药物以及GLP-1类似物/DPP-4抑制剂增强。有关葡萄糖刺激胰岛素分泌(GSIS)中编号步骤的解释,请参见正文。
临床应用
口服和注射降糖药物
ATP敏感的\mathsf{K}^{+}通道是一个八聚体蛋白复合物,包含四个称为SUR亚基的ATP结合亚基。这些亚基被磺脲类药物结合,磺脲类药物也会关闭\mathsf{K}^{+}通道,并广泛用作口服降糖药,用于治疗部分β细胞功能受损患者的高血糖(见图39.7)。如果过量或不正确地与其他药物联合使用,磺脲类药物可能会导致低血糖,这是由于胰岛素的不适当高释放所致。
目前,GLP-1的DPP-4抗性类似物和DPP-4抑制剂已被批准用于治疗具有一定β细胞功能的2型糖尿病患者。重要的是,这些药物允许葡萄糖对β细胞的作用,因此在没有葡萄糖的情况下仅微弱地增加胰岛素分泌。因此,GLP-1类似物引发低血糖的频率远低于磺脲类药物。
胰岛素受体
胰岛素受体({\bf I n s R})是受体酪氨酸激酶(RTK)基因家族的成员(见第3章)。胰岛素对代谢的大部分作用涉及蛋白激酶Akt的激活,而Akt对细胞代谢具有多效性作用。
临床相关
MODY与β细胞转录因子
胰岛素基因表达和胰岛细胞生物发生依赖于胰腺、肝脏和肾脏特有的几种转录因子。这些转录因子包括肝细胞核因子4α(HNF-4α)、HNF-1α、胰岛素启动子因子1(IPF-1)、HNF- 1\upbeta 和神经源性分化1/β细胞E-box反式激活因子2(NeuroD1 \left(\mathfrak{p}_{2}\right))。这些因子之一的杂合性缺失突变会导致胰岛素逐渐不足的产生,并在25岁之前引发青年发病的成年型糖尿病(MODY)。MODY的特征是非酮症性高血糖,通常在儿童或青少年时期开始,且常无症状。除了这五种转录因子外,葡萄糖激酶的突变也会导致MODY。
InsR在细胞膜上以同源二聚体的形式表达,每个单体在胞质侧含有一个酪氨酸激酶结构域(见图39.9A)。胰岛素与受体的结合诱导亚基的交叉磷酸化。这些磷酸酪氨酸残基随后被胰岛素受体底物(IRS)蛋白结合(即IRS蛋白被“招募”到InsR)。IRS蛋白本身在特定的酪氨酸上被InsR磷酸化,然后招募磷酸肌醇-3-激酶(PI3K)到与InsR结合的IRS蛋白上(见图39.9B)。PI3K将磷酸肌醇-4,5-二磷酸(PIP2)转化为磷酸肌醇-3,4,5-三磷酸(PIP3)。PIP3是一种信息脂质,能够将蛋白质招募到膜上。在该通路中,PIP3将Akt蛋白激酶招募到细胞膜上并激活它。这种多效性的Akt蛋白激酶信号通路协调了胰岛素在肝细胞、骨骼肌和脂肪细胞中的多种代谢作用,包括(见图39.9C):
• 图39.8 胰岛素分泌的次级调节因子。缩写解释见正文。
- GLUT4葡萄糖转运蛋白向细胞膜的转运,从而使葡萄糖能够进入骨骼肌细胞和脂肪细胞。
- 激活多种蛋白磷酸酶(protein phosphatases),进而调节所有胰岛素靶细胞中多种代谢酶的活性。
- 激活蛋白质复合物雷帕霉素靶蛋白复合物1(mechanistic target of rapamycin complex 1, mTORC1),该复合物促进蛋白质合成,并可能抑制胰岛素靶细胞中蛋白酶体介导的蛋白质降解。
- 激活转录因子固醇调节元件结合蛋白1(sterol response element–binding protein 1, SREBP1)。SREBP1对胰岛素在肝脏中的作用尤为重要,它协调糖酵解和从头脂肪生成(de novo lipogenesis, DNL),将过量摄入的葡萄糖和果糖转化为磷脂、脂肪酸(FAs)和三酰甘油(TGs)。InsR/Akt信号通过直接激活SREBP1以及通过激活mTORC1间接激活SREBP1来刺激SREBP1。SREBP1还诱导催化磷酸戊糖途径(pentose phosphate pathway, PPP)氧化分支中第一个反应的酶。该反应生成辅酶NADPH,这是DNL途径所需的辅助因子。
- 转录因子FOXO1的失活。Akt介导的FOXO1磷酸化促进FOXO1的核排斥。在缺乏胰岛素/Akt信号的情况下,FOXO1诱导编码糖异生酶和参与肝脏极低密度脂蛋白(VLDL)组装和输出的蛋白质的基因表达。
Akt的这些作用将在后面详细讨论。InsR还通过Ras/Raf/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)途径促进某些靶细胞的增殖/更新(见图39.9B)。MAPK途径也参与一些代谢调节。
胰高血糖素
胰高血糖素是主要的反调节激素,主要通过其对肝脏葡萄糖输出的影响来增加血糖水平。胰高血糖素还增强肝细胞中线粒体内脂肪酸氧化和酮体生成。
胰高血糖素是分泌素基因家族的成员。前体前胰高血糖素(preproglucagon)包含胰高血糖素、GLP-1和GLP-2的氨基酸序列(图39.10)。前胰高血糖素在α细胞中以细胞特异性方式被蛋白水解切割,生成肽类胰高血糖素。胰高血糖素以未结合形式循环,半衰期短,约为6分钟。胰高血糖素降解的主要部位是肝脏,肝脏在一次循环中降解多达80%的循环胰高血糖素。由于胰高血糖素进入肝门静脉并在到达体循环之前被携带到肝脏,因此大部分激素从未到达体循环。肝脏是胰高血糖素的主要靶器官,对脂肪细胞的影响较小。骨骼肌不表达胰高血糖素受体。
• 图39.9 A,细胞膜中二聚化胰岛素受体的结构。B,InsR下游Akt激酶和MAPK途径的简化示意图。C,胰岛素/InsR激活的Akt激酶的作用总结。
• 图39.10 前胰高血糖素分子的不同蛋白水解切割模式。GLP,胰高血糖素样肽;GLUC,胰高血糖素;GRPP,胰高血糖素相关多肽。
胰高血糖素受体是一种Gs偶联的G蛋白偶联受体,它能够增加腺苷酸环化酶(adenylyl cyclase)的活性,从而提高cAMP水平。胰高血糖素通过PKA信号传导发挥许多快速作用。胰高血糖素还通过磷酸化和激活转录因子(如CREB,cAMP反应元件结合蛋白)发挥一些转录效应。
胰岛素-胰高血糖素比例决定了代谢途径对血糖的净效应。胰高血糖素分泌的主要刺激因素是血糖水平的下降。胰岛素抑制胰高血糖素的分泌,因此低血糖通过解除胰岛素的抑制作用间接影响胰高血糖素的分泌(图39.11)。最近的一些证据还表明,低血糖对α细胞有直接作用,能够增加胰高血糖素的分泌。
循环中的儿茶酚胺通过{\bf{\alpha}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{2}-肾上腺素能受体抑制\upbeta细胞分泌胰岛素,同时通过{\bf\beta_{\mu_{2}}}-肾上腺素能受体刺激\upalpha细胞分泌胰高血糖素(见图39.11)。血清中的氨基酸(AAs)也促进胰高血糖素的分泌。这意味着蛋白质餐会增加餐后胰岛素和胰高血糖素的水平(这有助于防止低血糖),而碳水化合物餐仅刺激胰岛素分泌。
• 图39.11 胰岛素和反调节因子(胰高血糖素和儿茶酚胺,如去甲肾上腺素、肾上腺素)对血糖的综合调节。
• 图39.12 肝细胞在消化期(^{\mathrm{{4}}}\mathrm{{D}}^{\mathrm{{9}}}数字)和空腹期(“F”数字)的代谢途径。反应/途径:\mathcal{I}D,葡萄糖激酶;1F;G6Pase;2D,糖原合成;2F_{:},糖原分解;3D,磷酸果糖激酶1;3F_{:},果糖-1,6-二磷酸酶;4D,葡萄糖-6-磷酸脱氢酶;5D,丙酮酸激酶;6D,丙酮酸脱氢酶;6F_{\mathrm{:}},丙酮酸羧化酶;7F_{:},磷酸烯醇式丙酮酸羧激酶;8D,ATP-柠檬酸裂解酶;9D,乙酰辅酶A羧化酶;9F,丙二酰辅酶A脱羧酶;10D,脂肪酸合成酶;11D,酯化和甘油三酯(TG)的形成;12D,丙二酰辅酶A(Mal CoA)对线粒体外膜上的脂肪酸辅酶A转运蛋白、肉碱/棕榈酰转运蛋白1(CPT1)的抑制作用;13F,脂肪酸辅酶A通过CPT1(和CPT2)进入线粒体并进行β-氧化生成乙酰辅酶A。
儿茶酚胺:肾上腺素和去甲肾上腺素
其他主要的反调节因子是儿茶酚胺类物质肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)。肾上腺素是肾上腺髓质的主要产物(见第43章),而去甲肾上腺素则从交感神经节后神经末梢释放(见第11章)。儿茶酚胺类物质的释放是对血糖浓度降低、各种形式的压力和运动的反应。血糖水平的降低(即低血糖)主要由中枢神经系统(CNS)的神经元感知,这些神经元通过下丘脑启动一个综合的交感反应。儿茶酚胺的直接代谢作用主要通过位于肌肉、脂肪和肝脏组织上的\mathbf{\alpha_{1}}^{\mathbf{\alpha}}、{\mathfrak{P}}_{2^{-}}和{\bf\beta}_{{\bf\beta}_{3}}肾上腺素能受体介导(见后文)。与胰高血糖素受体类似,\upbeta肾上腺素能受体({\upbeta}_{2}和\upbeta_{3})增加细胞内cAMP水平。
特定代谢反应和途径的激素调节
本节讨论肝细胞、骨骼肌细胞和脂肪细胞中参与综合代谢的主要途径。如需更详细的描述,学生可参考生物化学教材。
肝细胞代谢:消化期与空腹期
在肝脏中,胰岛素和胰高血糖素(以及儿茶酚胺)调节的一些关键代谢步骤如下(参见图39.12中的编号途径;“D”表示消化期,“F”表示空腹期):
- 捕获与释放细胞内葡萄糖。虽然葡萄糖通过不依赖胰岛素的GLUT2转运蛋白进入肝细胞,但胰岛素通过增加葡萄糖激酶(Pathway 1D)的表达来增加肝脏对葡萄糖的保留和利用。胰岛素通过增加转录因子固醇调节元件结合蛋白1C(SREBP1C)的表达和激活来增加葡萄糖激酶的基因表达,SREBP1C在进食状态下充当“主开关”,协调增加参与葡萄糖利用和新生脂肪生成(DNL;见图39.9C)的几种酶的水平。肝细胞还表达葡萄糖-6-磷酸酶(G6Pase;Pathway 1F),该酶将G6P转化回葡萄糖,然后葡萄糖可以通过GLUT2转运蛋白离开肝细胞。胰岛素通过抑制G6Pase酶的基因表达来防止葡萄糖磷酸化-去磷酸化的无效循环。转录因子FOXO1刺激G6Pase的基因表达。胰岛素激活的Akt激酶磷酸化并失活FOXO1(图39.9C)。在空腹期,FOXO1是活跃的并促进G6Pase的表达,而SREBP1C是不活跃的,不会刺激葡萄糖激酶的表达。因此,SREBP1C和FOXO1的相互调节主要取决于胰岛素的存在或缺失。
- 糖原合成与分解。胰岛素通过增加葡萄糖激酶(glucokinase)的表达间接促进糖原合成,因为高水平的G6P(葡萄糖-6-磷酸)通过变构作用增加糖原合酶(glycogen synthase)的活性。通过刺激特定的蛋白磷酸酶(protein phosphatases),胰岛素促进糖原合酶的去磷酸化,从而激活糖原合酶(图39.12,途径2D)。胰岛素还通过磷酸酶介导的糖原磷酸化酶(glycogen phosphorylase)的抑制,防止糖原合成到糖原分解的无用循环(途径2F)。胰高血糖素激活的PKA(蛋白激酶A)磷酸化磷酸化酶激酶(phosphorylase kinase),后者在空腹期(Fasting Phase)磷酸化并激活糖原磷酸化酶,促进糖原分解(途径2F)。
- 增加糖酵解。
A. 激活磷酸果糖激酶1(phosphofructokinase 1, PFK1)并抑制果糖-2,6-二磷酸酶(fructose-2,6-bisphosphatase)。胰岛素增加PFK1的活性,PFK1将果糖-6-磷酸(fructose-6-phosphate, F6P)磷酸化为果糖-1,6-二磷酸(fructose-1,6-bisphosphate)(途径3D)。该反应被称为糖酵解的“承诺”反应。胰岛素还抑制由糖异生酶果糖-1,6-二磷酸酶(fructose-1,6-bisphosphatase)催化的逆反应(途径3F)。胰岛素通过一个间接的两步机制调节这两种酶,如图39.13所示。该机制涉及一种称为PKFBP的双功能酶,它催化两种相反的反应:1)磷酸果糖激酶-2(phosphofructokinase-2, PFK2)和2)果糖-2,6-二磷酸酶(fructose-2,6-bisphosphatase, F-2,6-BPase)。胰岛素/Akt激活的蛋白磷酸酶促进PKFBP的去磷酸化,从而激活激酶功能(PFK2)并减弱磷酸酶功能(F-2,6BPase)。这将F6P磷酸化为果糖-2,6-二磷酸(fructose-2,6-bisphosphate, F-2,6-bisP)。F-2,6-bisP反过来结合并变构激活PFK1,从而推动糖酵解。F-2,6-bisP还竞争性抑制果糖-1,6-二磷酸酶(fructose-1,6-bisphosphatase, F-1,6BPase),从而阻止F6P到果糖-1,6-二磷酸再到F6P的无用循环(图39.13)。
B. 激活丙酮酸激酶(pyruvate kinase, PK)。PK催化磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)不可逆地转化为丙酮酸(pyruvate)(见图39.12中的途径5D)。同样,胰岛素/Akt激酶激活的蛋白磷酸酶使PK去磷酸化,从而激活该酶。胰岛素还通过SREBP1C增加P K基因的表达。最后,果糖-1,6-二磷酸(途径3D的产物)变构激活PK。相比之下,胰高血糖素和儿茶酚胺在空腹期促进PK的磷酸化,从而抑制糖酵解的最后一步。
- 激活丙酮酸脱氢酶(PDH)复合物。PDH复合物将丙酮酸转化为乙酰辅酶A(acetyl CoA),随后乙酰辅酶A与草酰乙酸(OA)缩合形成柠檬酸(citrate),从而进入三羧酸循环(TCA cycle)(图39.12,途径6D)。胰岛素通过Akt激酶激活PDH复合物磷酸酶,进而使PDH复合物去磷酸化并激活,从而增加PDH复合物的活性。增加肝内甘油三酯(TG)的合成。在消化阶段,部分乙酰辅酶A以柠檬酸的形式从线粒体转移到细胞质中,随后通过细胞质中的ATP-柠檬酸裂解酶(ATP-citrate lyase)将柠檬酸转化回乙酰辅酶A和草酰乙酸(途径8D)。胰岛素通过转录因子SREBP1C增加ATP-柠檬酸裂解酶的基因表达。一旦进入细胞质,乙酰辅酶A可以进入脂肪酸合成途径。第一步是通过乙酰辅酶A羧化酶(acetyl-CoA carboxylase)将乙酰辅酶A转化为丙二酰辅酶A(malonyl CoA)(途径9D)。胰岛素通过转录因子SREBP1C刺激乙酰辅酶A羧化酶的基因表达。胰岛素还促进乙酰辅酶A羧化酶的去磷酸化,从而激活该酶。丙二酰辅酶A通过脂肪酸合成酶(FASN)复合物反复添加乙酰基(由丙二酰辅酶A提供)转化为16碳脂肪酸棕榈酰辅酶A(palmitoyl CoA)(途径10D)。胰岛素通过转录因子SREBP1C增强FASN基因的表达。胰岛素还刺激甘油磷酸-脂肪酰基转移酶,将游离脂肪酸(FFAs)酯化为甘油-3-磷酸(G3P),形成肝内甘油三酯(途径11D)。
• 图39.13 胰岛素和反调节激素通过改变双功能酶磷酸果糖激酶2/果糖-2,6-二磷酸酶(PKFBP)的活性,从而调节磷酸果糖激酶1(PFK1;图39.12中的反应3D)和果糖-1,6-二磷酸酶(F1,6BPase;图39.12中的反应3F)的活性,进而影响变构调节代谢物果糖-2,6-二磷酸(F-2,6-bisP)的水平。F6P,果糖-6-磷酸。
棕榈酸合成需要辅酶NADPH。NADPH的主要来源是磷酸戊糖途径(PPP;见图39.12)。第一步反应是通过葡萄糖-6-磷酸脱氢酶(G6PD;步骤4D)将葡萄糖-6-磷酸(G6P)转化为6-磷酸葡萄糖酸内酯。胰岛素通过转录因子SREBP1C增加G6PD基因的表达。
通过激活导致丙二酰辅酶A生成的步骤,胰岛素间接抑制游离脂肪酸(FFAs)的氧化。丙二酰辅酶A抑制肉碱棕榈酰转移酶I(CPT-I)的活性,该酶负责将游离脂肪酸从细胞质转运到线粒体中(途径12D)。因此,通过从头脂肪合成(DNL)合成的游离脂肪酸无法被转运到线粒体中,从而无法进行β-氧化(途径13F)。因此,增加的丙二酰辅酶A阻止了游离脂肪酸合成与氧化的无效循环。
游离脂肪酸被肝脏转化为甘油三酯(途径11D),并储存在肝脏中或以极低密度脂蛋白(VLDL)的形式转运到脂肪组织和肌肉中(见后文)。胰岛素迅速促进VLDL载脂蛋白apoB-100的降解。这防止了肝脏在进餐时分泌VLDL,因为此时血液中富含来自胃肠道的乳糜微粒。因此,在进餐期间由胰岛素刺激产生的脂质在消化间期和禁食期间以VLDL的形式释放,为骨骼肌和心肌提供重要的能量来源。
- 糖异生酶丙酮酸羧化酶(pyruvate carboxylase, PC)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)的激活与抑制。丙酮酸也可以通过PC(Pathway 6F)转化为草酰乙酸(oxaloacetate, OA)。然而,胰岛素通过多种方式间接抑制这一反应。首先,如前所述,胰岛素激活丙酮酸脱氢酶(PDH),从而将丙酮酸从PC反应中分流出去。此外,PC被线粒体内高水平的乙酰辅酶A(acetyl CoA)变构激活。胰岛素通过激活胞质中的脂肪生成(DNL)来保持线粒体内乙酰辅酶A的低水平,DNL通过柠檬酸促进乙酰辅酶A从线粒体中移除。另一个关键机制是防止线粒体内脂肪酸(FFAs)的\upbeta-氧化,该过程会生成高水平的乙酰辅酶A。通过刺激DNL,胰岛素还增加了胞质中丙二酰辅酶A(malonyl CoA)的水平,从而抑制FFAs进入线粒体(Pathway 12D)。此外,胰岛素对胰高血糖素分泌和脂肪细胞内甘油三酯(TG)脂解的抑制作用,阻止了脂肪组织释放FFAs及其进入肝细胞的过程。
相反,在禁食阶段,低胰岛素水平与高胰高血糖素和/或儿茶酚胺共同刺激脂肪细胞释放FFAs(见后文),从而增加了FFAs进入肝细胞的流量。胰高血糖素还通过磷酸化并激活丙二酰脱羧酶(malonyl decarboxylase),将丙二酰辅酶A转化回乙酰辅酶A(Pathway 9F)。丙二酰脱羧酶的增强,加上由于低胰岛素水平导致的DNL普遍降低,减少了丙二酰辅酶A的水平,从而解除了对CPT1转运蛋白的抑制。这使得FFAs能够进入线粒体并经历\upbeta-氧化(Pathway 13F),生成高水平的线粒体内乙酰辅酶A,从而激活PC(Pathway 6F)并变构抑制PDH(Pathway 6D)。参与\upbeta-氧化的酶被PKA信号激活。胰高血糖素还激活转录因子PPARα,进一步诱导参与\upbeta-氧化的酶的表达。贝特类药物激活PPARα,促进肝内TG的氧化并改善胰岛素抵抗。
胞质中的丙酮酸可以通过多步过程生成,该过程涉及PC(Pathway 6F)、草酰乙酸(OA)转化为苹果酸(MAL)、MAL从线粒体中转移、转化回OA,然后转化为胞质中的丙酮酸。随后,丙酮酸可以通过磷酸烯醇式丙酮酸羧激酶(PEPCK;Pathway 7F)的作用转化为磷酸烯醇式丙酮酸(PEP),进入糖异生途径。胰岛素抑制糖异生酶PEPCK的基因表达。PEPCK主要在转录水平上受到调控,这部分解释了禁食阶段糖异生作用缓慢启动的原因。与对G6Pase的作用类似,FOXO1在禁食阶段刺激PEPCK的转录,而胰岛素/Akt激酶信号在消化阶段使FOXO1失活。胰高血糖素和儿茶酚胺在禁食阶段也通过PKA-CREB信号增加PEPCK的基因表达。因此,丙酮酸可以通过涉及四个不可逆且高度调控的反应的途径在肝细胞中生成葡萄糖:PC(反应6F)、PEPCK(反应7F)、F-1,6-BPtase(反应3F)和G6Ptase(反应1F)。
骨骼肌和脂肪组织代谢:消化阶段与禁食阶段
- 骨骼肌(图39.14)。葡萄糖耐量(glucose tolerance)指的是个体在消化期(Digestive Phase)后最小化血糖浓度升高的能力。胰岛素促进葡萄糖耐量的主要方式是通过激活骨骼肌中的葡萄糖转运蛋白。胰岛素刺激预先存在的含有GLUT4转运蛋白的囊泡向细胞膜转运(途径1D)。骨骼肌表达一种高亲和力的己糖激酶(hexokinase)同工酶,能够有效地将葡萄糖转化为葡萄糖-6-磷酸(glucose-6-P)(途径4D)。需要注意的是,肌肉不表达葡萄糖-6-磷酸酶(glucose-6-phosphatase),因此不能直接贡献于血糖。
胰岛素还促进葡萄糖以糖原(glycogen)的形式储存在肌肉中(途径2D),并通过糖酵解(glycolysis)、丙酮酸脱氢酶(PDH)、三羧酸循环(TCA)和氧化磷酸化(OxPhos)促进葡萄糖的氧化(途径3D/F)。在禁食期(Fasting Phase),低胰岛素水平导致细胞膜上的GLUT4转运蛋白数量减少(反应1F),因此这些细胞消耗的葡萄糖减少(葡萄糖节约)。骨骼肌纤维分解储存的糖原以供该纤维内部使用(途径2F和3D)。具有线粒体的骨骼肌纤维增加了对脂肪细胞释放的游离脂肪酸(FFAs)和肝细胞释放的酮体(KBs)的利用(途径3F)。骨骼肌细胞不表达胰高血糖素受体。游离脂肪酸和酮体的摄取及其氧化生成ATP的过程主要受细胞内\mathrm{Ca^{++}}水平、高AMP:ATP比率以及肾上腺素能刺激的调控。
- 脂肪细胞\rightarrow葡萄糖(图39.15A)。胰岛素也刺激依赖GLUT4的葡萄糖摄取。脂肪细胞也表达一种己糖激酶,能够有效地将葡萄糖转化为葡萄糖-6-磷酸(途径5D),并且与肌肉一样,不表达葡萄糖-6-磷酸酶。
胰岛素刺激脂肪组织中的后续糖酵解(途径1D和2D)。脂肪组织利用糖酵解来满足能量需求,同时也用于生成甘油-3-磷酸(G3P)(途径3D),这是将游离脂肪酸酯化为甘油三酯(TGs)所必需的(途径4D)。在禁食期,胰岛素水平较低,因此GLUT4向细胞膜的转运被阻断(途径1F)。
- 脂肪细胞\rightarrow游离脂肪酸(FFAs)和甘油三酯(TGs)(见图39.15B)。胰岛素刺激脂肪细胞内脂蛋白脂肪酶(LPL)的表达及其向脂肪毛细血管内皮顶端的迁移(途径1D)。胰岛素的这一作用使得LPL能够从脂肪组织毛细血管床中的乳糜微粒(chylomicrons)中提取游离脂肪酸(途径2D)。乳糜微粒残余物(CRs;稍后讨论)被肝脏清除。胰岛素还通过将游离脂肪酸转化为脂肪酰辅酶A(fatty acyl CoAs)来刺激其活化(途径3D)。如前所述,胰岛素刺激脂肪细胞中的糖酵解,生成甘油-3-磷酸,这是将游离脂肪酸与甘油-3-磷酸重新酯化为甘油三酯所必需的(途径4D)。脂肪细胞中的甘油三酯液滴被脂滴包被蛋白(perilipins, PL)包裹。胰岛素直接抑制激素敏感性脂肪酶(HSL;途径5D),从而促进游离脂肪酸的储存而非释放。在禁食期,胰高血糖素和儿茶酚胺通过磷酸化激活HSL(途径5F),从而促进从储存的甘油三酯中释放游离脂肪酸和甘油(途径6F)。在缺乏胰岛素的情况下,这两种脂解产物被输出到血液中。
• 图39.14 骨骼肌在消化期(“D”反应)与禁食期(“F”反应)的代谢。反应/途径:\mathcal{I}D,GLUT4转运蛋白向细胞膜的转位;1F,GLUT4转运蛋白向细胞膜转位的缺失;4D,葡萄糖转化为G-6-P;2D,糖原合成;^{2F,},糖原分解;3D,糖酵解和乳酸脱氢酶,或丙酮酸脱氢酶/TCA循环/氧化磷酸化(\mathrm{Ox}{\mathsf{P h o s}}),取决于肌纤维类型;3F_{:},FFAs的\upbeta氧化或酮体分解,随后进入TCA循环和氧化磷酸化。
反应/途径:1D和1F,GLUT4转运蛋白插入细胞膜或缺乏插入(见图39.14图例);5D,葡萄糖转化为G-6-P;_{2D},糖酵解,丙酮酸脱氢酶/TCA循环/氧化磷酸化;3D,甘油-3-磷酸脱氢酶;4D,FFAs酯化为G3P形成甘油三酯。B,脂肪细胞在消化期(“D”途径)和禁食期(“F”途径)的脂质代谢。反应/途径:1D,脂蛋白脂肪酶(L P L)的合成和LPL分泌到毛细血管下间隙,与GPI锚定蛋白结合(粗红线),并迁移到毛细血管内皮细胞的腔面;2D,乳糜微粒TG的脂解并释放游离FFA(消化后,乳糜微粒残体(CR)被肝脏从循环中清除);3D,通过将FFAs转移到乙酰CoA形成脂肪酰CoA来激活导入的FFAs;4D,脂肪酰CoAs酯化为G3P形成TG);5D,激素敏感性脂肪酶(HSL)的去磷酸化和失活,从而促进TG的储存;5F,HSL的磷酸化和激活,有助于TG的完全脂解;6F,单甘油酯脂肪酶在TG脂肪酶的最后一步释放FFA和甘油。
所有激素靶细胞中的蛋白质代谢:消化期与禁食期
胰岛素通过刺激氨基酸摄取和mRNA翻译促进肌肉和脂肪组织中的蛋白质合成。胰岛素还抑制蛋白质分解。尽管肝脏使用氨基酸进行ATP合成,但胰岛素在消化期也促进蛋白质的合成,并减弱肝脏中尿素循环酶的活性。胰高血糖素和儿茶酚胺在禁食期激活蛋白质的蛋白酶体降解和氨基酸的释放。
脂蛋白的代谢作用:消化期与禁食期
本节概述了脂蛋白代谢,如图39.16所示。更多详细信息,请参考生物化学教科书。
游离脂肪酸(FFAs)在血液中主要与白蛋白结合循环。然而,甘油三酯(TG)、游离胆固醇、胆固醇酯、磷脂以及一些脂溶性维生素,由于它们都是疏水性的,会倾向于进入内皮细胞的膜而不是在血液中循环,因此它们通过血液运输时是以脂质聚集体的形式(即上述物质的混合物)与特定的载脂蛋白结合。这些脂质-蛋白质复合物被称为脂蛋白。富含TG的脂蛋白包括乳糜微粒和极低密度脂蛋白(VLDL),它们的主要功能是将FFAs(以TG的形式)输送到骨骼肌和心肌以提供能量,或输送到脂肪细胞以储存。富含胆固醇的脂蛋白包括低密度脂蛋白(LDL)和高密度脂蛋白(HDL),它们将胆固醇输送到增殖细胞、类固醇生成细胞和产生胆汁的肝细胞。HDL还从外周清除多余的胆固醇(例如,来自巨噬细胞吞噬的死亡细胞)。此外,还有一些脂蛋白的“残余物”,它们的脂质部分被消化后由肝脏从循环中清除。
消化阶段:乳糜微粒和乳糜微粒残余物(图39.16A)
膳食中的TG在肠道腔内被酶解为FFAs和2-单甘油酯。肠道上皮细胞吸收这两种脂质并将它们重新酯化为TG。TG与脂溶性维生素、胆固醇、胆固醇酯和磷脂一起,与载脂蛋白ApoB48结合形成乳糜微粒。乳糜微粒被分泌后进入淋巴系统,最终进入血液循环。在血液中,其他载脂蛋白如ApoE和ApoC2从HDL颗粒转移到乳糜微粒上(HDL的一个功能是提供各种载脂蛋白的循环储备)。这使新生的乳糜微粒转化为成熟的乳糜微粒。
• 图39.16 脂蛋白在能量代谢中的作用。A,消化阶段。B,空腹阶段。
当乳糜微粒在消化阶段进入脂肪组织的毛细血管时,它们会被脂蛋白脂肪酶(LPL)部分消化。LPL由脂肪细胞合成并分泌到内皮下层空间。LPL随后与内皮膜上的GPI锚定蛋白结合,后者将LPL转运到毛细血管内皮细胞的腔面(顶端)。一旦到达这个位置,LPL分子就会与乳糜微粒接触。乳糜微粒中的ApoC2是LPL二聚化和活化的激活剂。FFAs通过LPL介导的TG脂解从乳糜微粒中释放出来。(关于FFAs在脂肪细胞内转化为储存TG的过程,请参见前面的讨论和图39.15B。)
LPL也在心肌和骨骼肌中表达。心肌优先使用FFA作为能量来源,并从脂蛋白颗粒中获得大部分FFAs(图39.16)。因此,心肌在消化阶段也从乳糜微粒中提取FFA。心肌细胞中LPL的活性受到局部因素的高度调控,例如冠状动脉毛细血管床中FFAs的局部浓度。在消化阶段,骨骼肌中的LPL活性相对较低。
在脂肪组织和心肌毛细血管床内经过脂解消化后,乳糜微粒(chylomicrons)被转化为更小、密度更高的乳糜微粒残粒(chylomicron remnants, CRs),此时其甘油三酯(TG)含量降低。CR颗粒能够在内皮功能障碍的部位穿透血管内膜,因此具有致动脉粥样硬化性。由于它们仍然与ApoE蛋白结合,它们可以结合到识别ApoE的几种膜受体之一。结合的CR随后被肝细胞(hepatocytes)内吞(见Fig. 39.16)。CR内吞后释放的剩余游离脂肪酸(FFAs)被重新酯化为肝内TG。
空腹阶段:VLDL、IDL和LDL(Fig. 39.16B)
在空腹阶段,循环中的TG主要来源于肝脏(见Fig. 39.16)。在消化阶段,肝内TG通过从头合成(DNL)和内吞的CR积累。肝内TG与其他脂质(包括胆固醇和胆固醇酯)一起,由肝细胞以极低密度脂蛋白(VLDL)的形式输出。VLDL颗粒是由与ApoB100蛋白复合的脂质组装而成。ApoB100的表达以及参与VLDL组装的其他成分,受到转录因子FOXO1的刺激。
• Fig. 39.17 瘦素(Leptin)与参与食欲调节的下丘脑中枢。缩写解释见正文。
FOXO1反过来受到胰岛素信号通路的抑制。这意味着在血液中富含乳糜微粒时,肝脏的VLDL产量最低。在空腹阶段,胰岛素水平较低,因此FOXO1活性较高,VLDL的组装和分泌恢复。一旦VLDL颗粒进入循环,它们会接受其他载脂蛋白(如ApoE、ApoC2)并成为成熟的VLDL。
在禁食阶段,脂肪细胞表现出较低的脂蛋白脂肪酶(LPL)活性,部分原因是胰岛素水平较低。然而,心肌细胞和骨骼肌细胞表达LPL,LPL在禁食阶段消化极低密度脂蛋白(VLDL)并为这些肌肉细胞类型提供游离脂肪酸(FFA)。从VLDL中脂解提取一些FFA会产生一种称为中间密度脂蛋白(IDL)的残余颗粒。IDL循环到肝脏,在那里它以两种方式之一进行处理(见图39.16)。大约一半的IDL与肝细胞上的几种ApoE识别受体之一结合,经历受体介导的内吞作用,并在内溶酶体中被消化。释放的脂质可以重新组装成VLDL颗粒并返回循环,随着禁食阶段的进展为心脏和骨骼肌提供燃料。另一半IDL经历肝细胞特异性LPL相关酶肝脂肪酶(HL)的进一步消化。HL提取IDL中大部分剩余的甘油三酯(TG),形成VLDL的最终残余物,即低密度脂蛋白(LDL)。LDL的TG含量低但胆固醇含量高。需要注意的是,成熟的乳糜微粒和VLDL在循环过程中可以通过胆固醇酯转运蛋白(CETP)的作用从高密度脂蛋白(HDL)中获得额外的胆固醇,因此残余颗粒(ChyR、IDL和LDL)的胆固醇含量可能会有所不同。无论如何,LDL颗粒是一种小而密、富含胆固醇的颗粒,在内皮损伤的情况下可能具有极强的致动脉粥样硬化性。LDL颗粒通过LDL受体安全地导入细胞。需要注意的是,在IDL转化为LDL的过程中,ApoE蛋白从颗粒中解离。这意味着只有ApoB100受体可以从血液中清除LDL。与多种ApoE受体不同,只有一种受体,即LDL受体,可以识别并结合ApoB100。因此,功能性LDL受体的丧失或减少具有重要的临床后果(见细胞水平框)。LDL受体在增殖细胞上表达,包括一些需要合成新细胞膜的癌细胞。LDL受体也在类固醇生成细胞上表达,这些细胞使用胆固醇制造类固醇激素。LDL摄取的主要部位是肝脏,肝脏将胆固醇以及基于胆固醇的胆汁酸作为胆汁分泌到胆道系统中。一些胆固醇通过肠道排泄。其他胆固醇副产物(如类固醇激素)主要在肾脏排泄。
细胞水平
SREBP2被发现为驻留在内质网(ER)膜中的转录因子。在高细胞内胆固醇存在的情况下,SREBP2被一种称为SCAP(SREBP裂解激活蛋白)的脂质感应蛋白保持在ER中。在固醇耗竭的情况下,SCAP将SREBP2护送到高尔基体,在那里SREBP被蛋白酶依次裂解并释放到细胞质中。SREBP2随后转移到细胞核并增加涉及胆固醇合成和摄取的基因的转录。最近发现的该转录因子家族成员是SREBP1C,它在脂肪和肝脏中高度表达。与SREBP2不同,SREBP1C刺激涉及脂肪酸(FA)和甘油三酯(TG)合成的基因。SREBP1C的调节发生在SREBP1C基因的转录水平,多不饱和脂肪酸诱导其裂解,MAPK通路激活其活性。
过氧化物酶体增殖激活受体(Peroxisome proliferation activator receptors, PPARs)属于核激素受体超家族,该家族还包括类固醇激素受体和甲状腺激素受体。PPARs与视黄醇X受体(retinoid X receptors, RXRs)形成异二聚体。与类固醇和甲状腺激素受体不同,PPARs以微摩尔范围内的亲和力与配体结合(即亲和力较低)。PPARs能够结合饱和和不饱和脂肪酸,以及天然和合成的类前列腺素。PPARγ在脂肪组织中高度表达,在骨骼肌和肝脏中表达水平较低。其天然配体包括多种多不饱和脂肪酸。PPARγ调控促进脂肪储存的基因。它还与SREBP1C协同作用,促进前脂肪细胞向脂肪细胞的分化。在小鼠中组织特异性敲除PPARγ,以及在人类中PPARγ显性负突变,会导致脂肪营养不良(即缺乏白色脂肪组织),从而导致肌肉和肝脏中甘油三酯(TG)的沉积(称为脂肪变性)、胰岛素抵抗、糖尿病和高血压。噻唑烷二酮类是PPARγ的外源性配体。尽管它们会促进体重增加,但中等剂量的噻唑烷二酮类显著改善胰岛素敏感性。PPARγ还刺激脂联素的分泌,脂联素促进肌肉和脂肪中脂质的氧化,从而改善胰岛素敏感性。PPARα在肝脏中大量表达,在骨骼肌、心肌和肾脏中表达较少。PPARα促进游离脂肪酸(FFAs)的摄取和氧化。因此,PPARα是一种抗脂肪变性的分子。贝特类药物是PPARα的外源性配体,用于减少肌肉和肝脏中的TG沉积,从而改善胰岛素敏感性。第三个成员PPARδ同样促进脂肪和肌肉组织中的脂肪酸氧化。PPARδ促进慢肌氧化纤维的发育,并增加肌肉耐力。PPARδ通过增加载脂蛋白A(ApoA)的产生和高密度脂蛋白(HDL)颗粒的数量,对脂蛋白代谢产生积极影响。
另一个脂质感应转录因子家族是肝脏X受体(liver X receptor, LXR)家族,由LXRα和\mathsf{L X R}\mathsf{\beta}组成。LXRα主要在脂肪组织、肝脏、肠道和肾脏中表达,而\mathsf{L X R}\mathsf{\beta}则广泛表达。LXRs与PPARs相关,因为它们都属于核激素受体家族,并与RXR形成异二聚体。LXRs是胆固醇感应器。在高胆固醇条件下,LXRs上调ATP结合盒(ATP-binding cassette, ABC)蛋白的表达。在胆固醇过量的情况下,LXRs还增加胃肠道中ABC蛋白的表达,促进胆固醇从肠细胞向肠腔的流出以进行排泄。这些转运蛋白(ABCG5和ABCG8)的突变会导致谷固醇血症,其特征是胆固醇和植物固醇的过度吸收。在肝脏中,LXRs促进胆固醇转化为胆汁酸以进行排泄,或转化为胆固醇酯以进行储存。在后一种作用中,LXRs增加SREBP1C的表达,从而增加酯化所需的脂肪酰辅酶A。
糖尿病(Diabetes mellitus)是一种疾病,其特征是胰岛素水平或组织对胰岛素的反应性(或两者)不足以维持正常的血浆葡萄糖水平。尽管糖尿病的诊断主要基于血浆葡萄糖水平,但糖尿病还会导致循环中脂质和脂蛋白水平的不平衡(即血脂异常)。糖尿病的主要症状包括高血糖、多尿、多饮、多食、肌肉消耗、电解质耗竭和酮症酸中毒(在T1DM中)。在正常空腹状态下(即至少8小时无热量摄入),血浆葡萄糖水平应低于110 mg/dL。如果空腹血浆葡萄糖水平在110至126 mg/dL之间,则认为患者存在葡萄糖控制受损,如果连续两天空腹血浆葡萄糖水平超过126 mg/dL,则可诊断为糖尿病。另一种诊断糖尿病的方法是口服葡萄糖耐量试验。在过夜空腹后,患者口服一定量的葡萄糖(通常为75 g),并在2小时后测量血糖水平。如果连续两天2小时血浆葡萄糖浓度超过200 mg/dL,则足以诊断为糖尿病。如果患者有与糖尿病相关的症状,并且非空腹血浆葡萄糖水平超过200 mg/dL,也可诊断为糖尿病。
糖尿病目前分为1型(T1DM)和2型(T2DM)。T2DM是目前更为常见的形式,占诊断病例的90%。然而,T2DM通常是一种进展性疾病,在相当比例的患者中多年未被诊断。T2DM通常与内脏肥胖和缺乏运动有关——事实上,与肥胖相关的T2DM在全球范围内已达到流行病的比例。通常,T2DM的发展在个体中有多种原因,这些原因与靶器官对胰岛素反应能力的缺陷(即胰岛素抵抗)以及一定程度的β细胞功能不足有关。胰岛素敏感性可能在InsR水平或受体后信号传导水平上受到损害。T2DM似乎是胰岛素抵抗的结果,随后是反应性高胰岛素血症,但最终是相对低胰岛素血症(即胰岛素释放不足以补偿终末器官的抵抗)和β细胞衰竭。
胰岛素抵抗的根本原因在患者之间有所不同。肥胖引起的胰岛素抵抗的三大根本原因是:
- 胰岛素增加GLUT4介导的葡萄糖摄取能力下降,尤其是在骨骼肌中。这一功能是胰岛素对葡萄糖代谢调节的一部分,可能是由于肥胖个体肌肉中TG的过度积累所致。过量的热量摄入会诱导高胰岛素血症。最初,这会导致骨骼肌中葡萄糖的过度摄取。正如在肝脏中一样,过量的葡萄糖形式的热量会促进脂肪生成,并通过生成丙二酰辅酶A抑制脂肪酸辅酶A的氧化。脂肪酸和TG合成的副产物(如二酰甘油、神经酰胺)可能会积累并刺激信号通路(如依赖蛋白激酶C的通路),这些通路会拮抗来自InsR或IRS蛋白的信号传导,或两者兼而有之。因此,肥胖个体骨骼肌中的胰岛素抵抗可能是由于脂毒性所致。
- 胰岛素抑制肝脏葡萄糖生成的能力下降。肝脏在短期内通过糖原分解(glycogenolysis)生成葡萄糖,在长期则通过糖异生(gluconeogenesis)生成葡萄糖。在胰岛素抵抗的个体中,胰岛素抑制这两条途径中关键肝脏酶的能力减弱。肝脏的胰岛素抵抗也可能与肥胖个体的脂毒性(lipotoxicity)有关(例如,脂肪肝或肝脂肪变性(hepatic steatosis))。除了脂毒性的影响外,内脏脂肪组织还可能通过多种方式影响肝脏的胰岛素信号传导。例如,内脏脂肪组织释放细胞因子肿瘤坏死因子(TNF)-\upalpha,该因子已被证明可以拮抗胰岛素信号通路。此外,内脏脂肪组织中的甘油三酯(TG)具有较高的周转率(可能是由于丰富的交感神经支配),因此肝脏暴露于高水平的游离脂肪酸(FFAs),这进一步加剧了肝脏的脂毒性。
- 胰岛素无法抑制脂肪组织中的激素敏感性脂肪酶(hormone-sensitive lipase, HSL)或增加脂蛋白脂肪酶(lipoprotein lipase, LPL)(或两者兼有)。高HSL和低LPL是与胰岛素抵抗和糖尿病相关的血脂异常(dyslipidemia)的主要因素。尽管抵抗胰岛素对HSL和LPL作用的因素尚未完全明确,但有证据表明脂肪组织中旁分泌的致糖尿病因子(如TNF-\upalpha)的产生增加。这种血脂异常的特征是高甘油三酯血症(hypertriglyceridemia),伴有肝脏产生的大量富含TG的极低密度脂蛋白(VLDL)颗粒。由于其高TG含量,大颗粒的VLDL和中间密度脂蛋白(IDL)被非常有效地消化,从而产生小而致密的低密度脂蛋白(LDL)颗粒,这些颗粒具有极强的致动脉粥样硬化性。此外,高密度脂蛋白(HDL)通过交换胆固醇酯来摄取过量的TG,这似乎缩短了HDL和载脂蛋白A(ApoA)的循环半衰期。因此,HDL颗粒的水平降低,而HDL通常在血管疾病中起到保护作用。
T1DM(1型糖尿病)的特征是β细胞的破坏,几乎总是由自身免疫机制引起。T1DM也被称为胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus)。T1DM的特征包括:
- T1DM患者需要外源性胰岛素来维持生命并预防酮症(ketosis);几乎不产生胰腺胰岛素。
- 胰腺β细胞存在病理损伤。在疾病发作时,胰腺单核细胞浸润的胰岛炎(insulitis)是一个特征性表现。细胞因子可能在胰腺的早期破坏中起作用。
- T1DM患者容易发生酮症酸中毒(ketoacidosis)。
- 90%的病例始于儿童期,大多在10至14岁之间。这一常见观察结果导致该疾病被称为青少年糖尿病(juvenile diabetes)。这一术语不再使用,因为T1DM可以在生命的任何阶段发生,尽管青少年发病是典型模式。
- 在发病时,胰岛细胞自身抗体(islet cell autoantibodies)通常存在。如果T1DM由病毒诱发,这些自身抗体是短暂的。偶尔,抗体会长期存在,特别是如果它们与其他自身免疫性疾病相关。大约50%的T1DM与6号染色体上的主要组织相容性复合体(major histocompatibility complex)问题有关。它与某些人类白细胞抗原(HLA)等位基因的频率增加相关。HLA类型DR3和DR4最常与糖尿病相关。
瘦素(Leptin)与能量平衡
白色脂肪组织(WAT, White adipose tissue)由多种细胞类型组成。储存甘油三酯(TG, triglyceride)的细胞被称为脂肪细胞(adipocyte)。这些细胞在人类妊娠期间由前脂肪细胞(preadipocyte)发育而来。脂肪细胞分化的过程可能持续一生,这一过程由多种转录因子促进。其中一种因子是SREBP1C,它被脂质、胰岛素以及多种生长因子和细胞因子激活。WAT中另一个重要的转录因子是PPARγ。激活的PPARγ促进与TG储存相关的基因表达。因此,食物摄入的增加会导致SREBP1C和PPARγ的激活,从而促进前脂肪细胞分化为小脂肪细胞,并上调这些细胞内的酶,以便储存多余的脂肪。
瘦素(Leptin)
脂肪组织产生多种旁分泌和内分泌因子。瘦素(Leptin)是一种由脂肪细胞衍生的蛋白质,它向大脑下丘脑传递关于脂肪量和营养状况的信息,从而控制进食行为和能量消耗。瘦素缺乏的小鼠和人类会变得极度肥胖。这些发现最初让人们希望瘦素疗法可以用于对抗病态肥胖。然而,对饮食诱导的肥胖患者施用瘦素并没有显著的厌食或能量消耗效果。事实上,肥胖个体的内源性循环瘦素水平已经升高,并且似乎已经产生了瘦素抵抗。
瘦素在外周组织的脂质调节中具有重要作用。瘦素通过将多余的热量摄入引导到脂肪组织中储存,从而保护外周组织(如肝脏、骨骼肌、心肌、β细胞)免受过多脂质积累的影响。瘦素的这一作用虽然与胰岛素的促脂生成作用相反,但对维持外周组织的胰岛素敏感性(定义为胰岛素依赖的葡萄糖摄取)有显著贡献。瘦素还作为一种信号,表明身体有足够的能量储备以允许繁殖,并增强红细胞生成、淋巴细胞生成和髓细胞生成。例如,在患有神经性厌食症的女性中,瘦素水平极低,导致卵巢类固醇水平低、闭经(无月经出血)、红细胞生成减少引起的贫血以及免疫功能失调。
结构、合成与分泌
瘦素是一种由成熟脂肪细胞分泌的16 kDa蛋白质,其结构与细胞因子相关。因此,它有时被称为脂肪细胞因子(adipocytokine)。循环中的瘦素水平与脂肪量和营养状况有直接关系。瘦素的分泌由胰岛素增加,胰岛素为身体正确分配摄入的营养做好准备。瘦素在禁食、体重减轻以及脂解信号(如cAMP增加和β3-激动剂)的作用下受到抑制。
饮食诱导的肥胖、高龄和2型糖尿病(T2DM, Type 2 Diabetes Mellitus)与瘦素抵抗有关。因此,关闭瘦素信号传导的机制是潜在的治疗靶点。
能量储存
个体储存的能量量由每日摄入的卡路里和消耗的卡路里决定。在许多个体中,摄入和消耗是平衡的,因此体重保持相对稳定。然而,廉价的高脂肪、高碳水化合物食物的丰富供应,以及更为久坐的生活方式,目前正在导致肥胖及其病理后遗症(包括T2DM和心血管疾病)的流行。
储存的能量主要由脂肪组成,个体之间脂肪组织的量和占体重的百分比差异很大。大约25%的总体脂肪差异似乎是由遗传因素造成的。遗传对脂肪量的影响得到了以下支持:(1) 被收养儿童的体重与其生物学父母的相关性比与其养父母的相关性更好;(2) 同卵双胞胎(monozygotic twins)的脂肪储存比异卵双胞胎(dizygotic twins)更为相似,无论是一起抚养还是分开抚养;(3) 当摄入过量卡路里时,同卵双胞胎之间的体重增加和腹部脂肪的相关性比异卵双胞胎更大;(4) 发现了几种导致肥胖的基因。
此外,妊娠环境对成年后的体重有深远影响。母体饮食对后代体重和身体组成的影响被称为胎儿编程(fetal programming)。低出生体重与肥胖、心血管疾病和糖尿病的风险增加相关。这些发现表明,胎儿代谢的效率具有可塑性,并可以被子宫内环境改变。对于出生在营养不良的母亲和长期营养不良的生活环境中的个体来说,发展出“节俭”代谢将是有利的。
体重指数
衡量肥胖的一个指标是体重指数(BMI)。个体的BMI计算如下:
#公式 39.1
$$
\mathrm{{BMI}=\mathrm{{体重}\left(kg\right)/身高\left(m\right)^{2}}}
$$
健康瘦个体的BMI范围在20到25之间。BMI大于25表示个体超重,而BMI高于30则表示肥胖。超重或肥胖状态是多种病理的风险因素,包括胰岛素抵抗、血脂异常、糖尿病、心血管疾病和高血压。
WAT组织分为皮下和腹腔内(内脏)储存库。腹腔内WAT主要指网膜和肠系膜脂肪,是两者中较小的储存库。这些储存库接受不同的血液供应,其静脉回流方式也根本不同,腹腔内脂肪的静脉回流进入肝门系统。因此,腹腔内来源的FFA主要由肝脏清除,而皮下脂肪是运动或禁食期间向肌肉提供FFA的主要部位。腹腔内和皮下脂肪组织的调节也有所不同。腹部脂肪高度受自主神经支配,周转率更高。此外,这两个储存库在激素产生和酶活性方面表现出差异。
男性倾向于在腹腔内脂肪库(android [苹果形] 肥胖)中积累脂肪,而女性则倾向于在皮下脂肪库中积累脂肪,特别是在大腿和臀部(gynecoid [梨形] 肥胖)。显然,腹部脂肪过多对前述病理状况构成了更大的风险因素。因此,另一个身体成分的指标是腰围(在呼气后从前视图测量肋骨和臀部之间最窄点的周长,单位为英寸)除以臀围(从侧面视图测量臀部最大点的周长)。这个腰臀比可能是比BMI更好的体脂指标,尤其是与疾病发展风险相关时。男性的腰臀比大于0.95或女性的腰臀比大于0.85与显著更高的糖尿病和心血管疾病风险相关。
能量平衡的中枢机制
近年来,许多激素和神经肽已被证明在人类的食欲、饱腹感和能量消耗的慢性和急性调节中起作用。一个简化的模型涉及两种肽激素,瘦素和胰岛素(见图39.17),已经讨论过。瘦素作用于下丘脑弓状核中的至少两种神经元类型。在第一种神经元中,瘦素抑制神经肽Y(NPY)的产生,NPY是一种非常有效的食物寻求行为(能量摄入)的刺激剂和能量消耗的抑制剂。去甲肾上腺素,另一种食欲刺激剂,与NPY在这些神经元中的一些中共定位。同时,瘦素抑制agouti相关肽(AGRP)的产生,AGRP是一种内源性拮抗剂,作用于MC4R,即下丘脑中抑制食欲的肽\upalpha -黑色素细胞刺激激素(α-MSH)的受体,从而抑制食物摄入。在另一种弓状神经元中,瘦素刺激前阿片黑皮质素(POMC)产物的产生,其中之一是α-MSH,以及可卡因-安非他明调节转录物(CART)的产生,这两者都抑制食物摄入。因此,瘦素通过同时抑制NPY和\upalpha -MSH拮抗剂AGRP,并刺激\upalpha -MSH和CART,减少食物消耗并增加能量消耗(见图39.17)。这些二级神经肽被传递到并与下丘脑室旁核(“饱腹感”神经元)和外侧下丘脑核(“饥饿”神经元)中的神经元受体相互作用。反过来,这些下丘脑神经元产生信号,协调进食行为和自主神经系统活动(尤其是交感神经输出)与对甲状腺功能、生殖和生长的多种内分泌作用。
另一个调节食物摄入和身体能量储存的分子是黑色素浓缩激素(MCH)。这种神经肽通过拮抗\upalpha -MSH与其MC4R受体相互作用后的饱腹效应,增加食物寻求和脂肪组织。这种分子的可能重要性通过以下事实得到证明:它是唯一一个通过基因敲除导致消瘦的调节剂。
为了维持整体的能量稳态,系统还必须平衡特定营养素的摄入和消耗——例如,碳水化合物的摄入与碳水化合物的氧化。这可能解释了神经肽和神经递质对餐食反应的一些特异性。摄入葡萄糖后,血清素(serotonin)会产生饱腹感。胃肠道激素如胆囊收缩素(cholecystokinin)和GLP-1通过体液效应产生饱腹感,但它们在大脑中的局部产生可能参与了营养素和热量的调节。最近发现的激素胃饥饿素(ghrelin)是一种酰化肽,具有强烈的促食欲活性,由胃的泌酸腺细胞产生。在人类正常进餐前的1到2小时内,血浆中的胃饥饿素水平会上升。进食后约1小时,血浆中的胃饥饿素水平急剧下降至最低值。胃饥饿素似乎通过与下丘脑神经元中表达NPY的受体反应来刺激食物摄入。
关键概念
- 细胞通过产生ATP来满足其能量需求。ATP通过糖酵解和与氧化磷酸化耦合的三羧酸循环(TCA cycle)产生。
- 细胞可以氧化碳水化合物(主要以葡萄糖的形式)、氨基酸(AAs)和游离脂肪酸(FFAs)来产生ATP。此外,肝脏在禁食期间会生成酮体(KBs)供其他组织氧化以获取能量。
- 某些细胞类型在能够氧化的能量底物方面受到限制。大脑通常完全依赖葡萄糖作为能量来源。因此,血糖必须维持在60\mathrm{{mg/dL}}以上,以保证正常的自主神经和中枢神经系统功能。相反,不适当的高血糖水平(即空腹血糖> 100mg/dL)会促进葡萄糖毒性,从而导致糖尿病的长期并发症。
- 内分泌胰腺产生胰岛素(insulin)、胰高血糖素(glucagon)、生长抑素(somatostatin)、胃泌素(gastrin)和胰多肽(pancreatic polypeptide)。
- 胰岛素是一种合成代谢激素,在营养物质过剩时分泌。它使身体能够利用碳水化合物作为能量来源并储存营养物质。
- 胰岛素分泌的主要刺激因素包括血清葡萄糖的增加和一些氨基酸。胆碱能(毒蕈碱)受体的激活也会增加胰岛素分泌,而{\bf{\alpha}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}}{\bf{{\alpha}}}_{{\bf{{\alpha}}}} -肾上腺素能受体的激活则会抑制胰岛素分泌。胃肠道释放的肠促胰岛素激素会刺激胰腺分泌胰岛素。GLP-1在增强葡萄糖依赖性胰岛素分泌刺激(GSIS)方面特别有效。GLP-1被二肽基肽酶(DPP)-4降解。目前使用DPP-4抗性GLP-1类似物和DPP-4抑制剂来增加2型糖尿病患者的GSIS。
- 胰岛素与胰岛素受体(InsR)结合,该受体与介导胰岛素代谢(Akt激酶)和生长效应(MAPK)的多种途径相连。
- 在消化阶段,胰岛素作用于肝脏,促进葡萄糖以G6P的形式被捕获。胰岛素还增加肝脏中的糖原生成、糖酵解和从头脂肪生成(DNL)。胰岛素抑制糖异生、糖原分解和脂质组装成极低密度脂蛋白(VLDL)。
- 胰岛素增加肌肉和脂肪组织中GLUT4介导的葡萄糖摄取。
- 胰岛素增加肌肉中的糖原生成、糖酵解,并在热量过剩时增加脂肪生成。
- 胰岛素增加脂肪细胞中的糖酵解和G3P的生成。胰岛素诱导LPL的表达并将其转运至毛细血管内皮细胞的管腔侧。胰岛素促进FFA的摄取和活化,以及脂肪酸酰基CoA与G3P的酯化反应以形成TG,并降低脂肪细胞中激素敏感性脂肪酶的活性。
- 胰岛素增加骨骼肌中氨基酸的摄取和蛋白质合成,同时也作用于几乎所有胰岛素靶细胞。胰岛素/Akt激酶信号通路激活mTORC1和S6K,促进核糖体蛋白和参与mRNA翻译的蛋白质以及其他类型蛋白质的合成。胰岛素抑制蛋白质的蛋白酶体降解。
- 胰高血糖素是一种分解代谢的对抗调节激素。在食物匮乏期间,其分泌增加,并作用于动员营养储备。它还动员糖原、脂肪甚至蛋白质。
- 胰高血糖素的释放是对血清葡萄糖降低(因此胰岛素减少)和血清氨基酸水平升高以及\upbeta-肾上腺素能信号传导的响应。
- 胰高血糖素与胰高血糖素受体结合,该受体与PKA依赖性通路相连。胰高血糖素的主要靶器官是肝脏。胰高血糖素通过增加糖原分解和糖异生来增加肝脏葡萄糖输出。它增加脂肪酸的\upbeta-氧化和酮体生成。
- 胰高血糖素通过基因表达的调控和翻译后PKA依赖性通路来调节肝脏代谢。
- 肌肉和脂肪组织中的主要对抗调节因子是肾上腺激素肾上腺素和交感神经递质去甲肾上腺素。这两个因子通过β2-和{\upbeta}_{3}-肾上腺素能受体作用,增加cAMP水平。肾上腺素和去甲肾上腺素增强肌肉中的糖原分解和脂肪酸氧化,并增加脂肪组织中的激素敏感性脂肪酶。
- 糖尿病分为1型(T1DM)和2型(T2DM)。T1DM的特征是胰腺β细胞的破坏,治疗需要外源性胰岛素。T2DM可能由多种因素引起,但通常被描述为胰岛素抵抗伴随一定程度的β细胞功能不足。T2DM患者在某些时候可能需要外源性胰岛素以维持血糖水平。
- 与肥胖相关的T2DM目前在全球范围内呈流行趋势,其特征是由于脂肪毒性、高胰岛素血症和脂肪组织产生的炎症因子导致的胰岛素抵抗。T2DM常与肥胖、胰岛素抵抗、高血压和冠状动脉疾病相关。这一系列风险因素被称为代谢综合征。
- 糖尿病的主要症状包括高血糖、多尿、多饮、多食、肌肉消耗、电解质耗竭和酮症酸中毒(在T1DM中)。
- 控制不良的糖尿病的长期并发症是由于细胞内葡萄糖过多(葡萄糖毒性),尤其是在视网膜、肾脏和周围神经中。这导致视网膜病变、肾病和神经病变。
- 脂肪组织具有内分泌功能,特别是在能量稳态方面。脂肪组织产生的激素包括瘦素和脂联素。瘦素作用于下丘脑以促进饱腹感。
