第四十二章 甲状腺:修订间差异
无编辑摘要 |
|||
| (未显示2个用户的3个中间版本) | |||
| 第6行: | 第6行: | ||
# 描述甲状腺的解剖学和组织学,包括甲状腺滤泡的结构。 | # 描述甲状腺的解剖学和组织学,包括甲状腺滤泡的结构。 | ||
# 解释甲状腺激素在甲状腺内的合成过程,包括碘的摄取、甲状腺过氧化物酶/双氧化酶对甲状腺球蛋白中酪氨酸残基的碘化以及偶联形成T4和T3的过程。 | # 解释甲状腺激素在甲状腺内的合成过程,包括碘的摄取、甲状腺过氧化物酶/双氧化酶对甲状腺球蛋白中酪氨酸残基的碘化以及偶联形成T4和T3的过程。 | ||
# 描述通过内吞作用从滤泡腔中回收甲状腺球蛋白并加工生成T3和 | # 描述通过内吞作用从滤泡腔中回收甲状腺球蛋白并加工生成T3和 T4的过程,这些激素随后被分泌到循环中。 | ||
# 绘制下丘脑-垂体-甲状腺轴图,展示TSH如何调节甲状腺功能以及甲状腺激素如何反馈调节该轴。列举中枢输入如何改变该轴设定点的例子。 | # 绘制下丘脑-垂体-甲状腺轴图,展示TSH如何调节甲状腺功能以及甲状腺激素如何反馈调节该轴。列举中枢输入如何改变该轴设定点的例子。 | ||
# 讨论甲状腺结合蛋白在甲状腺激素运输和稳定性中的作用,甲状腺转运蛋白在细胞进入中的作用,以及外周脱碘酶在T4激活为T3或失活为rT3中的作用。对比D1和D2脱碘酶的细胞位置和功能。 | # 讨论甲状腺结合蛋白在甲状腺激素运输和稳定性中的作用,甲状腺转运蛋白在细胞进入中的作用,以及外周脱碘酶在T4激活为T3或失活为rT3中的作用。对比D1和D2脱碘酶的细胞位置和功能。 | ||
| 第17行: | 第17行: | ||
== 甲状腺的解剖学和组织学 == | == 甲状腺的解剖学和组织学 == | ||
甲状腺由左右两叶组成,位于气管的前外侧(图42.1)。通常,两叶通过一个腹侧中部的峡部相连。甲状腺的血液供应非常丰富。每侧有三组静脉引流:上、中、下甲状腺静脉。<u>甲状腺接受交感神经支配,这些神经是血管运动性的,而非分泌运动性的。</u> | 甲状腺由左右两叶组成,位于气管的前外侧(图42.1)。通常,两叶通过一个腹侧中部的峡部相连。甲状腺的血液供应非常丰富。每侧有三组静脉引流:上、中、下甲状腺静脉。<u>甲状腺接受交感神经支配,这些神经是血管运动性的,而非分泌运动性的。</u> | ||
[[文件:BL-42.1.png|居中|缩略图|503x503像素|• 图42.1 A和B,甲状腺的解剖结构。C,正常甲状腺摄取高锝酸盐的图像。]] | |||
甲状腺的功能单位是'''甲状腺滤泡(thyroid follicle)''',这是一个直径约为200至300μm的球形结构,由单层甲状腺上皮细胞包围(图42.2)。上皮细胞位于基底膜上,基底膜是滤泡的最外层结构,周围有丰富的毛细血管供应。滤泡上皮细胞的顶端面向滤泡腔。滤泡腔内充满了'''胶质(colloid)''',胶质由'''甲状腺球蛋白(thyroglobulin)'''组成。这种大分子蛋白质(600kDa)被分泌到滤泡腔中,并由甲状腺上皮细胞进行碘化,作为甲状腺激素生产的支架。上皮细胞的大小和胶质的量是动态变化的,随着腺体的活动而变化。除了滤泡细胞外,甲状腺还含有另一种类型的细胞。散布在腺体中的是'''滤泡旁细胞(parafollicular cells)''',或称'''C细胞''',它们是多肽激素'''降钙素(calcitonin)'''的来源(见第40章)。 | |||
== 甲状腺激素 == | == 甲状腺激素 == | ||
[[文件:BL-42.3.png|缩略图|• 图42.3 碘甲状腺原氨酸 T4,T3,和rT3的结构。]] | |||
甲状腺的分泌产物是'''碘甲状腺原氨酸(iodothyronines)'''(图42.3),这是一类由两个碘化酪氨酸分子结合形成的激素。大约90%的甲状腺输出是3,5,3',5' -四碘甲状腺原氨酸(甲状腺素thyroxine,或T4),它作为一种激素前体发挥作用。约10%是3,5,3' -三碘甲状腺原氨酸(T3),这是甲状腺激素的活性形式。不到1%的甲状腺输出是3,3',5'-三碘甲状腺原氨酸(rT3,reverse T3),它是无活性的。通常,这三种产物以它们在腺体中储存的比例分泌。 | |||
=== 碘平衡 === | === 碘平衡 === | ||
由于碘在甲状腺生理中扮演着独特的角色,描述甲状腺激素的合成需要对碘的代谢有一定的理解(图42.4)。在美国,平均每人每天摄入400微克的碘,而成年人的最低每日需求量为150微克,儿童为90至120微克,孕妇为200微克。在稳态下,相同量的400微克碘通过尿液排出。碘在甲状腺、唾液腺、胃腺、泪腺、乳腺和脉络丛中主动浓缩。甲状腺每天从循环池中摄取约70至80微克的碘,循环池中大约含有250至750微克的碘。甲状腺的总碘含量平均为7500微克,几乎全部以胶体甲状腺球蛋白中储存的碘甲状腺原氨酸形式存在。在稳态下,每天从腺体中释放70至80微克的碘,约占总量的1%。其中,75%以甲状腺激素的形式分泌,其余以游离碘的形式分泌。激素形式储存的碘与每日代谢量的高比例(100: | [[文件:BL-42.4.png|缩略图|• 图42.4 人类中碘的分布和周转。HI,激素相关碘。]] | ||
由于碘在甲状腺生理中扮演着独特的角色,描述甲状腺激素的合成需要对碘的代谢有一定的理解(图42.4)。在美国,平均每人每天摄入400微克的碘,而成年人的最低每日需求量为150微克,儿童为90至120微克,孕妇为200微克。在稳态下,相同量的400微克碘通过尿液排出。碘在甲状腺、唾液腺、胃腺、泪腺、乳腺和脉络丛中主动浓缩。甲状腺每天从循环池中摄取约70至80微克的碘,循环池中大约含有250至750微克的碘。甲状腺的总碘含量平均为7500微克,几乎全部以胶体甲状腺球蛋白中储存的碘甲状腺原氨酸形式存在。在稳态下,每天从腺体中释放70至80微克的碘,约占总量的1%。其中,75%以甲状腺激素的形式分泌,其余以游离碘的形式分泌。激素形式储存的碘与每日代谢量的高比例(100:1)使得<u>甲状腺在碘缺乏的情况下能够维持约2个月</u>。当血清中碘浓度下降时,肾脏对碘的排泄显著减少,从而进一步节约碘。 | |||
=== 甲状腺激素合成概述 === | === 甲状腺激素合成概述 === | ||
[[文件:BL-42.5.png|缩略图|• 图42.5 甲状腺上皮细胞合成和分泌甲状腺激素的过程。MIT,单碘酪氨酸;NIS,钠-碘同向转运体;TBG,甲状腺素结合球蛋白;TG,甲状腺球蛋白;TSH,促甲状腺激素;TSHR,TSH受体。]] | |||
要理解甲状腺激素的合成和分泌,必须了解每个过程的方向性,因为它与极化的甲状腺上皮细胞相关(图42.5)。甲状腺激素的合成需要两种前体:碘和甲状腺球蛋白。碘从甲状腺上皮细胞的基底(血管)侧运输到顶端(滤泡腔)侧。甲状腺球蛋白在顶端膜上合成并分泌到滤泡腔中。因此,合成过程涉及这些前体从基底到顶端的运动进入滤泡腔(见图42.5)。碘甲状腺原氨酸的实际合成发生在滤泡腔内靠近上皮细胞顶端膜的酶促反应中(见后文)。甲状腺激素的分泌涉及碘化甲状腺球蛋白的内吞作用以及内吞囊泡从顶端到基底的运动,这些囊泡与溶酶体融合。甲状腺球蛋白被溶酶体酶降解,导致甲状腺激素从甲状腺球蛋白骨架中释放。最后,甲状腺激素可能通过特定的转运蛋白穿过基底外侧膜,最终进入血液(图42.5)。 | 要理解甲状腺激素的合成和分泌,必须了解每个过程的方向性,因为它与极化的甲状腺上皮细胞相关(图42.5)。甲状腺激素的合成需要两种前体:碘和甲状腺球蛋白。碘从甲状腺上皮细胞的基底(血管)侧运输到顶端(滤泡腔)侧。甲状腺球蛋白在顶端膜上合成并分泌到滤泡腔中。因此,合成过程涉及这些前体从基底到顶端的运动进入滤泡腔(见图42.5)。碘甲状腺原氨酸的实际合成发生在滤泡腔内靠近上皮细胞顶端膜的酶促反应中(见后文)。甲状腺激素的分泌涉及碘化甲状腺球蛋白的内吞作用以及内吞囊泡从顶端到基底的运动,这些囊泡与溶酶体融合。甲状腺球蛋白被溶酶体酶降解,导致甲状腺激素从甲状腺球蛋白骨架中释放。最后,甲状腺激素可能通过特定的转运蛋白穿过基底外侧膜,最终进入血液(图42.5)。 | ||
| 第34行: | 第35行: | ||
=== 在甲状腺球蛋白骨架上的碘甲状腺原氨酸合成 === | === 在甲状腺球蛋白骨架上的碘甲状腺原氨酸合成 === | ||
< | 碘化物通过位于甲状腺上皮细胞基底外侧膜上的'''钠-碘同向转运体(sodium-iodide symporter,NIS)'''逆化学和电化学梯度主动转运进入腺体(见图42.5)。NIS在甲状腺中高度表达,但在胎盘、唾液腺和活跃泌乳的乳腺中也有较低水平的表达。<u>一个碘离子逆碘化物梯度被转运,同时两个钠离子顺其电化学梯度从细胞外液进入甲状腺细胞</u>。这种次级主动转运的驱动力由质膜上的Na+,K+ -ATP酶提供。NIS基因的表达受碘化物抑制,并被促甲状腺激素刺激。饮食中碘化物摄入的减少会耗尽循环中的碘化物池,并显著增强碘化物捕获的活性。当饮食中碘化物摄入量低时,甲状腺对碘化物的摄取百分比可达到80%至90%。 | ||
[[文件:BL-42.6.png|居中|缩略图|419x419像素|• 图42.6 生成碘化物、MIT、DIT、T3和T4的反应。]] | |||
< | 甲状腺激素合成的步骤如图42.6所示。进入腺体后,碘化物迅速移动到上皮细胞的顶膜。从那里,碘化物通过<u>一种不依赖钠的碘化物/氯化物转运体</u>(称为'''pendrin,彭德莱素<ref>[https://www.termonline.cn/wordDetail?termName=%E5%BD%AD%E5%BE%B7%E8%8E%B1%E7%B4%A0&subject=6fb051bb26ad11eea2edb068e6519520&base=1]</ref>''')被转运到滤泡腔中。碘化物立即被氧化并掺入甲状腺球蛋白中的酪氨酸残基(见图42.5)。单个碘化反应形成单碘酪氨酸(MIT);同一残基的第二次碘化反应产生二碘酪氨酸(DIT)(见图42.6)。碘化后,两个DIT分子偶联形成T4; 一个MIT和一个DIT偶联形成T3。偶联发生在仍属于甲状腺球蛋白一级结构的碘化酪氨酸之间。<u>这一系列反应由'''甲状腺过氧化物酶(TPO)'''催化</u>,TPO是一种跨越顶膜的酶复合物。反应的直接氧化剂(电子受体)是<u>过氧化氢</u>。<u>滤泡腔中H2O2的生成由同样位于顶膜的'''双氧化酶(dual oxidases,DUOX1, DUOX2)'''催化</u>。 | ||
当碘化物供应受限时,T3的形成更有利,因为每分子有机碘化物能提供更多的活性激素。当甲状腺受到TSH或其他激活剂的过度刺激时,T3的比例也会增加。 | 当碘化物供应受限时,T3的形成更有利,因为每分子有机碘化物能提供更多的活性激素。当甲状腺受到TSH或其他激活剂的过度刺激时,T3的比例也会增加。 | ||
=== 甲状腺激素的分泌 === | === 甲状腺激素的分泌 === | ||
[[文件:BL-42.7.png|缩略图|• 图42.7 TSH快速诱导甲状腺球蛋白内吞作用前(A)和后(B)几分钟的情况。]] | |||
一旦甲状腺球蛋白被碘化,它就以胶体的形式储存在滤泡腔中(见图42.2)。T4和T3释放到血液中的过程是通过滤泡腔中的胶体通过大胞饮和小胞饮过程的内吞作用启动的。内吞囊泡随后与溶酶体融合,甲状腺球蛋白被降解(图42.7;另见图42.5)。在甲状腺球蛋白的蛋白水解过程中释放的MIT和DIT分子,在滤泡细胞内通过碘酪氨酸脱碘酶迅速脱碘(见图42.5)。这种脱碘酶对MIT和DIT具有特异性,不能以T4和T3为底物。然后,碘化物被重新循环用于T4和T3的合成。甲状腺球蛋白消化产生的氨基酸重新进入甲状腺内氨基酸池,并可以重新用于蛋白质合成。在正常情况下,只有极少量的完整甲状腺球蛋白离开滤泡细胞。酶促释放的T4和T3被转运到细胞的基底侧并进入血液。 | |||
• 图42. | |||
== 甲状腺激素的转运 == | == 甲状腺激素的转运 == | ||
分泌的T4和T3在血液中几乎完全与蛋白质结合循环。正常情况下,血浆中总T4的约0.03%和总T3的约0.3%以游离状态存在(图42. | [[文件:BL-42.8.png|缩略图|• 图42.8 血清中T4和T3通过转运蛋白的运输以及结合和游离激素的百分比。]] | ||
分泌的T4和T3在血液中几乎完全与蛋白质结合循环。正常情况下,血浆中总T4的约0.03%和总T3的约0.3%以游离状态存在(图42.8)。游离的T3具有生物活性,除了对垂体和下丘脑施加负反馈外,还介导甲状腺激素对外周组织的作用。主要的结合蛋白是'''甲状腺素结合球蛋白(thyroxine-binding globulin, TBG'''<ref>[https://www.termonline.cn/wordDetail?termName=%E7%94%B2%E7%8A%B6%E8%85%BA%E7%B4%A0%E7%BB%93%E5%90%88%E7%90%83%E8%9B%8B%E7%99%BD&subject=6fc0c25126ad11eeb63ab068e6519520&base=1]</ref>''')''',它在肝脏中合成,结合一个T4或T3分子。<u>循环中的T4和T3约70%与TBG结合;10%至15%与另一种称为'''甲状腺素转运蛋白(transthyretin, TTR'''<ref>[https://www.termonline.cn/wordDetail?termName=%E7%94%B2%E7%8A%B6%E8%85%BA%E7%B4%A0%E8%BD%AC%E8%BF%90%E8%9B%8B%E7%99%BD&subject=6fc26ed926ad11eeae73b068e6519520&base=1]</ref>''')'''的特异性甲状腺结合蛋白结合</u>。<u>白蛋白结合15%至20%,3%与脂蛋白结合。</u>通常只有TBG浓度的变化会显著影响血浆中总T4和T3的水平。TBG有两个重要的生物学功能。首先,它维持了一个大的循环T4储备库,缓冲了甲状腺功能的任何急性变化。其次,血浆T4和T3与蛋白质的结合防止了这些相对较小的激素分子在尿液中的丢失,从而有助于保存碘。TTR在脑脊液中运输T4,并向中枢神经系统提供甲状腺激素。 | |||
----'''临床相关''' | |||
[[文件:BL-42.9.png|缩略图|• 图42.9 正常、甲状腺功能减退、甲状腺功能亢进和有机化缺陷状态下甲状腺碘甲腺原氨酸摄取曲线。]] | |||
由于其能够捕获并将碘结合到甲状腺球蛋白中(称为有机化organification),甲状腺的活性可以通过'''放射性碘摄取(radioactive iodine uptake, RAIU)'''来评估。在该测试中,给予示踪剂量的<sup>123</sup>I,并在4至6小时和24小时时通过在颈部放置伽马探测器来测量RAIU。在美国,由于饮食中碘含量相对较高,6小时后的RAIU通常约为15%,24小时后约为25%(图42.9)。24小时后异常高的RAIU (>60%)表明甲状腺功能亢进。24小时后异常低的RAIU (<5%)表明甲状腺功能减退。在甲状腺受到极度慢性刺激的个体中(例如,Graves病相关的甲状腺毒症),碘被迅速捕获、有机化并作为激素释放。在这些高周转率的情况下,6小时RAIU会非常高,但24小时RAIU会较低(见图42.8)。一些阴离子,如硫氰酸盐(thiocyanate, CNS−)、高氯酸盐(perchlorate, HClO4-)和高锝酸盐(pertechnetate, \widetildeIcO4),是通过NIS进行碘转运的竞争性或非竞争性抑制剂。如果碘在被细胞摄取后不能迅速结合到酪氨酸中(有机化缺陷),给予这些阴离子之一会通过阻止进一步的碘摄取,导致碘从腺体中迅速释放(见图42.9)。这种释放是由于甲状腺-血浆浓度梯度高所致。 | |||
在给予示踪剂123I、131I或碘模拟物高锝酸盐(pertechnetate)后,可以使用直线扫描仪或伽马相机对甲状腺进行成像。成像可以显示甲状腺的大小和形状(见图42.1C),以及甲状腺内活跃组织与非活跃组织的异质性。这种异质性通常是由于甲状腺结节的形成,这些结节是扩大的滤泡区域,具有由于刺激和退化周期引起的退行性变化的证据。“热”结节(即在成像中显示高RAIU的结节)通常不是癌性的,但可能导致甲亢。“冷”结节癌变的可能性是热结节的10倍。这些结节可以通过细针穿刺活检进行病理分析取样。 | |||
甲状腺也可以通过超声成像进行成像,其分辨率优于RAIU成像。超声成像用于在结节细针穿刺活检时引导医生。甲状腺的最高分辨率是通过磁共振成像(MRI)实现的。 | |||
---- | ---- | ||
== | == 甲状腺激素进入细胞和外周转化 == | ||
多年来,人们认为甲状腺激素的亲脂性使其能够通过被动扩散穿过质膜。然而,'''现在已知甲状腺激素需要转运蛋白来促进其进入细胞。'''这一过程由属于多个基因家族的各种转运蛋白(20种或更多)完成。这些转运蛋白包括单羧酸转运蛋白MCT8和MCT10,它们能够将T4和T3转运穿过质膜(图42.13;另见图42.5)。最近,MCT8的突变已被证明会导致一种X连锁的发育综合征,其特征是T3水平升高、肌肉发育不全以及严重的神经和智力障碍。另一种转运蛋白OATP1C1在T4穿过血脑屏障的转运中发挥作用。其他甲状腺激素转运蛋白的相对重要性和组织分布仍有待阐明,这为我们理解甲状腺激素功能增加了另一层复杂性。 | |||
由于甲状腺的主要产物是T4,而甲状腺激素的活性形式是T3,因此甲状腺轴在很大程度上依赖于通过甲状腺素特异性脱碘酶(deiodinases)作用的外周转化(见图42.3)。这些酶在特异性、底物亲和力、组织分布和亚细胞定位方面有所不同。1型(D1)和2型(D2)脱碘酶都可以将T4转化为T3。<u>尽管D1对T4的亲和力相对较低(微摩尔级),但它在肝脏和肾脏的质膜上表达,这些大器官具有高血流量,能够快速将激素释放到血液中。</u>因此,D1有助于为局部T3生成较低或缺失的组织提供可用的循环T3池。有些矛盾的是,<u>D1的表达在甲状腺功能亢进时增加</u>,并导致甲状腺功能亢进疾病中循环T3水平的升高。 | |||
D2 是一种高亲和力(纳摩尔级)的外环脱碘酶(outer ring deiodinase),<u>定位于内质网</u>,能够将 T4 转化为 T3。表达 D2 的组织,包括中枢神经系统、垂体前叶和棕色脂肪,<u>因此可以独立于循环中的 T3 水平来调节细胞内 T3 的水平。尽管 D2 位于细胞内,但它提供了大部分循环中的 T3</u>。由于神经胶质细胞中存在 D2,即使循环中的 T4 下降到低水平,大脑仍能维持恒定的 T3 水平。因此,在甲状腺功能减退期间,D2 的表达会增加。D2 通过调节垂体促甲状腺细胞分泌的促甲状腺激素(thyroid-stimulating hormone, TSH),在甲状腺轴的反馈控制中起关键作用。这些细胞表达 D2,促进 T4 在细胞内转化为 T3,进而介导负反馈。这一机制允许对循环中 T3 和 T4 的总量进行整合的反馈反应。最后,还有一种“失活”脱碘酶,称为 3 型脱碘酶(type 3 deiodinase, D3)。这种高亲和力的内环脱碘酶将 T4 转化为无活性的 rT3。在甲状腺功能亢进期间,D3 会增加,这有助于抑制 T4 的过度产生。此外,在疾病或饥饿期间,D3 的表达也会增加(参见“临床视角”中的非甲状腺疾病综合征)。 | |||
D2 是一种高亲和力(纳摩尔级)的外环脱碘酶(outer ring | |||
矛盾的是,尽管甲状腺激素替代疗法使 TSH 水平恢复正常,但仍有少数甲状腺功能缺失的患者报告出现甲状腺功能减退的症状。这是否可能归因于这些患者中的脱碘酶多态性,是一个活跃的研究领域。 | 矛盾的是,尽管甲状腺激素替代疗法使 TSH 水平恢复正常,但仍有少数甲状腺功能缺失的患者报告出现甲状腺功能减退的症状。这是否可能归因于这些患者中的脱碘酶多态性,是一个活跃的研究领域。 | ||
----'''细胞水平''' | |||
TSH 对甲状腺激素分泌的调节受到精细的负反馈控制(见第 41 章)。循环中的甲状腺激素通过抑制 TSHβ亚基基因表达,反馈作用于垂体以减少 TSH 的分泌。如前所述,促甲状腺细胞中的反馈控制代表了对循环中游离 T4 和 T3 水平的整合反应。由于 TSH 分泌的昼夜变化较小,甲状腺激素的分泌和血浆浓度相对稳定。仅在夜间会出现 TSH 分泌和 T4 释放的少量增加。甲状腺激素还反馈作用于下丘脑的促甲状腺激素释放激素(thyroid-releasing hormone, TRH)分泌神经元。在这些神经元中,T3 抑制前体 TRH 基因的表达。 | |||
TSH 对甲状腺激素分泌的调节受到精细的负反馈控制(见第 41 章)。循环中的甲状腺激素通过抑制 | |||
甲状腺功能的自我调节是由碘化物本身引起的,它具有双相作用。在相对较低的碘摄入水平下,甲状腺激素的合成速率与碘的可用性直接相关。然而,如果碘的摄入量超过2毫克/天,腺体内的碘浓度达到一个水平,反而会抑制TPO(甲状腺过氧化物酶)的活性,阻断激素的生物合成。这种现象被称为Wolff- | 甲状腺功能的自我调节是由碘化物本身引起的,它具有双相作用。在相对较低的碘摄入水平下,甲状腺激素的合成速率与碘的可用性直接相关。然而,如果碘的摄入量超过2毫克/天,腺体内的碘浓度达到一个水平,反而会抑制TPO(甲状腺过氧化物酶)的活性,阻断激素的生物合成。这种现象被称为Wolff-Chaikoff效应。<u>对高碘摄入的适应通常通过减少NIS(钠碘同向转运体)的表达来实现,这导致甲状腺内碘水平下降</u>。随后,TPO活性恢复正常,甲状腺激素的合成在几天到几周内恢复。在特殊情况下,NIS未能下调会导致碘对激素合成的长期抑制,从而导致甲状腺功能减退。过量碘引起的激素合成暂时减少也被用于治疗甲状腺功能亢进症。 | ||
---- | |||
== 甲状腺功能的调节 == | |||
甲状腺功能和生长的最重要调节因子是TSH(促甲状腺激素),而TSH又受到下丘脑释放的甲状腺释放激素(TRH)进入门脉循环的调节(见第41章)。TSH刺激甲状腺功能的各个方面,包括对甲状腺上皮细胞的即时、中期和长期作用。TSH的快速作用包括将含有碘化甲状腺球蛋白的胶体滴通过胞吞作用进入细胞质形成内体(见图42.7)。内体随后与溶酶体融合,导致碘化甲状腺球蛋白的蛋白水解,并从腺体释放T4和T3。TSH刺激碘的摄取和TPO活性。它还刺激葡萄糖进入单磷酸己糖途径,该途径生成过氧化物酶反应所需的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。TSH对甲状腺的中期效应在几小时到几天后发生,涉及蛋白质合成和多个基因的表达,包括编码NIS、甲状腺球蛋白和TPO的基因。持续的TSH刺激会导致滤泡细胞肥大和增生的长期效应。毛细血管增生,甲状腺血流量增加。这些作用是TSH对腺体生长促进作用的基础,并得到局部生长因子的支持。明显增大的甲状腺被称为甲状腺肿(图42.10)。地方性甲状腺肿是由于饮食中缺乏足够的碘,导致甲状腺激素水平低和TSH水平升高。 | 甲状腺功能和生长的最重要调节因子是TSH(促甲状腺激素),而TSH又受到下丘脑释放的甲状腺释放激素(TRH)进入门脉循环的调节(见第41章)。TSH刺激甲状腺功能的各个方面,包括对甲状腺上皮细胞的即时、中期和长期作用。TSH的快速作用包括将含有碘化甲状腺球蛋白的胶体滴通过胞吞作用进入细胞质形成内体(见图42.7)。内体随后与溶酶体融合,导致碘化甲状腺球蛋白的蛋白水解,并从腺体释放T4和T3。TSH刺激碘的摄取和TPO活性。它还刺激葡萄糖进入单磷酸己糖途径,该途径生成过氧化物酶反应所需的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。TSH对甲状腺的中期效应在几小时到几天后发生,涉及蛋白质合成和多个基因的表达,包括编码NIS、甲状腺球蛋白和TPO的基因。持续的TSH刺激会导致滤泡细胞肥大和增生的长期效应。毛细血管增生,甲状腺血流量增加。这些作用是TSH对腺体生长促进作用的基础,并得到局部生长因子的支持。明显增大的甲状腺被称为甲状腺肿(图42.10)。地方性甲状腺肿是由于饮食中缺乏足够的碘,导致甲状腺激素水平低和TSH水平升高。 | ||
• 图42.10 甲状腺位于颈部前部,当它增大时(甲状腺肿)很容易被观察到。 | • 图42.10 甲状腺位于颈部前部,当它增大时(甲状腺肿)很容易被观察到。 | ||
----'''临床相关''' | |||
Graves病是最常见的甲状腺功能亢进症。它最常发生在20至50岁之间,<u>女性比男性常见5-10倍。</u>Graves病是一种自身免疫性疾病,其中产生了针对TSH受体的激活型自身抗体。由抗体驱动的甲状腺功能亢进症通常伴随着由于腺体增生和肥大引起的弥漫性甲状腺肿。滤泡上皮细胞变为高柱状细胞,胶体显示出扇贝状边缘,表明快速周转。 | |||
Graves病的主要临床表现是'''甲状腺毒症(thyrotoxicosis)'''——即血液和组织中甲状腺激素过量的状态。甲状腺毒症患者将表现出临床医学中最引人注目的症状之一。尽管食物摄入增加,但代谢率的大幅提高表现为体重减轻。过量的热量产生导致在温暖环境中感到不适、出汗以及更多的水分摄入。交感神经活动的增强导致心率加快、运动过度、震颤、紧张和眼睛睁大。肌肉质量的减少以及肌肉功能的受损导致虚弱。其他症状包括情绪不稳定、运动时呼吸急促,以及由于甲状腺肿大压迫食管或气管导致的吞咽或呼吸困难。最常见的心血管体征是窦性心动过速。由于正性肌力作用结合全身血管阻力降低,心输出量增加,伴随脉压增宽。Graves病的一个常见临床体征是'''突眼'''(exophthalmos,眼球异常突出)和眼眶周围水肿。这是由于自身抗体与眼眶成纤维细胞上表达的TSH受体结合,导致黏多糖生成增加、眼眶脂肪扩张和眼外肌水肿所致。 | |||
Graves病通常通过血清游离和总T4和T3水平升高以及弥漫性甲状腺肿和眼病的临床体征来诊断。血清TSH水平较低,因为下丘脑和垂体受到高水平的T4和T3的抑制。在大多数情况下,甲状腺对放射性碘的摄取是过量和弥漫性的。TSH水平的测定和循环中甲状腺刺激免疫球蛋白的存在可以区分Graves病(一种原发性疾病)与罕见的垂体促甲状腺激素腺瘤(一种继发性疾病),后者会产生高水平的TSH。 | Graves病通常通过血清游离和总T4和T3水平升高以及弥漫性甲状腺肿和眼病的临床体征来诊断。血清TSH水平较低,因为下丘脑和垂体受到高水平的T4和T3的抑制。在大多数情况下,甲状腺对放射性碘的摄取是过量和弥漫性的。TSH水平的测定和循环中甲状腺刺激免疫球蛋白的存在可以区分Graves病(一种原发性疾病)与罕见的垂体促甲状腺激素腺瘤(一种继发性疾病),后者会产生高水平的TSH。 | ||
Graves病的治疗通常涉及甲状腺切除,随后进行终身甲状腺素替代治疗。甲状腺组织可以通过131|放射性消融或手术切除。在手术切除甲状腺时,必须采取预防措施,以避免大量、可能危及生命的甲状腺激素释放,即甲状腺危象。另一种替代甲状腺组织切除的方法是使用抑制TPO活性的抗甲状腺药物。 | |||
---- | |||
== 甲状腺激素的生理作用 == | |||
甲状腺激素几乎作用于所有细胞和组织,甲状腺功能失衡构成了一些最常见的内分泌疾病。甲状腺激素有许多直接作用,但它也以允许性方式优化其他几种激素和神经递质的作用。 | 甲状腺激素几乎作用于所有细胞和组织,甲状腺功能失衡构成了一些最常见的内分泌疾病。甲状腺激素有许多直接作用,但它也以允许性方式优化其他几种激素和神经递质的作用。 | ||
=== 心血管作用 === | |||
甲状腺激素在临床上最重要的作用可能是对心血管生理的影响。T3 | 甲状腺激素在临床上最重要的作用可能是对心血管生理的影响。T3 增加心输出量,从而确保组织获得足够的O2供应(图 42.11)。静息心率和每搏输出量均增加。心肌收缩的速度和力量增强(分别为正性变时和正性变力作用),舒张期松弛时间缩短(正性松弛作用)。收缩压适度升高,舒张压降低。由此产生的脉压增宽反映了每搏输出量增加以及皮肤、肌肉和心脏血管扩张导致的全身血管阻力降低的综合效应。这些效应部分是由于甲状腺激素诱导的组织产热和CO2生成增加(见“对基础代谢率和产热的影响”)。此外,甲状腺激素通过扩张外周循环中的小动脉来降低全身血管阻力。通过激活肾素-血管紧张素-醛固酮轴,增加肾小管钠重吸收,从而增加总血容量(见第 34 章)。 | ||
T3 的心脏正性变力作用既有直接作用,也有间接作用。后者主要是由于对儿茶酚胺的反应性增强(见第 43 章)。直接的正性变力作用(见图 42.11)涉及多种增强收缩力的蛋白质的调节,包括增加 α-肌球蛋白重链表达和抑制质膜 Na+/Ca++ 交换体。肌浆网Ca++-ATP 酶(SERCA)被 T3增加,而phospholamban减少。因此,舒张期钙的隔离增强,松弛时间缩短。肌浆网中增加的雷诺丁 Ca++ 通道促进收缩期 Ca++ 从肌浆网释放。 | |||
• 图 42.11 甲状腺激素增加心输出量的机制。间接机制可能在数量上更为重要。 | • 图 42.11 甲状腺激素增加心输出量的机制。间接机制可能在数量上更为重要。 | ||
----'''临床意义''' | |||
正常范围内的甲状腺激素水平是心脏最佳功能所必需的。人类甲状腺激素缺乏会降低每搏输出量、左心室射血分数、心输出量和心脏功能效率。后一种缺陷表现为每搏功指数([每搏输出量/左心室质量] \times 收缩压峰值)的下降幅度大于心肌氧化代谢的下降幅度。全身血管阻力的升高可能加剧了这种心脏功能减退。相比之下,甲状腺激素过量通过增加心率和每搏输出量来增强心输出量。由于全身血管阻力降低,收缩压升高和舒张压降低导致脉压增宽。甲状腺毒症与心悸、房颤和二尖瓣脱垂有关(见第 15 章)。 | 正常范围内的甲状腺激素水平是心脏最佳功能所必需的。人类甲状腺激素缺乏会降低每搏输出量、左心室射血分数、心输出量和心脏功能效率。后一种缺陷表现为每搏功指数([每搏输出量/左心室质量] \times 收缩压峰值)的下降幅度大于心肌氧化代谢的下降幅度。全身血管阻力的升高可能加剧了这种心脏功能减退。相比之下,甲状腺激素过量通过增加心率和每搏输出量来增强心输出量。由于全身血管阻力降低,收缩压升高和舒张压降低导致脉压增宽。甲状腺毒症与心悸、房颤和二尖瓣脱垂有关(见第 15 章)。 | ||
---- | |||
=== 对基础代谢率和产热的影响 === | |||
增加的 | 增加的 O2使用最终依赖于氧化底物供应的增加。T3 增强了胃肠道对葡萄糖的吸收,并增加了葡萄糖的周转(葡萄糖摄取、氧化和合成)。在脂肪组织中,甲状腺激素诱导了脂肪酸合成的酶,包括乙酰辅酶A羧化酶和脂肪酸合酶,并通过增加β-肾上腺素能受体的数量来增强脂肪分解(参见对自主神经系统和儿茶酚胺作用的影响)。甲状腺激素还增强了乳糜微粒的清除。因此,脂质周转(脂肪组织中游离脂肪酸的释放和氧化)得到了增强。 | ||
蛋白质周转(肌肉氨基酸的释放、蛋白质降解,以及较小程度的蛋白质合成和尿素形成)也有所增加。T3 增强了肾上腺素、去甲肾上腺素、胰高血糖素、皮质醇和生长激素对糖异生、脂肪分解、酮体生成和不稳定蛋白质库的蛋白质分解的各自刺激作用。甲状腺激素的整体代谢效应被恰当地描述为加速了对饥饿的生理反应。此外,甲状腺激素刺激了从胆固醇合成胆汁酸,并促进了胆汁分泌。净效应是体内总胆固醇和低密度脂蛋白胆固醇的池和血浆水平降低。甲状腺激素还增加了肾上腺和性腺类固醇激素、某些B族维生素以及某些给药药物的代谢清除率。 | 蛋白质周转(肌肉氨基酸的释放、蛋白质降解,以及较小程度的蛋白质合成和尿素形成)也有所增加。T3 增强了肾上腺素、去甲肾上腺素、胰高血糖素、皮质醇和生长激素对糖异生、脂肪分解、酮体生成和不稳定蛋白质库的蛋白质分解的各自刺激作用。甲状腺激素的整体代谢效应被恰当地描述为加速了对饥饿的生理反应。此外,甲状腺激素刺激了从胆固醇合成胆汁酸,并促进了胆汁分泌。净效应是体内总胆固醇和低密度脂蛋白胆固醇的池和血浆水平降低。甲状腺激素还增加了肾上腺和性腺类固醇激素、某些B族维生素以及某些给药药物的代谢清除率。 | ||
甲状腺激素通过影响三磷酸腺苷(ATP)的利用和ATP合成的效率来刺激产热。ATP的利用通过上调几种能量依赖的过程而增强,包括 NaK-ATP酶和SERCA,特别是在骨骼肌中,细胞质和肌浆网之间的钙循环使用ATP并产生热量。最近的研究表明,人类棕色脂肪(brown fat)在成人中也似乎在兼性产热(facultative thermogenesis)中发挥作用,而以前认为它仅在新生儿中重要。影像学研究已经证明了纵隔中存在棕色脂肪,特别是在瘦个体中,并且棕色脂肪的代谢活性在暴露于寒冷时增强。棕色脂肪表达解偶联蛋白-1(uncoupling protein-1, UCP1),也称为产热素(thermogenin),它导致线粒体内膜上的质子梯度以热的形式消散,然后通过循环传播到身体的其他部位。UCP1受甲状腺激素的调节,棕色脂肪表达D2,提供了细胞内 T4 向 T3 的转化。棕色脂肪的产热涉及甲状腺激素和交感神经系统之间的协同作用。儿茶酚胺促进脂肪分解并上调D2的表达。T3 反过来上调肾上腺素能受体并增强对儿茶酚胺的反应性。甲状腺功能亢进症伴随热不耐受,而甲状腺功能减退症伴随冷不耐受。 | |||
==== 呼吸效应 ==== | ==== 呼吸效应 ==== | ||
甲状腺激素刺激氧气的利用并增强氧气的输送。相应地,T3 增加了静息呼吸频率、每分钟通气量以及对高碳酸血症和低氧血症的通气反应。这些作用在氧气利用增加时维持正常的动脉 | 甲状腺激素刺激氧气的利用并增强氧气的输送。相应地,T3 增加了静息呼吸频率、每分钟通气量以及对高碳酸血症和低氧血症的通气反应。这些作用在氧气利用增加时维持正常的动脉 PO2,在二氧化碳产生增加时维持正常的PCO2。此外,血细胞比容略有增加,以增强氧气的携带能力。这种增加是由于肾脏刺激促红细胞生成素的产生所致。 | ||
==== 骨骼肌效应 ==== | ==== 骨骼肌效应 ==== | ||
| 第123行: | 第115行: | ||
==== 对自主神经系统和儿茶酚胺作用的影响 ==== | ==== 对自主神经系统和儿茶酚胺作用的影响 ==== | ||
如前所述,儿茶酚胺和甲状腺激素之间存在重要的协同作用。甲状腺激素与儿茶酚胺在增加代谢率、产热、心率、运动活动和中枢神经系统兴奋方面具有协同作用。T3 可能通过增加心肌中 | 如前所述,儿茶酚胺和甲状腺激素之间存在重要的协同作用。甲状腺激素与儿茶酚胺在增加代谢率、产热、心率、运动活动和中枢神经系统兴奋方面具有协同作用。T3 可能通过增加心肌中 β -肾上腺素能受体的数量以及细胞内第二信使如环磷酸腺苷(cAMP)的生成来增强交感神经系统的活性。 | ||
==== 对生长和成熟的影响 ==== | ==== 对生长和成熟的影响 ==== | ||
| 第154行: | 第146行: | ||
成人甲状腺功能减退症(hypothyroidism)的临床表现在许多方面与甲状腺功能亢进症(hyperthyroidism)完全相反。低于正常水平的代谢率导致体重增加,而热量摄入并未显著增加。产热减少导致体温降低,引起对寒冷的耐受性下降、出汗减少和皮肤干燥。肾上腺素能活动减少,因此可能出现心动过缓(bradycardia)。运动、言语和思维均减慢,出现嗜睡、困倦和上眼睑下垂(ptosis)。带负电荷的黏多糖(mucopolysaccharides)在结缔组织中的积累会吸引钠和液体。由此导致的非凹陷性黏液性水肿(nonpitting myxedema)会引起面部浮肿、舌头增大、声音嘶哑、关节僵硬、胸腔、心包和腹腔积液,以及由于过多的基质物质压迫周围神经和颅神经。便秘、脱发、月经功能障碍和贫血也是其他症状。在缺乏甲状腺激素的成人中,正电子发射断层扫描(positron emission tomography)显示脑血流量和葡萄糖代谢普遍减少。这种异常可能解释了甲状腺功能减退患者的心理运动障碍和情绪低落状态。 | 成人甲状腺功能减退症(hypothyroidism)的临床表现在许多方面与甲状腺功能亢进症(hyperthyroidism)完全相反。低于正常水平的代谢率导致体重增加,而热量摄入并未显著增加。产热减少导致体温降低,引起对寒冷的耐受性下降、出汗减少和皮肤干燥。肾上腺素能活动减少,因此可能出现心动过缓(bradycardia)。运动、言语和思维均减慢,出现嗜睡、困倦和上眼睑下垂(ptosis)。带负电荷的黏多糖(mucopolysaccharides)在结缔组织中的积累会吸引钠和液体。由此导致的非凹陷性黏液性水肿(nonpitting myxedema)会引起面部浮肿、舌头增大、声音嘶哑、关节僵硬、胸腔、心包和腹腔积液,以及由于过多的基质物质压迫周围神经和颅神经。便秘、脱发、月经功能障碍和贫血也是其他症状。在缺乏甲状腺激素的成人中,正电子发射断层扫描(positron emission tomography)显示脑血流量和葡萄糖代谢普遍减少。这种异常可能解释了甲状腺功能减退患者的心理运动障碍和情绪低落状态。 | ||
每日剂量的T4替代治疗通常可以治愈甲状腺功能减退的成人,使促甲状腺激素水平恢复正常。在大多数患者中,不需要T3,因为外周D1和D2会根据需要生成T3。此外,T3的高效性和短半衰期使其给药复杂化,需要频繁给药,并且难以维持一致的生理水平T3。 | |||
甲状腺激素还对内分泌系统的其他部分有显著影响。甲状腺激素增加垂体生长激素的分泌,而减少催乳素的分泌。肾上腺皮质分泌的皮质醇(cortisol)(见第43章)及其代谢清除率受到刺激,但血浆游离皮质醇水平保持正常。在男性中,雌激素与雄激素的比例增加(甲状腺功能亢进时可能出现乳房增大)。甲状旁腺激素和1,25-二羟基维生素D的产生减少是甲状腺激素对骨吸收影响的代偿性后果(见第40章)。甲状腺激素还增加肾脏大小、肾血浆流量、肾小球滤过率以及多种物质的转运速率。 | 甲状腺激素还对内分泌系统的其他部分有显著影响。甲状腺激素增加垂体生长激素的分泌,而减少催乳素的分泌。肾上腺皮质分泌的皮质醇(cortisol)(见第43章)及其代谢清除率受到刺激,但血浆游离皮质醇水平保持正常。在男性中,雌激素与雄激素的比例增加(甲状腺功能亢进时可能出现乳房增大)。甲状旁腺激素和1,25-二羟基维生素D的产生减少是甲状腺激素对骨吸收影响的代偿性后果(见第40章)。甲状腺激素还增加肾脏大小、肾血浆流量、肾小球滤过率以及多种物质的转运速率。 | ||
| 第161行: | 第153行: | ||
==== 临床实践 ==== | ==== 临床实践 ==== | ||
非甲状腺疾病综合征(Nonthyroidal illness syndrome, NTIS),也称为甲状腺功能正常病态综合征,发生在需要住院治疗的严重疾病患者中。NTIS的特征是由于下丘脑-垂体-甲状腺轴的中枢性抑制导致的循环甲状腺激素和促甲状腺激素水平降低。下丘脑产生的促甲状腺激素释放激素(TRH)减少,因此在T4和T3水平降低的情况下,TSH水平可能较低或不适当地正常。此外,由于D3的上调,T4向无活性的r T3的外周代谢增加。在长期禁食时也会观察到类似的反应。尽管NTIS的机制尚未完全理解,但它被认为是对慢性疾病或饥饿的一种生理性能量节约适应。因此,不应在危重患者中评估甲状腺状态。 | |||
==== 在细胞水平 ==== | ==== 在细胞水平 ==== | ||
==== 甲状腺激素的作用机制 ==== | ==== 甲状腺激素的作用机制 ==== | ||
许多(但不是所有)T3的作用是通过其与甲状腺激素受体(TR)家族成员之一结合来介导的。TR家族属于核激素受体超家族的转录因子(另见第3章)。在人类中,有两个TR基因,THRA和THRB,分别位于17号和3号染色体上,编码核TR。THRA编码TRα,它通过选择性剪接形成两种主要亚型。T Rα1是一个真正的TR,而另一种亚型不结合T3。THRB编码\barT\barRβ1和T Rβ2,它们是T3的高亲和力受体。TRα1和T Rβ1的组织分布广泛。TRα1在心脏和骨骼肌中强烈表达。TRα1是甲状腺激素对心脏作用的主要介导者。相比之下,T Rβ1主要在脑、肝和肾中表达。T Rββ2的表达局限于垂体和下丘脑的关键区域,以及耳蜗和视网膜。T3通过T Rββ作用,负责抑制下丘脑室旁神经元中前体TRH基因和垂体促甲状腺细胞中TSH基因的β亚基的表达。因此,甲状腺激素对TRH和TSH分泌的负反馈作用主要由T Rβ2介导。 | |||
TR与RXR形成异二聚体(见图42.13)。未配体的TR-RXR结合到靶基因中的甲状腺反应元件,并招募共抑制因子,抑制基础基因转录。在T3结合后,共抑制因子被释放,共激活因子被招募到激素-受体复合物中,诱导基因转录。 | TR与RXR形成异二聚体(见图42.13)。未配体的TR-RXR结合到靶基因中的甲状腺反应元件,并招募共抑制因子,抑制基础基因转录。在T3结合后,共抑制因子被释放,共激活因子被招募到激素-受体复合物中,诱导基因转录。 | ||
了解TR亚型(thyroid hormone receptor subtypes)非常重要,因为已发现TR失活突变会导致甲状腺激素抵抗综合征。最常见的突变发生在T Rβ2亚型中,导致下丘脑-垂体水平的负反馈不完全。因此,T4水平升高,但TSH未被抑制。当抵抗主要发生在下丘脑-垂体水平时,患者可能表现出甲状腺功能亢进的症状,这是由于甲状腺激素水平升高对外周组织(尤其是心脏)的影响,这种影响由T Rα1介导。TR亚型也可能成为潜在的治疗靶点。例如,目前正在研究开发T Rβ特异性激动剂,这些激动剂对脂质和胆固醇代谢有益,且不会带来心血管副作用的风险。 | |||
越来越多的证据表明,T3和T4通过作用于质膜、线粒体或细胞质的受体介导非基因组作用。在某些情况下,这些受体是核甲状腺受体的修饰版本。例如,已报道的截短型T Rα1亚型可以在质膜中结合T3,介导骨骼中的非基因组效应,或在细胞质中结合T4,调节微丝组织。还有报道称,一种整合素,可以作为细胞表面的T4受体,通过非基因组机制调节细胞增殖和血管生成。甲状腺激素的经典基因组作用与非基因组作用之间的相互作用可能是未来研究的另一个活跃领域。 | |||
= 关键概念 = | = 关键概念 = | ||
| 第187行: | 第179行: | ||
# 甲状腺激素是基础代谢率和产热的主要正向调节因子。甲状腺激素的其他重要作用包括增加心率、心输出量和通气量,以及降低全身血管阻力。底物动员和代谢产物的清除也得到了增强。 | # 甲状腺激素是基础代谢率和产热的主要正向调节因子。甲状腺激素的其他重要作用包括增加心率、心输出量和通气量,以及降低全身血管阻力。底物动员和代谢产物的清除也得到了增强。 | ||
# 甲状腺激素对中枢神经系统(CNS)和骨骼的作用对正常生长发育至关重要。缺乏甲状腺激素会导致先天性甲状腺功能减退症(congenital hypothyroidism),表现为大脑发育不良、身材矮小和骨骼发育不成熟。在成人中,甲状腺激素支持骨重塑以及皮肤和毛发的降解。 | # 甲状腺激素对中枢神经系统(CNS)和骨骼的作用对正常生长发育至关重要。缺乏甲状腺激素会导致先天性甲状腺功能减退症(congenital hypothyroidism),表现为大脑发育不良、身材矮小和骨骼发育不成熟。在成人中,甲状腺激素支持骨重塑以及皮肤和毛发的降解。 | ||
# T3与甲状腺激素受体亚型结合,这些受体负责甲状腺激素的各种作用。甲状腺激素受体与RXR形成异源二聚体,调节靶基因上的甲状腺反应元件,从而在T3存在或缺失时分别诱导或抑制基因表达。 | # T3与甲状腺激素受体亚型结合,这些受体负责甲状腺激素的各种作用。甲状腺激素受体与RXR形成异源二聚体,调节靶基因上的甲状腺反应元件,从而在T3存在或缺失时分别诱导或抑制基因表达。 | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年12月13日 (六) 20:16的最新版本
学习目标
完成本章后,学生应能回答以下问题:
- 描述甲状腺的解剖学和组织学,包括甲状腺滤泡的结构。
- 解释甲状腺激素在甲状腺内的合成过程,包括碘的摄取、甲状腺过氧化物酶/双氧化酶对甲状腺球蛋白中酪氨酸残基的碘化以及偶联形成T4和T3的过程。
- 描述通过内吞作用从滤泡腔中回收甲状腺球蛋白并加工生成T3和 T4的过程,这些激素随后被分泌到循环中。
- 绘制下丘脑-垂体-甲状腺轴图,展示TSH如何调节甲状腺功能以及甲状腺激素如何反馈调节该轴。列举中枢输入如何改变该轴设定点的例子。
- 讨论甲状腺结合蛋白在甲状腺激素运输和稳定性中的作用,甲状腺转运蛋白在细胞进入中的作用,以及外周脱碘酶在T4激活为T3或失活为rT3中的作用。对比D1和D2脱碘酶的细胞位置和功能。
- 描述甲状腺激素作用的机制,包括甲状腺激素受体的性质和位置及其抑制或激活靶基因转录的能力。
- 讨论甲状腺激素在发育过程中的作用,特别是对中枢神经系统(CNS)和骨骼的影响,包括严重甲状腺功能减退的后果。
- 描述甲状腺激素对基础代谢率和产热、心血管系统(心率、心输出量、全身血管阻力)以及其他器官系统(皮肤、骨骼肌、消化道)的影响。
甲状腺产生前激素四碘甲状腺原氨酸(T4,也称为甲状腺素)和活性激素三碘甲状腺原氨酸(T3)。T4和T3的合成需要碘,这在世界某些地区可能是一个限制因素。大部分T3是通过T4在外周转化为T3而生成的。甲状腺激素主要通过调节基因转录的核受体发挥作用。T3对正常的大脑和骨骼发育至关重要,并对成人的代谢和心血管功能有广泛影响。
甲状腺的解剖学和组织学
甲状腺由左右两叶组成,位于气管的前外侧(图42.1)。通常,两叶通过一个腹侧中部的峡部相连。甲状腺的血液供应非常丰富。每侧有三组静脉引流:上、中、下甲状腺静脉。甲状腺接受交感神经支配,这些神经是血管运动性的,而非分泌运动性的。
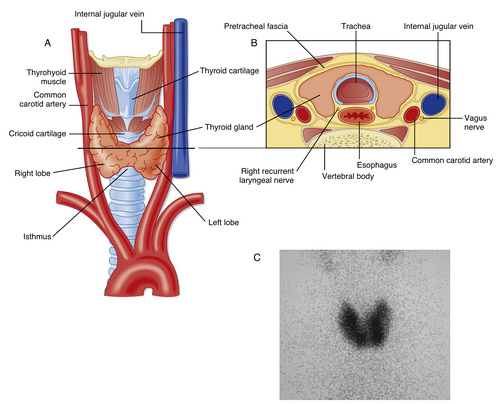
甲状腺的功能单位是甲状腺滤泡(thyroid follicle),这是一个直径约为200至300μm的球形结构,由单层甲状腺上皮细胞包围(图42.2)。上皮细胞位于基底膜上,基底膜是滤泡的最外层结构,周围有丰富的毛细血管供应。滤泡上皮细胞的顶端面向滤泡腔。滤泡腔内充满了胶质(colloid),胶质由甲状腺球蛋白(thyroglobulin)组成。这种大分子蛋白质(600kDa)被分泌到滤泡腔中,并由甲状腺上皮细胞进行碘化,作为甲状腺激素生产的支架。上皮细胞的大小和胶质的量是动态变化的,随着腺体的活动而变化。除了滤泡细胞外,甲状腺还含有另一种类型的细胞。散布在腺体中的是滤泡旁细胞(parafollicular cells),或称C细胞,它们是多肽激素降钙素(calcitonin)的来源(见第40章)。
甲状腺激素
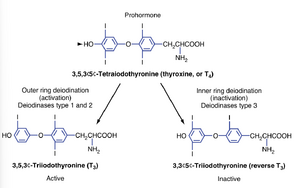
甲状腺的分泌产物是碘甲状腺原氨酸(iodothyronines)(图42.3),这是一类由两个碘化酪氨酸分子结合形成的激素。大约90%的甲状腺输出是3,5,3',5' -四碘甲状腺原氨酸(甲状腺素thyroxine,或T4),它作为一种激素前体发挥作用。约10%是3,5,3' -三碘甲状腺原氨酸(T3),这是甲状腺激素的活性形式。不到1%的甲状腺输出是3,3',5'-三碘甲状腺原氨酸(rT3,reverse T3),它是无活性的。通常,这三种产物以它们在腺体中储存的比例分泌。
碘平衡
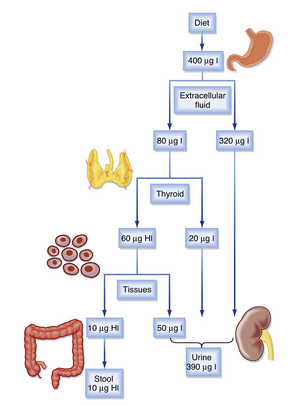
由于碘在甲状腺生理中扮演着独特的角色,描述甲状腺激素的合成需要对碘的代谢有一定的理解(图42.4)。在美国,平均每人每天摄入400微克的碘,而成年人的最低每日需求量为150微克,儿童为90至120微克,孕妇为200微克。在稳态下,相同量的400微克碘通过尿液排出。碘在甲状腺、唾液腺、胃腺、泪腺、乳腺和脉络丛中主动浓缩。甲状腺每天从循环池中摄取约70至80微克的碘,循环池中大约含有250至750微克的碘。甲状腺的总碘含量平均为7500微克,几乎全部以胶体甲状腺球蛋白中储存的碘甲状腺原氨酸形式存在。在稳态下,每天从腺体中释放70至80微克的碘,约占总量的1%。其中,75%以甲状腺激素的形式分泌,其余以游离碘的形式分泌。激素形式储存的碘与每日代谢量的高比例(100:1)使得甲状腺在碘缺乏的情况下能够维持约2个月。当血清中碘浓度下降时,肾脏对碘的排泄显著减少,从而进一步节约碘。
甲状腺激素合成概述
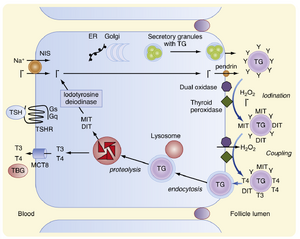
要理解甲状腺激素的合成和分泌,必须了解每个过程的方向性,因为它与极化的甲状腺上皮细胞相关(图42.5)。甲状腺激素的合成需要两种前体:碘和甲状腺球蛋白。碘从甲状腺上皮细胞的基底(血管)侧运输到顶端(滤泡腔)侧。甲状腺球蛋白在顶端膜上合成并分泌到滤泡腔中。因此,合成过程涉及这些前体从基底到顶端的运动进入滤泡腔(见图42.5)。碘甲状腺原氨酸的实际合成发生在滤泡腔内靠近上皮细胞顶端膜的酶促反应中(见后文)。甲状腺激素的分泌涉及碘化甲状腺球蛋白的内吞作用以及内吞囊泡从顶端到基底的运动,这些囊泡与溶酶体融合。甲状腺球蛋白被溶酶体酶降解,导致甲状腺激素从甲状腺球蛋白骨架中释放。最后,甲状腺激素可能通过特定的转运蛋白穿过基底外侧膜,最终进入血液(图42.5)。
• 图42.2 甲状腺在低倍(上图)和高倍(下图)放大下的组织学结构。C,胶质;F, 甲状腺滤泡;S, 结缔组织间隔。(来自Young B等人。Wheater’s Functional Histology。第5版。费城:Churchill Livingstone;2006年。)
在甲状腺球蛋白骨架上的碘甲状腺原氨酸合成
碘化物通过位于甲状腺上皮细胞基底外侧膜上的钠-碘同向转运体(sodium-iodide symporter,NIS)逆化学和电化学梯度主动转运进入腺体(见图42.5)。NIS在甲状腺中高度表达,但在胎盘、唾液腺和活跃泌乳的乳腺中也有较低水平的表达。一个碘离子逆碘化物梯度被转运,同时两个钠离子顺其电化学梯度从细胞外液进入甲状腺细胞。这种次级主动转运的驱动力由质膜上的Na+,K+ -ATP酶提供。NIS基因的表达受碘化物抑制,并被促甲状腺激素刺激。饮食中碘化物摄入的减少会耗尽循环中的碘化物池,并显著增强碘化物捕获的活性。当饮食中碘化物摄入量低时,甲状腺对碘化物的摄取百分比可达到80%至90%。
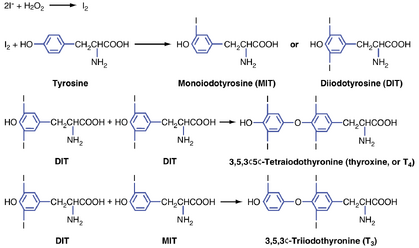
甲状腺激素合成的步骤如图42.6所示。进入腺体后,碘化物迅速移动到上皮细胞的顶膜。从那里,碘化物通过一种不依赖钠的碘化物/氯化物转运体(称为pendrin,彭德莱素[1])被转运到滤泡腔中。碘化物立即被氧化并掺入甲状腺球蛋白中的酪氨酸残基(见图42.5)。单个碘化反应形成单碘酪氨酸(MIT);同一残基的第二次碘化反应产生二碘酪氨酸(DIT)(见图42.6)。碘化后,两个DIT分子偶联形成T4; 一个MIT和一个DIT偶联形成T3。偶联发生在仍属于甲状腺球蛋白一级结构的碘化酪氨酸之间。这一系列反应由甲状腺过氧化物酶(TPO)催化,TPO是一种跨越顶膜的酶复合物。反应的直接氧化剂(电子受体)是过氧化氢。滤泡腔中H2O2的生成由同样位于顶膜的双氧化酶(dual oxidases,DUOX1, DUOX2)催化。
当碘化物供应受限时,T3的形成更有利,因为每分子有机碘化物能提供更多的活性激素。当甲状腺受到TSH或其他激活剂的过度刺激时,T3的比例也会增加。
甲状腺激素的分泌
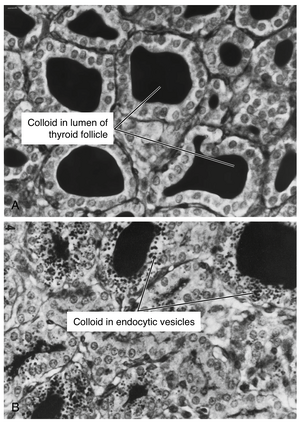
一旦甲状腺球蛋白被碘化,它就以胶体的形式储存在滤泡腔中(见图42.2)。T4和T3释放到血液中的过程是通过滤泡腔中的胶体通过大胞饮和小胞饮过程的内吞作用启动的。内吞囊泡随后与溶酶体融合,甲状腺球蛋白被降解(图42.7;另见图42.5)。在甲状腺球蛋白的蛋白水解过程中释放的MIT和DIT分子,在滤泡细胞内通过碘酪氨酸脱碘酶迅速脱碘(见图42.5)。这种脱碘酶对MIT和DIT具有特异性,不能以T4和T3为底物。然后,碘化物被重新循环用于T4和T3的合成。甲状腺球蛋白消化产生的氨基酸重新进入甲状腺内氨基酸池,并可以重新用于蛋白质合成。在正常情况下,只有极少量的完整甲状腺球蛋白离开滤泡细胞。酶促释放的T4和T3被转运到细胞的基底侧并进入血液。
甲状腺激素的转运
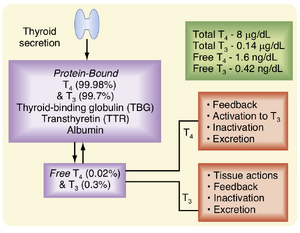
分泌的T4和T3在血液中几乎完全与蛋白质结合循环。正常情况下,血浆中总T4的约0.03%和总T3的约0.3%以游离状态存在(图42.8)。游离的T3具有生物活性,除了对垂体和下丘脑施加负反馈外,还介导甲状腺激素对外周组织的作用。主要的结合蛋白是甲状腺素结合球蛋白(thyroxine-binding globulin, TBG[2]),它在肝脏中合成,结合一个T4或T3分子。循环中的T4和T3约70%与TBG结合;10%至15%与另一种称为甲状腺素转运蛋白(transthyretin, TTR[3])的特异性甲状腺结合蛋白结合。白蛋白结合15%至20%,3%与脂蛋白结合。通常只有TBG浓度的变化会显著影响血浆中总T4和T3的水平。TBG有两个重要的生物学功能。首先,它维持了一个大的循环T4储备库,缓冲了甲状腺功能的任何急性变化。其次,血浆T4和T3与蛋白质的结合防止了这些相对较小的激素分子在尿液中的丢失,从而有助于保存碘。TTR在脑脊液中运输T4,并向中枢神经系统提供甲状腺激素。
临床相关
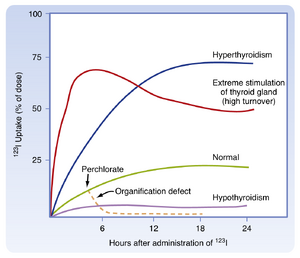
由于其能够捕获并将碘结合到甲状腺球蛋白中(称为有机化organification),甲状腺的活性可以通过放射性碘摄取(radioactive iodine uptake, RAIU)来评估。在该测试中,给予示踪剂量的123I,并在4至6小时和24小时时通过在颈部放置伽马探测器来测量RAIU。在美国,由于饮食中碘含量相对较高,6小时后的RAIU通常约为15%,24小时后约为25%(图42.9)。24小时后异常高的RAIU (>60%)表明甲状腺功能亢进。24小时后异常低的RAIU (<5%)表明甲状腺功能减退。在甲状腺受到极度慢性刺激的个体中(例如,Graves病相关的甲状腺毒症),碘被迅速捕获、有机化并作为激素释放。在这些高周转率的情况下,6小时RAIU会非常高,但24小时RAIU会较低(见图42.8)。一些阴离子,如硫氰酸盐(thiocyanate, CNS−)、高氯酸盐(perchlorate, HClO4-)和高锝酸盐(pertechnetate, \widetildeIcO4),是通过NIS进行碘转运的竞争性或非竞争性抑制剂。如果碘在被细胞摄取后不能迅速结合到酪氨酸中(有机化缺陷),给予这些阴离子之一会通过阻止进一步的碘摄取,导致碘从腺体中迅速释放(见图42.9)。这种释放是由于甲状腺-血浆浓度梯度高所致。
在给予示踪剂123I、131I或碘模拟物高锝酸盐(pertechnetate)后,可以使用直线扫描仪或伽马相机对甲状腺进行成像。成像可以显示甲状腺的大小和形状(见图42.1C),以及甲状腺内活跃组织与非活跃组织的异质性。这种异质性通常是由于甲状腺结节的形成,这些结节是扩大的滤泡区域,具有由于刺激和退化周期引起的退行性变化的证据。“热”结节(即在成像中显示高RAIU的结节)通常不是癌性的,但可能导致甲亢。“冷”结节癌变的可能性是热结节的10倍。这些结节可以通过细针穿刺活检进行病理分析取样。
甲状腺也可以通过超声成像进行成像,其分辨率优于RAIU成像。超声成像用于在结节细针穿刺活检时引导医生。甲状腺的最高分辨率是通过磁共振成像(MRI)实现的。
甲状腺激素进入细胞和外周转化
多年来,人们认为甲状腺激素的亲脂性使其能够通过被动扩散穿过质膜。然而,现在已知甲状腺激素需要转运蛋白来促进其进入细胞。这一过程由属于多个基因家族的各种转运蛋白(20种或更多)完成。这些转运蛋白包括单羧酸转运蛋白MCT8和MCT10,它们能够将T4和T3转运穿过质膜(图42.13;另见图42.5)。最近,MCT8的突变已被证明会导致一种X连锁的发育综合征,其特征是T3水平升高、肌肉发育不全以及严重的神经和智力障碍。另一种转运蛋白OATP1C1在T4穿过血脑屏障的转运中发挥作用。其他甲状腺激素转运蛋白的相对重要性和组织分布仍有待阐明,这为我们理解甲状腺激素功能增加了另一层复杂性。
由于甲状腺的主要产物是T4,而甲状腺激素的活性形式是T3,因此甲状腺轴在很大程度上依赖于通过甲状腺素特异性脱碘酶(deiodinases)作用的外周转化(见图42.3)。这些酶在特异性、底物亲和力、组织分布和亚细胞定位方面有所不同。1型(D1)和2型(D2)脱碘酶都可以将T4转化为T3。尽管D1对T4的亲和力相对较低(微摩尔级),但它在肝脏和肾脏的质膜上表达,这些大器官具有高血流量,能够快速将激素释放到血液中。因此,D1有助于为局部T3生成较低或缺失的组织提供可用的循环T3池。有些矛盾的是,D1的表达在甲状腺功能亢进时增加,并导致甲状腺功能亢进疾病中循环T3水平的升高。
D2 是一种高亲和力(纳摩尔级)的外环脱碘酶(outer ring deiodinase),定位于内质网,能够将 T4 转化为 T3。表达 D2 的组织,包括中枢神经系统、垂体前叶和棕色脂肪,因此可以独立于循环中的 T3 水平来调节细胞内 T3 的水平。尽管 D2 位于细胞内,但它提供了大部分循环中的 T3。由于神经胶质细胞中存在 D2,即使循环中的 T4 下降到低水平,大脑仍能维持恒定的 T3 水平。因此,在甲状腺功能减退期间,D2 的表达会增加。D2 通过调节垂体促甲状腺细胞分泌的促甲状腺激素(thyroid-stimulating hormone, TSH),在甲状腺轴的反馈控制中起关键作用。这些细胞表达 D2,促进 T4 在细胞内转化为 T3,进而介导负反馈。这一机制允许对循环中 T3 和 T4 的总量进行整合的反馈反应。最后,还有一种“失活”脱碘酶,称为 3 型脱碘酶(type 3 deiodinase, D3)。这种高亲和力的内环脱碘酶将 T4 转化为无活性的 rT3。在甲状腺功能亢进期间,D3 会增加,这有助于抑制 T4 的过度产生。此外,在疾病或饥饿期间,D3 的表达也会增加(参见“临床视角”中的非甲状腺疾病综合征)。
矛盾的是,尽管甲状腺激素替代疗法使 TSH 水平恢复正常,但仍有少数甲状腺功能缺失的患者报告出现甲状腺功能减退的症状。这是否可能归因于这些患者中的脱碘酶多态性,是一个活跃的研究领域。
细胞水平
TSH 对甲状腺激素分泌的调节受到精细的负反馈控制(见第 41 章)。循环中的甲状腺激素通过抑制 TSHβ亚基基因表达,反馈作用于垂体以减少 TSH 的分泌。如前所述,促甲状腺细胞中的反馈控制代表了对循环中游离 T4 和 T3 水平的整合反应。由于 TSH 分泌的昼夜变化较小,甲状腺激素的分泌和血浆浓度相对稳定。仅在夜间会出现 TSH 分泌和 T4 释放的少量增加。甲状腺激素还反馈作用于下丘脑的促甲状腺激素释放激素(thyroid-releasing hormone, TRH)分泌神经元。在这些神经元中,T3 抑制前体 TRH 基因的表达。
甲状腺功能的自我调节是由碘化物本身引起的,它具有双相作用。在相对较低的碘摄入水平下,甲状腺激素的合成速率与碘的可用性直接相关。然而,如果碘的摄入量超过2毫克/天,腺体内的碘浓度达到一个水平,反而会抑制TPO(甲状腺过氧化物酶)的活性,阻断激素的生物合成。这种现象被称为Wolff-Chaikoff效应。对高碘摄入的适应通常通过减少NIS(钠碘同向转运体)的表达来实现,这导致甲状腺内碘水平下降。随后,TPO活性恢复正常,甲状腺激素的合成在几天到几周内恢复。在特殊情况下,NIS未能下调会导致碘对激素合成的长期抑制,从而导致甲状腺功能减退。过量碘引起的激素合成暂时减少也被用于治疗甲状腺功能亢进症。
甲状腺功能的调节
甲状腺功能和生长的最重要调节因子是TSH(促甲状腺激素),而TSH又受到下丘脑释放的甲状腺释放激素(TRH)进入门脉循环的调节(见第41章)。TSH刺激甲状腺功能的各个方面,包括对甲状腺上皮细胞的即时、中期和长期作用。TSH的快速作用包括将含有碘化甲状腺球蛋白的胶体滴通过胞吞作用进入细胞质形成内体(见图42.7)。内体随后与溶酶体融合,导致碘化甲状腺球蛋白的蛋白水解,并从腺体释放T4和T3。TSH刺激碘的摄取和TPO活性。它还刺激葡萄糖进入单磷酸己糖途径,该途径生成过氧化物酶反应所需的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。TSH对甲状腺的中期效应在几小时到几天后发生,涉及蛋白质合成和多个基因的表达,包括编码NIS、甲状腺球蛋白和TPO的基因。持续的TSH刺激会导致滤泡细胞肥大和增生的长期效应。毛细血管增生,甲状腺血流量增加。这些作用是TSH对腺体生长促进作用的基础,并得到局部生长因子的支持。明显增大的甲状腺被称为甲状腺肿(图42.10)。地方性甲状腺肿是由于饮食中缺乏足够的碘,导致甲状腺激素水平低和TSH水平升高。
• 图42.10 甲状腺位于颈部前部,当它增大时(甲状腺肿)很容易被观察到。
临床相关
Graves病是最常见的甲状腺功能亢进症。它最常发生在20至50岁之间,女性比男性常见5-10倍。Graves病是一种自身免疫性疾病,其中产生了针对TSH受体的激活型自身抗体。由抗体驱动的甲状腺功能亢进症通常伴随着由于腺体增生和肥大引起的弥漫性甲状腺肿。滤泡上皮细胞变为高柱状细胞,胶体显示出扇贝状边缘,表明快速周转。
Graves病的主要临床表现是甲状腺毒症(thyrotoxicosis)——即血液和组织中甲状腺激素过量的状态。甲状腺毒症患者将表现出临床医学中最引人注目的症状之一。尽管食物摄入增加,但代谢率的大幅提高表现为体重减轻。过量的热量产生导致在温暖环境中感到不适、出汗以及更多的水分摄入。交感神经活动的增强导致心率加快、运动过度、震颤、紧张和眼睛睁大。肌肉质量的减少以及肌肉功能的受损导致虚弱。其他症状包括情绪不稳定、运动时呼吸急促,以及由于甲状腺肿大压迫食管或气管导致的吞咽或呼吸困难。最常见的心血管体征是窦性心动过速。由于正性肌力作用结合全身血管阻力降低,心输出量增加,伴随脉压增宽。Graves病的一个常见临床体征是突眼(exophthalmos,眼球异常突出)和眼眶周围水肿。这是由于自身抗体与眼眶成纤维细胞上表达的TSH受体结合,导致黏多糖生成增加、眼眶脂肪扩张和眼外肌水肿所致。
Graves病通常通过血清游离和总T4和T3水平升高以及弥漫性甲状腺肿和眼病的临床体征来诊断。血清TSH水平较低,因为下丘脑和垂体受到高水平的T4和T3的抑制。在大多数情况下,甲状腺对放射性碘的摄取是过量和弥漫性的。TSH水平的测定和循环中甲状腺刺激免疫球蛋白的存在可以区分Graves病(一种原发性疾病)与罕见的垂体促甲状腺激素腺瘤(一种继发性疾病),后者会产生高水平的TSH。
Graves病的治疗通常涉及甲状腺切除,随后进行终身甲状腺素替代治疗。甲状腺组织可以通过131|放射性消融或手术切除。在手术切除甲状腺时,必须采取预防措施,以避免大量、可能危及生命的甲状腺激素释放,即甲状腺危象。另一种替代甲状腺组织切除的方法是使用抑制TPO活性的抗甲状腺药物。
甲状腺激素的生理作用
甲状腺激素几乎作用于所有细胞和组织,甲状腺功能失衡构成了一些最常见的内分泌疾病。甲状腺激素有许多直接作用,但它也以允许性方式优化其他几种激素和神经递质的作用。
心血管作用
甲状腺激素在临床上最重要的作用可能是对心血管生理的影响。T3 增加心输出量,从而确保组织获得足够的O2供应(图 42.11)。静息心率和每搏输出量均增加。心肌收缩的速度和力量增强(分别为正性变时和正性变力作用),舒张期松弛时间缩短(正性松弛作用)。收缩压适度升高,舒张压降低。由此产生的脉压增宽反映了每搏输出量增加以及皮肤、肌肉和心脏血管扩张导致的全身血管阻力降低的综合效应。这些效应部分是由于甲状腺激素诱导的组织产热和CO2生成增加(见“对基础代谢率和产热的影响”)。此外,甲状腺激素通过扩张外周循环中的小动脉来降低全身血管阻力。通过激活肾素-血管紧张素-醛固酮轴,增加肾小管钠重吸收,从而增加总血容量(见第 34 章)。
T3 的心脏正性变力作用既有直接作用,也有间接作用。后者主要是由于对儿茶酚胺的反应性增强(见第 43 章)。直接的正性变力作用(见图 42.11)涉及多种增强收缩力的蛋白质的调节,包括增加 α-肌球蛋白重链表达和抑制质膜 Na+/Ca++ 交换体。肌浆网Ca++-ATP 酶(SERCA)被 T3增加,而phospholamban减少。因此,舒张期钙的隔离增强,松弛时间缩短。肌浆网中增加的雷诺丁 Ca++ 通道促进收缩期 Ca++ 从肌浆网释放。
• 图 42.11 甲状腺激素增加心输出量的机制。间接机制可能在数量上更为重要。
临床意义
正常范围内的甲状腺激素水平是心脏最佳功能所必需的。人类甲状腺激素缺乏会降低每搏输出量、左心室射血分数、心输出量和心脏功能效率。后一种缺陷表现为每搏功指数([每搏输出量/左心室质量] \times 收缩压峰值)的下降幅度大于心肌氧化代谢的下降幅度。全身血管阻力的升高可能加剧了这种心脏功能减退。相比之下,甲状腺激素过量通过增加心率和每搏输出量来增强心输出量。由于全身血管阻力降低,收缩压升高和舒张压降低导致脉压增宽。甲状腺毒症与心悸、房颤和二尖瓣脱垂有关(见第 15 章)。
对基础代谢率和产热的影响
增加的 O2使用最终依赖于氧化底物供应的增加。T3 增强了胃肠道对葡萄糖的吸收,并增加了葡萄糖的周转(葡萄糖摄取、氧化和合成)。在脂肪组织中,甲状腺激素诱导了脂肪酸合成的酶,包括乙酰辅酶A羧化酶和脂肪酸合酶,并通过增加β-肾上腺素能受体的数量来增强脂肪分解(参见对自主神经系统和儿茶酚胺作用的影响)。甲状腺激素还增强了乳糜微粒的清除。因此,脂质周转(脂肪组织中游离脂肪酸的释放和氧化)得到了增强。
蛋白质周转(肌肉氨基酸的释放、蛋白质降解,以及较小程度的蛋白质合成和尿素形成)也有所增加。T3 增强了肾上腺素、去甲肾上腺素、胰高血糖素、皮质醇和生长激素对糖异生、脂肪分解、酮体生成和不稳定蛋白质库的蛋白质分解的各自刺激作用。甲状腺激素的整体代谢效应被恰当地描述为加速了对饥饿的生理反应。此外,甲状腺激素刺激了从胆固醇合成胆汁酸,并促进了胆汁分泌。净效应是体内总胆固醇和低密度脂蛋白胆固醇的池和血浆水平降低。甲状腺激素还增加了肾上腺和性腺类固醇激素、某些B族维生素以及某些给药药物的代谢清除率。
甲状腺激素通过影响三磷酸腺苷(ATP)的利用和ATP合成的效率来刺激产热。ATP的利用通过上调几种能量依赖的过程而增强,包括 NaK-ATP酶和SERCA,特别是在骨骼肌中,细胞质和肌浆网之间的钙循环使用ATP并产生热量。最近的研究表明,人类棕色脂肪(brown fat)在成人中也似乎在兼性产热(facultative thermogenesis)中发挥作用,而以前认为它仅在新生儿中重要。影像学研究已经证明了纵隔中存在棕色脂肪,特别是在瘦个体中,并且棕色脂肪的代谢活性在暴露于寒冷时增强。棕色脂肪表达解偶联蛋白-1(uncoupling protein-1, UCP1),也称为产热素(thermogenin),它导致线粒体内膜上的质子梯度以热的形式消散,然后通过循环传播到身体的其他部位。UCP1受甲状腺激素的调节,棕色脂肪表达D2,提供了细胞内 T4 向 T3 的转化。棕色脂肪的产热涉及甲状腺激素和交感神经系统之间的协同作用。儿茶酚胺促进脂肪分解并上调D2的表达。T3 反过来上调肾上腺素能受体并增强对儿茶酚胺的反应性。甲状腺功能亢进症伴随热不耐受,而甲状腺功能减退症伴随冷不耐受。
呼吸效应
甲状腺激素刺激氧气的利用并增强氧气的输送。相应地,T3 增加了静息呼吸频率、每分钟通气量以及对高碳酸血症和低氧血症的通气反应。这些作用在氧气利用增加时维持正常的动脉 PO2,在二氧化碳产生增加时维持正常的PCO2。此外,血细胞比容略有增加,以增强氧气的携带能力。这种增加是由于肾脏刺激促红细胞生成素的产生所致。
骨骼肌效应
骨骼肌的正常功能也需要适量的甲状腺激素。这一需求可能与能量产生和储存的调节有关。糖酵解和糖原分解增加,而糖原和磷酸肌酸在甲状腺激素过量时减少。肌肉无法摄取和磷酸化肌酸导致其尿中排泄增加。
对自主神经系统和儿茶酚胺作用的影响
如前所述,儿茶酚胺和甲状腺激素之间存在重要的协同作用。甲状腺激素与儿茶酚胺在增加代谢率、产热、心率、运动活动和中枢神经系统兴奋方面具有协同作用。T3 可能通过增加心肌中 β -肾上腺素能受体的数量以及细胞内第二信使如环磷酸腺苷(cAMP)的生成来增强交感神经系统的活性。
对生长和成熟的影响
甲状腺激素的一个主要作用是促进生长和成熟。少量但关键的甲状腺激素穿过胎盘,胎儿甲状腺轴在妊娠中期开始发挥作用。甲状腺激素对胎儿的正常神经发育和骨骼形成极为重要。在婴儿中,胎儿甲状腺激素不足会导致先天性甲状腺功能减退症,其特征是不可逆的智力障碍和身材矮小(见临床框)。
对骨骼、硬组织和真皮的影响
甲状腺激素促进软骨内骨化、线性骨生长以及骨骺骨中心的成熟。T3 通过增加局部生长因子的产生和作用,部分地增强了软骨生长板中软骨细胞的成熟和活性。在出生后的线性生长过程中,T3 支持生长激素、胰岛素样生长因子-I 和其他生长因子的作用。T3 还支持正常的成人骨重塑。
牙齿的发育和萌出进程依赖于甲状腺激素,表皮、毛囊和指甲的正常生长和成熟周期也是如此。甲状腺激素刺激这些结构和皮肤组织的正常降解过程。因此,甲状腺激素过多或过少都可能导致脱发和指甲形成异常。甲状腺激素通过抑制细胞外结缔组织中粘多糖(糖胺聚糖)和纤维连接蛋白的合成并增加其降解来调节皮下组织的结构(见后文对粘液性水肿的描述)。
对神经系统的影响
甲状腺激素调节中枢神经系统(CNS)发育的时间和速度。在子宫内和婴儿早期,甲状腺激素缺乏会抑制大脑和小脑皮质的生长、轴突的增殖和树突的分支、突触形成、髓鞘形成以及细胞迁移。如果新生儿甲状腺激素缺乏未被及时发现和治疗,会导致不可逆的中枢神经系统损伤。这些形态学缺陷伴随着生化异常。甲状腺激素水平降低会减少细胞大小、RNA和蛋白质含量、微管蛋白和微管相关蛋白、髓鞘的蛋白质和脂质含量、关键生长因子的局部生成以及蛋白质合成速率。
甲状腺激素还增强清醒度、警觉性、对各种刺激的反应能力、听觉、饥饿感、记忆力和学习能力。此外,正常的情绪状态依赖于适当的甲状腺激素水平。此外,甲状腺激素会增加周围神经反射的速度和幅度,以及胃肠道的运动性。
• 图42.12 A,正常6岁儿童(左)和来自同一村庄的先天性甲状腺功能减退症17岁患者(右),该地区为地方性甲状腺功能减退症区域。手部X光片比较了正常13岁儿童(B)和患有甲状腺功能减退症的13岁儿童(C)。注意,甲状腺功能减退症患者的手部小骨、手指两端的生长板以及桡骨远端生长板的发育明显延迟。(A,来自Delange FM。见:Braverman LE, Utiger RD, 编。Werner和Ingbar的《甲状腺》。第7版。费城:Lippincott-Raven;1996。B,来自Tanner JM等。《骨骼成熟度评估和成人身高预测(TW2方法)》。纽约:学术出版社;1975。C,来自Andersen HJ。见:Gardner LI, 编。《儿童和青少年内分泌和遗传疾病》。费城:Saunders;1975。)
对生殖器官和内分泌腺的影响
在女性和男性中,甲状腺激素在生殖功能的调节中起着重要的允许作用。正常的卵巢周期(包括卵泡发育、成熟和排卵)、同源的睾丸精子生成过程以及健康妊娠状态的维持,都会因甲状腺激素水平显著偏离正常范围而受到干扰。这些有害效应部分可能是由于类固醇激素的代谢或可用性发生改变所致。例如,甲状腺激素刺激肝脏合成和释放性激素结合球蛋白。
临床相关
甲状腺功能减退症(hypothyroidism)指的是甲状腺激素生成不足,可能表现为原发性、继发性或三级内分泌疾病(见第41章)。在原发性甲状腺功能减退症中,T4和T3水平异常低,而TSH水平高。在继发性和三级甲状腺功能减退症中,甲状腺激素和TSH水平均低。TSH水平对合成TRH的反应可用于区分垂体和下丘脑疾病。
胎儿或幼儿期的甲状腺功能减退症(hypothyroidism)会导致先天性甲状腺功能减退症(congenital hypothyroidism,以前称为克汀病 [图42.12])。受影响的个体会出现严重的智力障碍、身材矮小且骨骼发育不全、面部特征粗糙以及舌头突出。全球范围内,儿童甲状腺功能减退症的最常见原因是碘缺乏。历史上,碘缺乏曾被视为南美洲、非洲和亚洲某些山区甲状腺功能减退症的主要原因,但最近的证据表明,这一问题甚至更为普遍。这种地方性甲状腺功能减退症的悲剧形式可以通过公共卫生计划来预防,例如在食盐中添加碘或每年注射一种缓慢吸收的碘制剂。先天性缺陷是新生儿/儿童甲状腺功能减退症的较少见原因。在大多数情况下,甲状腺根本没有发育(甲状腺发育不全,thyroid gland dysgenesis)。儿童甲状腺功能减退症的较少见原因包括与甲状腺激素产生相关的基因突变(例如,NIS、TPO、甲状腺球蛋白、pendrin)或针对TSH受体的阻断抗体。神经和骨骼缺陷的严重程度与诊断时间和甲状腺激素(T4)替代治疗的时机密切相关,早期治疗可以恢复正常的认知能力,并仅留下轻微的神经缺陷。另一方面,如果出生时的甲状腺功能减退症在2至4周内未得到治疗,中枢神经系统(CNS)在生命的第一年将无法正常发育。发育里程碑(如坐、站和走)会延迟,并可能导致严重的不可逆认知缺陷。甲状腺功能减退的婴儿通常在出生时看起来正常,因为受到母体甲状腺激素的保护。因此,新生儿筛查(T4和TSH水平)在先天性甲状腺功能减退症的诊断和预防中发挥了关键作用。
在非碘缺乏的成年人中,甲状腺功能减退症最常见的原因是另一种自身免疫性疾病,称为桥本氏病(Hashimoto’s disease,以前称为淋巴细胞性甲状腺炎)。与Graves病中自身抗体的刺激作用不同,桥本氏病中的甲状腺自身抗体(针对TPO、甲状腺球蛋白或TSH受体)会导致甲状腺细胞凋亡和甲状腺滤泡破坏。这些抗体固定补体并促进甲状腺细胞溶解,导致甲状腺球蛋白释放到血液循环中。甲状腺被B淋巴细胞和T淋巴细胞浸润,可能导致甲状腺肿大。
甲状腺功能减退症的其他原因包括医源性原因(例如,放射化学损伤或手术治疗甲状腺功能亢进症)、结节性甲状腺肿以及垂体或下丘脑疾病。使用抗心律失常药物胺碘酮(amiodarone)治疗患者可能会引起甲状腺功能减退或甲状腺功能亢进,因为该药物含有大量碘。服用此药物的患者必须密切监测甲状腺功能。
成人甲状腺功能减退症(hypothyroidism)的临床表现在许多方面与甲状腺功能亢进症(hyperthyroidism)完全相反。低于正常水平的代谢率导致体重增加,而热量摄入并未显著增加。产热减少导致体温降低,引起对寒冷的耐受性下降、出汗减少和皮肤干燥。肾上腺素能活动减少,因此可能出现心动过缓(bradycardia)。运动、言语和思维均减慢,出现嗜睡、困倦和上眼睑下垂(ptosis)。带负电荷的黏多糖(mucopolysaccharides)在结缔组织中的积累会吸引钠和液体。由此导致的非凹陷性黏液性水肿(nonpitting myxedema)会引起面部浮肿、舌头增大、声音嘶哑、关节僵硬、胸腔、心包和腹腔积液,以及由于过多的基质物质压迫周围神经和颅神经。便秘、脱发、月经功能障碍和贫血也是其他症状。在缺乏甲状腺激素的成人中,正电子发射断层扫描(positron emission tomography)显示脑血流量和葡萄糖代谢普遍减少。这种异常可能解释了甲状腺功能减退患者的心理运动障碍和情绪低落状态。
每日剂量的T4替代治疗通常可以治愈甲状腺功能减退的成人,使促甲状腺激素水平恢复正常。在大多数患者中,不需要T3,因为外周D1和D2会根据需要生成T3。此外,T3的高效性和短半衰期使其给药复杂化,需要频繁给药,并且难以维持一致的生理水平T3。
甲状腺激素还对内分泌系统的其他部分有显著影响。甲状腺激素增加垂体生长激素的分泌,而减少催乳素的分泌。肾上腺皮质分泌的皮质醇(cortisol)(见第43章)及其代谢清除率受到刺激,但血浆游离皮质醇水平保持正常。在男性中,雌激素与雄激素的比例增加(甲状腺功能亢进时可能出现乳房增大)。甲状旁腺激素和1,25-二羟基维生素D的产生减少是甲状腺激素对骨吸收影响的代偿性后果(见第40章)。甲状腺激素还增加肾脏大小、肾血浆流量、肾小球滤过率以及多种物质的转运速率。
• 图42.13 甲状腺激素作用的机制,包括MCT转运蛋白、D2脱碘酶和TR-RXR异二聚体的作用。C o A, 共激活因子;CoR,共抑制因子;MCT,单羧酸转运蛋白;RXR,视黄醇X受体;TR,甲状腺激素受体;TRE,甲状腺激素反应元件。
临床实践
非甲状腺疾病综合征(Nonthyroidal illness syndrome, NTIS),也称为甲状腺功能正常病态综合征,发生在需要住院治疗的严重疾病患者中。NTIS的特征是由于下丘脑-垂体-甲状腺轴的中枢性抑制导致的循环甲状腺激素和促甲状腺激素水平降低。下丘脑产生的促甲状腺激素释放激素(TRH)减少,因此在T4和T3水平降低的情况下,TSH水平可能较低或不适当地正常。此外,由于D3的上调,T4向无活性的r T3的外周代谢增加。在长期禁食时也会观察到类似的反应。尽管NTIS的机制尚未完全理解,但它被认为是对慢性疾病或饥饿的一种生理性能量节约适应。因此,不应在危重患者中评估甲状腺状态。
在细胞水平
甲状腺激素的作用机制
许多(但不是所有)T3的作用是通过其与甲状腺激素受体(TR)家族成员之一结合来介导的。TR家族属于核激素受体超家族的转录因子(另见第3章)。在人类中,有两个TR基因,THRA和THRB,分别位于17号和3号染色体上,编码核TR。THRA编码TRα,它通过选择性剪接形成两种主要亚型。T Rα1是一个真正的TR,而另一种亚型不结合T3。THRB编码\barT\barRβ1和T Rβ2,它们是T3的高亲和力受体。TRα1和T Rβ1的组织分布广泛。TRα1在心脏和骨骼肌中强烈表达。TRα1是甲状腺激素对心脏作用的主要介导者。相比之下,T Rβ1主要在脑、肝和肾中表达。T Rββ2的表达局限于垂体和下丘脑的关键区域,以及耳蜗和视网膜。T3通过T Rββ作用,负责抑制下丘脑室旁神经元中前体TRH基因和垂体促甲状腺细胞中TSH基因的β亚基的表达。因此,甲状腺激素对TRH和TSH分泌的负反馈作用主要由T Rβ2介导。
TR与RXR形成异二聚体(见图42.13)。未配体的TR-RXR结合到靶基因中的甲状腺反应元件,并招募共抑制因子,抑制基础基因转录。在T3结合后,共抑制因子被释放,共激活因子被招募到激素-受体复合物中,诱导基因转录。
了解TR亚型(thyroid hormone receptor subtypes)非常重要,因为已发现TR失活突变会导致甲状腺激素抵抗综合征。最常见的突变发生在T Rβ2亚型中,导致下丘脑-垂体水平的负反馈不完全。因此,T4水平升高,但TSH未被抑制。当抵抗主要发生在下丘脑-垂体水平时,患者可能表现出甲状腺功能亢进的症状,这是由于甲状腺激素水平升高对外周组织(尤其是心脏)的影响,这种影响由T Rα1介导。TR亚型也可能成为潜在的治疗靶点。例如,目前正在研究开发T Rβ特异性激动剂,这些激动剂对脂质和胆固醇代谢有益,且不会带来心血管副作用的风险。
越来越多的证据表明,T3和T4通过作用于质膜、线粒体或细胞质的受体介导非基因组作用。在某些情况下,这些受体是核甲状腺受体的修饰版本。例如,已报道的截短型T Rα1亚型可以在质膜中结合T3,介导骨骼中的非基因组效应,或在细胞质中结合T4,调节微丝组织。还有报道称,一种整合素,可以作为细胞表面的T4受体,通过非基因组机制调节细胞增殖和血管生成。甲状腺激素的经典基因组作用与非基因组作用之间的相互作用可能是未来研究的另一个活跃领域。
关键概念
- 甲状腺位于颈部腹侧,由位于气管前外侧的左右两叶组成,并通过峡部连接。
- 甲状腺是四碘甲状腺原氨酸(thyroxine, T4)和三碘甲状腺原氨酸(triiodothyronine, T3)的来源。
- 腺体中的基本内分泌单位是滤泡,滤泡由单层球形上皮细胞围绕中央腔组成,腔内含有胶体或储存的激素。
- 碘化物通过基底外侧质膜中的钠-碘同向转运体被摄取到甲状腺细胞中。
- T4和T3由酪氨酸和碘化物通过双氧化酶和甲状腺过氧化物酶的酶复合物合成。甲状腺球蛋白中的酪氨酸残基发生碘化,随后两个碘酪氨酸分子偶联生成碘甲状腺原氨酸。
- 储存的T4和T3的分泌需要通过内吞作用从滤泡腔中回收甲状腺球蛋白。随后,甲状腺球蛋白在内溶酶体中被降解,释放出T4和T3。未在甲状腺球蛋白内发生偶联的碘酪氨酸分子通过循环被回收以保存碘化物。
- TSH通过其质膜受体作用于甲状腺,刺激T4和T3生产的所有步骤。这些步骤包括碘化物的摄取、碘化和偶联,以及从甲状腺球蛋白中回收。TSH还刺激葡萄糖氧化、蛋白质合成和上皮细胞的生长。
- 超过99.5%的T4和T3在循环中与以下蛋白质结合:甲状腺结合球蛋白(thyroid-binding globulin)、转甲状腺素(transthyretin)和白蛋白(albumin)。只有游离的T4和T3具有生物活性。
- T4主要作为一种激素前体发挥作用,其代谢由三种脱碘酶(deiodinases)调控。外环单脱碘反应产生每日T3产量的75%,T3是主要的活性激素。相反,内环单脱碘反应产生rT3,后者没有生物活性。T4在T3和rT3之间的分配调节了活性甲状腺激素的可用性。
- 甲状腺激素是基础代谢率和产热的主要正向调节因子。甲状腺激素的其他重要作用包括增加心率、心输出量和通气量,以及降低全身血管阻力。底物动员和代谢产物的清除也得到了增强。
- 甲状腺激素对中枢神经系统(CNS)和骨骼的作用对正常生长发育至关重要。缺乏甲状腺激素会导致先天性甲状腺功能减退症(congenital hypothyroidism),表现为大脑发育不良、身材矮小和骨骼发育不成熟。在成人中,甲状腺激素支持骨重塑以及皮肤和毛发的降解。
- T3与甲状腺激素受体亚型结合,这些受体负责甲状腺激素的各种作用。甲状腺激素受体与RXR形成异源二聚体,调节靶基因上的甲状腺反应元件,从而在T3存在或缺失时分别诱导或抑制基因表达。
