第十一章 自主神经系统与其中枢调控:修订间差异
自动添加 Sofia 模板和分类 |
|||
| (未显示2个用户的5个中间版本) | |||
| 第14行: | 第14行: | ||
== 自主神经系统的组织结构 == | == 自主神经系统的组织结构 == | ||
自主感觉神经元位于背根神经节(dorsal root ganglia)和脑神经节(cranial nerve ganglia)中。与背根神经节的其他神经元类似,它们是假单极细胞:其轴突外周分支延伸至某一内脏,中枢分支则进入中枢神经系统。 | 自主感觉神经元位于背根神经节(dorsal root ganglia)和脑神经节(cranial nerve ganglia)中。与背根神经节的其他神经元类似,它们是假单极细胞:其轴突外周分支延伸至某一内脏,中枢分支则进入中枢神经系统。 | ||
关于自主运动传出,交感与副交感神经系统均采用双神经元运动通路。该通路由节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)组成:节前神经元胞体位于中枢神经系统内,节后神经元胞体位于自主神经节中(图11.1和图11.2)。此运动通路的效应靶点包括平滑肌、心肌和腺体。 | 关于自主运动传出,交感与副交感神经系统均采用双神经元运动通路。该通路由节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)组成:节前神经元胞体位于中枢神经系统内,节后神经元胞体位于自主神经节中(图11.1和图11.2)。此运动通路的效应靶点包括平滑肌、心肌和腺体。 | ||
肠神经系统包含位于胃肠道壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)中的神经元及神经纤维。 | 肠神经系统包含位于胃肠道壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)中的神经元及神经纤维。[[文件:BL-11.1.png|缩略图|• 图11.1 交感神经与副交感神经通路的示意图。红色表示交感神经通路,蓝色表示副交感神经通路。节前神经元用深色表示,节后神经元用浅色表示。|居中|691x691px]]交感神经系统(sympathetic nervous system)和副交感神经系统(parasympathetic nervous system)通常通过拮抗作用调节器官功能。为强调这种对立关系,交感神经系统和副交感神经系统有时分别被称为"战斗或逃跑(fight or flight)"系统和"休息与消化(rest and digest)"系统。当机体面临威胁时产生的"战斗或逃跑"反应,本质上反映了交感神经系统的强烈激活,这会引发多种生理反应,包括心率加快、血压升高、血液重新分配至肌肉、胃肠蠕动减弱及分泌减少、瞳孔扩大和出汗等。 | ||
交感神经系统(sympathetic nervous system)和副交感神经系统(parasympathetic nervous system)通常通过拮抗作用调节器官功能。为强调这种对立关系,交感神经系统和副交感神经系统有时分别被称为"战斗或逃跑(fight or flight)"系统和"休息与消化(rest and digest)"系统。当机体面临威胁时产生的"战斗或逃跑"反应,本质上反映了交感神经系统的强烈激活,这会引发多种生理反应,包括心率加快、血压升高、血液重新分配至肌肉、胃肠蠕动减弱及分泌减少、瞳孔扩大和出汗等。 | |||
然而在多数情况下,自主神经系统的这两个部分通过协同工作——时而拮抗、时而协同——来共同调节内脏功能。此外,并非所有内脏结构都接受双重神经支配。例如皮肤中的平滑肌和腺体,以及体内大多数血管仅接受交感神经支配;仅有小部分血管具有副交感神经支配。事实上,副交感神经系统并不支配体壁结构,仅支配头部、胸腔、腹腔和盆腔内的器官。 | 然而在多数情况下,自主神经系统的这两个部分通过协同工作——时而拮抗、时而协同——来共同调节内脏功能。此外,并非所有内脏结构都接受双重神经支配。例如皮肤中的平滑肌和腺体,以及体内大多数血管仅接受交感神经支配;仅有小部分血管具有副交感神经支配。事实上,副交感神经系统并不支配体壁结构,仅支配头部、胸腔、腹腔和盆腔内的器官。 | ||
| 第69行: | 第66行: | ||
无论是交感还是副交感神经节,其经典神经递质均为乙酰胆碱(acetylcholine)。自主神经节中的两类乙酰胆碱受体是烟碱型(nicotinic)和毒蕈碱型(muscarinic)受体,其名称源于它们对植物生物碱尼古丁(nicotine)和毒蕈碱(muscarine)的反应特性。烟碱型乙酰胆碱受体可被箭毒(curare)或六烃季铵(hexamethonium)等药物阻断,毒蕈碱型受体则可被阿托品(atropine)阻断。自主神经节中的烟碱型受体与骨骼肌细胞上的烟碱型受体略有不同。 | 无论是交感还是副交感神经节,其经典神经递质均为乙酰胆碱(acetylcholine)。自主神经节中的两类乙酰胆碱受体是烟碱型(nicotinic)和毒蕈碱型(muscarinic)受体,其名称源于它们对植物生物碱尼古丁(nicotine)和毒蕈碱(muscarine)的反应特性。烟碱型乙酰胆碱受体可被箭毒(curare)或六烃季铵(hexamethonium)等药物阻断,毒蕈碱型受体则可被阿托品(atropine)阻断。自主神经节中的烟碱型受体与骨骼肌细胞上的烟碱型受体略有不同。 | ||
烟碱型和毒蕈碱型受体均介导兴奋性突触后电位(excitatory postsynaptic potentials, EPSPs),但这些电位具有不同的时间进程。刺激节前神经元会引发一个快EPSP,随后出现一个慢EPSP。快EPSP由烟碱型受体激活引起,其通过离子通道开放实现;慢EPSP则由毒蕈碱型受体(主要是 | 烟碱型和毒蕈碱型受体均介导兴奋性突触后电位(excitatory postsynaptic potentials, EPSPs),但这些电位具有不同的时间进程。刺激节前神经元会引发一个快EPSP,随后出现一个慢EPSP。快EPSP由烟碱型受体激活引起,其通过离子通道开放实现;慢EPSP则由毒蕈碱型受体(主要是{M}_{2}受体,见第6章)介导,该受体通过抑制钾电导产生的M电流(M current)发挥作用。 | ||
=== 效应器器官对自主神经冲动的反应—续 === | === 效应器器官对自主神经冲动的反应—续 === | ||
| 第88行: | 第85行: | ||
==== 交感神经节后神经元 ==== | ==== 交感神经节后神经元 ==== | ||
β受体最初是根据拮抗剂阻断它们的能力进行分类的,但这一分类已通过遗传学研究得到补充。β_{1}和β_{2}蛋白的研究远较β_{3}深入,但人们认为所有三类β受体蛋白均具有相似结构,包含七个跨膜区域,并由细胞内和细胞外结构域连接(参见第3章)。作用于β受体的激动剂药物会激活一种G蛋白(G protein),该蛋白刺激腺苷酸环化酶(adenylyl cyclase)以增加cAMP浓度。这一作用会因二磷酸鸟苷(guanosine diphosphate)的积累而终止。 | |||
<nowiki> | <nowiki>β受体的活性可通过多种方式调控。它可被{\bf{α}}_{1}受体的作用拮抗。β受体还可因长期暴露于激动剂而发生磷酸化(phosphorylation)导致脱敏。β受体数量的调节是第三种调控机制。例如,β受体可通过内化(internalized)减少数量。相反,在某些情况下β受体数量可增加(上调,upregulated),例如去神经支配(denervation)后。需注意,α受体的数量同样受调控。</nowiki> | ||
除释放去甲肾上腺素外,交感神经节后神经元还释放神经肽如生长抑素(somatostatin)和神经肽Y(neuropeptide Y)。例如,同时释放去甲肾上腺素和生长抑素的细胞支配胃肠道黏膜,而同时释放去甲肾上腺素和神经肽Y的细胞支配肠道和四肢的血管。交感神经节后神经元中的另一种化学介质是腺苷三磷酸(ATP)。 | 除释放去甲肾上腺素外,交感神经节后神经元还释放神经肽如生长抑素(somatostatin)和神经肽Y(neuropeptide Y)。例如,同时释放去甲肾上腺素和生长抑素的细胞支配胃肠道黏膜,而同时释放去甲肾上腺素和神经肽Y的细胞支配肠道和四肢的血管。交感神经节后神经元中的另一种化学介质是腺苷三磷酸(ATP)。 | ||
| 第101行: | 第98行: | ||
副交感神经节后神经元释放的神经递质是乙酰胆碱。这些神经元对各靶器官的作用列于表11.1。副交感神经节后作用由毒蕈碱受体(muscarinic receptors)介导。根据药理学结合研究、选择性拮抗剂的作用以及分子克隆技术,目前已鉴定出五种毒蕈碱受体类型(见第6章)。 | 副交感神经节后神经元释放的神经递质是乙酰胆碱。这些神经元对各靶器官的作用列于表11.1。副交感神经节后作用由毒蕈碱受体(muscarinic receptors)介导。根据药理学结合研究、选择性拮抗剂的作用以及分子克隆技术,目前已鉴定出五种毒蕈碱受体类型(见第6章)。 | ||
M1受体激活可增强胃中胃酸分泌。{M}_{2}受体是平滑肌(包括肠道、子宫、气管和膀胱的平滑肌)中最丰富的受体类型。此外,它们也存在于自主神经节和心脏中,在心脏发挥负性变时和变力作用(见第18章)。{M}_{3}受体同样存在于多种器官的平滑肌中,虽然其丰度低于{M}_{2}受体,但正常的收缩模式似乎需要两种受体之间的相互作用。{M}_{4}受体与{M}_{2}受体类似,存在于自主神经节中,因此参与这些部位的突触传递。{M}_{5}受体存在于瞳孔括约肌、食管、腮腺以及脑血管中。 | |||
与肾上腺素能受体类似,毒蕈碱受体具有多样化的作用。部分效应通过特定的第二信使系统介导。例如,心脏的{M}_{2}毒蕈碱受体可能通过IP3系统发挥作用,也可能通过抑制腺苷酸环化酶从而减少cAMP合成。毒蕈碱受体还可开启或关闭离子通道(尤其是K+或Ca++通道),这一作用可能通过G蛋白激活实现。毒蕈碱受体的第三种作用是通过影响内皮细胞(产生内皮源性舒张因子,EDRF)来松弛血管平滑肌。EDRF实质是一氧化氮(nitric oxide),即一氧化氮合酶(''nitric oxide synthase'')将精氨酸转化为瓜氨酸时释放的气体(见第18章)。一氧化氮通过刺激鸟苷酸环化酶升高环磷酸鸟苷(cGMP)水平,进而激活cGMP依赖性蛋白激酶,从而使血管平滑肌松弛(见第3章)。毒蕈碱受体的数量可受调控,暴露于毒蕈碱受体激动剂会通过受体内化(internalization)减少受体数量。 | |||
= IN THE CLINIC = | = IN THE CLINIC = | ||
| 第218行: | 第215行: | ||
==== 神经系统对免疫系统的影响 ==== | ==== 神经系统对免疫系统的影响 ==== | ||
环境应激可导致免疫抑制(immunosuppression),表现为辅助T细胞(helper T cell)数量减少和自然杀伤细胞(natural killer cell)活性降低。免疫抑制甚至可通过经典条件反射诱发。此类效应的机制之一涉及下丘脑释放促肾上腺皮质激素释放因子(corticotropin-releasing factor)。该因子促使垂体释放促肾上腺皮质激素(adrenocorticotropic hormone, ACTH),进而刺激肾上腺皮质激素分泌,最终引发免疫抑制(见第43章)。其他机制包括神经对淋巴组织的直接作用。免疫系统也可能影响神经活动。 | 环境应激可导致免疫抑制(immunosuppression),表现为辅助T细胞(helper T cell)数量减少和自然杀伤细胞(natural killer cell)活性降低。免疫抑制甚至可通过经典条件反射诱发。此类效应的机制之一涉及下丘脑释放促肾上腺皮质激素释放因子(corticotropin-releasing factor)。该因子促使垂体释放促肾上腺皮质激素(adrenocorticotropic hormone, ACTH),进而刺激肾上腺皮质激素分泌,最终引发免疫抑制(见第43章)。其他机制包括神经对淋巴组织的直接作用。免疫系统也可能影响神经活动。 | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 17:23的最新版本
自主神经系统(autonomic nervous system)的主要功能是协助机体维持内环境稳定(稳态(homeostasis))。当内部刺激信号提示需要调节机体环境时,中枢神经系统(central nervous system, CNS)及其自主神经传出通路会发出指令以引发代偿性反应。例如,体循环血压突然升高会激活压力感受器(baroreceptors),后者继而调节自主神经系统的活动,使血压回降至原有水平(参见第17章)。
自主神经系统包含感觉和运动两个部分。运动部分进一步分为交感神经(sympathetic)和副交感神经(parasympathetic)。由于自主神经系统的许多功能与内脏调控相关,因此有时也被称为内脏神经系统(visceral nervous system)。
为执行稳态功能,自主神经系统介导内脏反射(如胃结肠反射(gastrocolic reflex),即胃扩张触发肠道蠕动),并向中枢神经系统提供内脏状态的感觉信息——这种感知体验对任何饮食过量的人都不陌生。
更广泛地说,自主神经感受器的激活可引发多种感觉体验,如疼痛、饥饿、口渴、恶心和内脏充盈感;这些感知可进一步引发代偿性随意行为以协助维持稳态。
除在稳态调节中发挥核心作用外,自主神经系统还参与对外部刺激的适切协调反应,这些反应是躯体神经系统(somatic nervous system)执行随意行为时实现最佳功能所必需的。例如,自主神经系统根据环境光照强度的变化调节瞳孔大小,从而帮助视觉系统在宽泛的光强范围内正常工作。
本章将肠神经系统(enteric nervous system)也视为自主神经系统的一部分,尽管有时它被视为独立实体(另见第27章)。此外,由于自主神经系统受中枢神经系统调控,本章还将讨论自主神经系统的中枢成分。这些中枢成分包括下丘脑(hypothalamus)及边缘系统(limbic system)的高级中枢——它们与情绪(见第10章)和多种具有生存意义的内脏相关行为(如摄食、饮水、体温调节、生殖、防御和攻击)相关联。
自主神经系统的组织结构
自主感觉神经元位于背根神经节(dorsal root ganglia)和脑神经节(cranial nerve ganglia)中。与背根神经节的其他神经元类似,它们是假单极细胞:其轴突外周分支延伸至某一内脏,中枢分支则进入中枢神经系统。
关于自主运动传出,交感与副交感神经系统均采用双神经元运动通路。该通路由节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)组成:节前神经元胞体位于中枢神经系统内,节后神经元胞体位于自主神经节中(图11.1和图11.2)。此运动通路的效应靶点包括平滑肌、心肌和腺体。
肠神经系统包含位于胃肠道壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)中的神经元及神经纤维。
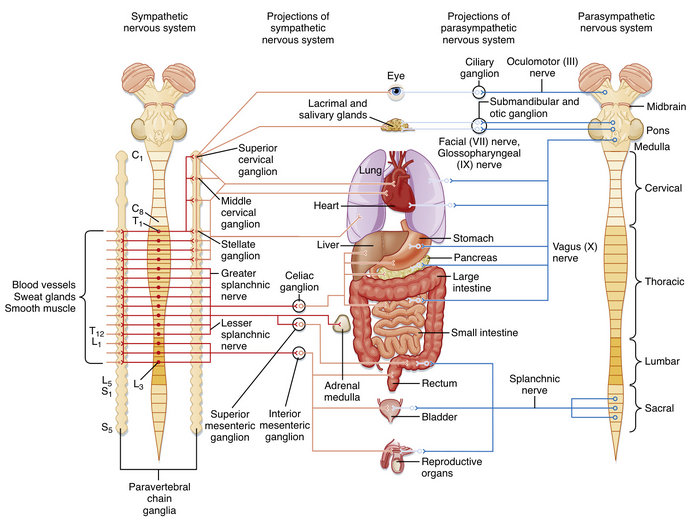
交感神经系统(sympathetic nervous system)和副交感神经系统(parasympathetic nervous system)通常通过拮抗作用调节器官功能。为强调这种对立关系,交感神经系统和副交感神经系统有时分别被称为"战斗或逃跑(fight or flight)"系统和"休息与消化(rest and digest)"系统。当机体面临威胁时产生的"战斗或逃跑"反应,本质上反映了交感神经系统的强烈激活,这会引发多种生理反应,包括心率加快、血压升高、血液重新分配至肌肉、胃肠蠕动减弱及分泌减少、瞳孔扩大和出汗等。
然而在多数情况下,自主神经系统的这两个部分通过协同工作——时而拮抗、时而协同——来共同调节内脏功能。此外,并非所有内脏结构都接受双重神经支配。例如皮肤中的平滑肌和腺体,以及体内大多数血管仅接受交感神经支配;仅有小部分血管具有副交感神经支配。事实上,副交感神经系统并不支配体壁结构,仅支配头部、胸腔、腹腔和盆腔内的器官。
交感神经系统
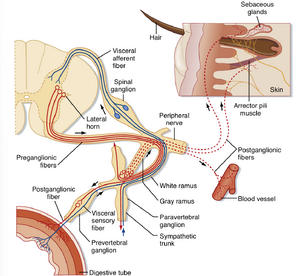
交感神经节前神经元(preganglionic neuron)位于脊髓胸段和上腰段。因此,交感神经系统有时被称为自主神经系统的胸腰段部分。具体而言,交感神经节前神经元集中在脊髓胸段和上腰段的中间外侧细胞柱(intermediolateral cell column)(外侧角)(见图11.2)。部分神经元也可见于C8节段。除中间外侧细胞柱外,交感神经节前神经元群还分布于其他区域,包括外侧索(lateral funiculus)、中间灰质(intermediate gray matter)以及中央管背侧的灰质。交感神经节后神经元(postganglionic neuron)通常位于椎旁神经节(paravertebral ganglia)或椎前神经节(prevertebral ganglia)。椎旁神经节沿脊柱两侧排列形成两组神经节,每侧各神经节通过纵向走行的轴突相连构成交感干(sympathetic trunk)(见图11.1和11.2)。椎前神经节位于腹腔内,包括腹腔神经节(celiac ganglia)和肠系膜上下神经节(superior and inferior mesenteric ganglia)(见图11.1)。因此,椎旁和椎前神经节都与其靶器官保持一定距离。
节前神经元(preganglionic neurons)的轴突通常是细小的有髓神经纤维(称为B纤维,参见表5.1),但也有部分为无髓C纤维。它们经腹根离开脊髓,通过白交通支(white communicating ramus)进入同节段的椎旁神经节。白交通支仅存在于T1至L2节段。节前轴突可能在其进入平面的神经节内与节后神经元(postganglionic neurons)形成突触;也可能在交感干内向头侧或尾侧走行,并向经过的神经节发出侧支;或可能穿过神经节,离开交感干,进入内脏神经(splanchnic nerve)到达椎前神经节(prevertebral ganglion)(见图11.1和11.2)。内脏神经支配内脏器官,包含内脏传入纤维和自主运动纤维(交感或副交感)。
胞体位于椎旁神经节的节后神经元,通常通过灰交通支(gray communicating ramus)将其轴突送入脊神经(见图11.2)。31对脊神经每对都具有灰交通支。节后轴突通过外周神经分布至效应器,如位于皮肤、肌肉和关节中的竖毛肌、血管和汗腺。节后轴突通常为无髓纤维(C纤维),但存在例外情况。白交通支和灰交通支的名称反映了这些交通支中有髓与无髓轴突的相对含量。
内脏神经中的节前轴突常走行至椎前神经节并形成突触,也可能穿过神经节和自主神经丛(autonomic plexus),终止于更远的神经节。部分节前轴突穿过内脏神经直接终止于肾上腺髓质细胞,这些细胞相当于节后细胞。
从颈段延伸至尾段的双侧交感神经节构成神经节链,通常称为交感链(sympathetic chain)。这种结构作为分配系统,使局限于胸段和上腰段的节前神经元能够激活支配所有体节的节后神经元。然而椎旁神经节的数量少于脊髓节段数,因为部分节段神经节在发育过程中发生融合。例如:颈上交感神经节(superior cervical sympathetic ganglion)代表C1至C4融合的神经节;颈中交感神经节(middle cervical sympathetic ganglion)是C5和C6的融合;颈下交感神经节(inferior cervical sympathetic ganglion)由C7和C8的神经节合并而成。星状神经节(stellate ganglion)指颈下交感神经节与T1神经节的融合。颈上交感神经节向头颈部提供节后支配,颈中和星状神经节则支配心脏、肺和支气管。
副交感神经系统
副交感神经节前神经元(parasympathetic preganglionic neurons)分布于脑干的若干脑神经核和骶髓(S3-S4)灰质(见图11.1)。因此,自主神经系统的这一部分有时被称为颅骶部。含有副交感神经节前神经元的脑神经核包括:Edinger-Westphal核(第III对脑神经)、上泌涎核(第VII对脑神经)和下泌涎核(第IX对脑神经),以及迷走神经背核与疑核(第X对脑神经)。副交感神经节后细胞位于颅神经节中,包括睫状神经节(其节前输入来自Edinger-Westphal核)、翼腭神经节与下颌下神经节(输入来自上泌涎核),以及耳神经节(输入来自下泌涎核)。睫状神经节支配眼内的瞳孔括约肌和睫状肌。翼腭神经节支配泪腺以及鼻咽和口咽部的腺体。下颌下神经节投射至下颌下腺、舌下腺以及口腔内的腺体。耳神经节支配腮腺和口腔内的腺体。
其他副交感神经节后神经元位于胸腔、腹腔和盆腔内脏器官壁内或附近。肠神经丛(enteric plexus)的神经元中也包含可被视为副交感神经节后神经元的细胞。所有这些细胞均接受来自迷走神经(vagus nerves)或盆神经(pelvic nerves)的输入。迷走神经支配心脏、肺、支气管、肝脏、胰腺以及从食管至结肠脾曲的胃肠道。结肠和直肠的剩余部分,以及膀胱和生殖器官,则由骶部副交感神经节前神经元通过盆神经投射至盆腔神经节中的节后神经元所支配。
内脏传入纤维
自主神经中的内脏运动纤维常伴随内脏传入纤维。大多数传入纤维传递源自内脏感受器的信息。这些感觉受体的活动很少达到意识层面,但它们会启动反射弧的传入支。内脏-内脏反射和内脏-躯体反射均可由这些传入纤维引发。尽管这些内脏反射通常在潜意识层面运作,但它们对稳态调节和对外界刺激的适应至关重要。
内脏传入纤维释放的快速作用神经递质尚未完全明确,但许多此类神经元会释放兴奋性神经递质谷氨酸(glutamate)。内脏传入纤维还含有多种神经肽或其组合,包括血管紧张素II(angiotensin II)、精氨酸加压素(arginine vasopressin)、蛙皮素(bombesin)、降钙素基因相关肽(calcitonin gene–related peptide)、胆囊收缩素(cholecystokinin)、甘丙肽(galanin)、P物质(substance P)、脑啡肽(enkephalin)、催产素(oxytocin)、生长抑素(somatostatin)和血管活性肠肽(vasoactive intestinal polypeptide)。
能够介导意识感觉的内脏传入纤维包括走行于交感神经(如splanchnic nerves)中的伤害感受器。内脏疼痛由空腔脏器过度扩张、梗阻性收缩或缺血引起。由于疼痛的弥散性及其向躯体结构的牵涉倾向(见第7章),内脏疼痛的起源常难以定位。交感神经中的内脏伤害感受器通过交感链、白交通支和背根到达脊髓。伤害性传入纤维的末梢投射至背角和中央管周围区域,激活参与反射弧的局部中间神经元,以及包括向大脑传递疼痛信号的脊髓丘脑束细胞在内的投射细胞。
内脏神经系统
来自骨盆的主要内脏伤害性(visceral nociceptive)通路涉及腰骶段脊髓灰质的突触传递。这些神经元的轴突进入薄束(fasciculus gracilis),终止于薄束核(nucleus gracilis)。因此,背柱(dorsal columns)不仅包含精细触觉、振动觉和本体感觉的初级传入(其主要成分),还包含内脏疼痛通路的二级神经元(需注意躯体疼痛的二级轴突作为脊髓丘脑束的一部分走行于外侧索)。内脏伤害性信号随后传递至丘脑腹后外侧核(ventral posterior lateral nucleus, VPL),并推测从VPL传递至大脑皮层。通过手术在胸段下部制造背柱损伤以缓解盆腔器官癌症疼痛的治疗效果,正是基于对此通路的阻断。
其他内脏传入纤维走行于副交感神经中。这些纤维通常参与反射而非感觉(味觉传入纤维除外;见第8章)。例如,支配颈动脉窦的压力感受器传入纤维位于舌咽神经中。它们进入脑干,穿过孤束(solitary tract),终止于孤束核(nucleus of the solitary tract)(见图4.6E)。这些神经元与脑干网状结构的中间神经元连接,后者进而投射至控制心率和血压的自主神经节前神经元(见第18章)。
孤束核接收来自除盆腔器官外所有内脏器官的信息。该核可进一步分为多个亚区,分别接收特定内脏器官的信息。
肠道神经系统
位于胃肠道壁内的肠道神经系统(enteric nervous system)包含约1亿个神经元。该系统分为肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus):肌间神经丛位于肠道的纵行肌层与环行肌层之间,黏膜下神经丛位于肠道的黏膜下层。肌间神经丛的神经元主要控制胃肠运动(见第27章),而黏膜下神经丛的神经元主要调节体液稳态(见第35章)。
肌间神经丛中的神经元类型不仅包括兴奋性和抑制性运动神经元(可视为副交感节后神经元),还包括中间神经元和初级传入神经元。传入神经元支配胃肠道壁内的机械感受器,这些机械感受器是肠道神经丛内反射弧传入支的起点。局部兴奋性和抑制性中间神经元参与这些反射,输出信号通过运动神经元传递至平滑肌细胞。兴奋性运动神经元释放乙酰胆碱和P物质;抑制性运动神经元释放强啡肽和血管活性肠肽。肠道神经丛的回路网络极其复杂,即使肠道被完全移出体外仍能协调运动。但正常功能仍需依赖自主神经节前神经元的支配和中枢神经系统的调控。
自主神经节
自主神经节中的主要神经元类型是节后神经元(postganglionic neuron)。这些细胞接受来自节前神经元(preganglionic neuron)的突触连接,并投射到自主效应器细胞。然而,许多自主神经节也含有中间神经元(interneuron)。这些中间神经元在自主神经节内处理信息;肠神经系统可被视为这类信息处理的复杂范例。某些自主神经节中存在的一类中间神经元含有高浓度的儿茶酚胺(catecholamine),因此这些中间神经元被称为小强荧光(small, intensely fluorescent, SIF)细胞。SIF细胞被认为具有抑制性功能。
神经递质
自主神经节中的神经递质
无论是交感还是副交感神经节,其经典神经递质均为乙酰胆碱(acetylcholine)。自主神经节中的两类乙酰胆碱受体是烟碱型(nicotinic)和毒蕈碱型(muscarinic)受体,其名称源于它们对植物生物碱尼古丁(nicotine)和毒蕈碱(muscarine)的反应特性。烟碱型乙酰胆碱受体可被箭毒(curare)或六烃季铵(hexamethonium)等药物阻断,毒蕈碱型受体则可被阿托品(atropine)阻断。自主神经节中的烟碱型受体与骨骼肌细胞上的烟碱型受体略有不同。
烟碱型和毒蕈碱型受体均介导兴奋性突触后电位(excitatory postsynaptic potentials, EPSPs),但这些电位具有不同的时间进程。刺激节前神经元会引发一个快EPSP,随后出现一个慢EPSP。快EPSP由烟碱型受体激活引起,其通过离子通道开放实现;慢EPSP则由毒蕈碱型受体(主要是{M}_{2}受体,见第6章)介导,该受体通过抑制钾电导产生的M电流(M current)发挥作用。
效应器器官对自主神经冲动的反应—续
a长横线(-)表示未发现明确的功能性神经支配。 b反应标记为^+至+{\mathrel{+{+}}},用于近似表示肾上腺素能和胆碱能神经活动对所列器官及功能调控的重要性。 c原位状态下因代谢性自我调节现象而以扩张效应为主。 d这些部位的胆碱能血管扩张作用的生理学意义尚存疑。
在生理释放的循环肾上腺素通常浓度范围内,骨骼肌和肝脏血管中主要发生β受体反应(血管舒张,vasodilation),而其他腹腔内脏血管中主要发生α受体反应(血管收缩,vasoconstriction)。肾血管和肠系膜血管还含有特异性多巴胺能受体,其激活可引起扩张,但其生理学意义尚未明确。f交感胆碱能系统引起骨骼肌血管舒张,但大多数生理反应不涉及此机制。 g有假说认为肾上腺素能纤维终止于平滑肌纤维的抑制性β受体,以及Auerbach神经丛副交感胆碱能(兴奋性)神经节细胞的抑制性α受体。 h取决于月经周期阶段、循环雌激素和孕酮水平及其他因素。 i手掌等部位存在“肾上腺素能出汗”现象。 j不同物种中介导特定代谢反应的受体类型存在显著差异。 引自Goodman LS, Gilman A. The Pharmacological Basis of Therapeutics. 6th ed. New York: Macmillan; 1980.
自主神经节中的神经元也释放作为神经调质的神经肽。除乙酰胆碱(acetylcholine)外,交感神经节前神经元可能释放脑啡肽(enkephalin)、P物质(substance P)、促黄体生成激素释放激素(luteinizing hormone–releasing hormone)、神经降压素(neurotensin)或生长抑素(somatostatin)。
去甲肾上腺素(norepinephrine)和多巴胺(dopamine)等儿茶酚胺类物质作为自主神经节中SIF细胞的神经递质。
节后神经元与自主效应器间的神经递质
交感节后神经元
交感节后神经元通常释放去甲肾上腺素(norepinephrine),可兴奋某些效应细胞,同时抑制其他细胞。靶细胞上的受体可能是α-肾上腺素能受体或β-肾上腺素能受体。根据药理学和遗传学特征,这些受体可进一步分为α₁、α₂、β₁、β₂和β₃受体亚型。表11.1列出了这些受体类型在不同靶器官中的分布及其被交感节后神经元激活时介导的作用。
α₁受体位于突触后膜,而α₂受体可位于突触前或突触后。位于突触前的受体通常称为自身受体(autoreceptor),通常抑制递质释放。通过使用特异性阻断剂可区分激活α₁或α₂受体的效应。例如哌唑嗪(prazosin)是选择性α₁-肾上腺素能拮抗剂,育亨宾(yohimbine)是选择性α₂-肾上腺素能拮抗剂。α₁受体的效应通过激活三磷酸肌醇(InsP3)和二酰甘油(DAG)第二信使系统介导(参见第3章;表3.1)。相比之下,α₂受体通过作用于G蛋白降低环磷酸腺苷(cAMP)的合成速率。
交感神经节后神经元
β受体最初是根据拮抗剂阻断它们的能力进行分类的,但这一分类已通过遗传学研究得到补充。β_{1}和β_{2}蛋白的研究远较β_{3}深入,但人们认为所有三类β受体蛋白均具有相似结构,包含七个跨膜区域,并由细胞内和细胞外结构域连接(参见第3章)。作用于β受体的激动剂药物会激活一种G蛋白(G protein),该蛋白刺激腺苷酸环化酶(adenylyl cyclase)以增加cAMP浓度。这一作用会因二磷酸鸟苷(guanosine diphosphate)的积累而终止。
β受体的活性可通过多种方式调控。它可被{\bf{α}}_{1}受体的作用拮抗。β受体还可因长期暴露于激动剂而发生磷酸化(phosphorylation)导致脱敏。β受体数量的调节是第三种调控机制。例如,β受体可通过内化(internalized)减少数量。相反,在某些情况下β受体数量可增加(上调,upregulated),例如去神经支配(denervation)后。需注意,α受体的数量同样受调控。
除释放去甲肾上腺素外,交感神经节后神经元还释放神经肽如生长抑素(somatostatin)和神经肽Y(neuropeptide Y)。例如,同时释放去甲肾上腺素和生长抑素的细胞支配胃肠道黏膜,而同时释放去甲肾上腺素和神经肽Y的细胞支配肠道和四肢的血管。交感神经节后神经元中的另一种化学介质是腺苷三磷酸(ATP)。
肾上腺髓质的内分泌细胞在许多方面与交感神经节后神经元相似(另见第43章)。它们接受交感神经节前神经元的输入,被乙酰胆碱激活,并释放儿茶酚胺。然而,肾上腺髓质细胞与交感神经节后神经元的不同之处在于,它们将儿茶酚胺释放入血液循环而非突触间隙。此外,其主要释放的儿茶酚胺是肾上腺素(epinephrine)而非去甲肾上腺素。在人类中,肾上腺髓质释放的儿茶酚胺80%为肾上腺素,20%为去甲肾上腺素。
部分交感神经节后神经元以乙酰胆碱而非去甲肾上腺素作为神经递质。例如,支配外泌汗腺(eccrine sweat glands)的交感神经节后神经元是胆碱能(cholinergic)的。涉及的乙酰胆碱受体为毒蕈碱型(muscarinic),因此可被阿托品(atropine)阻断。类似地,部分血管也受胆碱能交感神经节后神经元支配。除释放乙酰胆碱外,支配汗腺的节后神经元还释放神经肽,包括降钙素基因相关肽(calcitonin gene–related peptide)和血管活性肠肽(vasoactive intestinal polypeptide)。
副交感神经节后神经元
副交感神经节后神经元释放的神经递质是乙酰胆碱。这些神经元对各靶器官的作用列于表11.1。副交感神经节后作用由毒蕈碱受体(muscarinic receptors)介导。根据药理学结合研究、选择性拮抗剂的作用以及分子克隆技术,目前已鉴定出五种毒蕈碱受体类型(见第6章)。
M1受体激活可增强胃中胃酸分泌。{M}_{2}受体是平滑肌(包括肠道、子宫、气管和膀胱的平滑肌)中最丰富的受体类型。此外,它们也存在于自主神经节和心脏中,在心脏发挥负性变时和变力作用(见第18章)。{M}_{3}受体同样存在于多种器官的平滑肌中,虽然其丰度低于{M}_{2}受体,但正常的收缩模式似乎需要两种受体之间的相互作用。{M}_{4}受体与{M}_{2}受体类似,存在于自主神经节中,因此参与这些部位的突触传递。{M}_{5}受体存在于瞳孔括约肌、食管、腮腺以及脑血管中。
与肾上腺素能受体类似,毒蕈碱受体具有多样化的作用。部分效应通过特定的第二信使系统介导。例如,心脏的{M}_{2}毒蕈碱受体可能通过IP3系统发挥作用,也可能通过抑制腺苷酸环化酶从而减少cAMP合成。毒蕈碱受体还可开启或关闭离子通道(尤其是K+或Ca++通道),这一作用可能通过G蛋白激活实现。毒蕈碱受体的第三种作用是通过影响内皮细胞(产生内皮源性舒张因子,EDRF)来松弛血管平滑肌。EDRF实质是一氧化氮(nitric oxide),即一氧化氮合酶(nitric oxide synthase)将精氨酸转化为瓜氨酸时释放的气体(见第18章)。一氧化氮通过刺激鸟苷酸环化酶升高环磷酸鸟苷(cGMP)水平,进而激活cGMP依赖性蛋白激酶,从而使血管平滑肌松弛(见第3章)。毒蕈碱受体的数量可受调控,暴露于毒蕈碱受体激动剂会通过受体内化(internalization)减少受体数量。
IN THE CLINIC
临床知识
查加斯病(Chagas disease)是由寄生虫克氏锥虫(Trypanosoma cruzi)感染所致。全球约有1800万人感染,每年约5万人因该病并发症死亡。最严重的临床表现包括食管、结肠和心脏的扩大。副交感神经控制的丧失是该病初期的重要特征:感染初期后,支配心脏、食管和结肠的副交感神经元会遭到破坏,导致心律失常(可能引发猝死)和蠕动不能(aperistalsis)。约30%感染者会出现可致死的慢性心肌病(心肌功能障碍)。尽管心肌病的发病机制尚未完全阐明,主流假说认为与自身免疫有关。已发现针对寄生虫抗原的抗体会与心脏的β-肾上腺素能受体和M₂乙酰胆碱受体结合。这些抗体不仅会引发破坏心肌的自身免疫反应,还能作为这些受体的激动剂,导致心血管系统对外界需求变化产生异常反应。
自主功能的中枢控制
自主神经节前神经元的放电活动受突触连接于其上的神经通路调控。影响自主神经活性的通路包括脊髓和脑干反射通路,以及源自下丘脑等更高级神经中枢的下行控制系统。
特定器官的自主神经调控实例
瞳孔
虹膜的扩张肌和括约肌分别受交感神经纤维和副交感神经纤维支配,共同决定瞳孔大小。通过胸段白交通支和交感干神经节激活眼的交感神经支配,可引起瞳孔扩张——这种反应见于情绪激动或疼痛刺激时。交感神经节后突触的神经递质是去甲肾上腺素,作用于α受体。
副交感神经系统对瞳孔大小的调控作用与交感系统相反。交感系统引起瞳孔扩张,而副交感系统则使瞳孔收缩。支配瞳孔括约肌的副交感节前神经位于中脑的Edinger-Westphal核,通过第III对脑神经(动眼神经)走行,因此该神经损伤可导致瞳孔扩大(散瞳)。
临床关联
交感神经对瞳孔的控制有时会受到疾病影响。例如,头颈部交感神经支配的中断会导致霍纳氏综合征(Horner’s syndrome)。该综合征的特征性三联征包括:瞳孔缩小(miosis,异常瞳孔收缩)、上睑下垂(ptosis,因上睑板肌(superior tarsal muscle)功能丧失导致的眼睑轻度下垂;亦称Müller肌)以及面部无汗(anhydrosis)。霍纳氏综合征可能由交感神经通路不同部位的损伤引起:(1) 中枢神经系统一级神经元(first-order neurons)的破坏,包括下丘脑——其发出的下行纤维通过脑干到达脊髓以调节交感功能;(2) T1节段脊髓发出的二级交感节前纤维(second-order sympathetic preganglionic fibers)中断,这些纤维进入颈交感链;(3) 支配Müller肌、面部汗腺及虹膜开大肌的三级节后纤维(third-order postganglionic fibers)损伤。在第一种情况下,脑干纤维的损伤会导致许多其他症状,具体取决于同时受损的脑干核团。
瞳孔大小通过瞳孔对光反射(pupillary light reflex)和近视力调节(accommodation)而缩小。在瞳孔对光反射中,照射到视网膜的光线由视网膜回路处理,兴奋W型视网膜神经节细胞(W-type retinal ganglion cells)(参见第8章)。这些细胞对弥散光照产生反应。部分W型细胞的轴突通过视神经和视束投射到顶盖前区(pretectal area),并在橄榄顶盖前核(olivary pretectal nucleus)形成突触。该核团的神经元同样对弥散光照产生反应。橄榄顶盖前核神经元的活动通过双侧连接作用于艾-韦核(Edinger-Westphal nuclei)中的副交感节前神经元,从而引起瞳孔收缩。此反射会导致双眼瞳孔括约肌收缩,即使光线仅照射单侧眼睛。
调节反应(accommodation response)对聚焦近处物体至关重要,包括瞳孔缩小、晶状体曲率增加和双眼会聚。该反应由视网膜M细胞的信息触发,这些信息通过膝-纹状体视觉通路(geniculostriate visual pathway)传递至纹状皮层(参见第8章)。触发调节的具体刺激被认为是视网膜图像的模糊和双眼图像的差异。信息在视觉皮层处理后,信号直接或间接传递至颞中皮层(middle temporal cortex),激活称为MT区的视觉区域神经元。MT区神经元将信号传递至中脑,激活艾-韦核的副交感节前神经元,从而导致瞳孔缩小。同时,信号传递至睫状肌使其收缩。睫状肌收缩使晶状体变圆并增强其屈光力。(会聚反应是由中脑动眼神经核【脑神经III】介导的躯体反应。)
瞳孔对光反射(Pupillary Light Reflex)
三期(晚期)梅毒累及中枢神经系统(如脊髓痨)患者的瞳孔对光反射可能消失。尽管瞳孔对光无反应,但其调节反应正常。这种现象称为阿盖尔·罗伯逊瞳孔(Argyll Robertson pupil)。其确切机制尚存争议。一种解释基于视束纤维投射至中脑顶盖前区的现象。梅毒性脑膜炎可能因蛛网膜下腔存在螺旋体而损伤这些纤维。需注意,顶盖前区也投射至中脑的埃丁格-韦斯特法尔核(Edinger-Westphal nucleus),该核团细胞发出支配眼的副交感神经纤维,控制瞳孔括约肌。尽管顶盖前橄榄核的输入通路中断,但投射至外侧膝状体的视束纤维未被破坏,因此视觉功能保留,调节反射时的瞳孔收缩也得以维持。
膀胱(Urinary Bladder)
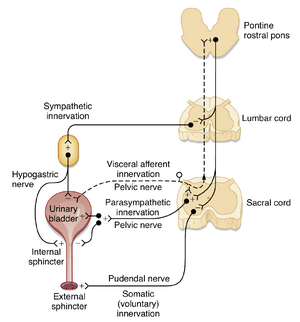
膀胱活动受脊髓反射通路和脊髓上中枢共同调控(图11.3)。交感神经支配起源于脊髓上腰段的交感节前神经元。交感节后纤维可抑制膀胱体部的平滑肌(逼尿肌),同时兴奋膀胱三角区平滑肌和尿道内括约肌。膀胱充盈时,逼尿肌持续受抑制以防止排尿。这种抑制由去甲肾上腺素作用于β受体介导,而三角区及尿道内括约肌的兴奋则由去甲肾上腺素作用于α受体实现。
膀胱充盈时内压较低(5~10 cm H₂O),但排尿开始时压力骤增。排尿可通过反射或意识控制触发。反射性排尿中,膀胱传入纤维激活脑干投射神经元,进而兴奋脑桥头端的排尿中枢(巴林顿核,Barrington’s nucleus)。下行投射同时抑制阻止排尿的交感节前神经元。当该上行通路活动达到阈值时,排尿中枢触发排尿指令,通过网状脊髓束到达骶髓。此时膀胱交感投射活动被抑制,副交感投射被激活。膀胱壁肌肉收缩引发机械感受器强烈放电,进一步激活脊髓上环路,最终实现膀胱完全排空。
排尿的脊髓反射通路
排尿也存在脊髓反射通路。这一通路在新生儿时期即可运作。然而随着发育成熟,脊髓上控制通路在触发排尿过程中逐渐占据主导地位。脊髓损伤后,成年人在脊髓休克(spinal shock)期间会出现膀胱失控(尿失禁)。当脊髓从休克中恢复后,由于脊髓排尿反射的增强,膀胱功能可部分恢复。但此时膀胱肌张力增高且无法完全排空,这种情况常导致尿路感染。
尿道外括约肌也参与排尿控制。该括约肌为横纹肌,由躯体神经——阴部神经(pudendal nerves)中的运动轴突支配。其运动神经元位于骶髓(sacral spinal cord)前角的Onuf核。
控制膀胱的副交感节前神经元位于骶髓(S2和S3或S3和S4节段)。这些胆碱能神经元通过盆神经(pelvic nerves)投射,分布至盆神经丛和膀胱壁的神经节。膀胱壁内的副交感节后神经元支配逼尿肌(detrusor muscle)、膀胱三角(trigone)和括约肌。副交感活动使逼尿肌收缩,同时松弛膀胱三角和尿道内括约肌,这些作用共同导致排尿(micturition)。部分副交感节后神经元为胆碱能,另一些为嘌呤能(释放ATP)。
排尿通常由排尿反射调控(见图11.3)。膀胱壁内的机械感受器可被膀胱壁肌肉的牵张和收缩激活。随着尿液积聚使膀胱扩张,机械感受器的传入纤维开始放电。
脑内的自主神经中枢
对自主神经输出的调控由分布于多个脑区的自主神经中枢(由局部神经元网络构成)维持。前文讨论的脑桥(pons)排尿中枢即为一例。此外还存在许多具有不同功能的自主神经中枢:延髓(medulla)内有血管舒缩中枢,延髓和脑桥存在呼吸中枢。自主神经中枢最密集的区域当属下丘脑(hypothalamus)。
下丘脑与视前区
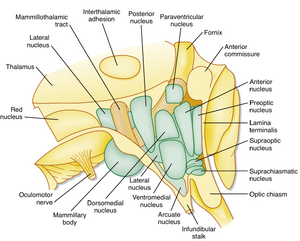
下丘脑是间脑(diencephalon)的组成部分。图11.4展示了部分下丘脑核团。位于下丘脑前方的端脑(telencephalic)结构包括视前区(preoptic region)和隔区(septum),二者均参与调节自主神经功能。穿过下丘脑的重要纤维束包括穹窿(fornix)、内侧前脑束(medial forebrain bundle)和乳头丘脑束(mammillothalamic tract)。穹窿常被用作划分下丘脑内侧区与外侧区的解剖标志。
下丘脑具有多种功能(关于其内分泌调控功能的讨论详见第41章)。本文将重点阐述其对自主神经功能的调控作用。在自主神经调控方面,下丘脑的功能类似于工程学中称为伺服机制(servomechanism)的控制系统:即通过负反馈环路维持特定生理参数于设定点或设定值的调控系统。以下以体温调节、体重与脂肪量调控以及水摄入调控为例说明这一原理。
温度调节
恒温动物(homeothermic animals)能够在环境温度波动和机体活动水平变化(导致内源性产热)的情况下维持相对恒定的核心体温。这种能力依赖于皮肤、中枢神经系统(CNS)和内脏器官中三大类温度感受器(thermoreceptors)的信息输入。
外界温度信息由皮肤温度感受器提供。核心体温由视前区(preoptic area)(可能还包括脊髓)的中枢温度感受神经元监控,这些神经元通过局部血液温度进行监测。内脏温度感受器则监测这些器官的温度。所有感受器都将温度信息传递至视前区(传导通路后文详述)及下丘脑相关区域,共同维持核心体温恒定。因此,视前区与下丘脑共同构成以正常体温为设定点的伺服机制。
虽然来自各感受器的信号会被整合,但其相对重要性可能随不同条件而变化。环境温度变化引起的皮肤温度变化比核心体温变化更迅速且显著,因此皮肤感受器可能是应对外界温度变化的初始且最常用机制。中枢温度感受器对由内部因素(如运动)引起的温度变化更为重要,或当外界温度变化过于剧烈或持久,导致外周温度感受器信号不足以维持核心体温时发挥作用。最后,摄入冷热食物或液体引起的体温变化则由内脏温度感受器检测。
代表偏离伺服机制设定点的误差信号(即机体冷却或升温)会引发促使体温回归设定点的调节反应。这些反应通过自主神经系统、躯体神经系统和内分泌系统共同介导。
涉及体温降低的情况会触发多种反应,以增加产热(thermogenesis)并减少散热。产热的增加通过以下机制实现:战栗产热(shivering thermogenesis)(骨骼肌不同步收缩以增加产热)和棕色脂肪组织(BAT)产热(BAT thermogenesis)(在BAT产热中,氧化磷酸化与ATP合成解偶联,使反应释放的能量以热量形式散逸),以及甲状腺激素水平升高导致代谢增强。通过皮肤血管收缩和立毛(piloerection)减少散热。立毛对有毛动物有效,但对人类无效;后者仅表现为鸡皮疙瘩。此外,还会发生心动过速(tachycardia),这可能有助于向产热组织(脂肪和肌肉)提供代谢产物用于产热,并帮助将产生的热量分布至全身。最后,寒冷感知会影响启动自主行为的决策,例如决定穿上外套。
体温升高通常会引起相反方向的变化。甲状腺活动减弱,导致代谢活性降低和产热减少。通过出汗、流涎(某些动物而非人类)和皮肤血管扩张(因交感神经活动减弱)增加散热。然而,此时仍会出现心动过速,推测是为了优化皮肤循环灌注以促进散热。
早期研究发现视前区(preoptic region)和下丘脑前部(anterior hypothalamus)是散热中枢,而下丘脑后部(posterior hypothalamus)是保热中枢。例如,视前区损伤会阻止出汗和皮肤血管扩张,若将此类损伤个体置于温暖环境中会出现高热(hyperthermia)。相反,刺激散热中枢会引起皮肤血管扩张并抑制战栗。相比之下,乳头体(mammillary body)背外侧区域的损伤会干扰产热和保热机制,当个体处于寒冷环境中时可能导致低体温(hypothermia)。刺激该脑区可诱发战栗。
目前已知温度调节反应背后的神经环路和生理过程的许多细节,表明视前区(preoptic area)和下丘脑背内侧核(dorsal medial hypothalamic nucleus)是体温调节的关键组成部分。特别是视前区似乎是各种感觉信息输入的整合中枢。皮肤温度信息通过温度敏感性初级传入神经传递,这些传入神经在脊髓背角(dorsal horn)与神经元形成突触,进而投射并激活中脑尾侧的臂旁核(parabrachial nucleus)。来自内脏传入的信息也通过孤束核(solitary nucleus)中继至臂旁核。臂旁神经元继而激活视前区特定部位——视前区正中核(median nucleus of the preoptic area)内的神经元。许多正中核神经元对血液温度的局部变化敏感,并含有前列腺素E2(PGE2)受体3(EP3),该受体介导发热反应(参见后文"临床视角"专栏)。
临床相关
发热(伴随某些感染出现)可被视为体温调定点的上移。这种上移可由微生物释放致热原(pyrogen)或介导炎症反应的细胞释放致热原所引起。致热原升高调定点的作用主要通过前列腺素PGE2与视前区神经元上的EP3受体结合所介导。PGE2由外周组织和供应视前区的血管释放。PGE2与EP3受体结合会导致视前区神经元活动性降低。这种神经元活动性的降低通过寒战和BAT产热作用增加产热,并通过皮肤血管收缩减少散热,综合效应是升高体温。支持该发热机制的证据包括:向视前区注射PGE2可诱导发热的研究;以及选择性敲除视前神经元EP3受体后,PGE2注射失去诱导发热能力的研究。
摄食与体重的调节
能量稳态(energy homeostasis)对动物生存至关重要。其挑战在于:大多数细胞需要持续的营养供应才能正常运作,但多数动物并不持续进食,而是周期性摄食。因此,为维持能量稳态,摄食行为受多种因素调控:短期机制控制摄入行为,长期机制控制体重以保障充足的能量储备。其中既涉及享乐性因素(此处指进食带来的愉悦感)也涉及稳态性因素;但本章重点讨论后者,这下丘脑在能量稳态中的核心作用。
短期摄食行为受多种机制调控。首先,胃壁存在牵张感受器,当食物充盈胃部时传递扩张信号。这些信号通过迷走神经传入纤维传递至延髓的孤束核(solitary nucleus)。信息随后被传递至多个脑区:通过直接通路或臂旁核(parabrachial nucleus)中继传递至下丘脑,以组织对摄入物质的自主神经反应;传递至丘脑和皮层,使机体产生胃充盈的感知。下丘脑中,室旁核(paraventricular nucleus)、背内侧核(dorsomedial nucleus)、弓状核(arcuate nucleus)以及外侧下丘脑是这些信号的主要靶区。
#
感觉传入神经还能感知肠道和肝门静脉循环中的葡萄糖与脂质浓度,并以类似于牵张受体的方式将这些信息传递至孤束核,继而传至下丘脑。此外,胃和肠道在摄食时会释放多种激素,包括胆囊收缩素(cholecystokinin)、肽YY(peptide YY)、胰高血糖素样肽-1(GLP-1)和饥饿素(ghrelin)。下丘脑细胞具有这些激素的多种受体,可直接受其影响。此外,其他脑区细胞也含有这些激素的受体,因此可能形成通往下丘脑的间接通路。其中一个区域是最后区(area postrema),它位于孤束核背侧并向其投射。位于第四脑室底部的最后区不受血脑屏障保护(属于室周器官之一),其神经元可响应胆囊收缩素和GLP-1,从而减少摄食量(最后区还可通过引发呕吐反应响应化学毒素)。
长期体重的调控受多种因素影响,涉及神经系统与内分泌系统的相互作用。本节重点讨论下丘脑的作用及其对自主神经系统的控制,这为下丘脑作为伺服机制组成部分提供了另一例证。在此案例中,脂肪沉积量(adiposity)是受控参数。关于内分泌系统作用的更多细节,请参阅第38和39章。
早期通过损毁和电刺激的研究表明,下丘脑腹内侧区(ventromedial hypothalamus)和腹外侧区(ventrolateral hypothalamus)参与能量稳态调节。腹内侧区损毁会导致摄食量增加(食欲亢进)并引发肥胖,而对该区域的电刺激则会抑制摄食行为。研究还发现这些损毁会改变自主神经活动,增强副交感神经张力并降低交感神经张力,两者均会导致血液胰岛素水平升高,进而促进能量储存(见第39章)。这些观察结果支持了"下丘脑腹内侧区存在饱食中枢"的观点。然而另一种解释认为,主要受控变量可能并非单纯的摄食行为本身,而是体重——更具体地说是体脂水平(即脂肪沉积量)。因此,摄食行为的调控可能只是用于维持体重设定点的多种机制之一。与此复杂性一致的是,损毁实验可观察到初期因食欲亢进引发的动态体重增长期,随后进入无需食欲亢进即可维持较高体重的静态期。此外,即使通过固定饲喂量(正常量)防止下丘脑腹内侧区损毁动物出现食欲亢进,其仍会发展为肥胖,这提示其他代谢过程的调控发生了改变。最后,下丘脑腹内侧区损毁已被证实会改变能量消耗水平。
与下丘脑腹内侧部损伤不同,下丘脑外侧部(lateral hypothalamus)的损伤会抑制食物摄入(摄食减少,hypophagia)并导致体重下降;事实上,动物在此类损伤后可能因饥饿而死亡。相反,若存在食物,对下丘脑外侧部内侧前脑束(medial forebrain bundle)的电刺激会引发探索行为和摄食。这种刺激还会产生多巴胺依赖性奖赏(dopamine-dependent reward),这种奖赏既可介导自然奖赏(食物、性)的激励效应,也可介导大多数成瘾药物的奖赏效应。这些观察结果使人们认为下丘脑外侧部存在摄食中枢。然而,由于黑质(substantia nigra)神经元的多巴胺能轴突在通往纹状体(striatum)的路径中正好经过下丘脑外侧部的旁侧,因此这些纤维的缺失或激活可能是实验中观察到的效应的原因,这使得该解释变得复杂。不过,已发现下丘脑外侧部神经元可合成食欲素(orexin)等影响摄食行为的肽类,因此下丘脑外侧部可能在能量稳态中确实发挥着作用。
在较新的研究中,研究者已鉴定出多种参与摄食和体重调控的激素与神经肽,并阐明了内分泌系统与神经系统之间许多与能量稳态相关的相互作用。
在正常个体中,血液胰岛素水平与肥胖程度相关(此外还与葡萄糖和其他物质的血液浓度急剧变化相关)。类似地,由脂肪细胞(adipocytes,主要指形成白色脂肪组织的细胞)释放的激素瘦素(leptin)的蛋白水平也与肥胖程度相关。高水平的瘦素抑制食物摄入并刺激分解代谢过程(包括脂肪组织的减少),而低瘦素水平则会触发相反的作用。同样,高胰岛素水平会促进能量储存过程。
瘦素和胰岛素调控体重的能力与其对下丘脑(尤其是弓状核,arcuate nucleus)的作用有关,该核团神经元表达这两种激素的受体(另见第39章)。目前已鉴定出两类主要的响应瘦素和胰岛素的弓状核神经元:表达前黑素皮质素(proopiomelanocortin, POMC)及可卡因-苯丙胺相关转录物(cocaine- and amphetamine-related transcript, CART)的神经元会被瘦素和胰岛素激活,其活动会导致分解代谢增强;相反,另一组表达神经肽Y(neuropeptide Y, NPY)和刺鼠相关肽(agouti-related peptide, AgRP)的神经元活动会触发合成代谢过程,但被瘦素和胰岛素抑制。因此,体脂水平升高会导致瘦素和胰岛素水平升高,进而(1)增强POMC和CART表达神经元的活动,促进分解代谢;(2)抑制NPY和AgRP表达神经元的活动,减少合成代谢;二者共同作用使体脂水平回归设定值(set point)。降低体脂水平则会引发与上述过程相反的事件序列,使体脂水平回升至原有水平或设定值。
水摄入的调节
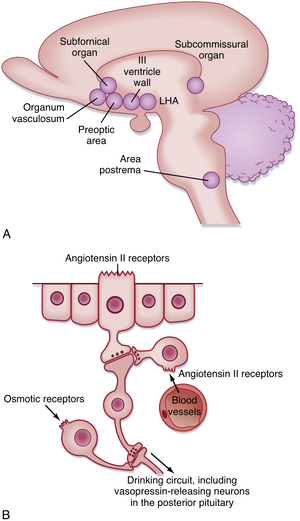
水摄入同样依赖于伺服机制(servomechanism)。液体摄入受血液渗透压和容量的影响(图11.5)。
当水分缺乏时,细胞外液变为高渗状态,进而导致细胞内液也变为高渗。大脑中存在神经元,可充当渗透压感受器(osmoreceptors)以检测细胞外液渗透压的升高(参见第35章)。这些渗透压感受器似乎位于终极板血管器(organum vasculosum of the lamina terminalis),这是室周器官(circumventricular organ)之一。室周器官围绕脑室分布,且缺乏血脑屏障。穹窿下器(subfornical organ)和终极板血管器参与口渴的调节。
水分缺乏还会导致血容量减少,这一变化由血管系统低压侧(包括心脏右心房)的感受器感知(参见第17章)。此外,血容量减少会触发肾脏释放肾素(renin)。肾素将血管紧张素原(angiotensinogen)分解为血管紧张素I(angiotensin I),后者随后水解为血管紧张素II(angiotensin II)(参见第34章)。这种肽类物质通过作用于另一个室周器官——穹窿下器中的血管紧张素II受体来刺激饮水行为。血管紧张素II还可引起血管收缩,并促进醛固酮(aldosterone)和抗利尿激素(antidiuretic hormone, ADH)的释放。
水分摄入不足通常比过量饮水更具危害性。然而,当摄入水量超过需求时,通过抑制视上核(supraoptic nucleus)神经元在后垂体腺终末释放ADH,可轻松排出多余水分(参见第41章)。如前所述,抑制ADH释放的信号包括血容量增加和细胞外液渗透压降低。下丘脑其他区域(特别是视前区和外侧下丘脑)以及下丘脑外的若干结构也参与水摄入的调节。
其他自主神经调控结构
关键要点
- 自主神经系统(autonomic nervous system)控制平滑肌、心肌和腺体。它帮助维持稳态并协调对外界刺激的反应。该系统包含感觉和运动成分,其运动成分由交感神经(sympathetic)和副交感神经(parasympathetic)分支组成。肠神经系统(enteric nervous system)通常被视为自主神经系统的一部分,但专门负责胃肠道的调控。
- 自主运动通路包含节前神经元(preganglionic neuron)和节后神经元(postganglionic neuron)。节前神经元位于中枢神经系统(CNS),而节后神经元位于外周神经节。交感节前神经元位于脊髓的胸腰段(thoracolumbar region),交感节后神经元位于椎旁神经节(paravertebral ganglia)和椎前神经节(prevertebral ganglia)。副交感节前神经元位于脑神经核或脊髓骶段,副交感节后神经元位于靶器官内部或附近的神经节。
- 自主传入纤维(autonomic afferent fiber)支配内脏的感觉受体。大多数功能是激活反射;部分传入纤维的激活也会产生可被意识感知的感觉。
- 肠神经系统包括胃肠壁内的肌间神经丛(myenteric plexus)和黏膜下神经丛(submucosal plexus)。肌间神经丛调节运动功能,黏膜下神经丛调控离子和水转运以及分泌功能。
前脑中除下丘脑外的其他区域也参与自主神经调控,包括杏仁核中央核(central nucleus of the amygdala)、终纹床核(bed nucleus of the stria terminalis)以及大脑皮层的多个区域。内脏信息通过上行系统传递至这些高级自主神经中枢,该上行系统涉及孤束核(nucleus of the solitary tract)、臂旁核(parabrachial nucleus)、导水管周围灰质(periaqueductal gray matter)和下丘脑。控制自主神经活动的下行通路起源于下丘脑室旁核(PVN)、去甲肾上腺素能A5细胞群(noradrenergic cell group A5)、延髓头端腹外侧区(rostral ventrolateral medulla)以及延髓腹内侧的中缝核(raphe nuclei)和邻近结构。
神经系统对免疫系统的影响
环境应激可导致免疫抑制(immunosuppression),表现为辅助T细胞(helper T cell)数量减少和自然杀伤细胞(natural killer cell)活性降低。免疫抑制甚至可通过经典条件反射诱发。此类效应的机制之一涉及下丘脑释放促肾上腺皮质激素释放因子(corticotropin-releasing factor)。该因子促使垂体释放促肾上腺皮质激素(adrenocorticotropic hormone, ACTH),进而刺激肾上腺皮质激素分泌,最终引发免疫抑制(见第43章)。其他机制包括神经对淋巴组织的直接作用。免疫系统也可能影响神经活动。
