第四章 神经系统:细胞和系统导论:修订间差异
无编辑摘要 标签:手工回退 |
|||
| (未显示2个用户的4个中间版本) | |||
| 第244行: | 第244行: | ||
# 外周神经系统(PNS)包括初级传入神经元及其支配的感觉受体、躯体运动神经元的轴突和自主神经元。 | # 外周神经系统(PNS)包括初级传入神经元及其支配的感觉受体、躯体运动神经元的轴突和自主神经元。 | ||
# 信息通过神经回路传递的途径包括:神经元轴突上的动作电位,轴突与其他神经元树突/胞体之间的突触传递,以及轴突与效应细胞之间的突触传递。 | # 信息通过神经回路传递的途径包括:神经元轴突上的动作电位,轴突与其他神经元树突/胞体之间的突触传递,以及轴突与效应细胞之间的突触传递。 | ||
# 不同类型的神经元因其独特的形态结构及胞体、树突和轴突细胞膜上的离子通道分布而具有功能特异性。 | |||
# 感觉受体(sensory receptors)包括外感受器(exteroceptors)、内感受器(interoceptors)和本体感受器(proprioceptors)。刺激(stimuli)是激活感觉受体的环境事件,反应(responses)是刺激产生的效应,感觉转导(sensory transduction)是通过将刺激能量转化为电信号实现检测的过程。 | |||
# 感觉受体可根据其转导的能量类型或输入来源进行分类。中枢通路通常根据其起点和终点命名,或依据传递的信息类型命名。 | |||
# 化学物质通过快速或慢速轴突运输沿轴突分布。轴突运输方向可为顺行(anterograde)或逆行(retrograde)。 | |||
# 神经胶质细胞包括:星形胶质细胞(astrocytes,调节中枢神经系统微环境)、少突胶质细胞(oligodendroglia,形成中枢髓鞘)、施万细胞(Schwann cells,形成周围神经髓鞘)、室管膜细胞(ependymal cells,覆盖脑室)和小胶质细胞(microglia,中枢神经系统巨噬细胞)。髓鞘可提高轴突传导速度。 | |||
# 脉络丛的室管膜细胞产生脑脊液(CSF)。脑脊液与血液的区别在于:K+、葡萄糖和蛋白质浓度较低,Na+和Cl-浓度较高;正常脑脊液不含血细胞。 | |||
# 中枢神经系统的细胞外液成分由脑脊液、血脑屏障和星形胶质细胞共同调节。 | |||
# 神经元轴突损伤会引起胞体的轴突反应(轴突染色质溶解,chromatolysis)以及损伤部位远端轴突的沃勒变性(Wallerian degeneration)。周围神经系统轴突比中枢神经系统轴突更易再生。 | |||
{{:BERNE & LEVY 生理学 第八版}} | |||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 17:25的最新版本
学习目标
完成本章学习后,学生应能回答以下问题:
- 中枢神经系统和周围神经系统的主要细胞类型有哪些?
- 神经元的主要组成部分及其功能角色是什么?
- 主要神经胶质细胞类型的功能角色是什么?
- 中枢神经系统的主要分区有哪些?
- 脑脊液如何形成、在何处形成?它在脑室系统中如何循环和排出?
- 轴突运输与轴突对横断损伤的反应有何关联?
神经系统是一个通讯与控制网络,使生物体能够快速、适应性地与其环境进行交互。这里的环境既包括外部环境(外感受性;体外世界)也包括内部环境(内感受性;体内组分和腔室)。为执行其功能,神经系统通过特化的传感器(受体)接收来自多种来源的感觉信息,将这些信息与先前存储为记忆的信息以及通过进化内置于神经系统中的生物体固有目标和驱动力进行整合,决定行动方案,然后向效应器官(肌肉和腺体)发出指令以执行所选择的行为反应。
此外,几乎所有行为反应都需要多个身体部位的协调配合。例如,即使一个简单的手臂伸展动作,也可能需要轴心肌的协同激活,甚至下肢肌肉的参与以维持姿势和平衡。这些过程本身可能由多达三个不同的感觉系统(视觉、前庭觉和本体感觉)共同监测,其信息必须进行整合。此外,运动可能改变内环境,从而需要心率和呼吸频率、血管直径等内部过程的代偿性调节。所有这些变量都由神经系统的各种专门子系统监测和控制,这些子系统必须协同工作才能使生物体完成运动并维持生存。后续章节将分别描述这些主要子系统;但需要记住的是,实际上它们的活动是整合在一起以产生正常行为的。
首先,将神经系统分为中枢和外周两部分是很有帮助的。中枢神经系统(CNS)由脑和脊髓组成。外周神经系统(PNS)由神经和神经节(神经元的小型集群)构成,它们支配全身各部位,并在环境与CNS之间提供界面。CNS与PNS的过渡区位于脊髓发出的背侧和腹侧根丝附近,以及脑发出的颅神经纤维附近。
神经系统的细胞组成
神经系统由细胞、结缔组织和血管构成。主要细胞类型包括神经元(神经细胞)和胶质细胞(neuroglia="神经胶")。广义而言,神经元的功能可定义为:通过整合自身电特性与其他神经元的电化学信号,产生信号(传递至其他神经元或效应细胞[如肌细胞])。特定神经元间发生通讯的连接点称为突触,突触传递过程对神经元功能至关重要(见第6章)。神经胶质细胞(简称胶质细胞)传统上被认为是支持性细胞,在代谢和物理层面维持神经元,隔离单个神经元,并帮助维持神经系统的内环境;然而现已发现,它们在调节神经系统活动流向上也发挥重要作用。
神经元
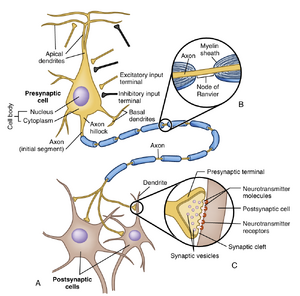
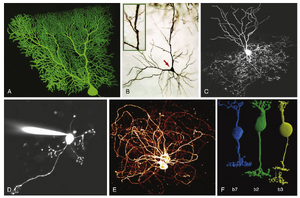
典型神经元包含三个主要细胞区室:胞体(亦称核周体或soma)、从胞体延伸出的数量不等的树突,以及一条轴突(图4.1)。这一基本模板存在大量形态学变异,包括缺乏树突或轴突的情况(图4.2)。这些变异并非随机产生,而是与每类神经元独特的功能特性相关。事实上,具有相似形态的神经元通常表征CNS特定区域,反映各CNS区域执行的独特神经处理过程。
胞体(cell body)是神经元主要的遗传和代谢中心。相应地,它包含细胞的细胞核和核仁,并具有发达的生物合成装置(biosynthetic apparatus)用于制造膜成分、合成酶以及神经细胞特殊功能所需的其他化学物质。神经元生物合成装置包括尼氏体(Nissl bodies)——由粗面内质网堆叠形成,以及显著的高尔基体(Golgi apparatus)。胞体还含有大量线粒体和细胞骨架成分,包括神经丝(neurofilaments)和微管(microtubules)。
胞体也是神经元接收突触输入的区域(即来自其他神经元的电信号和化学信号)。虽然从数量上看,胞体的突触输入通常远少于树突的输入,但其在性质上常与树突输入不同。由于胞体靠近轴突,对胞体的输入可以覆盖对树突的输入(详见第6章)。
树突(dendrites)是胞体逐渐变细的分支状延伸结构,是其他神经元信号的主要直接接收者。它们可被视为扩展和特化神经元表面积的方式,事实上可能占据可用于突触接触表面积(胞体加树突)的90%以上。树突可分为初级树突(primary dendrites,直接从胞体延伸出的树突)和高阶树突(higher-order dendrites,从更近端分支延伸出的子分支,"近端"指靠近胞体)。树突中的主要细胞器包括微管、神经丝和滑面内质网;初级树突还含有尼氏体和高尔基体部分结构。
神经元的树突集合称为其树突树(dendritic tree)。不同神经元的树突树在树突大小、数量和空间结构方面存在巨大差异。一个树突树可能仅由少量未分支的树突组成,也可能由许多高度分支化的树突构成。单个树突长度可超过1毫米,或仅有10-20微米。另一个主要形态学差异在于树突是否具有棘突(spines)——这些是从主树突伸出的蘑菇状或棒棒糖状小突起。棘突是专门用于(通常但不总是)接收兴奋性输入突触接触的部位。
轴突是细胞的延伸部分,负责将细胞输出传递给其他神经元(在运动神经元的情况下还包括肌细胞)。一般来说,每个神经元只有一个轴突,且直径通常均匀。轴突的长度和直径随神经元类型而异。
有些轴突长度仅略超过树突,而另一些可能长达一米或更长。轴突可能沿途发出直角分支(orthogonal branches en passant),但通常以称为终末分支树(terminal arborization)的刷状分支结束(如图4.1A中的四个终末分支及其突触终末所示)。终末分支树的大小、形状和组织结构决定了它将与哪些其他细胞建立联系。
轴突的起始部分称为始段(initial segment),从胞体(有时从近端树突)的轴丘(axon hillock)区域发出。轴突与胞体及近端树突的区别在于其缺乏粗面内质网、游离核糖体和高尔基体。始段通常是沿轴突传导的动作电位(锋电位)起始的部位(见第5章)。轴突可能在末端形成突触,也可能在沿途形成突触。突触将在第6章详细讨论。
神经元的特殊性在于其控制和响应电信号的能力。此外,神经元各部分的响应和控制机制与其他部分存在明显差异。这种神经元内部的区室化特化是各部分特定形态和离子通道组成的结果。例如:树突具有配体门控离子通道,使神经元能够响应其他神经元释放的化学物质,其特有的分支模式允许整合多种输入信号;而轴突通常具有较长的长度和高浓度的电压门控通道,使其能够长距离快速传递电信号(动作电位)且不发生衰减。
轴突运输
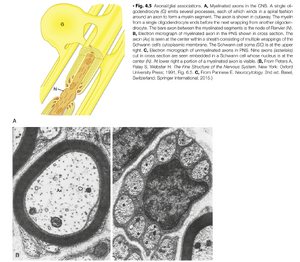
由于胞体是神经元的代谢中枢,维持轴突和突触功能所需的物质均在此合成。这些物质必须被分配到轴突各处(尤其是突触前末梢)以补充分泌或失活的物质。大多数轴突过长,无法通过简单扩散使物质从胞体高效移动到突触末梢。因此进化出了特殊的轴突运输机制来完成这一任务(图4.3)。这种代谢依赖性的一个结果是:当轴突与胞体断开时会发生变性。科学家利用这一现象追踪神经通路——切断轴突通路后,通过确定切断处远端的变性轴突投射位置来绘制通路。
轴突运输存在多种类型。膜结合细胞器和线粒体通过快速轴突运输(fast axonal transport)以相对高速运输。溶解于细胞质中的物质(如蛋白质)则通过慢速轴突运输(slow axonal transport)移动。哺乳动物中,快速轴突运输速度可达400mm/天,而慢速运输速度约为1mm/天。通过快速运输的突触小泡从脊髓运动神经元胞体到达足部神经肌肉接头仅需约2.5天。相比之下,某些可溶性蛋白质通过相同距离的运输需要近3年时间。
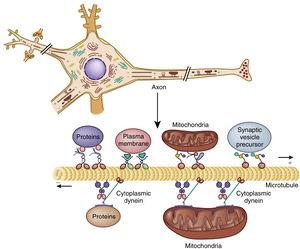
轴突运输需要代谢能量并依赖钙离子。微管(microtubule)提供了膜结合细胞器移动的导向轨道(见图4.3)。细胞器通过类似骨骼肌纤维粗、细丝之间的连接方式附着于微管。Ca++触发细胞器沿微管移动。轴突运输需要特殊的微管相关运动蛋白——驱动蛋白(kinesin)和动力蛋白(dynein)。
轴突运输具有双向性。从胞体向轴突末端的运输称为顺行轴突运输(anterograde axonal transport)。该过程由驱动蛋白介导,负责补充突触末梢的突触小泡和神经递质合成酶。相反方向的运输由动力蛋白驱动,称为逆行轴突运输(retrograde axonal transport)。此过程将回收的突触小泡膜运回胞体进行溶酶体降解。
临床相关
某些病毒和毒素可通过轴突运输(axonal transport)沿外周神经传导。例如水痘病毒(herpes zoster)会侵入背根神经节(dorsal root ganglion)细胞。这些神经元可能携带该病毒长达数年。然而,由于免疫状态的改变,病毒最终可能被激活。随后病毒可沿感觉轴突运输至皮肤,引发带状疱疹(shingles)——一种伴随剧烈疼痛的疾病。另一个例子是破伤风毒素(tetanus toxin)的轴突运输。破伤风梭菌(Clostridium tetani)可能在脏污的伤口中繁殖,若患者未接种破伤风疫苗,毒素可在运动神经元轴突中进行逆向运输。该毒素可进入脊髓前角(ventral horn)的细胞外间隙,阻断抑制性氨基酸(inhibitory amino acids)的突触受体,最终导致强直性惊厥(tetanic convulsions)。
神经胶质细胞(Glia)
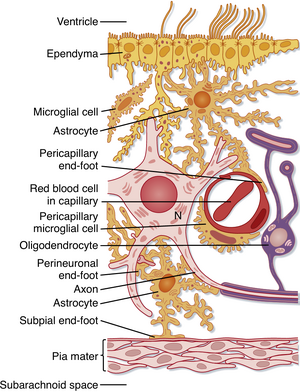
神经系统主要的非神经元细胞成分是神经胶质细胞(图4.4)。人类中枢神经系统(CNS)中的胶质细胞数量是神经元的4到10倍,约有10¹³个胶质细胞和10¹²个神经元。CNS中的胶质细胞包括星形胶质细胞(astrocytes)、少突胶质细胞(oligodendrocytes)、小胶质细胞(microglia)和室管膜细胞(ependymal cells)(见图4.4);外周神经系统(PNS)中的胶质细胞则是施万细胞(Schwann cells)和卫星细胞(satellite cells)。传统观点认为胶质细胞是支持性细胞,与其功能定位一致,它们的作用包括微环境调节和轴突髓鞘形成。现在研究还发现,胶质细胞通过调节突触和非突触传递(nonsynaptic transmission),以及在突触发生(synaptogenesis)和突触维持中的作用,已成为神经环路信号传递的重要调控者。
星形胶质细胞(因星状形态得名)在正常生理状态和神经系统损伤反应中均参与调控CNS的微环境。其胞体发出数个主突起,通过反复分支形成数百至数千个细分支。星形胶质细胞突起接触神经元并包裹突触末梢,将其与邻近突触及普通细胞外空间隔离。星形胶质细胞还具有终足(foot processes)结构,这些终足与CNS表面的毛细血管和结缔组织(即软脑膜(pia mater)接触(见图4.4),可能介导物质进入CNS。星形胶质细胞可主动摄取K⁺离子和神经递质,通过代谢、生物降解或缓慢再释放至细胞外环境,从而缓冲神经元周围微环境中的离子和神经递质浓度。其胞质内的胶质丝(glial filaments)为CNS组织提供机械支撑。
损伤后,星形胶质细胞会发生一系列变化成为反应性星形胶质细胞(reactive astrocytes)。例如某类反应性星形胶质细胞会在局灶损伤区域周围形成胶质瘢痕(glial scar),隔离受损组织,使炎症反应选择性地作用于损伤部位,从而最小化对周围正常组织的影响。星形胶质细胞还可影响突触传递特性,相关内容将在第6章讨论。
在细胞水平
星形胶质细胞通过间隙连接(gap junctions)相互耦联,形成合胞体(syncytium),使得小分子和离子能够沿着浓度梯度或通过电流流动进行重新分布。当正常神经活动引起细胞外[[K^{+}]]局部升高时,这种耦联网络可通过多个星形胶质细胞中的电流流动,实现K+在大范围区域的空间再分布。
在缺氧条件下(例如继发于动脉阻塞的缺血情况,即中风),脑区细胞外间隙的[K+]可升高达20倍。这将导致神经元和突触终末去极化,引发谷氨酸(glutamate)等递质的释放,进而促使神经元释放更多K+。这种额外释放会加剧问题,最终导致神经元死亡。在此情况下,局部星形胶质细胞可能通过K+{-}\mathsf{Cl}^{-}同向转运(symport)而非空间缓冲(spatial buffering)来摄取过量K+,因为此时细胞外[[K^{+}]]的升高往往是广泛性而非局部性的。
少突胶质细胞和施万细胞对轴突功能至关重要。许多轴突被髓鞘(myelin sheath)包裹,这是由胶质细胞膜形成的螺旋多层结构(图4.5A,B)。在中枢神经系统中,髓鞘由少突胶质细胞形成,而在周围神经系统中则由施万细胞形成。髓鞘通过将离子电流限制在相邻胶质细胞之间轴突的无髓部分(称为郎飞结(nodes of Ranvier))来提高动作电位传导的速度和保真度(见第5章)。尽管两者都旨在提高传导速度,但轴突与少突胶质细胞或施万细胞的关系存在几个重要差异。主要区别之一是:单个少突胶质细胞通常参与中枢神经系统中多个轴突的髓鞘形成,而每个施万细胞仅参与周围神经系统中单个轴突的髓鞘形成。第二个区别是:在中枢神经系统中,无髓轴突是裸露的;而在周围神经系统中,无髓轴突并非裸露,而是被施万细胞突起包裹——不过施万细胞不会形成多层覆盖(即髓鞘),而是延伸突起包裹多个轴突的部分(包裹一组无髓轴突的施万细胞称为Remak束)(见图4.5C)。
卫星细胞包裹背根神经节(dorsal root)和脑神经节(cranial nerve ganglion)细胞,其调节微环境的方式与星形胶质细胞相似。
小胶质细胞起源于发育早期迁移入中枢神经系统(CNS)的髓系干细胞(erythromyeloid stem cells)。它们在中枢神经系统的免疫反应中起重要作用。当中枢神经系统受损时,小胶质细胞通过吞噬作用(phagocytosis)帮助清除损伤产生的细胞产物。其他胶质细胞和从循环系统侵入中枢神经系统的吞噬细胞也参与这一过程。除免疫功能外,最新证据表明它们在健康脑组织中亦具有活性,可能在正常脑发育和功能中发挥重要作用,包括修剪发育过程中形成的冗余突触以及调节突触可塑性(synaptic plasticity)。
室管膜细胞构成脑室腔(ventricular spaces)的上皮层,这些腔隙内含有脑脊液(CSF)。脑脊液由位于脑室系统的脉络丛(choroid plexuses)特化室管膜细胞分泌。许多物质可自由扩散通过室管膜,该结构位于脑细胞外间隙与脑脊液之间。
临床视角(IN THE CLINIC)
成年神经系统中的大多数神经元是终末分化细胞(postmitotic cells)(尽管某些脑区可能仍保留部分干细胞)。成年脑内存在大量胶质前体细胞,它们仍具有分裂和分化能力。因此,成年脑内大多数原发性脑肿瘤的细胞来源是胶质细胞。例如:
- 星形胶质细胞来源:恶性程度从生长缓慢的星形细胞瘤(astrocytoma)到快速致命的胶质母细胞瘤(glioblastoma multiforme)
- 少突胶质细胞来源:少突胶质细胞瘤(oligodendroglioma)
- 室管膜细胞来源:室管膜瘤(ependymoma)
脑膜细胞可形成生长缓慢的脑膜瘤(meningiomas)压迫脑组织,施万细胞(Schwann cells)也可形成肿瘤(如第八对脑神经施万细胞来源的听神经瘤(acoustic schwannomas))。婴幼儿脑中仍具分裂能力的神经元可能形成神经母细胞瘤(neuroblastomas)(如第四脑室顶)或视网膜母细胞瘤(retinoblastomas)(眼部)。
周围神经系统(The Peripheral Nervous System)
外周神经系统(PNS)在环境与中枢神经系统(CNS)之间提供了接口,既负责将感觉信息传递至CNS,也负责执行CNS发出的运动指令。它包括感觉(或初级传入)神经元(primary afferent neurons)、躯体运动神经元(somatic motor neurons)和自主运动神经元(autonomic motor neurons)。
进入神经系统的感觉通路始于受体(receptor)。这些受体可能是PNS中轴突的特化部分,也可能包含其他辅助细胞。每个感觉受体通过将特定类型的能量转换为电信号而组织形成,可根据其转导的能量类型进行分类(例如光感受器转导光信号,机械感受器转导位移和力)。它们也可根据输入来源进行分类(例如外感受器传递外部事件信号,本体感受器传递身体部位状态如肘关节角度的信号,内感受器传递肠道扩张等内部信号)。
转导过程会在初级传入神经元中产生称为受体电位(receptor potential)的电反应,进而触发支配该受体的初级传入纤维产生动作电位。这些动作电位携带关于感觉刺激的信息,通过初级传入神经元传递至CNS。
躯体与自主运动神经元将信号从CNS传递至各自的效应靶点。躯体运动神经元支配全身骨骼肌,其胞体位于脊髓前角(ventral horn)或等效的脑干核团,通过前根(ventral root)或脑神经(cranial nerve)投射至CNS外。其与肌肉的详细关系将在第9章讨论。自主运动通路负责控制器官、平滑肌和腺体的功能,实际上是一个双神经元通路,其特性将在第11章阐述。
中枢神经系统
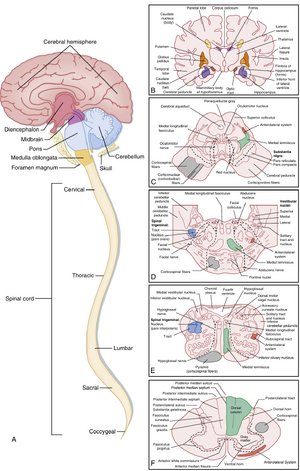
中枢神经系统(CNS)由前述各类细胞元件构成,包括脊髓和脑(图4.6A)。这些细胞元件通过多种复杂方式连接,形成支持CNS众多功能的子系统。这些系统的生理学将在第7至11章讨论,但理解系统生理学需要掌握CNS解剖学的基础知识,本节将对此作简要说明。
CNS中轴突通路高度集中(神经元极稀少)的区域称为白质(white matter),因为轴突的髓鞘对光具有高度折射性。相反,神经元和树突高度集中的区域称为灰质(gray matter)。需注意灰质中也存在轴突,这些轴突可能参与局部信息处理(即起源于局部神经元或终止于局部神经元),也可能是过路纤维(fibers of passage)。因此,某区域的损伤可能导致局部功能丧失,和/或通过该损伤区域的过路纤维所连接的远端区域发生功能脱节。
在CNS中,轴突通常以束或传导束(tracts)的形式走行。传导束的命名通常反映其起源与终止部位。例如脊髓小脑传导束(spinocerebellar tracts)将信息从脊髓传递至小脑。术语"通路(pathway)"与传导束类似,但通常用于描述特定功能(如听觉通路(auditory pathway):通过多个突触进行神经元间连接,传递和处理听觉信息的系列结构)。
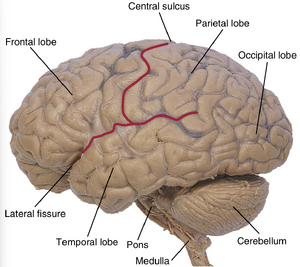
CNS中的灰质(gray matter)主要有两种组织方式。神经核(nucleus)是CNS内的神经元群(在周围神经系统PNS中此类结构称为神经节(ganglion)),例如丘脑核、小脑核和颅神经核。皮质(cortex)指分层排列且通常位于CNS表面的神经元群,最显著的是端脑皮质(cerebral cortex)和小脑皮质(cerebellar cortex),分别覆盖端脑半球和小脑表面(图4.7)。
在大多数神经核和皮质中,神经元可分为两大类:投射细胞(projection cells)和局部中间神经元(local interneurons)。投射细胞的轴突延伸至其他区域,是神经系统各传导束的起源。而局部中间神经元的轴突终止于其胞体所在的神经结构内,主要参与局部信息处理而非跨区域信号传递。这两类并非互斥;许多神经元的轴突既发出局部分支,又投射至一个或多个远端区域。
CNS的区域解剖
脊髓可细分为多个区域(见图4.6A),每个区域由若干节段组成,节段名称根据其神经根进出椎骨的部位而定:8个颈段、12个胸段、5个腰段、5个骶段和1个尾段。每个节段均保持管状外观。灰质内,背侧角(dorsal horn)接收并处理来自背根的感觉信息,而腹侧角(ventral horn)主要为运动结构,包含通过腹根向外投射轴突的运动神经元(图4.8)。
周围的白质由连接不同脊髓节段并与大脑进行信息传递的众多纤维束组成。其中三个主要传导束为:外侧皮质脊髓束(运动功能,lateral corticospinal tract)、脊髓丘脑束/前外侧系统(感觉功能,spinothalamic tract/anterolateral system)以及背柱-内侧丘系通路(感觉功能,dorsal column-medial lemniscus pathway)(见图4.6F)。
脑干由延髓(medulla)、脑桥(pons)和中脑(midbrain)组成(图4.9;另见图4.6)。除了与脊髓相连的纵向传导通路外,脑干还包含神经核团和多种随脑干水平变化的额外传导通路。这些结构具有多重功能,部分功能与脊髓类似(如传递基本感觉信息和运动指令),另一些则涉及多种其他脑功能,例如心脏调控和意识状态。脑干还通过脑神经接收输入信号并发出运动输出信号(表4.1)。
小脑位于脑桥和延髓背侧。它接收来自脊髓、脑干和大脑皮层的输入信号,并向这些结构中多个相同部位发出投射。小脑在运动协调和运动学习中起关键作用,并日益被认识到在其他认知功能和行为中具有重要作用。
丘脑位于脑干上端,被与之高度互联的大脑半球所包绕(见图4.6B)。除少数例外,上行信息首先到达丘脑,再由丘脑传递至大脑皮层。这些结构在意识觉知、意志活动、记忆和语言等众多功能中起主要作用。除皮层外,大脑半球还包含一组深部核团——基底神经节,它们与皮层和丘脑形成神经环路,其功能将在第9章详述。
中枢神经系统各主要区域功能总结见表4.1。
| 区域 | 神经(输入/输出) | 该区域的一般功能 |
|---|---|---|
| 脊髓 | 背根/腹根 | 感觉输入,反射回路,躯体和自主运动输出 |
| 延髓 | 颅神经 VIII–XII | 心血管和呼吸控制,听觉和前庭输入,脑干反射 |
| 脑桥 | 颅神经 V–VIII | 呼吸/泌尿控制,眼动控制,面部感觉/运动控制 |
| 小脑 | 颅神经 VIII | 运动协调,运动学习,平衡 |
| 中脑 | 颅神经 III–IV | 听觉信息中继与定位,眼控制(包括眼动、晶状体调节和瞳孔反射),痛觉调制 |
| 丘脑 | 颅神经 II | 感觉和运动信息向大脑皮层的中继,皮层激活调节,视觉输入 |
| 下丘脑 | - | 自主神经和内分泌控制,动机行为 |
| 基底神经节 | - | 塑形丘脑皮质运动抑制模式 |
| 大脑皮层 | 颅神经 I | 感觉感知,认知,学习与记忆,运动规划与随意运动,语言 |
脑脊液(Cerebrospinal Fluid, CSF)
脑脊液充盈于脑室系统(大脑内部相互连通的腔室)和直接包裹脑组织的蛛网膜下腔。脑室内的脑脊液通过室管膜的自由交换反映脑细胞外液的成分特性,而脑组织"悬浮"于蛛网膜下腔脑脊液中以缓冲外部机械冲击。脑室系统内脑脊液容量约为30mL,蛛网膜下腔约125mL。按每分钟产生0.35mL计算,脑脊液每日更替超过三次。
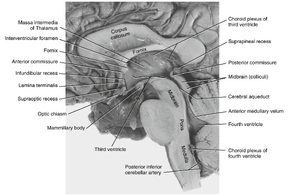
脑脊液主要是由脉络丛形成的毛细血管滤过液。脉络丛由软脑膜、内陷毛细血管和特化运输功能的室管膜细胞构成,分布于侧脑室、第三脑室和第四脑室(见图4.9)。脑脊液通过脑室间的孔道流动:两侧大脑半球内的侧脑室经室间孔(Monro孔)与中线位置的第三脑室相连;中脑内的中脑导水管(Sylvius导水管)连接第三与第四脑室;第四脑室是由下方的脑桥/髓质和上方的小脑围成的空间。虽然成人脊髓中央管随年龄增长逐渐闭锁,但其头端仍与第四脑室延续。
脑脊液(cerebrospinal fluid, CSF)通过位于第四脑室顶部的三个孔(一个正中孔【Magendie孔】和两个外侧孔【Luschka孔】)离开脑室系统。离开脑室系统后,CSF在包围脑和脊髓的蛛网膜下隙(subarachnoid space)中循环。这些间隙扩大的区域称为蛛网膜下池(subarachnoid cisterns)。例如腰池(lumbar cistern),它包围脊髓终止平面以下的腰骶神经根。腰池是腰椎穿刺(临床采集CSF样本的操作)的目标部位。大部分CSF通过瓣膜状蛛网膜颗粒(arachnoid granulations)以整体流动方式进入颅内的硬脑膜静脉窦。
由于中枢神经系统内的细胞外液与CSF相通,CSF的组成是反映脑和脊髓神经元细胞外环境成分的重要指标。表4.2列出了腰池中CSF的主要成分。为便于比较,表中也给出了血液中相同成分的浓度。与血液相比,CSF含有较低的K⁺、葡萄糖和蛋白质浓度,但具有更高的Na⁺和Cl⁻浓度。此外,CSF几乎不含血细胞。Na⁺和Cl⁻浓度的升高使得CSF与血液保持等渗。
当人体处于卧位时,CSF柱的压力约为120至180毫米水柱(mm H₂O)。CSF的生成速率相对独立于脑室和蛛网膜下隙的压力以及全身血压。然而,CSF的吸收速率直接取决于CSF压力。
| 成分 (Constituent) | 腰椎脑脊液 (Lumbar CSF) | 血液 (Blood) | 核心差异说明 |
|---|---|---|---|
| Na⁺ (钠离子) mEq/L | 148 | 136 - 145 | CSF钠浓度略高于血液 |
| K⁺ (钾离子) mEq/L | 2.9 | 3.5 - 5 | CSF钾浓度显著低于血液 |
| Cl⁻ (氯离子) mEq/L | 120 - 130 | 100 - 106 | CSF氯浓度显著高于血液 |
| 葡萄糖 (Glucose) mg/dL | 50 - 75 | 70 - 100 | CSF葡萄糖浓度低于血液 |
| 蛋白质 (Protein) mg/dL | 15 - 45 | 6,800 (6.8×103) | CSF蛋白质浓度极低,远低于血液 (相差约150-450倍) |
| pH值 | 7.3 | 7.4 | CSF pH值略低于血液 (CSF偏酸一点) |
| 摘自Willis WD, Grossman RG. Medical Neurobiology. 3rd ed. St Louis: Mosby; 1981. | |||
临床相关
CSF循环受阻会导致CSF压力升高和脑积水(颅内液体异常积聚)。在脑积水中,脑室会扩张,若压力持续升高将导致脑实质丧失。当阻塞发生在脑室系统内或第四脑室孔时,称为非交通性脑积水(noncommunicating hydrocephalus)。若阻塞位于蛛网膜下隙或蛛网膜绒毛,则称为交通性脑积水(communicating hydrocephalus)。
血脑屏障
中枢神经系统中神经元所处的局部环境受到严格调控,使得神经元通常能够免受细胞外液成分剧烈变化的影响。这种调控部分依赖于血脑屏障(blood-brain barrier)的存在(其他机制包括神经胶质的缓冲功能、中枢神经系统循环的调控,以及脑脊液与中枢神经系统细胞外液之间的物质交换)。大分子和高电荷离子从血液向脑和脊髓的移动受到严格限制。这种限制至少部分源于中枢神经系统毛细血管内皮细胞及其紧密连接的屏障作用。星形胶质细胞(astrocytes)也可能协助限制某些物质的移动。例如,星形胶质细胞可摄取钾离子,从而调控细胞外空间的[K⁺]浓度。部分药物(如青霉素)可通过转运机制被清除出中枢神经系统。
神经组织对损伤的反应
神经组织损伤会引发神经元和胶质细胞的反应。严重损伤可导致细胞死亡。除特定情况外,神经元一旦死亡便无法再生,因为神经元通常属于有丝分裂后细胞(postmitotic cells)。在动物中,嗅球和海马神经元是两种例外情况;然而在人类中,仅有证据表明成年中枢神经系统的海马(hippocampus)存在显著水平的神经发生。
临床关联
脑部病理状态可破坏血脑屏障。例如,脑肿瘤可能允许原本被屏障排斥的物质从循环系统进入脑组织。放射科医师可利用此特性,将一种正常情况下无法穿透血脑屏障的物质注入循环系统。若该物质可被成像,其向脑肿瘤区域的渗漏可用于显示肿瘤的分布范围。
变性
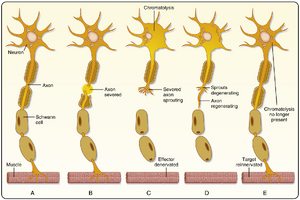
当轴突被横断时,神经元的胞体可能呈现染色质溶解(chromatolysis)或"轴突反应"。正常情况下,尼氏体(Nissl bodies)能被碱性苯胺染料(basic aniline dyes)良好染色,这些染料可结合核糖体的RNA(图4.10A)。轴突受损后(见图4.10B),神经元通过合成新结构蛋白试图修复轴突,粗面内质网的池腔因蛋白质合成产物而扩张。此时核糖体呈现无序排列,碱性苯胺染料对尼氏体的染色减弱。这种称为染色质溶解的过程改变了染色模式(见图4.10C)。此外,胞体可能出现肿胀变圆,细胞核可能偏位。这些形态学改变反映了伴随蛋白质合成增强的细胞学过程。
由于无法合成新蛋白,横断处远端的轴突将死亡(见图4.10C)。数日内,轴突及其所有相关突触终末将崩解。若为中枢神经系统的有髓轴突,其髓鞘也将碎裂并最终被吞噬清除。但在外周神经系统中,形成髓鞘的施万细胞(Schwann cells)仍保持活性,事实上会进行细胞分裂。这一系列现象最早由Waller描述,称为华勒变性(Wallerian degeneration)。
再生
在外周神经系统(PNS)中,轴突因损伤丧失后,许多神经元能再生新轴突。受损轴突的近端残端会产生芽突(见图4.10C),这些芽突会延长,并在原有神经通路可用时沿原路径生长(见图4.10D)。神经远端残端的施万细胞(Schwann cells)不仅能在华勒变性(Wallerian degeneration)中存活,还会增殖并沿原有轴突路径排列成行。发芽轴突的生长锥沿这些施万细胞排列的路径延伸,最终可能重新支配原有的外周靶结构(见图4.10E)。随后施万细胞对轴突进行髓鞘再形成。再生速率受轴突慢速运输的限制,约为1\mathrm{毫米/天}。
在中枢神经系统(CNS)中,横断的轴突也会发芽。然而,芽突缺乏正确的引导路径,部分原因是少突胶质细胞(oligodendroglia)无法形成可供芽突生长的路径。这种限制可能与以下事实有关:单个少突胶质细胞可为多个中枢轴突形成髓鞘,而外周神经系统中单个施万细胞仅为一个轴突提供髓鞘。此外,不同的化学信号可能对外周和中枢的再生尝试产生不同影响。中枢神经系统成功再生的其他障碍包括星形胶质细胞形成的胶质瘢痕,以及缺乏发育时期引导轴突轨迹的营养因子作用。
关键要点
- 神经系统功能包括兴奋性(excitability)、感觉检测(sensory detection)、信息处理(information processing)和行为(behavior)。
- 中枢神经系统(CNS)包括脊髓和脑。脑包含延髓、脑桥、小脑、中脑、丘脑、下丘脑、基底神经节和大脑皮层。
- 神经元(neuron)是神经系统的功能单元,具有三个主要区室:树突(dendrites)、胞体(cell body)和轴突(axon)。前两者负责接收和整合信号,轴突将神经元的输出信号传递给其他细胞。
- 外周神经系统(PNS)包括初级传入神经元及其支配的感觉受体、躯体运动神经元的轴突和自主神经元。
- 信息通过神经回路传递的途径包括:神经元轴突上的动作电位,轴突与其他神经元树突/胞体之间的突触传递,以及轴突与效应细胞之间的突触传递。
- 不同类型的神经元因其独特的形态结构及胞体、树突和轴突细胞膜上的离子通道分布而具有功能特异性。
- 感觉受体(sensory receptors)包括外感受器(exteroceptors)、内感受器(interoceptors)和本体感受器(proprioceptors)。刺激(stimuli)是激活感觉受体的环境事件,反应(responses)是刺激产生的效应,感觉转导(sensory transduction)是通过将刺激能量转化为电信号实现检测的过程。
- 感觉受体可根据其转导的能量类型或输入来源进行分类。中枢通路通常根据其起点和终点命名,或依据传递的信息类型命名。
- 化学物质通过快速或慢速轴突运输沿轴突分布。轴突运输方向可为顺行(anterograde)或逆行(retrograde)。
- 神经胶质细胞包括:星形胶质细胞(astrocytes,调节中枢神经系统微环境)、少突胶质细胞(oligodendroglia,形成中枢髓鞘)、施万细胞(Schwann cells,形成周围神经髓鞘)、室管膜细胞(ependymal cells,覆盖脑室)和小胶质细胞(microglia,中枢神经系统巨噬细胞)。髓鞘可提高轴突传导速度。
- 脉络丛的室管膜细胞产生脑脊液(CSF)。脑脊液与血液的区别在于:K+、葡萄糖和蛋白质浓度较低,Na+和Cl-浓度较高;正常脑脊液不含血细胞。
- 中枢神经系统的细胞外液成分由脑脊液、血脑屏障和星形胶质细胞共同调节。
- 神经元轴突损伤会引起胞体的轴突反应(轴突染色质溶解,chromatolysis)以及损伤部位远端轴突的沃勒变性(Wallerian degeneration)。周围神经系统轴突比中枢神经系统轴突更易再生。
