第十七章 血管的特性:修订间差异
自动添加《BERNE & LEVY 生理学 第八版》章节导航 |
自动添加 Sofia 模板和分类 |
||
| 第786行: | 第786行: | ||
{{:BERNE & LEVY 生理学 第八版}} | {{:BERNE & LEVY 生理学 第八版}} | ||
{{学科分类}} | |||
[[Category:生理学]] | |||
2025年8月23日 (六) 17:23的版本
学习目标
完成本章学习后,学生应能回答以下问题:
- 决定血流动力学的血管和血液的物理特性有哪些?什么是泊肃叶定律(Poiseuille’s law)?
- 搏出量和脉压如何与动脉顺应性相关?动脉顺应性如何影响动脉脉搏波和心脏做功?
- 平均压、收缩压、舒张压和脉压是什么?如何测量?
- 微循环由哪些血管构成?大动脉中的搏动血流如何转化为微循环中的稳态血流?
- 毛细血管功能的斯塔林假说(Starling’s hypothesis)所依据的静水压和渗透压因素是什么?
- 内在和外在因素如何调节外周循环?这些因素如何影响特定器官的血流?
- 肌源性假说(myogenic hypothesis)如何解释血流的自主调节?组织代谢对自主调节有何影响?
- 骨骼肌血流的主要决定因素是什么?
- 血流与心肌耗氧量之间有何关系?冠状动脉血流的主要决定因素是什么?
- 出生时发生的循环系统变化有哪些?
- 脑循环中血脑屏障的功能是什么?
血管系统由封闭的管道系统组成,负责将血液从心脏分配到组织,并将血液从组织返回心脏。它可分为三个组成部分:动脉系统(将血液从心脏输送至组织)、静脉系统(将血液从组织返回心脏)和微循环(分隔动脉和静脉系统,是血液与组织之间进行营养物质和细胞废物交换的场所)。本章将描述这些血管系统的组成部分,并探讨特定血管床和组织的血流特性。作为本部分内容的引言,首先回顾血液/液体在血管系统中流动的物理学原理(即血流动力学)。
血流动力学
尽管血管并非刚性管道且血液也非简单的均质流体,但流体流经刚性管道的物理学原理为理解血液在血管中的流动提供了基础。掌握这些物理原理有助于理解血流速度(velocity)、血压(blood pressure)与体循环各组成部分的尺寸之间的相互关系。
血流速度
流速(velocity)与流体运动相关,指流体粒子在单位时间内移动的距离,其单位以距离/时间表示(如厘米/秒)。而流量(flow)则指单位时间内流体体积的位移速率,以体积/时间表示(如立方厘米/秒)。在刚性管道中,流速(v)与流量(Q)通过管道的横截面积(A)相互关联:
公式 17.1:v = Q / A
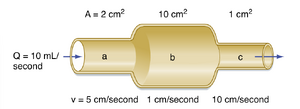
流速、流量与横截面积之间的关系如图17.1所示。由于质量守恒定律要求流经刚性管道的流体总量恒定,因此流体的流速与横截面积成反比。即流体流速在横截面积最小的管段最大,而在横截面积最大的管段最慢。
如图15.3所示,当血液流经动脉系统时,其流速逐渐降低。在毛细血管中,流速降至最低值。随后当血液通过静脉系统向心脏回流时,流速再次逐渐升高。循环系统各组成部分中的相对流速仅与其各自的横截面积相关。
流速与压力的关系
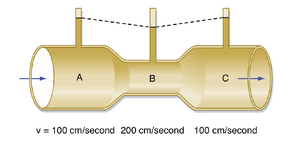
液压系统的总能量由三个分量组成:压力、重力和速度。血流速度对管道内的压力可产生重要影响。试考虑不同横截面积的管道中流速对压力的影响(图17.2)。在此系统中,总能量保持恒定。管道内的总压力等于侧(静)压(lateral (static) pressure)与动态压力(dynamic pressure)之和。由于管道水平放置,重力分量可忽略不计。若黏性导致的能量损失可忽略(即该流体为“理想流体”),则A、B、C各段的总压力相等。流速对动态分量(Pdyn)的影响可通过以下方式估算:
公式 17.2: P = ρV2/2
式中,ρ为流体密度(克每立方厘米,g/cm³),V为速度(厘米每秒,cm/s)。假设流体密度为1 g/cm³。图17.2中A段的侧压为100 mmHg(注:1 mmHg等于1330 dynes/cm²)。根据公式17.2,P_dyn=5000 dynes/cm²,即3.8 mmHg。在管道的狭窄部分B中,速度加倍时P_dyn=20,000 dynes/cm²,即15 mmHg。因此B段的侧压比总压低15 mmHg,而A段和C段的侧压仅比总压低3.8 mmHg。在大多数动脉部位,动态分量占总压力的比例可忽略不计。然而,在动脉狭窄或阻塞处,高流速伴随大动能,动态压力分量可能显著增加,从而导致压力降低,远端节段的灌注相应减少。此例有助于解释动脉粥样硬化或血管壁痉挛导致的血管狭窄处的压力变化:在管道的狭窄段,因流速与大动能相关,动态分量显著增加。
压力与流量的关系
法国生理学家Jean Léonard Marie Poiseuille于19世纪40年代通过实验推导出流体流经圆柱形管道的最基本定律。他最初关注血流动力学的物理决定因素,但在测量玻璃毛细管流量时使用更简单的液体替代血液。其研究精确且重要,故该定律被命名为Poiseuille定律。
泊肃叶定律(Poiseuille's law)
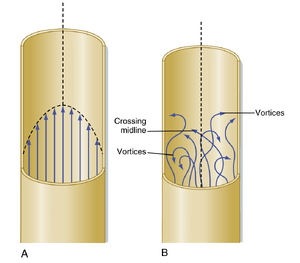
泊肃叶定律适用于牛顿流体通过刚性圆柱形管道的稳定(即非脉冲性)层流。牛顿流体是指粘度保持恒定的流体,而层流是指流体以一系列独立层状结构运动的类型,其中每层的运动速度与其相邻层不同(图 17.3A)。在通过管道的层流中,流体由一系列无限薄的同心管相互滑动组成,其中中心管的速度最大。同心薄层的速度向血管壁呈抛物线形递减。尽管血管系统存在差异(即流动是脉动的、血管并非刚性圆柱体、血液不是牛顿流体),泊肃叶定律仍为理解血管系统中血流的影响因素提供了重要依据。然而在某些特殊情况下,流动可能变为湍流(见图 17.3B)而非层流。此时会出现涡流(旋涡),流速分布呈现混沌状态。本章后续将详细描述这种情况。
泊肃叶定律通过压力、管道尺寸和液体粘度描述了流体在圆柱形管道中的层流:
公式 17.3:Q = π(Pi-Po)r4/8ηl
其中:
- Q= 流量
- Pi - Po = 管道入口(i)到出口(o)的压力梯度
- r = 管道半径
- η= 流体粘度
- l= 管道长度
从公式可明显看出,管道的流量随压力梯度增加而增加,随流体粘度或管道长度增加而减少。管道半径是决定流量的关键因素,因其被提升至四次方。
流动阻力
在电学理论中,欧姆定律(Ohm’s law)指出电阻(R)等于电压降(E)与电流(I)的比值:
公式 17.4:R = E / I
类似地,在流体力学中,液压阻力(hydraulic resistance,R)可定义为压力降与流量(Q)的比值:
公式 17.5:R = (Pi - Po) / Q
对于牛顿流体在圆柱形管道中的稳定层流,液压阻力的物理成分可通过重新排列泊肃叶定律得到液压阻力方程:
公式 17.6:R = (Pi - Po) / Q = 8ηl/πr4
因此,当泊肃叶定律适用时,流动阻力仅取决于管道的尺寸和流体特性。
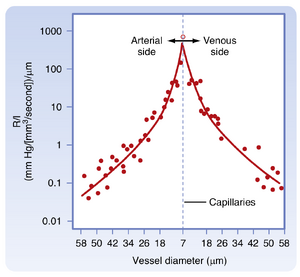
任何血管中血流阻力的主要决定因素是血管的口径,因为阻力与管道半径的四次方成反比。图17.4中测量了通过小血管的流动阻力,并将单位长度血管的阻力(R/l)与血管直径绘制成图。如图所示,毛细血管(直径7μm)的阻力最高,随着毛细血管动脉端和静脉端血管直径的增大,阻力逐渐降低。在毛细血管两侧较大血管中,R/l的值实际上与直径(或半径)的四次方成反比。
当血管口径变化时,血管阻力会发生改变。导致血管口径变化的最重要因素是血管壁中环形平滑肌细胞的收缩。内部压力的变化也会改变血管口径,从而改变通过这些血管的血流阻力。血管是弹性管道。因此,跨血管壁的跨壁压(即内外压力差)越大,血管的口径越大,其液压阻力(hydraulic resistance)越小。
从图15.3可以明显看出,压力降最大的部位发生在微小动脉和小动脉。然而,平均直径约7μm的毛细血管具有最大的血流阻力。尽管如此,在彼此串联的所有不同类型血管中(如图15.3所示),阻力最大的血管是小动脉而非毛细血管。这个看似矛盾的现象与平行毛细血管和平行小动脉的相对数量有关:体循环中的毛细血管数量远多于小动脉,多个平行排列的毛细血管总阻力远少于较少平行排列的小动脉总阻力。此外,小动脉具有厚层环形排列的平滑肌纤维,可以改变管腔半径。从液压阻力公式(式17.6)可以看出,即使半径发生微小变化,也会显著改变阻力,其中R与r⁴成反比。
串联与并联阻力
在心血管系统中,图15.3横轴上列出的各类血管彼此串联排列。每类血管的个体成员通常彼此平行排列(见图15.1)。因此,除了肾血管系统(其中管周毛细血管与肾小球毛细血管串联)和内脏血管系统(其中肠毛细血管与肝毛细血管彼此串联)外,身体各处的毛细血管大多呈平行分布。串联或并联排列组件的总液压阻力可以通过与类似电阻组合相同的方法推导得出。
串联血管的阻力
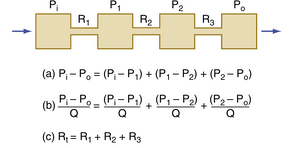
在图17.5所示的系统中,三个液压阻力(hydraulic resistance)R1,R2,R3以串联方式排列。整个系统的压降由各个阻力上的压降之和组成(图17.5中的方程[a])。在稳态(steady state)下,通过任一横截面的流量必须等于通过其他任一横截面的流量。当方程(a)中的每个分量除以Q时(图17.5中的方程[b]),根据阻力定义(式17.5)可明显看出:对于串联排列的阻力,系统的总阻力(Rt)等于各个阻力之和,即:
公式17.7:Rt = R1 + R2 +R3
并联血管的阻力
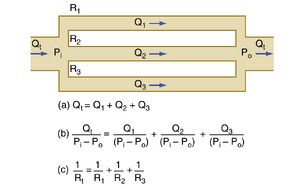
对于图17.6所示的并联阻力,所有管道的流入压和流出压相同。在稳态下,系统的总流量(Q_{\mathrm{}})等于通过各并联单元的流量之和(图17.5中的方程[a])。由于压力梯度(\mathrm{P_{i}}-\mathrm{P_{o}})对所有并联单元相同,方程(a)中的每项均可除以该压力梯度得到方程(b)。根据阻力定义,可推导出图17.5中的方程(c)。该方程表明:对于并联排列的阻力,总阻力(Rt)的倒数等于各阻力倒数之和,即:
公式17.8:1/Rt = 1/R1 + 1/R2 + 1/R3
通过几个简单示例,可以明显看出并联液压系统的基本特性。例如,若图17.6中三个并联单元的阻力均相等,则:
[弱智推导,略]
由此可见,总阻力小于单个阻力。对于任何并联结构,总阻力必定小于任一单独组件的阻力。例如,在一个系统中,若将高阻力管与低阻力管并联,系统的总阻力必定低于单独低阻力组件的阻力,因为高阻力组件为流体流动提供了额外的通路(即导流能力,conductance)。
考虑整个体循环血管床的总外周阻力(Total Peripheral Resistance, TPR)与其组成部分(如肾血管系统)阻力之间的生理学关系。TPR是动静脉(AV)压力差(动脉压Pa − 静脉压Pv)与流经整个体循环血管床的血流量(即心输出量[Q])的比值。例如,肾血管阻力(R_{r})则是相同的动静脉压力差(Pa-Pv)与肾血流量(Q_{r})的比值。
假设个体的Pa为100mmHg,外周Pv为0mmHg,心输出量为5000mL/分钟,则TPR为0.02mmHg/mL/分钟,即0.02外周阻力单位(Peripheral Resistance Units, PRUs)。正常情况下,单侧肾脏的血流量约为600~mL/分钟。因此,肾阻力为100mmHg ÷ 600mL/min,即0.17 PRUs,是TPR的8.5倍。对于肾脏这类仅占全身重量约1%的器官,其血管阻力远高于整个体循环的阻力。因此,像肾脏这样的单个器官的流动阻力高于整个体循环并不奇怪,因为体循环不仅包含一个肾脏,还包含更多血液流动的替代路径。
层流与湍流
在层流中(见图17.3A),与管壁接触的薄层流体黏附于管壁,因此静止不动。紧邻外层流体的内侧层必须相对于静止层发生剪切运动,故该层以有限速度缓慢移动。类似地,更靠近中心的相邻层运动更快;纵向速度剖面呈抛物面形(见图17.3A)。流体沿管长纵向流动时,任何特定流层的流体元素始终保留在该流层内。流束中心的速度最大,等于整个管横截面平均流速的两倍。
流体流经管道时可能产生不规则运动,这种流动称为湍流。在此状态下,流体元素不再局限于特定流层,而是发生快速的径向混合(见图17.3B)。当流动为湍流时,推动相同流量通过同一管道所需的压力比层流时更大。湍流中压降近似与流量的平方成正比,而层流中压降与流量的一次方成正比。因此,若发生湍流,心脏等泵器官需做更多功以维持特定流量。
在特定条件下,管道内流动是湍流还是层流可通过无量纲数——雷诺数(\mathbf{N}_{\mathbf{R}})预测。该数值表示惯性力与黏性力的比值。对于流经圆柱管的流体:
公式 17.12:NR = ρDv/η
其中ρ= 流体密度,D= 管径,V= 平均流速,η= 黏度。当NR ≤2000 时,流动通常为层流;当 NR ≥3000 时,流动为湍流;当 NR 介于 2000-3000 时,流动处于层流向湍流的过渡状态。公式 17.12 表明高流体密度、小管径、高流速和低流体黏度易导致湍流。除这些因素外,管径的突然变化或管壁的不规则性也可能产生湍流。
血管壁的剪切应力
当血液流经血管时,会对血管壁施加一个平行于管壁的力,这个力称为剪切应力(shear stress)(τ)。剪切应力与流体流速和黏度成正比:
公式 17.13:τ = 4ηQ/πr3
临床知识
湍流通常伴随可听见的振动。心血管系统中的湍流可通过听诊器在体格检查中发现。当湍流发生在心脏时,产生的声音称为杂音(murmur);发生在血管时则称为血管杂音(bruit)。在严重贫血患者中,常可检测到功能性心脏杂音(非结构性异常引起的杂音)。此类杂音的物理基础是:(1) 贫血时血液黏度降低;(2) 贫血患者通常存在高心输出量相关的高流速。血栓在湍流中比在层流中更易形成。在心脏瓣膜病手术治疗中使用人工瓣膜的一个问题是:血栓可能在人工瓣膜周围形成,脱落后可能阻塞关键血管。因此,设计此类瓣膜时必须避免湍流,并在治疗方案中纳入抗凝剂。
临床知识
在某些动脉疾病(尤其是高血压)中,血管内皮下层易发生局部变性,内皮细胞小区域可能失去正常支撑。动脉壁受到的黏滞力可能使正常支撑区与无支撑区内皮之间产生撕裂,血液则通过内皮裂隙从管腔流入动脉各层之间。这种病变称为夹层动脉瘤(dissecting aneurysm),最常发生于主动脉近端,病情极其凶险。该部位易发此病的原因之一是血流速度高,导致内皮壁处剪切速率值较大。血管壁剪切应力还影响许多其他血管功能,如大分子通过血管壁的通透性、内皮细胞的生化活性、血液有形成分的完整性以及血液凝固过程。内皮壁剪切应力的增加也是血管内皮细胞释放一氧化氮(NO)的有效刺激因素,而 NO 是强效血管舒张剂(见"微循环与淋巴系统"章节)。
血液的流变特性
对于特定牛顿流体(Newtonian fluid)而言,在给定温度下其粘度在广泛的管径尺寸和流速范围内保持恒定。然而,对于血液这类非牛顿流体(non-Newtonian fluid),粘度可能随管径尺寸和流速发生显著变化。因此,"粘度"这一术语对血液并无唯一确定的含义。"表观粘度(apparent viscosity)"常用于表示特定测量条件下获得的血液粘度值。
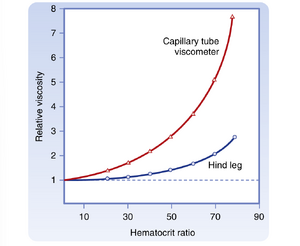
从流变学角度,血液是成型元素(formed elements)(主要是红细胞)悬浮于相对均质的液体(血浆)中所形成的悬浊液。由于血液是悬浊液,其表观粘度会随血细胞比容(hematocrit)(红细胞体积与全血体积的比值)变化。血浆粘度是水的1.2至1.3倍。图17.7中上方的曲线显示,正常血细胞比容比值(45%)血液的表观粘度是血浆的2.4倍。严重贫血时血液粘度较低。随着血细胞比容增加,曲线斜率逐渐增大;在红细胞浓度较高范围内,斜率变化尤为显著(见图17.7)。
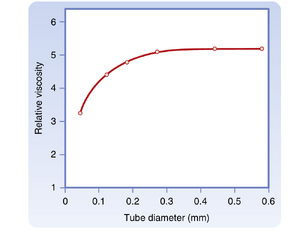
对于任何给定的血细胞比容,血液表观粘度取决于测量所用管道的尺寸。图17.8显示当管径减小至约0.3毫米以下时,血液表观粘度持续降低。具有最大血流阻力的血管(微动脉(arterioles))管径远小于该临界值,这种现象反而降低了高阻力血管中的血流阻力。管径对表观粘度的影响部分源于血液流经小管时成分的实际变化:红细胞倾向于聚集在流速更快的中心流层,而血浆则多分布于流速较慢的边缘层。由于血流中心区域红细胞比例更高且流速更快,红细胞通过管道的时间短于血浆。此外,小血管中的血细胞比容值低于大动脉或静脉中的血液。
当血液以正常速率流动时,负责使红细胞(erythrocytes)向轴流迁移并远离血管壁的物理力尚未完全明确。一个重要因素是红细胞的高度柔韧性。在微循环等低流速条件下,刚性颗粒不会向管腔中央轴迁移,而柔性颗粒会。剪切速率(shear rate)的增加会增强柔性颗粒在管腔中央轴附近的聚集。
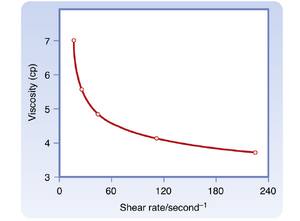
血液的表观粘度(apparent viscosity)随剪切速率增加而降低(图17.9),这种现象称为剪切稀化(shear thinning)。流体流量越大,相邻流体层之间的剪切速率也越大。在较高流速下红细胞更易聚集于轴向层,这是这种非牛顿行为(non-Newtonian behavior)的部分原因。然而更重要的因素是:在极低流速下,悬浮细胞倾向于形成聚集体,这种聚集会增加血液粘度。随着流速增加,这种聚集减少,血液表观粘度也随之降低(见图17.9)。
红细胞在低流速下的聚集倾向取决于血浆中大分子蛋白质(尤其是纤维蛋白原(fibrinogen))的浓度。因此当纤维蛋白原浓度较高时,血液粘度随流速变化的程度更为显著。
此外在低流速下,白细胞(leukocytes)倾向于粘附于微血管内皮细胞,从而增加血液的表观粘度。
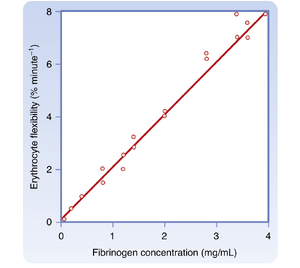
红细胞的变形能力(deformability)也是剪切稀化的影响因素,尤其在血细胞比容(hematocrit)较高时。人类红细胞的平均直径约7μm,但能通过直径仅3μm的孔隙。当高密度红细胞血液以逐渐增大的速率流动时,红细胞会发生越来越明显的形变。这种形变降低了血液的表观粘度。血浆纤维蛋白原浓度升高可增强人类红细胞的柔韧性(图17.10)。若红细胞硬化(如某些球形红细胞性贫血(spherocytic anemias)时),剪切稀化效应可能减弱。
动脉系统
动脉弹性
体循环与肺循环动脉系统将血液输送至全身毛细血管床。小动脉(arterioles)是该系统中的高阻力血管,负责调节不同毛细血管床的血流分配。主动脉、肺动脉及其主要分支的血管壁含有大量弹性蛋白,使得这些血管具有高度可扩张性(即顺应性,compliant)。这种扩张性能够缓冲心脏间断泵血产生的血流脉动特性。当心室在收缩期射血时,这些血管扩张;在舒张期,它们回弹并推动血液向前流动(图17.11)。因此心脏的间断性射血被转化为通过毛细血管的稳定血流。
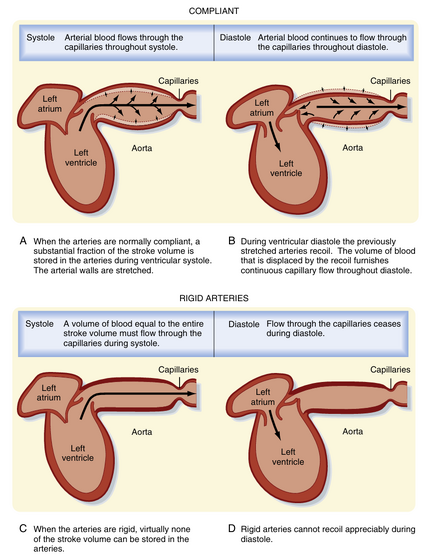
大动脉的弹性特性还能减少心脏作功。若这些动脉具有刚性而非顺应性,收缩期压力将急剧升高。这种压力升高会迫使心室对抗更大的负荷(即后负荷,afterload),从而增加心脏作功。而实际上当血液射入这些血管时,血管扩张使得收缩压的增幅减小,进而降低心脏作功。
临床意义
随着年龄增长,大动脉中的弹性蛋白含量减少并被胶原蛋白取代。这会导致动脉顺应性降低(图17.12)。因此,随着年龄增长,收缩压升高,收缩压与舒张压之间的差值(称为脉压,pulse pressure,将在下一节详述)也随之增大。
动脉血压的决定因素
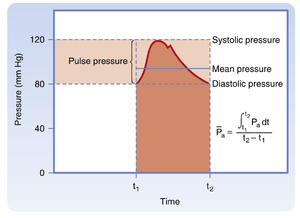
临床上常规测量患者动脉血压,这为评估心血管状态提供了有效依据。动脉血压可定义为(Pa拔)(时间平均压力),以及在心动周期中的收缩压(最高值)和舒张压(最低值)(图17.13)。收缩压与舒张压的差值称为脉压。
动脉血压的决定因素可人为划分为"物理性"和"生理性"因素。两个物理性因素(即流体力学特性)包括动脉系统内的液体容积(即血容量)和系统的静态弹性特性(顺应性)。生理性因素则包括心输出量(等于心率×每搏输出量)和外周阻力。
平均动脉压
要估算动脉血压描记曲线中的平均动脉压(Pa),需将压力曲线下的面积除以相应的时间间隔(见图17.13)。此外,也可通过收缩压(Ps)和舒张压(Pd)的测量值,使用以下公式近似计算Pa:
公式17.14:Pa = Pd + (Ps-Pd)/3
【译注:原文这里写错了,予以更正】
需注意Pa仅取决于两个物理因素:动脉系统的平均血容量和动脉顺应性(arterial compliance)(图17.14)。动脉血容量(\mathrm{{V}_{a}})则取决于心脏向动脉的流入速率(\mathrm{Q_{h}},即心输出量)以及通过阻力血管的流出速率(Q_{r},即外周流出量)。这些关系可用数学公式表示为:
公式17.15:dVa/dt = Qh - Qr
• 图 17.12 不同年龄组人类(曲线右端数字表示年龄组)尸检获得的主动脉压力-容积关系。注意顺应性(ΔV/ΔP)随年龄增长而降低。(改绘自 Hallock P, Benson IC. \mathcal{J} Clin Invest. 1937;16:595.)
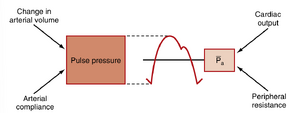
式中\mathrm{{dV_{a}/d t}}为单位时间内动脉血容量的变化量。若Q_{\mathrm{h}}大于Q_{r},则动脉血容量增加,动脉壁进一步扩张,压力上升;反之,当Q_{r}大于Q_{\mathrm{h}}时,则出现相反的变化。当Q_{\mathrm{h}}等于Q_{r}时,P_{\mathrm{a}}保持恒定。因此,心输出量增加会升高Pa,外周阻力增加同样会升高Pa。相反,心输出量或外周阻力降低会减小Pa。
动脉脉搏压为收缩压与舒张压之差。它主要取决于一个生理因素——每搏输出量(stroke volume),该因素决定了心室收缩期动脉血容量(物理因素)的变化。这一物理因素与另一个物理因素(动脉顺应性)共同决定了动脉脉搏压(见图17.14)。
每搏输出量
如前所述,平均动脉压(Pa)取决于心输出量和外周阻力。在收缩期的快速射血期,进入动脉系统的血液量超过通过小动脉流出系统的血量。因此动脉压力和血容量达到峰值;此时的峰值动脉压力即为收缩压。在心动周期的剩余阶段(即心室舒张期),心脏射血停止,外周流出量此时远超心脏射血量。由此导致的动脉血容量减少使得压力降至最低值,即舒张压。图17.15展示了当动脉顺应性恒定时,每搏输出量对脉压的影响。
动脉顺应性
动脉顺应性(\mathrm{C_{a}})是血容量与平均血压的比值(见公式19.1),也会影响脉压。这种关系如图17.16所示。当心输出量和总外周阻力(TPR)恒定时,动脉顺应性降低会导致脉压增加。即使两人每搏输出量、总外周阻力和动脉压(Pa)相等,动脉顺应性下降也会增加左心室的工作负荷(即增加后负荷)。
• 图17.15 在动脉顺应性于压力-容量范围内保持恒定的系统中,每搏输出量变化对脉压的影响。血容量增量较大时(即\mathsf{(V_{4}-V_{3})>(V_{2}-V_{1})}),平均血压(\cdot\overline{{\mathsf{P}}}_{\mathsf{B}}>\overline{{\mathsf{P}}}_{\mathsf{A}})和脉压均增大,因此(\mathsf{P}_{4}-\mathsf{P}_{3})>(\mathsf{P}_{2}-\mathsf{P}_{1})。
总外周阻力与动脉舒张压
如前所述,若心率和每搏输出量保持恒定,总外周阻力增加会导致Pa升高。当动脉顺应性恒定时,总外周阻力增加会引起收缩压和舒张压成比例升高,因此脉压保持不变(图17.17A)。然而动脉顺应性并非线性。随着Pa升高和动脉受到压力,顺应性会降低(见图17.17B)。由于动脉顺应性随Pa升高而降低,当Pa升高时脉压会增大。
临床意义
当动脉顺应性基本正常时,动脉脉压能为个体的每搏输出量(stroke volume)提供重要信息。患有严重充血性心力衰竭或大出血的患者,由于其每搏输出量异常减少,往往表现出极低的动脉脉压。相反,在主动脉瓣反流等每搏输出量增大的情况下,个体的动脉脉压通常会增加。同理,训练有素的运动员在静息状态下由于心率较低,心室充盈时间延长,往往具有较大的每搏输出量,因此其脉压也较大。
外周动脉压力曲线
左心室射血引起的升主动脉径向扩张会引发一个压力波,该压力波沿着主动脉及其分支传播。这种压力波的传播速度(约4-12米/秒)远快于血液本身的流动速度。正是这种压力波构成了通过触诊外周动脉可感知的"脉搏"。
• 图17.16 在给定容积增量(\mathsf{V}_{2}-\mathsf{V}_{1})下,动脉顺应性降低(顺应性B[低\mathrm{C_{a}}] < 顺应性A[高\underline{{\mathrm{C}}}_{\mathrm{a}}])会导致脉压升高,表现为(\mathsf{P}_{4}-\mathsf{P}_{1})>(\mathsf{P}_{3}-\mathsf{P}_{2})。\mathsf{P}_{\mathsf{a}}表示平均动脉压。
动脉顺应性对心肌能量消耗的影响
图17.18展示了僵硬的动脉系统所导致的心脏能量需求增加。图中数据显示,左心室输出的血液无论是通过自然路径(主动脉)还是通过硬质塑料管流向周围动脉,总外周阻力(TPR)值基本一致。实验结果表明,在任一给定每搏输出量下,当血液通过塑料管分流时,心肌耗氧量显著高于通过主动脉流动时的情况。这种耗氧量增加表明,左心室需要通过顺应性较差的管道泵血时需要消耗更多能量。
• 图17.17 当动脉系统压力-容积曲线呈直线(A)或曲线(B)时,相同外周阻力变化对脉压(P)影响的比较。两种情况下动脉容积增量相等,即(\mathsf{V}_{4}-\mathsf{V}_{3})=(\mathsf{V}_{2}-\mathsf{V}_{1})。
• 图17.18 麻醉犬心肌耗氧量(1mL/100\mathrm{g}/\mathrm{beat})与每搏输出量(毫升)的关系,其心输出量可由左心室通过主动脉或硬质塑料管泵入外周动脉。(改编自Kelly RP, Tunin R, Kass DA. Circ Res. 1992;71:490.)
人类血压测量
最常用的血压测量方法是通过血压计(sphygmomanometer)进行间接评估。在医院重症监护室中,可通过将针头或导管插入患者外周动脉,利用应变计(strain gauge)直接测量动脉血压。当从手臂测量血压时,可通过触诊腕部桡动脉(radial artery)估算收缩压(触诊法)。当袖带压力超过收缩压水平时,无法感知脉搏。当压力略低于收缩压水平时(图17.20A),在收缩期峰值时会有少量血液通过袖带下方的肱动脉(brachial artery),此时可在腕部感受到轻微脉搏。
临床关联
在慢性高血压(chronic hypertension)患者中,其特征为总外周阻力(TPR)持续升高,动脉压力-容积曲线类似于图17.17B所示。由于当动脉压(\mathsf{P}_{\mathrm{a}})升高时动脉顺应性(arterial compliance)显著降低,TPR的增加会导致收缩压比舒张压升高更明显。此类患者的舒张压虽会升高,但通常不超过平均正常水平80 mm H₉的10至40 mm Hg。然而,收缩压常比平均正常水平120 mm Hg升高50至100 mm Hg。
压力波的传播速度与动脉顺应性成反比。一般而言,传播速度随年龄增长而增加,这证实了动脉随年龄增长顺应性降低的观察结果。当脉搏波从升主动脉向周围传递时,其速度也逐渐增加。这种速度的增加反映了动脉系统远端部分比近端部分的血管顺应性更低。
随着压力波沿动脉系统传递,\mathsf{P}_{\mathrm{a}}波形会发生畸变。图17.19展示了人类动脉树压力波形的畸变程度与年龄和记录部位的关系。动脉脉搏高频成分的衰减主要由动脉壁的黏弹性特性(viscoelastic properties)引起。由于顺应性降低,老年人的脉搏压力波传播速度比年轻人更快。波反射与共振、血管逐渐变细以及压力引起的传播速度变化等因素共同导致\mathsf{P}_{\mathrm{a}}波的峰值形成。
听诊法(auscultatory method)是一种更灵敏、因而更精确的测量收缩压的技术,同时也可用于评估舒张压。操作者将听诊器置于肘前区皮肤表面覆盖肱动脉的位置进行听诊。当袖带压力超过收缩压时,肱动脉被完全闭塞,此时听不到任何声音(见图17.20B)。当充气压力刚降至收缩压水平以下时(图17.20A中的120 mmHg),少量血液突破袖带闭塞压力,每次心搏均可闻及轻微的叩击音(称为Korotkoff音)。首次检测到声音时的压力即代表收缩压,通常与直接测量的收缩压高度吻合。
随着袖带充气压力持续下降,每次心搏时突破袖带的血量增加,声音也随之增强。当充气压力接近舒张压水平时,Korotkoff音变得低沉。当充气压力刚降至舒张压水平以下时(图17.20A中的80 mmHg),声音完全消失,此时的压力读数即为舒张压。Korotkoff音的产生与血液通过袖带下方时的间断性喷射有关,这些喷射的血流遇到袖带远端的静态血柱时,产生的冲击和湍流引发可闻及的振动。一旦充气压力低于舒张压,肱动脉血流恢复连续性,此时不再能听到声音(见图17.20C)。
• 图17.19 不同年龄段人体动脉树各部位记录的脉压曲线。24岁个体的动脉脉搏在沿动脉树下行过程中,脉压幅度和波形轮廓发生显著变化。68岁个体的脉压波则显示较小的增幅,且随脉搏传导变化较小,这与反射波减少有关。(经Hodder Education许可复制,引自Nichols WW, O’Rourke M主编《McDonald's Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles》第5版,伦敦:Arnold出版社;2005年。)
临床专栏
踝肱指数(ankle-brachial index, ABI)是踝部(足背动脉)与肱动脉收缩压的比值。通过简单测量获得的ABI可作为外周动脉疾病的潜在指标,同时也有研究提出ABI可作为心脑血管疾病风险的预测因子。ABI比值正常(1.1-1.4)的人群,其冠心病或脑血管事件发生率低于比值≤0.9者。此外,随着ABI随时间推移的升高,心血管疾病发病率和死亡率也相应增加。
静脉系统
容抗与阻抗
静脉系统
静脉是循环系统中将血液从组织输送回心脏的组成部分。此外,静脉构成了一个巨大的储血库,可容纳循环中高达70%的血液。静脉的储血功能使其能够调节返回心脏的血量(即前负荷(preload)),从而在心脏输出量改变时满足机体需求(见第19章)。这种高顺应性(compliance)是静脉的重要特性。
毛细血管后微静脉中的静水压约为20毫米汞柱(mmHg),而在胸腔腔静脉(venae cavae)和右心房中降至约0 mmHg。胸腔腔静脉和右心房的静水压也被称为中心静脉压(central venous pressure)。静脉具有高度可扩张性,对血流阻力极低。这种低阻力使得血液从外周静脉回流至心脏时,中心静脉压仅需轻微下降。此外,静脉通过调节毛细血管后阻力(见"静水压作用"章节)控制滤过和重吸收过程,并参与体位变化时的心血管调节。
静脉参与这些多种功能的能力取决于其扩张性(即顺应性(compliance))。静脉顺应性随身体位置而变化,下肢静脉的顺应性低于心脏水平或更高位置的静脉。下肢静脉壁也较脑部或上肢静脉更厚。与动脉类似,静脉顺应性随年龄增长而降低,血管壁增厚的同时伴随弹性蛋白减少和胶原含量增加。
静脉回流的调节通过以下机制实现:静脉张力调节、呼吸活动调节(见第19章)以及体位性应激或重力作用。
• 图17.20 A至C,使用血压计测量动脉血压
重力作用
重力会影响静脉系统中的血容量,因此可能显著影响心脏输出。例如,长时间立正的士兵可能因重力导致血液淤积于下垂部位的血管而发生晕厥,这会降低心输出量。环境温度升高会干扰代偿性血管运动反应,而肌肉活动的缺失会加剧这些效应。
飞行员在进行俯冲改出机动时,重力效应会被放大。此时足部方向的离心力可能达到重力的数倍。在改出机动过程中,飞行员会特征性地出现短暂黑视现象,这是由于血液从头部区域被引流并淤积于身体下部所致。
临床相关知识
某些用于治疗慢性高血压(chronic hypertension)的药物会干扰站立时的反射性调节机制。类似地,暴露于失重状态的宇航员在太空数日后会丧失对重力的适应能力,当他们首次返回地球时会经历显著的生理困难。当这类宇航员或其他反射调节受损者站立时,其血压可能出现显著下降。这种反应称为体位性低血压(orthostatic hypotension),可能导致头晕或昏厥。
肌肉活动与静脉瓣膜
当仰卧者站立但保持静止时,身体下垂区域的静脉压力会升高(图17.21)。下肢的Pv逐渐增加,直到开始站立近1分钟后才达到平衡值。这种Pv上升的缓慢特性可归因于仅允许血流向心脏方向的静脉瓣膜(venous valves)。当人体站立时,瓣膜阻止静脉中的血液向足部下坠。因此,静脉血柱被这些瓣膜在多个水平面上支撑。由于这些瓣膜的存在,静脉血柱可被视作由许多不连续节段组成。然而,血液持续从许多微静脉和小属支静脉进入血柱,压力持续上升。一旦某节段的压力超过其上方相邻节段,中间的瓣膜即被推开。最终所有瓣膜开放,血柱形成连续整体。
血流动力学效应与代偿机制
这种静脉扩张(静脉淤积,venous pooling)的血流动力学效应类似于等量血液从体内流失所产生的影响。当成人从仰卧位转为放松站立位时,300至800~mL血液会淤积于下肢。这种淤积可使心输出量(cardiac output)减少约2\mathrm{L}/分钟。为适应站立姿势的代偿性调节机制与失血后的调节机制相似(另见第19章):
通过反射作用使心率加快、心肌收缩力增强。此外,微动脉和静脉均发生收缩;其中微动脉的收缩程度大于静脉。
对重力致心输出量降低理论的辨析
虽然已有若干解释试图说明重力导致心输出量降低的现象,但这些解释并不准确。例如,有观点认为当个体站立时,重力会阻碍身体下垂区域的静脉回心血量。这种解释并不完整,因为它未考虑同一血管环路动脉侧的重力反作用力(gravitational counterforce),而这种反作用力实际上促进静脉回流。此外,该解释未考虑重力导致静脉淤积(venous pooling)的效应。当人体直立时,重力使血液在下肢蓄积并导致动静脉扩张。由于静脉顺应性(venous compliance)远大于动脉顺应性(arterial compliance),这种扩张在静脉侧的表现比动脉侧更为显著。
精确测量表明,静息站立时足部最终的Pv仅略高于从右心房延伸至足部的静态血柱压力。这一发现表明,血液从足静脉流向右心房所引起的压降非常微小。由于这种极低的阻力,在第19章所阐述的循环系统模型中,所有静脉可被视为具有共同的静脉顺应性(venous compliance)。当个体从静息站立转为行走时,下肢的Pv显著降低(见图17.21)。由于收缩的腿部肌肉对静脉产生的间歇性压迫作用,以及静脉瓣膜的功能运作,血液被从静脉压向心脏。因此,肌肉收缩降低了下肢的平均Pv,起到了辅助泵的作用。此外,肌肉收缩可防止静脉淤血并降低毛细血管静水压。通过这种方式,肌肉收缩减少了站立期间水肿液在足部积聚的趋势。
微循环与淋巴系统
循环系统为组织提供的血流量需满足机体对\mathrm{O}_{2}和营养物质的需求。由单层内皮细胞构成的毛细血管壁,允许气体、水和溶质与组织液快速交换。作为主要阻力血管的肌性小动脉,可调节毛细血管床的局部血流量。微静脉和静脉主要作为收集通道和储血容器。淋巴系统由淋巴管、淋巴结和淋巴组织组成。该系统收集从血液逸出的液体和蛋白质,并将其运回静脉进行血液再循环。本节将详细探讨人体最小的血管网络以及淋巴管系统。
临床视角
正常个体坐立时,颈部的浅表静脉通常处于部分塌陷状态。头部的静脉回流主要通过较深的颈静脉完成,这些静脉因与周围结构相连而避免塌陷。当中心静脉压异常升高时,颈部浅表静脉会扩张,即使患者坐立时也不会塌陷。这种颈静脉扩张是充血性心力衰竭的重要临床体征。
临床视角
对于腿部患有varicose veins的患者,骨骼肌收缩产生的辅助泵机制效能显著降低。这些病变静脉中的瓣膜功能异常,因此当腿部肌肉收缩时,静脉中的血液会同时向逆流和顺流方向流动。因此当varicose veins患者站立或行走时,踝部和足部的\mathsf{P}_{\mathsf{v}}会异常升高。由此产生的高毛细血管压导致水肿液在踝部和足部积聚。
微循环
微循环
微循环(microcirculation)是指血液通过机体最小血管的循环系统,包括微动脉、毛细血管和微静脉。微动脉(直径5-100 μm)具有较厚的平滑肌层、较薄的外膜层和内皮衬里(见图15.2)。微动脉直接分支形成毛细血管(直径5-10 μm),或在某些组织中先形成后微动脉(metarterioles)(直径10-20 μm),再由此分出毛细血管(图17.22)。后微动脉可绕过毛细血管床直接连接微静脉,也可直接连接毛细血管床。直接分支形成毛细血管的微动脉通过收缩或舒张来调控通过这些毛细血管的血流。毛细血管形成相互连接的管网,平均长度为0.5-1 mm。
• 图17.21 人类受试者在静立、行走和跑步时足部静脉的平均压力(±95%置信区间)。(From Stick C, et al. \mathcal{J} Appl Physiol. 1992;72:2063.)
• 图17.22 微循环结构的复合示意图。微动脉和微静脉上的环形结构代表平滑肌纤维,分支实线代表交感神经纤维。箭头指示血流方向。AV,动静脉。
毛细血管的功能特性
在代谢活跃的器官(如心脏、骨骼肌和腺体)中,毛细血管密度较高。在活性较低的组织(如皮下组织或软骨)中,毛细血管密度较低。毛细血管直径也存在差异:某些毛细血管的直径小于红细胞直径。红细胞通过这些微小血管时需要暂时变形。正常红细胞具有极好的柔韧性。
毛细血管中的血流主要取决于微动脉的收缩状态。毛细血管内血流平均速度约为1 mm/秒,但同一血管内的流速可在短时间内从零波动至数毫米/秒。这些血流变化可能呈随机性或节律性。毛细血管的节律性振荡行为由毛细血管前血管(即微动脉和小动脉)的收缩与舒张(血管舒缩,vasomotion)引起。
血管运动(Vasomotion)
血管运动是血管平滑肌的固有收缩行为,不依赖于外部输入。跨壁压(transmural pressure)(血管内压减去血管外压)的变化也会影响毛细血管前血管的收缩状态。跨壁压的升高(由Pv升高或小动脉扩张引起)会导致终末小动脉收缩。跨壁压降低则会引起毛细血管前血管舒张。体液因素和可能的神经因素也会影响血管运动。例如,当跨壁压升高导致毛细血管前血管收缩时,这种收缩反应可能被代谢性(体液)因素所抑制,从而消除血管运动。当实质组织的\mathrm{O}_{2}供应无法满足需求时(如运动中的骨骼肌),这种效应就会发生。
尽管跨壁压降低可使终末小动脉舒张,但若血管内压的降低是由于上游微血管的强烈收缩引起的,则毛细血管的血流量仍无法增加。大动脉和小动脉(metarterioles)也表现出血管运动。然而,它们的收缩通常不会完全闭塞管腔或阻断血流,而终末小动脉的收缩可能完全阻断血流。因此,毛细血管的血流量可通过小动脉、微动脉和小动脉的收缩与舒张进行调节。
流经毛细血管的血流被称为营养性血流(nutritional flow),因为它负责血液与组织间的气体和溶质交换。相反,通过小动脉从动脉侧直接绕开毛细血管流向静脉侧的血流被称为非营养性血流(nonnutritional flow)或分流(shunt flow)(见图17.22)。在身体某些部位(如指尖、耳朵),存在真正的动静脉分流(AV shunt)(见图17.37)。然而,在肌肉等许多组织中,解剖学意义上的分流并不存在。即使没有这些分流,非营养性血流仍可能发生。在具有小动脉的组织中,当代谢活动较低(此时许多毛细血管前血管处于关闭状态)时,非营养性血流可能持续从微动脉流向小静脉。当这些组织的代谢活动增强时,更多毛细血管前血管开放以允许毛细血管灌注。
真正的毛细血管缺乏平滑肌,因此无法主动收缩。然而,构成毛细血管壁的内皮细胞含有肌动蛋白(actin)和肌球蛋白(myosin),可响应某些化学刺激改变自身形状。
由于毛细血管管腔狭窄(即半径小),其薄壁能够承受较高的内压而不破裂。这一特性可通过皮埃尔-西蒙·拉普拉斯定律(law of Pierre-Simon Laplace)解释:
公式17.16
$$
\mathrm{T}=\Delta\mathrm{Pr}
$$
其中: \mathrm{T}= 血管壁张力 \DeltaP= 跨壁压差 \mathrm{~\bf~r~}= 血管半径
临床知识
拉普拉斯方程适用于极薄壁的血管(如毛细血管)。管壁张力(wall tension)对抗使血管理论纵裂口扩张的分离力(\Delta\mathrm{Pr})(图17.23)。活体血管的跨壁压实质上等于管腔内压,因为血管外压通常可忽略不计。计算管壁张力时,需将mmHg单位的压力通过公式\mathrm{P=h\rhog}转换为达因每平方厘米,其中^\mathrm{h}为汞柱高度(厘米),\uprho为汞的密度(\mathrm{g}/\mathrm{cm}^{3}),^\mathrm{g}为重力加速度(\mathrm{cm}/\mathrm{s}^{2})。对于压力为25mmHg、半径为5\times10^{-4}~\mathrm{cm}的毛细血管,其压力(2.5 \mathrm{cm~Hg}\times13.6~\mathrm{g}/\mathrm{cm}^{3}\times980~\mathrm{cm}/\mathrm{sec}^{2})为3.33\times10^{4} \mathrm{dyne/cm}^{2},此时管壁张力为16.7\mathrm{dyne/cm}。对于压力100mmHg、半径1.5\mathrm{cm}的主动脉,其管壁张力为2\times10^{5} dyne/cm。因此,在主动脉和毛细血管的正常压力下,主动脉管壁张力约为毛细血管的12,000倍。人体静立时,足部毛细血管压可达100mmHg。即使在此条件下,毛细血管管壁张力的增加量仍仅为相同内压下主动脉管壁张力的三千分之一。
• 图17.23 小血管示意图说明拉普拉斯定律。T=P r,其中P=管腔内压,r=血管半径,T=管壁张力(即沿血管壁切线方向单位长度的力)。管壁张力防止血管理论纵裂口的破裂。
阻力血管(微动脉)的直径由血管平滑肌收缩力与管腔内压产生的扩张力之间的平衡决定。微动脉血管平滑肌收缩活动越强,其直径越小。在微小动脉中,收缩可持续至血管完全闭塞。闭塞由内皮内折和血管内血细胞滞留引起。
随着血管内压逐渐降低,血管直径减小(根据拉普拉斯定律,管壁张力也随之降低),即使微动脉内压仍高于组织压,血流最终仍会停止。导致血流停止的压力称为临界闭合压(critical closing pressure),其机制尚未明确。当血管交感神经活动受抑制导致血管运动活性降低时,临界闭合压下降;当血管交感神经纤维激活使血管运动张力增强时,临界闭合压升高。
毛细血管内皮的血管活性作用
内皮是引起血管平滑肌收缩或舒张物质的重要来源。其中一种物质是前列环素(prostacyclin),又称前列腺素I2(PGI2)。PGI2可通过增加环磷酸腺苷(cyclic adenosine monophosphate, cAMP;图17.24)使血管平滑肌松弛。PGI2由内皮细胞中的花生四烯酸生成,该过程由PGI2合酶催化。触发PGI2合成的机制尚不清楚,但血流加速引起的剪切应力增加可能促进其释放。PGI2的主要功能是抑制血小板黏附于内皮和血小板聚集,从而预防血管内血栓形成。PGI2也能引起血管平滑肌松弛。
在内皮介导的血管舒张中更为重要的是内皮源性舒张因子(endothelium-derived relaxing factor,见图17.24)的组成成分——一氧化氮(nitric oxide, NO)的生成与释放。当内皮细胞受到乙酰胆碱或其他血管舒张剂(如三磷酸腺苷[ATP]、缓激肽、5-羟色胺、P物质、组胺)刺激时,NO被释放。这些物质在缺乏内皮的血管中不会引起血管舒张。NO(由L-精氨酸合成)通过激活血管平滑肌中的鸟苷酸环化酶,增加环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)的浓度,后者通过降低肌丝对\left[\mathrm{Ca^{++}}\right]的敏感性而产生舒张作用。血流对内皮的剪切应力可刺激NO释放。药物硝普钠(nitroprusside)可直接作用于血管平滑肌增加cGMP,其作用不依赖内皮介导。腺苷、\mathrm{H^{+}}、\mathrm{CO}_{2}和\mathrm{K^{+}}等血管舒张物质可能从实质组织释放,并局部作用于阻力血管(见图17.24)。
AT THE CELLULAR LEVEL
(注:原文中公式及专业术语已按规范保留未译。首次出现术语后标注英文原文。物种名、学名、药物名及文献标注均维持原格式。)
毛细血管内皮的被动作用
跨毛细血管交换
溶剂和溶质通过三种过程穿过毛细血管内皮壁:扩散、滤过和胞饮作用。扩散是跨毛细血管交换最重要的过程,胞饮作用最不重要。
扩散 正常情况下,每100克组织每分钟仅有约0.06mL水因滤过作用穿过毛细血管壁。相比之下,每100克组织每分钟有300~mL水通过扩散穿过毛细血管壁。因此,扩散是为毛细血管与组织细胞之间提供气体、底物和代谢产物交换的关键因素。
扩散过程由菲克定律描述(另见第1章):
公式 17.17
$$
\mathrm{J=-DA(\Delta C/\Delta x)}
$$
其中
方程 17.18
$$
\mathrm{J=-PS\big(C_{\mathrm{o}}-C_{\mathrm{i}}\big)}
$$
其中
P= 物质对毛细血管的通透性 \mathrm{S}= 毛细血管表面积 $\mathrm{C_{\mathrm{{o}}}=$ 毛细血管外物质浓度 $\mathrm{C_{i}=}$ 毛细血管内物质浓度
PS乘积为可用毛细血管表面积提供了便捷的表达方式,因为在生理条件下,毛细血管的固有通透性很少发生显著改变。然而在病理状态下(如蜜蜂蜇伤),毛细血管通透性可能发生改变。
在毛细血管中,脂不溶性分子的扩散仅限于充水通道或孔隙。溶质通过毛细血管内皮的移动过程复杂,涉及溶质与溶剂分子间吸引力的校正、溶质分子间的相互作用、孔隙构型,以及与内皮细胞电荷相关的分子电荷关系。此类溶质运动并非简单的分子随机热运动沿浓度梯度下降的过程。对于水、NaCl、尿素和葡萄糖等小分子,毛细血管孔隙对其扩散的限制极小(即具有低反射系数(reflection coefficient);参见“渗透力”一节)。这些物质的扩散速度极快,因此穿过毛细血管内皮的平均浓度梯度极小。脂不溶性分子越大,其通过毛细血管的扩散受限越明显。当分子量超过约60,000时,扩散作用最终可忽略不计。对于小分子而言,穿过毛细血管壁的净移动唯一限制因素是血流将分子运输至毛细血管的速率。这类分子的运输被称为流量限制性(flow limited)。
对于流量限制性小分子,血液中该分子的浓度在靠近毛细血管从母小动脉起源处的位置即与组织间液中的浓度达到平衡(图17.25A)。在毛细血管动脉端附近,其浓度降至可忽略水平。若血流量较大,该小分子仍可存在于毛细血管下游较远处。稍大的分子在血液中浓度降至不显著水平前,会沿毛细血管移动更远距离。此外,进入毛细血管动脉端但无法通过毛细血管孔隙的更大分子数量等于离开毛细血管静脉端的分子数量(见图17.25A)。
• 图17.25 毛细血管(Cap)向组织运输的流动受限与扩散受限机制。A,流动受限运输。最小的水溶性惰性示踪颗粒(蓝点)在仅沿毛细血管下行很短距离后即可达到可忽略的浓度。具有相似性质的较大颗粒(棕点)在沿毛细血管行进更远距离后,其毛细血管内浓度才会降至不显著水平。两种物质均可穿过间质液(ISF)到达实质组织(细胞)。由于体积差异,较小颗粒被组织细胞摄取更多。最大颗粒(红圈)无法穿透毛细血管孔隙,因此除通过胞饮囊泡运输外,不能逃离毛细血管管腔。增加血流量或毛细血管密度可提高可扩散溶质的组织供应量。需注意,由于静脉端毛细血管(以及微静脉,未显示)孔隙数量更多,该区域毛细血管通透性更高。B,扩散受限运输。当因水肿或低毛细血管密度导致毛细血管与实质组织间距增大时,即使毛细血管流速较高,扩散仍会成为溶质从毛细血管向组织运输的限制因素。
对于大分子物质而言,跨毛细血管的扩散成为限制因素(扩散受限),即毛细血管对大溶质分子的通透性限制了其跨血管壁运输。小分子脂不溶物质的扩散速度极快,仅当毛细血管与实质细胞间距离较大时(如组织水肿或毛细血管密度极低;见图17.25B),扩散才会限制血液-组织交换。
脂溶性分子跨毛细血管壁的运动不仅限于毛细血管孔隙(仅占毛细血管表面积的≈0.02%),还可直接通过整个毛细血管内皮层的脂质膜进行。因此,脂溶性分子在血液与组织间快速移动。脂溶程度(油水分配系数)可良好反映脂分子通过毛细血管内皮层的难易程度。
O₂和CO₂均为脂溶性物质,可轻易通过内皮细胞。基于以下参数的计算结果:(1)O₂的扩散系数,(2)毛细血管密度与扩散距离,(3)血流量,(4)组织氧耗量,表明正常组织在静息状态和活动状态下的氧供应不受扩散或开放毛细血管数量的限制。
微血管气体交换与毛细血管过滤
微血管中氧气分压(\mathrm{Po}_{2})和血液氧饱和度的测量表明,由于氧气从小动脉(arterioles)和微动脉扩散,许多组织毛细血管入口处的氧饱和度已降至约80%。此外,二氧化碳的装载及其引发的氧解离曲线血管内偏移现象也发生在毛细血管前血管中。因此,除了毛细血管处的气体交换,氧气和二氧化碳还直接在相邻的小动脉和小静脉之间(可能还包括动静脉之间)进行交换(逆流交换,countercurrent exchange)。这种逆流交换形成气体绕过毛细血管的扩散性分流;在低血流速率时,这种分流可能限制组织供氧。
毛细血管过滤
毛细血管内皮膜的通透性并非均质。例如,肝毛细血管的通透性相当高,白蛋白从其中逸出的速率比通透性较低的肌肉毛细血管高数倍。此外,通透性沿毛细血管纵长方向也存在差异:静脉端比动脉端通透性更高,而小静脉的通透性最大,这归因于该区域孔隙数量更多。
过滤作用发生于何处?部分水分子通过毛细血管内皮细胞膜,但大部分通过毛细血管内皮壁的孔隙(图17.26和17.27)。骨骼肌和心肌毛细血管的孔隙直径约为4~\mathrm{nm}。心肌相邻内皮细胞之间存在裂隙,最狭窄处的间隙约4~\mathrm{nm}。这些裂隙(孔隙)分布稀疏,仅占毛细血管表面积的约0.02%。脑毛细血管无孔隙存在,此处血脑屏障可阻挡许多小分子物质进入。
• 图 17.26 A,小鼠心室毛细血管横截面的电子显微照片。管腔直径约为4\upmu\mathrm{m}。在此截面中,毛细血管壁由单个内皮细胞(Nu,内皮细胞核)构成。毛细血管周围薄层间隙被周细胞(P C)和结缔组织(CT)细胞("成纤维细胞")占据,后者与自身形成功能复合体(箭头)。V,质膜囊泡。B,图A中内皮细胞细节显示附着于内皮细胞表面的质膜囊泡(V)。这些囊泡在血管内皮中尤为突出,参与物质跨血管壁的运输。注意复杂的肺泡状囊泡(星号)。BM,基底膜。C,小鼠心脏毛细血管中的连接复合体。这类小血管中通常形成"紧密"连接(T J),表现为相邻内皮细胞表面膜的融合。D,乳头肌中肌性动脉的内皮间连接。虽然这类大血管中也存在类似毛细血管的紧密连接,但动脉内皮中常出现类似心肌细胞间闰盘缝隙连接(G J)的广泛连接(示例见\cal G J)。
• 图 17.27 毛细血管横截面电子显微照片示意图。
除细胞间隙外,某些通透性较高的毛细血管(如肾脏和肠道中的毛细血管)含有20至100~\mathrm{nm}宽的窗孔结构,而其他毛细血管(如肝脏中的)则具有不连续内皮(见图17.27)。窗孔结构和不连续内皮允许过大而无法通过内皮细胞间隙的分子通过。
水分子跨毛细血管壁移动的方向和幅度可通过壁两侧静水压与渗透压的代数和来估算。毛细血管内静水压升高有利于液体从血管内向组织间隙移动,而血管内渗透活性颗粒浓度升高则有利于液体从组织间隙进入血管(图17.28)。
静水压作用 毛细血管内的静水压(血压)并非恒定。它取决于动脉和静脉压力,以及毛细血管前阻力(微动脉)和毛细血管后阻力(微静脉和小静脉)。动脉或静脉压力升高会提高毛细血管静水压,反之则降低。微动脉阻力增加或动脉关闭会降低毛细血管压力,而微静脉和静脉血流阻力增加则会升高毛细血管压力。
静水压是毛细血管滤过的主要驱动力。静脉压(Pv)的特定变化对毛细血管静水压的影响大于同等程度的动脉压(Pa)变化。静脉压升高的约80%会逆向传导至毛细血管。
• 图17.28 毛细血管壁滤过与吸收以及淋巴形成相关因素的示意图
毛细血管静水压(\mathrm{P_{c}})在不同组织中存在差异。通过人体皮肤直接测量获得的平均值显示:心脏水平处毛细血管动脉端约为32~\mathrm{mm}~\mathrm{Hg},静脉端约为15~\mathrm{mm}~\mathrm{Hg}(见图17.28)。如前所述,当人体站立时,下肢静水压升高而头部静水压降低。
组织压(更具体地说是毛细血管外的间质液压力(\mathrm{P_{i}}))会对抗毛细血管滤过。\mathrm{P_{c}}与\mathrm{P_{i}}之间的差值构成了滤过的驱动力。正常情况下\mathrm{P_{i}}接近零,因此\mathrm{P_{c}}本质上代表了静水驱动力。
渗透力 限制毛细血管液体流失的关键因素是血浆蛋白(如白蛋白)的渗透压。这种渗透压称为胶体渗透压(colloid osmotic pressure)或膨胀压(\pi_{\mathfrak{p}})。血浆总渗透压约为6000~\mathrm{mm}~\mathrm{Hg}(反映电解质、其他小分子及血浆蛋白的存在),而膨胀压仅约25~\mathrm{mm}~\mathrm{Hg}。这种低水平的膨胀压在毛细血管液体交换中起重要作用,因为血浆蛋白基本被限制在血管内空间,而电解质在毛细血管内皮两侧的浓度几乎相等。
溶质相对于水的渗透性会影响渗透压的实际大小。反射系数(\pmb{\upsigma})是物质通过毛细血管膜时所受相对阻力。水的反射系数为0,而白蛋白(内皮基本不可渗透)的反射系数为1。可过滤溶质的反射系数介于0到1之间。此外,不同组织对同一分子的反射系数不同,因此特定溶质穿过内皮壁的运动随组织类型而异。
血浆实际膨胀压(\pi_{\mathrm{p}})由以下方程定义(另见第1章):
公式17.19
$$
\pi_{\mathrm{p}}=\mathrm{{\upsigmaRTC}_{\mathrm{{p}}}
$$
式中: \upsigma=反射系数 R=气体常数 \mathrm{T}=开尔文温度 \mathrm{C_{\mathrm{p}}}=血浆溶质浓度
临床关联
长时间站立时,特别是伴随下肢静脉压(\mathsf{P_{v}})升高(如妊娠和充血性心力衰竭所致),毛细血管滤过量显著增加,超过淋巴系统从组织间隙清除滤出液的能力,从而导致水肿。
血浆蛋白浓度在多种病理状态下可能发生变化,从而改变渗透力和液体通过毛细血管膜的移动。脱水状态下(如禁水、长期出汗、严重呕吐、腹泻),血浆蛋白浓度会升高。在此情况下,通过渗透力从组织向血管腔转移的水分减少,从而导致组织液容量下降。相反,某些肾脏疾病中由于尿蛋白丢失,血浆蛋白浓度降低,可能引发水肿。其他因素(如肾脏远端肾单位对钠的重吸收增加)也可能参与典型伴随肾病综合征出现的水肿发生机制。
当毛细血管损伤范围广泛时(如严重烧伤),血管内液体和血浆蛋白会渗漏至受损组织的间质间隙。从血管腔逸出的蛋白质会增加组织液的胶体渗透压。这种毛细血管外增强的渗透力会导致额外的液体流失,并可能引发严重脱水。
流体静力与渗透力的平衡
流体静压与胶体渗透压之间的关系,以及这些力在调节液体通过毛细血管内皮转移中的作用,由Frank Starling于1896年阐明。这一关系构成了Starling假说。其数学表达式如下(另见第2章关于Starling力的讨论):
公式17.20
$$
Q_{\mathrm{f}}=\mathrm{k}\Big[\big(P_{\mathrm{c}}-P_{\mathrm{i}}\big)-\big(\pi_{\mathrm{p}}-\pi_{\mathrm{i}}\big)\Big]
$$
式中: Q_{\mathrm{f}}= 液体移动量 \mathrm{k}= 毛细血管膜滤过常数 \mathrm{P_{c}=} 毛细血管流体静压 \mathrm{P_{i}=} 组织液流体静压 \pi_{\mathrm{p}}= 血浆胶体渗透压 \pi_{\mathrm{i}}= 组织液胶体渗透压
当代数求和结果为正值时发生滤过,负值时则发生重吸收。
临床相关
在肺部,毛细血管平均静水压仅约8 mmHg(见第20章)。由于血浆胶体渗透压为25 mmHg,且肺组织间液压力约为15 mmHg,净作用力略微倾向于净吸收(即液体离开组织间隙)。尽管存在净吸收,肺淋巴仍会形成。这种淋巴由通过毛细血管内皮逸出的少量血浆蛋白从毛细血管渗透性抽吸的液体构成。在病理情况下,如左心室衰竭或二尖瓣狭窄,肺毛细血管静水压可能超过血浆胶体渗透压。此时可能引发肺水肿(pulmonary edema)——即过量液体在肺间质中积聚。这种液体蓄积会严重干扰肺内气体交换。
毛细血管滤过系数(Capillary Filtration Coefficient)。液体跨毛细血管壁移动速率(Q_f)不仅取决于跨内皮静水压与渗透压的代数和(ΔP),还与可用于滤过的毛细血管壁面积(A_m)、跨壁距离(Δx)、滤液黏度(η)及膜滤过常数(k)相关。这些因素可表达为:
公式 17.21
$$
Q_{\mathrm{f}}=\mathrm{kA}_{\mathrm{m}}\DeltaP/\upeta\Delta\mathrm{x}
$$
该表达式描述了液体通过膜孔的流动,本质上是通过管道的泊肃叶定律(Poiseuille’s law)。
由于毛细血管壁厚度和滤液黏度相对恒定,可将其纳入滤过常数k中。若毛细血管膜面积未知,滤过速率可按组织单位重量表示。因此方程可简化为:
公式 17.22
$$
\mathrm{Q_{f}=k_{t}\DeltaP}
$$
其中\mathbf{k}_{\mathrm{t}}表示特定组织的毛细血管滤过系数(capillary filtration coefficient),Q_{\mathrm{f}}的单位为毫升/分钟/100克组织。
在任何特定组织中,单位面积毛细血管表面的滤过系数(即毛细血管通透性)不会因生理状态(如小动脉舒张和毛细血管扩张)或病理状态(如缺氧、高碳酸血症或\mathrm{pH}降低)而改变。当毛细血管受损时(如毒素或严重烧伤),大量液体和蛋白质会从毛细血管渗漏到组织间隙。这种通透性增加表现为滤过系数的升高。
由于正常条件下毛细血管通透性恒定,滤过系数可用于评估开放毛细血管的相对数量(即组织中参与滤过的毛细血管表面积)。例如,骨骼肌收缩时代谢活动增强会使毛细血管前阻力血管舒张,从而开放更多毛细血管。这一过程称为毛细血管募集(capillary recruitment),可增加滤过表面积。
导致血管舒张代谢产物蓄积并使小动脉舒张。毛细血管前血管的舒张也可能由跨壁压降低引起(自身调节,见第18章)。因此吸收作用超过滤过作用,液体从组织间隙进入毛细血管。这些对出血的反应构成了机体恢复血容量的代偿机制之一(见第19章)。
单纯静脉压(Pv)升高(如人体直立时足部发生的情况)会提高毛细血管压并增强滤过。然而,跨壁压的增加会关闭毛细血管前血管(肌源性机制,见第18章),因此毛细血管滤过系数实际会降低。这种有效滤过表面积的减少可防止大量液体离开毛细血管进入组织间隙。
健康个体全身的滤过系数(\mathrm{k}_{\mathrm{t}})约为0.006毫升/分钟/100克组织/mm Hg。对于70公斤的男性,静脉压(Pv)升高10 mm Hg持续10分钟会使毛细血管滤过增加420毫升。由于淋巴管能将液体回输至血管腔,通常不会出现水肿。当发生水肿时,通常首先出现在身体下垂部位(此处静水压最大),但其位置和程度也受组织类型影响。疏松组织(如眼周或阴囊的皮下组织)比致密组织(如肌肉)或被膜包裹的结构(如肾脏)更容易积聚大量组织液。
胞饮作用(Pinocytosis)
某些物质通过毛细血管壁的转运可经由微小的胞饮小泡(pinocytotic vesicles)完成。这些囊泡(见图17.26和17.27)由内皮细胞膜内陷形成,能够从毛细血管壁的一侧摄取物质,通过动能将其运输至细胞另一侧并释放内容物。此过程称为跨细胞转运(transcytosis)。与扩散方式相比,通过此途径运输的物质总量极少。然而,胞饮作用可能是血液与组织液之间大分子(30 nm)脂不溶性物质转运的主要机制。不同组织中内皮细胞的胞饮小泡数量存在差异(肌肉 > 肺 > 脑),且从毛细血管动脉端到静脉端,其数量逐渐增加。
淋巴系统(Lymphatic System)
淋巴系统的终末管道由分布广泛、高度通透的盲端淋巴毛细管网络构成。这些淋巴毛细管与血管毛细管相似,但有两点重要区别:内皮细胞间缺乏紧密连接,且细丝状结构将淋巴管锚定于周围结缔组织。通过肌肉收缩,这些细丝牵拉淋巴管使内皮细胞间隙开放,允许蛋白质和大颗粒进入淋巴管。淋巴毛细管汇入更大的淋巴管,最终注入左右锁骨下静脉(subclavian veins),并与相应的颈内静脉(internal jugular veins)相连。
仅软骨、骨、上皮组织及中枢神经系统组织缺乏淋巴管。这些管道将毛细血管滤出的血浆成分回输至循环系统。该功能通过组织压实现,并因骨骼肌间歇性活动、淋巴管收缩及单向瓣膜系统的存在而增强。在此方面,淋巴管与静脉类似,但较大淋巴管的管壁较对应静脉更薄,仅含少量弹性组织和平滑肌。
24小时内经淋巴管运输的液体量约等于机体总血浆体积。淋巴管将所有滤出的蛋白质回输至血液;这些蛋白质约占血液中循环血浆蛋白总量的四分之一至二分之一。淋巴管是血管腔外蛋白质返回血液的唯一途径。由于存在较大的蛋白质浓度梯度,蛋白质无法通过逆向净扩散返回毛细血管。若未被淋巴管清除,蛋白质将积聚于组织液中,形成渗透压梯度,从毛细血管吸引液体并导致水肿。
除将液体和蛋白质回输至血管床外,淋巴系统还通过淋巴结过滤淋巴液并清除细菌等异物。最大的淋巴管——胸导管(thoracic duct)不仅引流下肢,还负责回输经通透性较高的肝毛细血管丢失的蛋白质。此外,胸导管还运输从胃肠道吸收的物质,其中主要成分为以乳糜微粒(chylomicrons)形式存在的脂肪。
淋巴液流量存在显著差异。静息状态下骨骼肌的淋巴液流量几乎为零,运动期间则随肌肉活动程度成比例增加。任何增加毛细血管滤过率的机制都会提高淋巴液流量,这些机制包括毛细血管压力或通透性增加以及血浆胶体渗透压降低。当组织间液体积超过淋巴管引流能力,或淋巴管发生阻塞时,组织间液会积聚并引发临床水肿。
冠状动脉循环
冠状血管的功能解剖
右冠状动脉和左冠状动脉分别起源于主动脉根部主动脉瓣右瓣叶和左瓣叶后方。这些动脉为心肌提供全部血液供应。右冠状动脉主要供应右心室和右心房。左冠状动脉在其起始部附近分为前降支和回旋支,主要供应左心室和左心房。左右冠状动脉供血区域存在部分重叠。在人类中,约50%个体的右冠状动脉为优势动脉(供应大部分心肌),另有20%个体的左冠状动脉为优势动脉,剩余30%个体两支主要动脉的血流量大致相等。冠状动脉和静脉的心外膜分布如图17.29所示。
冠状动脉血液流经毛细血管床后,大部分通过冠状窦返回右心房。冠状动脉系统中,心外膜动脉最粗(直径2-5 mm),大微动脉中等(直径1.0-0.5 mm),小微动脉最细(直径<0.1 mm)。部分冠状静脉血通过心前静脉进入右心房。此外,血管通道直接将心肌血管与心腔相连,这些通道包括动脉窦状隙、小动脉-心腔血管和特贝西乌斯血管。动脉窦状隙通道由小动脉或微动脉组成,这些血管在穿透心腔壁时失去动脉结构特征,分支形成不规则的内皮被覆窦状隙。这些窦状隙与其他窦状隙及毛细血管吻合,并与心腔相通。小动脉-心腔血管是直接开口于心房和心室的小动脉或微动脉。特贝西乌斯血管是连接毛细血管床与心腔并沟通心静脉的小静脉。所有心肌微血管以广泛的心内膜下血管丛形式相互交通。然而,心肌并不直接从心腔获得有意义的营养性血流。
影响冠状动脉血流的因素
物理因素
心肌灌注的主要决定因素是主动脉压力。主动脉压力的变化通常会引起冠状动脉血流的平行方向性改变。这部分由冠状动脉灌注压(coronary perfusion pressure)的变化所导致。然而,调节冠状动脉血流的主要因素是心脏代谢活动变化所引发的小动脉阻力改变。当心脏代谢活动增强时,冠状动脉阻力降低;当心脏代谢减弱时,冠状动脉阻力升高(参见第18章)。
心脏血流具有自动调节(autoregulation)特性。若通过压力控制储液器对插管处理的冠状动脉进行灌注,可在不改变主动脉压力和心脏做功的情况下改变灌注压。初始血流与稳态血流之间的关系如图17.30所示实验所展示。这是血流自动调节的范例,该调节由大小动脉的肌源性机制(myogenic mechanism)介导(参见第18章)。小动脉处心肌的代谢活动与内皮细胞共同调节这一自动调节过程。冠状循环通过微血管系统内串联阻力的调整,使血流适应\mathrm{O}_{2}需求。血压通过压力感受器反射机制被维持在狭窄范围内。因此,冠状动脉血流的变化主要由冠状动脉阻力血管直径为响应心脏代谢需求而发生的变化所引起。
• 图17.29 心脏前后表面示意图,显示主要冠状动脉的位置与分布。
除提供推动血液流经冠状血管的压力外,心脏还通过收缩心肌对自身血管产生的挤压效应(血管外压迫,extravascular compression)影响其血液供应。左右冠状动脉的血流模式如图17.31所示。左心室的冠状动脉灌注压等于主动脉舒张压与左心室舒张末期压之差。
左心室心肌压力(左心室壁内压力)在心内膜附近最高,心外膜附近最低。这种压力梯度通常不会损害心内膜血流,因为舒张期心内膜血流的增加可补偿收缩期心外膜血流的优势。冠状动脉血流测量表明,正常情况下左心室心外膜侧与心内膜侧接收的血流量大致相等。由于心室的血管外压迫在心内膜表面达到最大,这种血流量相等现象提示心内膜阻力血管的紧张度低于心外膜血管。
• 图17.30 冠状血管床的压力-流量关系。当主动脉压力保持恒定时,心输出量、心率和冠状动脉灌注压力从对照水平(两条线交叉点所示)突然增加或降低。实心圆表示灌注压力改变后立即产生的流量;空心圆表示新压力下的稳态流量。流量有向对照水平回归的趋势(血流自动调节(autoregulation of blood flow)),这种现象在中等压力范围(≈60-180mm H₉)内最为显著。(改编自Berne RM, Rubio R. Coronary circulation. 见:Page E主编. Handbook of Physiology: Section 2: The Cardiovascular System: The Heart. 第1卷. Bethesda, MD: American Physiological Society; 1979.)
IN THE CLINIC
在心肌受损和低血压患者中,可利用舒张期最低的血管外阻力和左心室无作功的特性来改善心肌灌注。通过称为反搏术(counterpulsation)的方法,将可充气球囊经股动脉置入胸主动脉。该球囊在每次心室舒张期充气,收缩期放气。此操作通过在冠状血管外阻力最低时提高舒张压来增强舒张期冠状动脉血流。此外,通过降低心室射血时的主动脉压力(后负荷(afterload))可减少心脏能量需求。
右冠状动脉的流量模式与左冠状动脉相似(见图17.31)。与左心室不同,右心室在收缩早期不会出现血流逆转,因为薄壁右心室在收缩期压力较低。因此,收缩期血流占总冠脉流入量的比例远高于左冠状动脉。
当心脏在舒张期突然停搏或诱发心室颤动时,可直观观察到血管外压迫限制冠状动脉流入的程度。图17.32A显示了左冠状动脉在恒定压力灌注下的平均血流。电诱发心室颤动时,冠脉血流立即显著增加。随后数分钟内冠状动脉阻力的增加使心肌血流降至诱发心室颤动前的水平以下(见图17.32B,星状神经节刺激前即刻)。
神经与神经体液因素
• 图17.31 左、右冠状动脉阶段性血流的比较。在心室收缩早期,血管外压迫作用非常显著,导致供应左心室的大冠状动脉血流方向短暂逆转。左冠状动脉的最大流入发生在舒张早期,此时心室已松弛,冠状动脉的血管外压迫几乎消失。左冠状动脉血流在收缩初期出现短暂逆流后,随主动脉压力变化直至舒张早期,此时血流突然上升,随后随着主动脉压力在舒张期剩余阶段的下降而缓慢降低。
当冠状动脉舒张压异常降低时(如严重低血压、部分冠状动脉闭塞或严重主动脉瓣狭窄),心内膜与心外膜血流量比值会降至1以下。该比值表明心内膜区域的血流受损程度比心室心外膜区域更严重。同时从心外膜到心内膜方向,心肌乳酸和心肌腺苷浓度梯度也会增加。因此,在动脉粥样硬化性心脏病(如冠状动脉闭塞后)中观察到的心肌损伤在左心室壁内层最为严重。
心动过速(tachycardia)和心动过缓(bradycardia)对冠状动脉血流具有双重影响。心率变化主要影响舒张期。心动过速时,收缩期所占时间比例增加,导致血流受限的时间延长。然而这种机械效应会被冠状动脉阻力血管的扩张所抵消,后者与更快搏动心脏的代谢活动增强相关。心动过缓时则相反:冠状动脉流入受限减少(舒张期时间更长),但心肌的代谢需求(\mathrm{O}_{2})也相应降低。
• 图17.32 A,通过诱导心室颤动(在左冠状动脉恒压灌注时)揭示心室收缩对平均冠状动脉血流的限制效应。心室颤动发生时,由于血管外压迫消除,冠状动脉血流突然增加。随后血流逐渐恢复并常低于颤动前水平。这种在血管外压迫消除后仍出现的冠状动脉阻力增加现象,证明了心脏具有根据能量需求调节血流的能力。B,左冠状动脉恒压灌注时,心脏交感神经刺激对心室颤动心脏的冠状动脉血流和冠状窦血氧分压(P O_{2})的影响。(Berne RM. 未发表观察数据)
代谢因素
冠状动脉循环的一个显著特征是心肌代谢活动水平与冠状动脉血流量之间存在密切关系(图17.33)。这种关系在去神经心脏和完全离体的心脏(无论是处于搏动状态还是颤动状态)中同样存在。当冠状动脉通过外部来源的动脉血进行灌注时,心室可以持续颤动数小时。如前所述,颤动心脏比泵血心脏消耗更少\mathrm{O}_{2},因此心肌血流量也相应减少。
注:【denervated heart翻译为:去神经心脏】
• 图17.33 在不同干预措施下心肌耗氧量与冠状动脉血流量的关系,这些干预措施可增加或降低心肌代谢率。(改编自Berne RM, Rubio R. Coronary circulation. In: Page E, ed. Handbook of Physiology: Section 2: The Cardiovascular System: The Heart. Vol 1. Bethesda, MD: American Physiological Society; 1979.)
心脏代谢率与冠脉血流量之间的调控机制尚未完全阐明。然而,当氧供应与氧需求之比降低时,心肌细胞会向间质液释放血管舒张物质,这些物质可使冠状动脉阻力血管舒张。动脉血氧含量降低、冠脉血流量减少或代谢率增加都会降低氧供应/需求比(图17.34)。因此,释放出的物质会使小动脉扩张,从而根据氧需求调整氧供应。当氧需求减少时,血管舒张物质的释放减少,使基础张力的表达增强。
多种代谢产物参与心脏做功增加时伴随的血管舒张过程。血管活性代谢产物的积累也可解释短暂缺血后血流量增加的现象(即反应性充血;见第18章)。在一定范围内,短暂闭塞血管解除后冠脉流量增加的持续时间与闭塞时间成正比。参与反应性充血的因素包括ATP敏感性钾通道(KATP通道)、NO、CO₂、H⁺、K⁺、缺氧、H₂O₂以及腺苷(adenosine)。
在以上这些介质中,关键因素似乎包括腺苷(adenosine)、一氧化氮(NO)、ATP敏感性钾通道(\mathrm{K}_{\mathrm{ATP}} channels)的开放以及过氧化氢(\mathrm{H}_{2}\mathrm{O}_{2})。这些介质在基础状态和心肌活动增强时的各自贡献及其相互作用机制十分复杂。血管平滑肌中氧化代谢的减少会降低ATP合成,进而开放\mathrm{K}_{\mathrm{ATP}}通道并引发超极化。这种电位变化减少了\mathrm{Ca^{++}}内流,使冠状血管平滑肌舒张从而增加血流量。
ATP的减少还会开放心肌细胞中的\mathrm{K_{ATP}}通道,产生外向电流,缩短动作电位时程并限制动作电位2相期的\mathrm{Ca^{++}}内流。这种作用可能在氧供需失衡期间发挥保护作用。此外,随着心脏作功增加,\mathrm{H}_{2}\mathrm{O}_{2}的生成增多,从而激活\mathrm{K}_{v}1.5通道,引起肌膜超极化和血管平滑肌舒张。同时,一氧化氮和腺苷的释放使小动脉扩张,从而根据\mathrm{O}_{2}需求调整\mathrm{O}_{2}供应。
低浓度腺苷似乎通过激活内皮细胞的\mathrm{K}_{\mathrm{ATP}}通道来增强一氧化氮的释放。相反,高浓度腺苷则直接作用于血管平滑肌,通过激活\mathrm{K}_{\mathrm{ATP}}通道发挥作用。\mathrm{O}_{2}需求的降低不仅能维持ATP水平,还能减少血管舒张物质的释放量,从而增强基础张力的表达。如果所有这些介质的生成被抑制,则在静息和运动状态下冠脉血流都会减少。此外,此时会出现收缩功能障碍和心肌缺血的明显征象。
• 图17.34 \mathrm{O}_{2}供应-需求比值的失衡通过心肌细胞释放血管舒张代谢物的速率来改变冠脉血流量。比值降低会引起血管舒张物质释放增加,而比值升高则产生相反效应。
• 图17.35 影响冠脉血管阻力增加(+)或降低(-)因素的示意图。血管内压力(动脉血压)会拉伸血管壁。K_{_{ATP}} channels, ATP敏感性钾通道;NO, 一氧化氮;P_{CO_{2}},二氧化碳分压;P_{O_{2}},氧分压。
根据腺苷假说
心肌\mathrm{O}_{2}张力降低(由冠状动脉血流不足、低氧血症或心脏代谢活动增强引起)会导致心肌释放腺苷(adenosine)。腺苷进入间质液空间后作用于冠状动脉阻力血管,通过激活腺苷(adenosine)受体引发血管舒张。然而,腺苷无法解释心脏代谢活动长期增强期间观察到的冠脉血流增加现象,因为心肌释放腺苷的过程是短暂的。图17.35展示了影响冠状动脉血管阻力的各类因素。
冠状动脉血流量减少的影响
冠状动脉血液中的\mathrm{O}_{2}在一次通过心肌毛细血管的过程中大部分被摄取。因此,心肌细胞的\mathrm{O}_{2}供应属于血流限制性(flow-limited);任何显著的冠脉血流减少都会削弱心肌的\mathrm{O}_{2}输送,因为即使在血流正常时,\mathrm{O}_{2}的摄取率也已接近最大值。
即使冠脉血流减少尚未严重到引发心肌坏死,仍可能导致显著(但暂时性)的心脏功能障碍。短暂的重度缺血后进行再灌注可引起明显的机械功能障碍(心肌顿抑,myocardial stunning)。但心脏最终能完全恢复功能。心肌顿抑的病理生理基础可能是缺血期间细胞内\mathrm{Ca^{++}}超载,加上再灌注早期产生的OH−和超氧自由基。这些变化会降低肌丝对\mathrm{Ca^{++}}的反应性。
冠状动脉侧支循环与血管扩张剂
正常人心脏中几乎没有功能性冠状动脉间交通支。冠状动脉或其分支的急性闭塞会导致该血管供血区的心肌发生缺血性坏死并最终纤维化。然而,若冠状动脉在数天或数周内缓慢渐进性狭窄,侧支血管会逐步形成,可能为缺血心肌提供足够血液以预防或缩小坏死范围。侧支血管可形成于闭塞动脉与非闭塞动脉的分支之间,起源于原有小血管的内皮细胞和平滑肌增殖性改变。这些变化可能是对壁应力及化学因子(包括缺血组织释放的血管内皮生长因子VEGFs)的应答。哺乳动物体内至少存在5种VEGFs,均为糖蛋白。VEGFs可诱导血管生成、引发血管舒张并增加内皮通透性。通过血管舒张作用,VEGFs能使更多毛细血管获得灌注;通过开放内皮细胞间的紧密连接并形成窗孔结构,可增加毛细血管通透性。
临床相关
心肌顿抑与心肌冬眠
心肌顿抑(myocardial stunning)表现为无心肌坏死情况下出现的持续性心室功能障碍,常见于急性冠状动脉闭塞患者。若患者及时接受冠状动脉搭桥手术或球囊血管成形术治疗,且缺血区域恢复充分血流,该区域心肌细胞可能完全恢复。然而,在随后数天甚至数周内,受累区域心肌的收缩功能可能显著低于正常水平。
冠状动脉血流长期减少(心肌缺血)可对心脏机械活动和电活动产生不可逆的严重损害。冠状动脉疾病(通常为冠状动脉粥样硬化)导致的冠脉血流减少是严重心脏疾病最常见的病因之一。缺血可为整体性(累及整个心室)或区域性(累及心室部分区域)。受累心肌机械收缩功能受损不仅由{\sf O}_{2}和代谢底物输送减少所致,也与心肌组织中潜在有害物质(如\mathsf{K}^{+}、乳酸、\mathsf{H}^{+})的蓄积有关。若心脏某区域冠脉血流减少达到足够严重程度并持续足够时间,将导致受累心肌细胞坏死。
心肌冬眠(myocardial hibernation)指因\mathrm{O}_{2}和营养供应不足导致功能受损的心肌细胞下调其代谢活动的现象。心肌冬眠主要见于冠状动脉疾病患者。此类患者的冠脉血流持续显著减少,心脏机械功能受损。若通过搭桥手术或血管成形术恢复冠脉血流至正常水平,机械功能可恢复正常。
皮肤循环
皮肤的\mathrm{O}_{2}和营养需求相对较低。与其他组织不同,\mathrm{O}_{2}和营养供应并非皮肤血流调节的主要因素。皮肤循环的首要功能是维持体温恒定。因此,皮肤血流会根据机体散热或保温需求发生显著波动。环境温度和体内温度变化可激活皮肤血流调节机制。
临床相关知识
为促进冠状动脉侧支血管发育,已尝试多种外科干预手段。但现有技术产生的侧支循环效果并未超越单纯冠状动脉狭窄本身引发的侧支形成。当冠状动脉发生局灶性闭塞或严重狭窄(如冠状动脉粥样硬化时),可通过动脉或静脉移植物对病变进行搭桥。通常可采用经外周动脉插入球囊导管至病变血管,通过球囊扩张狭窄节段。球囊扩张血管(血管成形术)可实现狭窄冠状动脉的持久扩张(图17.36),尤其在血管成形术中置入药物洗脱支架(支架携带药物可预防再狭窄)时效果更佳。
许多药物可用于冠状动脉疾病患者以缓解心绞痛(angina pectoris)——与心肌缺血相关的胸痛。这些化合物包括有机硝酸盐/亚硝酸盐(organic nitrates/nitrites)、钙通道拮抗剂(calcium channel antagonists)和\upbeta-肾上腺素受体拮抗剂(\upbeta-adrenoceptor antagonists)。有机硝酸盐/亚硝酸盐代谢生成NO。NO通过扩张大静脉减少静脉回流(前负荷,preload),从而降低心脏做功(见第19章)和心肌{\sf O}_{2}需求。此外,NO扩张冠状动脉以增加侧支血流。重要的是,有机硝酸盐/亚硝酸盐不会干扰冠脉自动调节(coronary autoregulation)。钙通道拮抗剂也引起血管舒张,但无选择性扩张冠状动脉的作用。\upbeta-肾上腺素受体拮抗剂通过降低心率间接增加冠脉血流,并拮抗有机硝酸盐/亚硝酸盐引起的反射性心动过速。
对于冠状动脉显著狭窄的患者,使用血管扩张剂双嘧达莫(dipyridamole)可使与狭窄段平行的正常血管分支完全扩张,从而降低部分闭塞血管的压力。狭窄血管压力降低会进一步减少缺血心肌的血流。这种现象称为冠脉窃血(coronary steal),其机制是双嘧达莫通过阻断内源性腺苷(endogenous adenosine)的细胞摄取和代谢发挥作用。值得注意的是,双嘧达莫会干扰冠脉自动调节。
• 图17.36 A. 左冠状动脉前降支显著狭窄的血管造影(冠脉内注射不透X线造影剂),白色箭头示狭窄部位。B. 血管成形术并置入药物洗脱支架后的同一冠脉节段(黑色箭头)。(由Michael Azrin博士提供)
皮肤血流的调节
神经因素
皮肤主要包含两类阻力血管:微动脉(arterioles)和动静脉吻合(arteriovenous anastomoses)。动静脉吻合将血液从微动脉分流至微静脉和静脉丛,从而绕过毛细血管床。此类吻合存在于指尖、手掌、足趾、足底、耳、鼻和唇部。动静脉吻合在形态上与微动脉不同:吻合血管短而直或长而卷曲,管腔直径约20至40~{\upmu\mathrm{m}},具有富含神经纤维的厚肌层(图17.37)。这些血管几乎完全受交感神经控制,当神经支配中断时会发生最大程度扩张。反之,交感神经纤维的反射性刺激可使其收缩直至完全闭塞管腔。尽管动静脉吻合无基础张力,但对肾上腺素(epinephrine)和去甲肾上腺素(norepinephrine)等缩血管物质高度敏感。此外,动静脉吻合不受代谢调控,不表现反应性充血(reactive hyperemia)或血流自动调节。因此,这些吻合通道的血流调节主要由神经系统通过温度感受器的反射激活或中枢神经系统高级中枢调控。
• 图17.37 耳部动静脉(AV)吻合经柏林蓝染料注射后的表现。A,动脉;V,静脉;箭头指示动静脉吻合处。指尖的动静脉吻合管壁较厚且细胞成分更多。(引自Pritchard MML, Daniel PM. J Anat. 1956;90:309)
临床视角
某些个体的手指和脚趾对寒冷异常敏感。暴露于寒冷环境时,指(趾)端小动脉会发生收缩。由此引发的缺血会导致局部皮肤苍白,伴随刺痛、麻木和疼痛。苍白现象随后转为发绀(皮肤呈现暗蓝色),当动脉痉挛缓解后又转为潮红。这种称为雷诺氏病(Raynaud's disease)的病症,其病因是寒冷或情绪压力引发的交感神经系统过度激活(即夸大的血管运动反应)。相关致病因素包括:(1)指(趾)动脉平滑肌细胞中肾上腺素能受体敏感性增强;(2)局部释放或全身循环的血管收缩剂(如血栓素、内皮素和5-羟色胺)存在;(3)氧化应激增强导致一氧化氮(NO)降解加速或缺乏。
皮肤中大多数阻力血管都具有基础张力,受交感神经系统和局部调节因素的双重控制。但以神经控制为主导。交感神经纤维的刺激会引起血管收缩,而交感神经的切断则导致血管舒张。皮肤血管长期去神经支配后,去神经前存在的张力水平会在数周内逐渐恢复。这种张力恢复是通过基础张力的增强实现的。皮肤血管的去神经支配会导致对循环中儿茶酚胺的敏感性增强(去神经支配超敏反应)。
副交感舒血管神经纤维不支配皮肤血管。但受交感胆碱能纤维支配的汗腺受到刺激时,会扩张皮肤阻力血管。汗液中含有一种酶,可分解组织液中的蛋白质(kallidin)生成缓激肽(bradykinin)——一种具有强效舒血管特性的多肽。局部形成的缓激肽可扩张小动脉,增加皮肤血流量。
某些皮肤血管(特别是头、颈、肩部和上胸部的血管)受大脑高级中枢调节。因窘迫或愤怒引发的面部潮红,以及因恐惧或焦虑引发的面色苍白,分别是受影响皮肤区域交感神经纤维被大脑抑制和激活的例证。
与皮肤中的动静脉吻合不同,阻力血管具有血流自动调节(autoregulation)和反应性充血(reactive hyperemia)功能。若通过血压袖带充气短暂阻断肢体动脉血流,解除压迫后血管闭塞点以下的皮肤会呈现鲜红色。这种皮肤血流量增加(反应性充血)也表现为患肢浅静脉的扩张。
温度在皮肤血流调节中的作用
皮肤颜色:与皮肤血容量、氧合血红蛋白及血流的关系
皮肤的主要功能是维持恒定的内环境并保护机体免受外界不利变化的影响。环境温度是机体必须应对的最重要外部变量之一。暴露于寒冷环境会引发全身性皮肤血管收缩(cutaneous vasoconstriction),在手部和足部尤为显著。该反应主要由神经系统介导。通过压力袖带阻断手部血液循环,并将该手浸入冷水时,会引发暴露于室温下的其他肢体部位皮肤血管收缩。若未阻断冷却手部的血液循环,则反射性全身血管收缩部分由返回体循环的冷却血液引起。这些回流血液随后刺激下丘脑前部(anterior hypothalamus)的温度调节中枢,进而激活下丘脑后部(posterior hypothalamus)的保温中枢以引发皮肤血管收缩。
冷却手部的皮肤血管也会直接对寒冷产生反应。中度冷却或短暂暴露于严寒(\mathrm{0^{\circ}C}至\mathrm{15^{\circ}C})会使阻力血管(resistance vessels)、容量血管(capacitance vessels)以及动静脉吻合(AV anastomoses)收缩。长时间暴露于严寒则会引发继发性血管舒张反应。将手浸入冰水会立即引发血管收缩和剧烈疼痛。然而,该反应很快会被皮肤血管扩张所取代,表现为浸泡部位发红且疼痛缓解。若持续浸泡手部,血管收缩与舒张会交替发生,但皮肤温度很少会降至初始血管收缩时的水平。当然,长时间暴露于严寒会损伤组织。暴露于寒冷环境的人群面部红润现象即为寒冷诱导血管舒张的例证。然而,尽管面部呈现潮红外观,其皮肤血流量可能已大幅减少。缓慢流动血液的红色主要源于寒冷皮肤对\mathrm{O}_{2}的摄取减少,以及低温引起的氧合血红蛋白解离曲线左移(参见第23章)。
直接对皮肤施加热量不仅会扩张局部的阻力血管、容量血管和动静脉吻合,还会反射性地扩张身体其他部位的血管。局部效应不依赖血管神经支配,而反射性血管舒张是对回流温血刺激下丘脑前部以及受热皮肤区域的热感受器刺激的综合反应。
大动脉与大静脉的紧密相邻允许其之间进行逆流热交换(countercurrent heat exchange)。从冷却手部流向心脏的静脉冷血会从邻近动脉吸收热量,从而使静脉血升温并使动脉血降温。当肢体暴露于热环境时,热量交换方向相反。因此,肢体暴露于寒冷环境时热保存增强,而暴露于温暖环境时热保存最小化。
皮肤颜色
皮肤颜色主要由色素含量决定。然而,除皮肤极暗的情况外,苍白或红润的程度主要取决于皮肤中的血液量。当静脉丛(venous plexus)中血液较少时,皮肤呈现苍白;而当静脉丛含有中等到大量血液时,皮肤会显示颜色。这种颜色可能是红色、蓝色或介于两者之间的色调,具体取决于血液的氧合程度。血管收缩(vasoconstriction)与还原血红蛋白(reduced hemoglobin)的共同作用可使皮肤呈现灰白色。静脉充血(venous engorgement)与还原血红蛋白含量的结合则可能使皮肤呈现暗紫色。
皮肤颜色几乎无法反映皮肤血流速率。当动静脉吻合支(AV anastomoses)开放时,快速血流可能伴随皮肤苍白;而当皮肤暴露于寒冷时,慢速血流可能与皮肤红润相关。
骨骼肌循环
骨骼肌中的血流速率与组织的收缩活动及肌肉类型直接相关。红肌(red muscle,即氧化能力高的慢缩肌)的血流量和毛细血管密度均高于白肌(white muscle,即氧化能力低的快缩肌)。在静息肌肉中,毛细血管前微动脉(precapillary arterioles)会间歇性收缩和舒张。因此,在任何特定时刻,大部分毛细血管床未被灌注,静息骨骼肌的总血流量较低(1.4–4.5 mL/分钟/100g)。运动期间,阻力血管(resistance vessels)舒张,肌肉血流量可增加至静息水平的15至20倍,具体取决于运动强度。
骨骼肌血流调节
神经和局部因素共同调节肌肉循环。物理因素如动脉压(Pa)、组织压和血液黏度会影响肌肉血流量。此外,另一物理因素——活动骨骼肌的挤压效应——也会影响血管中的血流。在间歇性收缩时,血液流入受限,而如前所述,静脉回流增强。静脉瓣(venous valves)在收缩间期阻止血液逆流,从而促进血液向前推进。在强烈持续收缩(如运动期间)时,血管床可能被压缩至血流暂时完全停止的程度。
神经因素
肌肉阻力血管具有高度的基础张力(basal tone);它们也通过交感缩血管神经纤维(sympathetic vasoconstrictor nerve fibers)的持续低频活动维持张力。交感缩血管纤维的基础放电频率仅为约1至2次/秒,最大血管收缩发生于约10次/秒的频率。
交感神经活动引发的血管收缩由去甲肾上腺素(norepinephrine)的局部释放引起。动脉内注射去甲肾上腺素仅引起血管收缩(α₁-肾上腺素能受体【α₁-adrenergic receptor】)。相反,低剂量肾上腺素(epinephrine)通过β₂-肾上腺素能受体【β₂-adrenergic receptor】引起血管舒张,而大剂量则导致血管收缩。
压力感受器反射(Baroreceptor Reflexes)
压力感受器反射对交感神经的紧张性活动具有显著影响。颈动脉窦(carotid sinus)压力升高可引起肌性血管床扩张,而颈动脉窦压力降低则会引发血管收缩(图17.38)。当交感缩血管神经张力较高时,颈总动脉(common carotid artery)闭塞引起的血流量减少幅度较小,但解除闭塞后的血流量增加幅度较大。压力感受器刺激引起的血管舒张是由于交感缩血管神经活动被抑制所致。
• 图17.38 颈总动脉闭塞及解除后,肌性血管床参与颈动脉窦压力感受器介导的血管收缩和血管舒张的证据。本实验模型中,坐骨神经(sciatic)和股神经(femoral)是后肢肌群唯一的直接神经支配来源。肌肉在恒定灌注压下接受血液灌注。(改绘自Jones RD, Berne RM. Am J Physiol. 1963;204:461.)
骨骼肌阻力血管对维持动脉血压具有重要作用,因为骨骼肌占人体质量的很大比例,其血管系统因此构成最大的血管床。骨骼肌血管参与血管反射对维持正常动脉血压至关重要。
图17.39总结了交感神经对肌肉和皮肤血管作用的比较。需注意:皮肤血管基础张力越低,其收缩反应越强;同时可观察到皮肤血管缺乏主动舒张反应。
局部因素(Local Factors)
在活动的骨骼肌中,血流量由代谢因素调控。在静息肌肉中,神经因素占主导地位,它们将神经源性张力叠加于基础张力之上(见图17.39)。切断支配肌肉的交感神经可消除血管张力的神经成分,显露出血管固有的基础张力。调控血流量的神经机制与局部机制相互拮抗,在肌肉收缩期间,局部血管舒张机制占据优势。然而在运动过程中,强烈的交感神经刺激会轻微减弱局部代谢物释放引起的血管舒张。
脑循环(Cerebral Circulation)
血液通过颈内动脉(internal carotid arteries)和椎动脉(vertebral arteries)到达脑部。椎动脉汇合形成基底动脉(basilar artery),后者与颈内动脉分支共同构成Willis环(circle of Willis)。脑表面动脉与脑实质内穿动脉存在差异:软脑膜动脉(pial arteries)和小动脉具有外源性神经支配(如通过颈上神经节、蝶腭神经、三叉神经);而实质内小动脉具有内源性神经支配(通过脑神经元)。软脑膜动脉比实质内小动脉含有更多平滑肌细胞。此外,软脑膜动脉具有侧支分支,而实质内小动脉无此结构。因此,实质内小动脉调控特定皮层区域的血流量,其闭塞可显著减少局部血流。
脑循环
脑循环的独特之处在于其位于刚性结构——颅骨内。由于颅内内容物不可压缩,动脉流入量的任何增加必须伴随静脉流出量的相应增加。在大多数体组织中,血液和血管外液体积可发生显著变化。然而在大脑中,血液和血管外液体积相对恒定;其中一种体液体积的变化必须伴随另一种体液的相反变化。脑血流量被维持在狭窄范围内,人类平均为55 mL/(分钟·100克脑组织)。
脑血流的调节
静息状态下,大脑消耗全身总氧量的20%和总葡萄糖量的25%。在所有体组织中,大脑对缺血的耐受性最低。脑血流中断仅5秒即可导致意识丧失。持续数分钟的缺血可能造成不可逆的组织损伤。幸运的是,脑循环的调节主要由大脑自身主导。在存在交感缩血管神经活动、循环体液血管活性物质和动脉血压变化等不利影响时,源于大脑的局部调节机制和反射倾向于维持相对恒定的脑循环。在某些情况下,大脑还通过引发全身血压变化来调节其血流量。
• 图17.39 肌肉(虚线)和皮肤(阴影区域)阻力血管在交感神经刺激和切断时的基础张力及反应范围。外周阻力以对数尺度表示。(改绘自Celander O, Folkow B. Acta Physiol Scand. 1953;29:241.)
脑血流变化与毛细血管的"功能性募集(functional recruitment)"相关。因此,每个毛细血管的血流速度会调整以满足器官需求。相比之下,"毛细血管募集(capillary recruitment)"则通过开放更多毛细血管来适应更大的血流量。
大脑具有多个调节血流的保护机制,包括血脑屏障、中枢心血管中枢的外源性调节、循环的内源性控制(自动调节),以及功能性的充血反应(即活动脑区血流量增加)。
血脑屏障
血脑屏障调节血液与大脑之间的离子和营养物质转运,同时限制有害物质从血液进入大脑。血脑屏障包含紧密连接蛋白(junctional adhesion molecule-1、occludins、claudins),这些蛋白与内皮细胞骨架连接形成屏障,阻止物质从血液到大脑的细胞旁路转运。此外,血脑屏障还包括神经血管单元(微循环、周细胞、细胞外基质、星形胶质细胞和神经元;图17.40)。
神经血管单元示意图
• 图17.40 显示星形胶质细胞将神经元与脑微循环小动脉连接的神经血管单元(neurovascular unit)示意图。微动脉张力受血管平滑肌和周细胞(pericyte)活动的调节。内皮细胞通过紧密连接(tight junction)限制物质的扩散。神经血管单元是血脑屏障的组成部分,并在神经元活动期间充当血流的调节器。
周细胞通过调节血管直径来控制血流,并分泌血管生成素(angiopoetin)——一种刺激内皮细胞中闭合蛋白(occludins)表达的生长因子。闭合蛋白在脑内皮细胞中显著表达,而在非神经内皮中分布稀疏。神经血管单元通过调节血流和毛细血管通透性,参与以血脑屏障功能障碍为特征的病理状态,包括缺氧、神经退行性疾病和炎症。
神经因素
脑(软脑膜)血管的外源性神经支配由自主神经系统组成。伴随颈内动脉和椎动脉进入颅腔的颈交感神经纤维支配脑血管。与其他血管床相比,脑血管的交感控制较弱,脑血管平滑肌的收缩状态主要依赖于局部代谢因素。其{\bf{\upalpha}}_{1}-肾上腺素能受体密度低于其他血管床。脑血管接受来自面神经的副交感纤维,刺激时产生轻微血管舒张。在病理生理条件下,交感神经系统对脑血流的影响最为显著。
局部因素
总体而言,全脑血流量相对恒定且具有自我调节能力。脑血流自我调节涉及肌源性、代谢性和神经性机制的相互作用,与外周血管的机制相似(见第18章)。然而,大脑区域血流与局部神经活动相关。例如,单侧手部运动仅导致对侧感觉运动皮层和前运动皮层手部代表区的血流量增加。说话、阅读等对大脑皮层的刺激也伴随对侧皮层相应区域的血流增加(图17.41)。葡萄糖摄取同样与局部皮层神经元活动相关——当视网膜受光刺激时,视觉皮层的葡萄糖摄取增强。
神经血管单元(neurovascular unit, NVU)在血流精细调控中发挥核心作用。血管活性物质的生成将神经元活动增强与氧和葡萄糖摄取增加相耦联。在神经血管单元内,星形胶质细胞(astrocyte)将神经元与微循环系统相连接(见图17.40)。在突触的一极,星形胶质细胞包绕突触前和突触后神经元;另一极则汇聚于脑血管的血管平滑肌和内皮细胞。当被神经递质谷氨酸或乙酰胆碱激活时,星形胶质细胞产生三磷酸肌醇(inositol trisphosphate, IP3),引起Ca²⁺释放,进而激活大电导钾通道(large conductance potassium channel, BKCa)。释放的K⁺使星形胶质细胞与小动脉平滑肌之间间隙的细胞外[K⁺]升高至8-15 mEq/L。细胞外[K⁺]升高通过激活Na⁺/K⁺-ATP酶以及增强内向整流钾通道(inward-rectifying K⁺ channel)电导,引起平滑肌超极化。由于膜电位偏离阈值,超极化减少Ca²⁺进入血管平滑肌,导致实质小动脉扩张,血流量增加。
• 图17.41 不同刺激对人对侧大脑皮层局部血流的影响。Sens 1:手部低强度电刺激;Sens 2:手部高强度(痛觉)电刺激。其他刺激标注如图所示。(改绘自Ingvar DH. Brain Res. 1976;107:181.)
关于K⁺的作用,缺氧、脑电刺激和癫痫发作等刺激可引起脑血流量快速增加,这些过程均伴随血管周围K⁺浓度的升高。当局部应用K⁺于软脑膜小动脉时,K⁺浓度的增量与引起血管扩张的幅度相似。当细胞外K⁺超过15 mEq/L时,平滑肌细胞去极化,Ca²⁺内流增加导致收缩和血管收缩。因此,细胞外[K⁺]通过作用于Na⁺/K⁺-ATP酶、K⁺电导和K⁺浓度梯度,对平滑肌功能产生双重效应。
临床关联
颅内压升高(由脑肿瘤引起)会导致全身血压升高。这种称为库欣现象(Cushing’s phenomenon)的反应由延髓血管运动中枢的缺血性刺激所引发。在颅内肿瘤扩大等情况下,库欣现象有助于维持脑血流。
二氧化碳可从脑组织或血管腔扩散至血管平滑肌,而血液中的\mathrm{H^{+}}被血脑屏障阻挡无法到达小动脉平滑肌。因此,当脑脊液的[\mathrm{H^{+}}]增加时脑血管会扩张,但对动脉血[\mathrm{H^{+}}]升高的反应仅表现为轻微扩张。在存在内皮功能障碍(如糖尿病、高血压)的人群中,\mathrm{Paco}_{2}对脑血流的化学调节功能受损;\mathrm{H^{+}}和一氧化氮(NO)在响应\mathrm{Paco}_{2}变化中的相对作用尚不明确。
钾离子浓度也影响脑血流。缺氧、脑电刺激和癫痫发作会引起脑血流及血管周围[\mathrm{K^{+}}]的快速升高。当局部施加\mathrm{K^{+}}于这些血管时,[\mathrm{K^{+}}]的升高幅度与引起软脑膜小动脉扩张的幅度相似。然而,在脑刺激期间[\mathrm{K^{+}}]的升高并不能持续。因此,只有脑血流的初始增加可归因于\mathrm{K^{+}}的释放。
肠道循环
解剖学
胃肠道由腹腔动脉(celiac artery)、肠系膜上动脉(superior mesenteric artery)和肠系膜下动脉(inferior mesenteric artery)供血。肠系膜上动脉输送超过心输出量的10%。细小的肠系膜动脉在胃肠道的黏膜下层形成广泛的血管网络。动脉分支穿透肠道的纵行肌层和环行肌层,并分出三级和四级微动脉(arterioles)。黏膜下层的部分三级微动脉为绒毛尖端供血(图17.42)。
绒毛内毛细血管和小静脉的血液流动方向与主微动脉相反(见图17.42)。这种结构构成逆流交换系统(countercurrent exchange system)。有效的逆流交换使\mathrm{O}_{2}能够从微动脉向小静脉扩散。在低血流速率时,大部分\mathrm{O}_{2}可能从绒毛基底部附近的微动脉分流至小静脉。这会减少绒毛尖端黏膜细胞的\mathrm{O}_{2}供应。当肠道血流极低时,\mathrm{O}_{2}的分流程度极高,导致绒毛广泛坏死。
(注:原文中的"pial arterioles"译为"软脑膜小动脉","reactive hyperemia"译为"反应性充血","autoregulation"译为"自动调节"。学名及解剖结构名称如"celiac artery"等均按要求保留原文未翻译。)
• 图17.42 小肠微循环模式图。A,毛细血管丛起源于绒毛和肠隐窝(intestinal crypt)的微动脉。血液通过进入门脉循环的微静脉离开肠隐窝。B,淋巴管(乳糜管,lacteals)起始于绒毛内部,最终在绒毛基部形成丛状结构。(改绘自Kierszenbaum A. Histology and Cell Biology: An Introduction to Pathology. Philadelphia: Mosby; 2002.)
神经调节
肠系膜循环的神经控制几乎完全由交感神经支配。通过\upalpha_{1}-肾上腺素能受体(adrenergic receptors)增强的交感神经活动会引起肠系膜微动脉和容量血管(capacitance vessels)的收缩。这些受体在肠系膜循环中占主导地位。然而,\upbeta_{2}-肾上腺素能受体也存在,因此激动剂异丙肾上腺素(isoproterenol)会引起血管舒张。
当面对攻击性行为或下丘脑"防御"区的人工刺激时,肠系膜血管床会发生显著的血管收缩。这种血管收缩将血流从相对次要的肠道循环转移到更关键的骨骼肌、心脏和脑部。
自身调节
肠道循环的血流自身调节(autoregulation)不如其他血管床发达。负责自身调节的主要机制是代谢性机制,尽管肌源性机制可能也参与其中(参见第18章)。短暂动脉闭塞后,肠系膜静脉血中的腺苷浓度会升高四倍。在肠黏膜代谢活动增强时(如食物吸收期间),腺苷浓度也会升高。腺苷作为肠系膜血管床的强效血管舒张剂,可能是自身调节的主要代谢介质。不过,\mathrm{K^{+}}浓度的变化和血浆渗透压的改变也可能参与自身调节。
小肠的氧耗比其血流受到更精确的调控。实验表明,当动脉灌注压在30至125mmHg之间变化时,小肠的\mathrm{O}_{2}摄取量保持恒定。
功能性充血
摄食会增加肠道血流量。某些胃肠激素的分泌参与了这种充血现象。胃泌素(gastrin)和胆囊收缩素(cholecystokinin)可增强肠道血流,这些激素在摄食时分泌。食物的吸收也会影响肠道血流。未消化的食物没有血管活性作用,而多种消化产物则是强效血管舒张剂。在食糜的各种成分中,肠系膜充血的主要介质是葡萄糖和脂肪酸。
解剖学
正常情况下,肝脏血流量约占心输出量的25%。肝脏血流有两个来源:
门静脉(约75%)和肝动脉。由于门静脉血液已经流经胃肠道毛细血管床,其血流中大部分\mathrm{O}_{2}已被提取。肝动脉输送剩余25%的血液,这些血液\mathrm{O}_{2}完全饱和。因此,肝脏消耗的\mathrm{O}_{2}约有四分之三来自肝动脉血。
门静脉和肝动脉的小分支发出终末门微静脉(terminal portal venules)和肝微动脉(hepatic arterioles)(图17.43)。这些终末血管从中心进入肝腺泡(hepatic acinus)(肝脏的功能单位)。血液从这些终末血管流入肝窦状隙毛细血管(sinusoid capillaries),后者构成肝脏的毛细血管网。肝窦状隙毛细血管向腺泡外周辐射,在此处与终末肝微静脉(terminal hepatic venules)相连。来自这些终末微静脉的血液汇入逐渐增大的肝静脉分支,最终流入下腔静脉(inferior vena cava)。
肝循环
血流动力学
门静脉的平均血压约为10 mmHg,肝动脉的平均血压约为90 mmHg。肝窦状隙毛细血管上游血管的阻力显著大于下游血管。因此,肝窦状隙毛细血管内的压力仅比肝静脉和下腔静脉高2-3 mmHg。肝脏中窦前(presinusoidal)与窦后(postsinusoidal)阻力比值远高于几乎任何其他血管床。因此,改变窦前阻力的药物或其他干预措施通常对肝窦状隙毛细血管内的压力及跨窦壁的液体交换影响甚微。然而,肝静脉压和中心静脉压的变化几乎会等量传递到肝窦状隙毛细血管,并显著影响跨窦的液体交换。
血流调节
门静脉系统和肝动脉系统的血流量呈现互补性变化。当某一系统的血流受限时,另一系统的血流会增加,但无法完全代偿前一系统的流量减少。
门静脉系统不具备自动调节功能。当门静脉压力(P_v)和流量升高时,血管阻力保持恒定或降低。然而肝动脉系统具有自动调节功能,腺苷(adenosine)可能参与这种血流调节。
由于肝脏从血液中摄取氧气的效率极高,其倾向于维持恒定的氧气(O₂)消耗量。当肝脏的氧气输送速率变化时,肝脏通过调整从血液中摄取的氧气比例进行代偿。腺泡中心的窦前血管与外周的窦后血管之间的距离(见图17.43)促进了这种氧气摄取。与肠绒毛中发生的逆流交换不同,这两类血管之间的显著距离阻止了氧气的逆流交换。
• 图17.43 肝腺泡的微循环。箭头显示血液从肝动脉和门静脉终末分支流向肝窦状隙毛细血管的方向。动静脉混合血流入中央静脉,随后进入小叶下静脉。(改编自Ross MH, Pawling W. Histology: A Text and Atlas: With Correlated Cell and Molecular Biology. Philadelphia: Lippincott Williams & Wilkins; 2006.)
胎儿循环
子宫内循环
胎儿循环与出生后婴儿的循环存在差异。最重要的区别在于胎儿肺功能尚未激活,胎儿完全依赖胎盘获取\mathrm{O}_{2}和营养物质。来自胎盘的氧合血通过脐静脉进入胎儿肝脏。约半数来自胎盘的血流会流经肝脏,剩余部分则绕过胎儿肝脏,通过静脉导管(ductus venosus)(图17.44)到达下腔静脉。来自静脉导管的血液与胎儿躯干下半部及四肢回流的血液在下腔静脉汇合。这部分血液再通过肝静脉与来自胎儿肝脏的血液混合。
临床联系
当中心静脉压升高时(如充血性心力衰竭),大量血浆水分从肝脏渗入腹腔;这种腹腔内液体积聚称为腹水(ascites)。肝脏广泛纤维化(如肝硬化)会显著增加肝血管阻力,从而大幅提高门静脉系统压力。由此引起的内脏循环(splanchnic circulation)毛细血管静水压升高也会导致大量液体渗出至腹腔。与门静脉吻合的其他静脉压力同样可能显著升高。例如,食管静脉可能显著扩张形成食管静脉曲张(esophageal varices)。这些曲张静脉可能破裂并导致严重的、常危及生命的内出血。为预防肝硬化门静脉高压(portal \mathsf{P}_{\mathsf{v}})相关的这些严重并发症,常通过外科手术在门静脉与下腔静脉间建立吻合(门腔静脉吻合术(portacaval shunt))以降低门静脉压力(portal \mathsf{P_{v}})。
【注】
- 术语"splanchnic circulation"直译为"内脏循环",指供应腹腔内脏器的血液循环系统
- "portacaval shunt"译为"门腔静脉吻合术",是连接门静脉与下腔静脉的外科分流术式
• 图17.44 胎儿循环示意图。数字表示流经指定血管的血液氧饱和度百分比。离开胎盘的胎儿血液具有80%的氧饱和度,但流经卵圆孔(foramen ovale)的血液饱和度下降至67%。这种氧饱和度的降低是由于饱和血液与来自胎儿下半身和肝脏回流的去饱和血液混合所致。来自胎儿肺部的去饱和血液进一步使左心室血液的氧饱和度降至62%,这是供应胎儿头部和上肢血液的饱和度水平。右心室血液——由去饱和的上腔静脉(superior vena cava)血液、冠状静脉血和下腔静脉(inferior vena cava)血液混合组成——氧饱和度仅为52%。当大部分血液通过动脉导管(ductus arteriosus)并与左心室泵出的血液混合后,流向胎儿下半身和返回胎盘的血流氧饱和度为58%。左上角插图示下腔静脉主要血流通过卵圆孔流入左心房的方向。箭头指示血流方向。(数据来自Dawes GS等,J Physiol. 1954;126:563)
在下腔静脉中,血流倾向于保持其特性,并被房间隔边缘(crista dividens)分成两个不等量的血流。较大的血流(主要包含脐静脉血液)通过卵圆孔从下腔静脉分流至左心房(见图17.44)。另一股血流进入右心房,在此处与通过上腔静脉返回的胎儿上半身血液以及心肌血液混合。
与成人心室不同,胎儿左右心室基本以并联方式运作。由于胎儿肺血管阻力较高,右心室输出量中仅十分之一流经肺部。其余部分通过动脉导管从胎儿肺动脉流向主动脉(位于供应胎儿头部和上肢的动脉分支点远端)。由于肺血管阻力高且动脉导管直径与降主动脉相当,血液得以从肺动脉流向主动脉。
通过卵圆孔进入左心房的大量血液与肺静脉回流血液汇合,被左心室泵入主动脉。升主动脉中的大部分血液流向胎儿头部、上胸部和手臂;剩余部分与动脉导管血液混合供应身体其他部位。左心室泵血量约为右心室的一半。降主动脉中大部分血液来自动脉导管和右心室,通过两条脐动脉流向胎盘。
胎儿血液的氧饱和度在不同部位存在差异(见图17.44)。因此,接收最高氧饱和血液的胎儿组织是肝脏、心脏以及包括头部在内的上半身。
出生时发生的循环变化
在胎盘处,绒毛膜绒毛(chorionic villi)浸入母体血窦(maternal sinuses),氧气(\mathrm{O}_{2})、二氧化碳(\mathrm{CO}_{2})、营养物质和代谢废物通过膜结构进行交换。交换屏障的存在使得在正常血流速率下,两个循环系统的氧气无法达到平衡。因此,离开胎盘的胎儿血液氧分压(\mathrm{Po}_{2})非常低。若非胎儿血红蛋白(fetal hemoglobin)对氧气的亲和力高于成人血红蛋白,胎儿将无法获得足够的氧气供应。胎儿氧合血红蛋白解离曲线(oxyhemoglobin dissociation curve)左移。因此,在相同氧气分压下,胎儿血液携带的氧气量显著高于母体血液。
妊娠早期,心肌细胞中普遍存在的高糖原水平可能保护心脏免受急性缺氧的影响。糖原水平在妊娠晚期下降,至足月时达到成人水平。
出生时发生的循环变化
脐血管具有厚肌层管壁,能对创伤、牵张、拟交感胺类物质、缓激肽(bradykinin)、血管紧张素(angiotensin)以及\mathrm{Po}_{2}变化产生反应。对于未结扎脐带的动物,新生儿的出血可通过以下机制得到控制:脐动脉受牵张引发的脐血管收缩,以及伴随的体循环动脉\mathrm{Po}_{2}升高。
脐血管的关闭会增加总外周阻力(total peripheral resistance, TPR)和婴儿的动脉血压。当脐静脉血流停止时,具有肌性括约肌的厚壁血管——静脉导管(ductus venosus)随之关闭。引发静脉导管关闭的具体因素尚不明确。
临床意义
若孕妇处于缺氧状态,胎儿血液\mathrm{Po}_{2}降低会引发心动过速(tachycardia)并增加脐血管血流量。若缺氧持续存在或脐血管血流受阻,则会出现胎儿窘迫(fetal distress),其最初表现为心动过缓(bradycardia)。
出生后,脐血管收缩或钳闭导致的窒息以及体温下降会激活新生儿的呼吸中枢。当肺部充满空气时,肺血管阻力(pulmonary vascular resistance)会降至肺扩张前值的约10%。这种血管阻力变化并非由肺部氧气存在引起,因为即使肺部充满氮气(\mathrm{N}_{_2}),阻力变化程度仍然相同。然而,若肺部充满液体则不会降低肺血管阻力。
出生后,左心房压力通过以下机制被提升至高于下腔静脉和右心房压力:(1) 肺阻力降低导致大量血液经肺循环流入左心房;(2) 脐静脉闭塞减少右心房血流量;(3) 脐动脉闭塞增加左心室输出的阻力。心房压力梯度的逆转使卵圆孔(foramen ovale)上的瓣膜突然关闭,其间隔瓣膜在数日内完成融合。
临床意义
动脉导管(ductus arteriosus)偶尔在出生后未能关闭。在新生儿中,这种被称为动脉导管未闭(patent ductus arteriosus,PDA)的先天性心血管异常,有时可通过给予非甾体类抗炎药物(如indomethacin或ibuprofen)进行纠正。若药物治疗未能实现导管闭合,或患儿年龄较大时,则必须通过其他方式实现闭合。PDA是与早产相关的最常见并发症之一。妊娠期不足8周的早产儿中,高达70%需要接受PDA治疗。与NSAIDs相比,acetaminophen已成为具有相似疗效且安全性更优的有效一线治疗药物。
关键点
- 血管系统由两个主要分支组成:体循环(systemic circulation)和肺循环(pulmonary circulation)。这两个分支呈串联关系,并由多种串联排列的血管类型(如动脉、小动脉、毛细血管)构成。通常,同类血管以并联方式排列。
- 特定类型血管中的血流平均速度(v)与心脏泵出的总血流量成正比,与该类所有并联血管的总横截面积成反比。
肺血管阻力(pulmonary vascular resistance)的下降使肺动脉压力降至原有水平的一半左右(约35 mmHg)。这种压力变化,加上主动脉压力的轻微升高,逆转了通过动脉导管的血流方向。然而在数分钟内,粗大的动脉导管开始收缩。这种收缩产生湍流,表现为新生儿心脏杂音。动脉导管的收缩是渐进性的,通常在出生后1至2天内完全闭合。动脉导管的闭合似乎由流经该处的动脉血高氧分压(Po₂)所启动:使用纯氧进行肺通气可关闭导管,而使用低氧空气通气则使该分流血管保持开放。目前尚不清楚氧气是直接作用于导管还是通过释放血管收缩物质发挥作用。
出生时,左右心室壁厚度大致相等。此外,肺动脉小动脉的肌层较厚;这种增厚是胎儿肺血管阻力较高的部分原因。出生后,右心室壁厚度逐渐减小,肺动脉小动脉的肌层也随之变薄。相比之下,左心室壁逐渐增厚。这些变化在出生后数周内逐步发展,反映了不同血流动力学力量(如血管阻力)对两个心室的作用。心脏肥大(cardiac hypertrophy)是出生后正常生长发育期心脏重量增加的基础。心血管系统发育产生的生理需求,连同可溶性因子(如生长激素、胰岛素样生长因子-1)水平的升高,共同解释了左心室质量从出生到成年早期增加超过一倍的生理性肥大机制。
- 泊肃叶定律(Poiseuille's law)描述了大于小动脉(arteriole)的血管中稳态层流血液的特性。然而,在非常小的血管中,血液流动呈现非牛顿流体性质(non-Newtonian)(即泊肃叶定律不适用)。
- 当存在以下情况时,流动易趋于湍流:(1)流速高,(2)流体黏度低,(3)流体密度大,(4)血管直径大,或(5)血管壁不规则。
- 动脉(artery)不仅将血液从心脏输送到毛细血管(capillary),还在每次心脏收缩期(cardiac systole)储存部分射出的血液。因此,在心脏舒张期(cardiac diastole)期间,血液仍持续流经毛细血管。静脉(vein)将血液从毛细血管运回心脏,其具有相对低阻力和高容量(capacitance)的特性,使其能够作为血液储库。
- 衰老过程会降低动脉和静脉的顺应性(compliance)。动脉顺应性越低,心脏为维持特定心输出量(cardiac output)所需做的功就越多。静脉顺应性越低,其储血能力越差。
- 平均动脉压(mean arterial pressure)与心输出量和总外周阻力(TPR)呈正相关。动脉脉压(arterial pulse pressure)与每搏输出量(stroke volume)呈正相关,但与动脉顺应性呈负相关。
- 毛细血管血流主要通过小动脉(阻力血管)的收缩进行调节。毛细血管内皮细胞(endothelium)是一氧化氮(NO)和前列环素(PGI₂)的来源,这些物质可松弛血管平滑肌。
- 水和溶质小分子主要通过扩散(diffusion),其次通过滤过(filtration)和吸收(absorption),经毛细血管孔在血管腔和间质液(interstitial fluid)之间移动。分子量超过约 60~\mathrm{kD} 的物质基本被限制在血管腔内。脂溶性物质(如 \mathrm{CO}_{2} 和 \mathrm{O}_{2})可直接穿过毛细血管的脂质膜;其转运速率与其脂溶性成正比。大分子可通过胞饮作用(pinocytosis)以囊泡(vesicle)形式跨越毛细血管壁,这些囊泡由毛细血管的脂膜形成。
- 毛细血管滤过和吸收可通过斯塔林方程(Starling's equation)描述:
$$
\mathrm{\Omega}=\mathrm{k}\Big[\big(\mathrm{P_{c}-P_{i}}\big)-\big(\pi_{\mathrm{p}}-\pi_{\mathrm{i}}\big)\Big]
$$
当方程各项的代数和为正值时发生滤过,为负值时发生吸收。
- 从毛细血管逸出的液体和蛋白质进入淋巴毛细血管(lymphatic capillary),并通过淋巴系统(lymphatic system)转运回血管腔。
- 影响冠状动脉血流(coronary arterial blood flow)的物理因素包括血液黏度、血管壁的摩擦阻力、主动脉压力以及左心室壁内血管的血管外压迫(extravascular compression)。左冠状动脉血流在心室收缩期因血管外压迫而受限,在舒张期当心肌内血管未受压时达到最大。冠状动脉血流的神经调节作用远不如代谢调节重要。心脏交感神经激活会收缩冠状动脉阻力血管(resistance vessels)。然而,由心率加快和收缩力增强引起的心肌代谢增强会产生血管舒张效应,这种效应会覆盖交感神经刺激的直接收缩作用。迷走神经心脏分支的刺激可引起冠状动脉小动脉(corterioles)的轻微扩张。心脏代谢活动与冠状动脉血流存在显著的平行关系。氧气(O₂)供应减少或需求增加会释放血管舒张物质(vasodilators),从而降低冠状动脉阻力。在已知可能介导此反应的因子(CO₂、O₂、H⁺、K⁺、H₂O₂、腺苷)中,KATP通道、NO、H₂O₂和腺苷是最可能的候选者,但CO₂、O₂和H⁺的作用也不能排除。
- 皮肤中大多数阻力血管(resistance vessels)同时接受交感神经系统和局部血管舒张代谢物(vasodilator metabolites)的双重调控。然而,手、足和面部的动静脉吻合支(AV anastomoses)仅受神经调控。皮肤血管的主要功能是通过收缩保存热量和舒张散失热量来调节体温。皮肤血管对高温会产生直接和反射性舒张,对低温则会产生直接和反射性收缩。
- 骨骼肌血流的调控由交感神经中枢性调控和血管舒张代谢物(vasodilator metabolites)局部释放共同完成。在静息状态下,血流主要受神经调控,但在肌肉收缩期间(如运动时)代谢调控占主导地位。
- 脑血流(cerebral blood flow)主要受代谢因子(尤其是CO₂、K⁺和腺苷)调控。由触觉、疼痛、手部运动、说话、阅读、推理和解决问题等刺激引起的局部脑活动增强,与对侧大脑皮层激活区域的血流增加相关。作为血脑屏障组成部分的神经血管单元(neurovascular unit)(微循环、周细胞、细胞外基质、星形胶质细胞和神经元)被认为能将脑活动与血流及氧合作用增强相连接。
- 肠绒毛(intestinal villi)的微循环构成了氧气(O₂)的逆流交换系统(countercurrent exchange system)。由于这种逆流交换系统的存在,在低血流状态下绒毛会处于危险状态。内脏阻力血管(splanchnic resistance vessels)和容量血管(capacitance vessels)对交感神经活动的变化反应极为敏感。
