第十章 神经系统的整合功能:修订间差异
自动添加《BERNE & LEVY 生理学 第八版》章节导航 |
|||
| 第210行: | 第210行: | ||
# 学习记忆的生物学基础可通过分子和细胞水平研究,使用不同动物及脑切片等多种实验模型。研究聚焦于长时程增强(LTP)和长时程抑制(LTD)等突触强度变化。 | # 学习记忆的生物学基础可通过分子和细胞水平研究,使用不同动物及脑切片等多种实验模型。研究聚焦于长时程增强(LTP)和长时程抑制(LTD)等突触强度变化。 | ||
# 损毁研究和行为研究表明大脑终生具有可塑性。但生命早期的可塑性更强,"关键期"的突触竞争对神经环路的建立至关重要。 | # 损毁研究和行为研究表明大脑终生具有可塑性。但生命早期的可塑性更强,"关键期"的突触竞争对神经环路的建立至关重要。 | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
2025年8月23日 (六) 17:12的版本
学习目标
完成本章学习后,学生应能回答以下问题:
- 新皮层(neocortex)的基本分层模式是什么?皮层输入和输出如何与该分层模式对应?皮层区域间分层模式差异的功能意义是什么?
- 大脑各叶的主要功能分别是什么?
- 脑电图(EEG)如何反映皮层活动?什么是诱发电位(evoked potentials)?
- 大脑优势半球如何与语言功能和利手偏好相关联?
- 失语症(aphasia)是什么?不同类型失语症中受损的功能有何不同?
- 突触和细胞过程如何支持学习与记忆?记忆在大脑中是如何分布的?
- 可塑性(plasticity)在神经系统发育和损伤后修复中起什么作用?
在前面的章节中,我们讨论了神经系统与身体及外部世界的相互作用,包括感觉事件的转导与分析、运动功能的组织,以及连接它们的相对简单的中枢过程(如牵张反射和前庭-眼动反射)。神经系统还具有其他能力——即所谓的整合功能或高级认知功能,这些功能与特定感觉模态或运动行为的关联较不直接。这些功能需要大脑皮层不同区域之间以及大脑皮层与其他脑区之间的相互作用。本章将讨论这些高级功能的神经基础。由于这些功能(以及感觉知觉和随意运动功能)高度依赖于大脑皮层,因此首先描述其基本组织结构。
- 基底神经节(basal ganglia)包括多个端脑深部核团(包括尾状核(caudate nucleus)、壳核(putamen)和苍白球(globus pallidus))。基底神经节与大脑皮层、底丘脑核(subthalamic nucleus)、黑质(substantia nigra)和丘脑相互作用。
- 从大脑皮层经基底神经节传递的活动对投射至皮层运动区的丘脑神经元具有促进或抑制作用,这取决于基底神经节直接通路与间接通路的平衡状态。当这两种通路失衡时,会出现运动过度或运动不足障碍。
- 某些类型的眼动有助于稳定视觉世界的成像。这一点至关重要,因为当视觉世界在视网膜上移动或滑动时,视敏度会急剧下降。前庭-眼动(vestibulo-ocular)和视动(optokinetic)运动通过补偿头部或外部世界(或两者)的运动,帮助将视觉世界稳定在视网膜上。平稳追踪运动(smooth pursuit movements)允许追踪视觉目标,使其始终保持在中央凹(foveae)中心。
- 扫视(saccades)的作用是将视觉场景的特定部分移至视敏度最高的视网膜区域——中央凹(fovea),以便进行详细观察。
- 脑干中存在专门控制垂直和水平眼动的神经环路与区域。这些区域既被皮层(当进行随意眼动时)使用,也被引发反射性眼动的感觉输入所使用。
大脑皮层
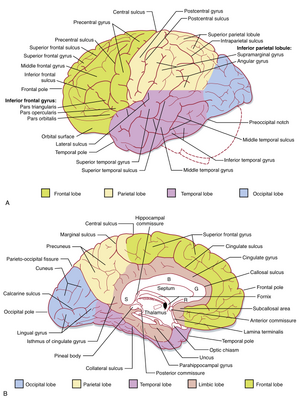
人类大脑皮层体积约为600cm3,表面积达2500cm2。皮层表面高度卷曲,形成称为回(gyri)的隆起结构。脑回之间被沟(较浅,sulci)或裂(较深,fissures)分隔(见图4.7)。这种折叠结构显著增加了能够容纳于颅骨有限固定空间内的皮层表面积。事实上,由于这种折叠结构,大部分皮层无法从脑表面直接观察。
大脑皮层可分为左右半球,并可进一步细分为若干脑叶(图10.1;另见图4.7),包括额叶(frontal)、顶叶(parietal)、颞叶(temporal)和枕叶(occipital)。中央沟(central sulcus)分隔额叶与顶叶,外侧裂(lateral fissure)将二者与颞叶分离。枕叶与顶叶在半球内侧表面由顶枕裂(parieto-occipital fissure)分隔(见图10.1)。外侧裂深部埋藏有另一脑叶——岛叶(insula)(见图4.6B)。边缘叶(limbic lobe)由一组结构组成,位于半球内侧,其最大组成部分海马结构(hippocampal formation)折叠进入颞叶的海马旁回(parahippocampal gyrus),无法从脑表面观察到。
大脑皮层两半球的活动通过大脑连合(cerebral commissures)的相互连接实现协调。大部分皮层通过庞大的胼胝体(corpus callosum)连接(见图4.9、10.1),颞叶部分则通过前连合(anterior commissure)连接。
大脑皮层可分为三种类型:新皮质(neocortex)、古皮质(archicortex)和旧皮质(paleocortex)。新皮质具有6层结构(图10.2),古皮质为3层,旧皮质为4-5层。人类约90\%的大脑皮层属于新皮质。
新皮质
新皮质中的神经元类型
新皮质包含多种不同类型的神经元(见图10.2)。锥体神经元(pyramidal neurons)是最主要的细胞类型,约占新皮质神经元的75%。其余由各类非锥体神经元(nonpyramidal neurons)构成,包括星形细胞(stellate cells)和GABA能中间神经元(GABAergic interneurons)。锥体细胞具有大型三角形胞体、一个指向皮层表面的长的主树突(apical dendrite)以及数个基树突(basal dendrites)。轴突从胞体与顶端树突相对的位置发出,较大锥体细胞的轴突可投射至皮层下白质。轴突在穿过皮层下降过程中可能发出侧支(collateral branches)。锥体神经元释放兴奋性氨基酸谷氨酸(glutamate)。抑制性中间神经元释放GABA,具有不同大小和形态,轴突投射范围局限在皮层区域内。皮层中的星形细胞胞体较小,具有多个分支树突,大量存在于第四层,虽主要进行局部投射,但可能为谷氨酸能或GABA能(详见下节)。
皮质层的细胞构筑
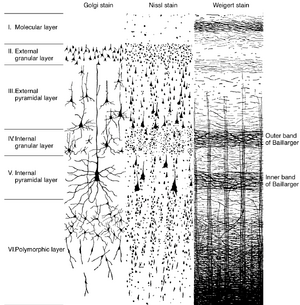
新皮质的六个层各具独特的细胞组成(见图10.2)。第I层(分子层)神经元胞体稀少,主要包含与顶树突形成突触的轴突末梢。第II层(外颗粒层)主要由星形细胞(stellate cells)构成。第III层(外锥体层)主要由小型锥体神经元组成。第IV层(内颗粒层)富含星形细胞和密集的轴突网络。第V层(内锥体层)主要由大型锥体神经元主导,这些神经元是皮质向大多数皮质下区域发出传出纤维的主要来源。第VI层(多形层)包含锥体细胞、梭形细胞和其他类型细胞。
皮质传入与传出纤维
中枢神经系统(CNS)其他区域向皮质的输入主要通过丘脑神经元中继,这在感觉和运动通路的早期章节已有描述。从丘脑到皮质的投射是皮质组织结构的重要组分,在分层模式中清晰可见。来自具有特异性(拓扑图谱化)皮质投射的丘脑核团的丘脑皮质纤维,主要终止于第IV层,但也分布于第III和VI层。其他丘脑核团(特别是中继脑干网状结构输入的核团)的神经元以弥散方式投射,终止于第I和VI层,可能在状态转换(如睡眠或觉醒)时对皮质活动进行整体调控。
除皮质下输入外,每个皮质区域都接受其他皮质区域的输入。存在连接远隔皮质区域的大型纤维束,连合纤维(commissural fibers)连接两侧半球的对应区域(这些投射终止于第I和VI层),但相对而言,皮质区域中最大的突触来源是局部连接,既包括区域内部也包括邻近区域的连接。
皮层传出轴突起源于锥体神经元(pyramidal neurons)。第II层和第III层较小的锥体细胞主要直接投射到相邻皮层区域,并通过胼胝体(corpus callosum)投射到对侧区域。第V层较大的锥体细胞通过多条通路投射到脊髓、脑干、纹状体和丘脑。第VI层的锥体神经元形成皮层-丘脑投射,这些投射靶向为其提供传入输入的相同丘脑核团,从而形成丘脑-皮层和皮层-丘脑的相互连接环路。
来自丘脑的特定输入模式对皮层组织具有另一种影响。如在感觉和运动系统中所讨论的,皮层输入的地形图式化(topographic mapping)定义了柱状组织结构。皮层柱是指从白质到皮层表面垂直方向上的狭窄区域,其中神经元由于共享来自丘脑的输入而具有协同活动。在皮层柱内部存在丰富的垂直连接,而横向连接(与相邻柱细胞的连接)较少,这使得皮层柱能够作为皮层的功能单位运作。然而尽管横向连接相对稀少,它们仍能产生强大的作用,例如运动皮层区域间的抑制性连接所示(见图9.16)。有趣的是,柱状组织既受遗传因素影响,也能被功能相互作用显著改变(参见"神经可塑性"章节)。
新皮层结构的区域差异
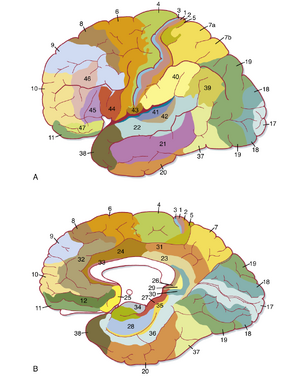
新皮层的构筑存在区域差异,这反映了皮层区域的功能特化。这种差异的不同方面是多种皮层分区方法的基础。最广泛使用的策略是细胞构筑学(cytoarchitectonics),即通过细胞密度和结构的差异进行分区。髓鞘构筑学(myeloarchitectonics,轴突密度和大小的差异)和化学构筑学(chemoarchitectonics,分子标记物的表达)也被用于皮层区域分类。
尽管已设计出多种细胞构筑学分区图谱,但最常使用的是Korbinian Brodmann的版本。该图谱将皮层划分为52个独立区域(图10.3),按Brodmann的研究顺序编号。常被提及的区域包括:Brodmann 3、1和2区(位于中央后回的主要躯体感觉皮层);4区(位于中央前回的主要运动皮层);6区(前运动皮层和辅助运动皮层);41和42区(颞上回的主要听觉皮层);以及17区(主要视觉皮层,大部分位于枕叶内侧)。后续研究证实Brodmann分区在细胞构筑、相互连接和功能方面具有独特性,但近期工作表明这些区域的大小和内部组织具有一定可塑性(参见"神经可塑性"章节)。
虽然细胞构筑图(如布罗德曼分区图)给人一种相邻脑区之间存在清晰界限的印象,但实际上,许多已界定皮质区之间的差异相当细微,且大多数相邻区域并非共享明确的分界,而是可能彼此间逐渐过渡。不过,一些脑区确实具有非常独特的皮质特征,尤其是初级感觉皮质和初级运动皮质。
例如,初级运动区和前运动区被称为无颗粒皮层,因为这些区域缺乏清晰可辨的第IV层。此外,在运动区中,初级运动皮层的特征性标志是存在大的第V层锥体细胞,其中最大的称为贝茨细胞 (Betz cells)。这些巨大的细胞发出的轴突参与构成皮质脊髓束,其巨大的胞体(直径>150微米)对于维持如此大量轴浆的物质代谢是必需的。需注意的是,尽管贝茨细胞在组织学上是识别初级运动皮层的标志,但它们的轴突仅占所有皮质脊髓纤维的不到5%。
与运动区相反,初级感觉皮质(例如,躯体感觉、听觉和视觉皮质)通常具有一个非常显著的第IV层(内颗粒层),该层主要分布着星状细胞(见图10.2),因此它们被划分为颗粒皮层。事实上,初级视觉皮质也被称为纹状皮质,正是因为其第IV层内有一层特别显著的含有髓鞘轴突的水平带,称为詹纳里带 (stripe of Gennari)。从某种意义上讲,“颗粒”和“无颗粒”这两个术语并不完全准确,因为所有皮质区域都含有大致相似比例的锥体细胞(≈75%)和非锥体细胞(25%)。然而,关键在于细胞类型在皮层中的分组方式在额叶运动区和初级感觉皮质之间存在着巨大差异:在额叶运动区,非锥体神经元未能形成一个清晰的内颗粒层;而在初级感觉皮质,它们却形成了这样的结构。
旧皮层与原皮层
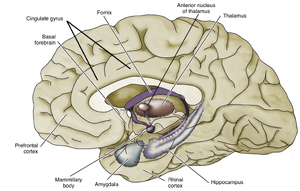
人类大脑皮层约10%由旧皮层(archicortex)和原皮层(paleocortex)构成。旧皮层具有三层结构;原皮层有四到五层。原皮层位于旧皮层与新皮层交界处。
在人类中,海马结构是旧皮层的一部分。它折叠于颞叶内,仅当大脑被解剖时可见。海马皮层分为三层:分子层、锥体细胞层和多形层。这些层与新皮层的I层、V层和VI层相似。覆盖海马的白质称为海马槽(alveus),内含海马的传入和传出纤维。传出轴突汇聚形成穹窿(fornix)(图10.4)。
大脑皮层各叶的功能
大脑皮层的褶皱(脑叶与脑回)与功能之间不存在精确对应关系,但大脑半球各叶与功能存在总体关联,这有助于理解皮层的组织方式。
额叶
额叶的主要功能之一是运动行为。如第9章所述,运动区(motor)、前运动区(premotor)、扣带回运动区(cingulate motor)和辅助运动区(supplementary motor)以及额眼区(frontal eye field)均位于额叶。这些区域对运动行为的规划和执行至关重要。人类语言优势半球(几乎总是左半球,后文将解释)的下额回(inferior frontal gyrus)内存在布罗卡区(Broca’s area),该区域对语言生成至关重要。此外,更前部的前额叶皮层(prefrontal cortex)在个性和情绪行为中起主要作用。
前额叶皮层的双侧损伤可能由疾病或手术性前额叶切除术(frontal lobotomy)导致。此类损伤会导致注意力缺陷、计划与解决问题困难、冲动性和不恰当社交行为。虽然痛觉保留,但攻击行为减少且疼痛的动机-情感成分减弱。由于伦理原因以及现代药物疗法为精神障碍和慢性疼痛提供了更人道有效的管理手段,前额叶切除术如今已极少实施。
顶叶
顶叶包含体感皮层(somatosensory cortex)(见第7章)和相邻的顶叶联合皮层(parietal association cortex)。顶叶联合皮层接收来自体感、视觉和听觉皮层的信息,参与感觉信息的处理、感知和整合。与额叶的连接使体感信息能辅助自主运动活动。体感、视觉和听觉信息也可传递至语言中枢(如后文所述的韦尼克区(Wernicke’s area))。左顶叶损伤可能导致格斯特曼综合征(Gerstmann’s syndrome),表现为患者无法命名自己或他人的手指,并丧失数字计算能力。右顶叶负责确定空间情境。右顶叶局灶性损伤(通常由卒中或创伤性脑损伤引起)可导致半侧空间忽视综合征(hemispatial neglect syndrome),患者会"忽视"其左侧视野。实际上,他们失去了对左侧感觉空间的意识:可能无法识别自身左侧身体,以及左侧的人、物体和事件(详见本章后文"在临床中"专栏)。极少数情况下,左顶叶皮层损伤可能导致右侧忽视。
在临床中
对运动任务的规划和执行至关重要的两个区域是顶叶皮层(parietal cortex)和额叶皮层(frontal cortex)。前者之所以重要,是因为它能整合定义任务情境所需的感官信息(见第7章);后者则因其含有直接调控运动执行所有组成部分的神经元(见第9章)。在猕猴的顶下小叶(inferior parietal cortex)和额下回(inferior frontal cortex)中均发现了镜像神经元(mirror neurons)。这些细胞在个体执行特定运动任务时会被激活,同时在观察其他个体执行相同任务时也会产生反应。由于这些镜像细胞似乎能编码并响应特定任务,推测它们可能是理解他人意图、共情能力以及通过观察学习任务等功能的基础。在人类中,与镜像神经元行为一致的脑电图(EEG)活动定位于额下回和顶上小叶(superior parietal lobes)。
枕叶
枕叶(occipital lobe)的主要功能是视觉信息处理与感知(见第8章)。初级视皮层(primary visual cortex,Brodmann 17区)位于距状沟(calcarine sulcus)周围,其两侧分别为次级视皮层(Brodmann 18区)和三级视皮层(Brodmann 19区)。楔叶(cuneus gyrus)的这些区域受损会导致对侧视野下半部失明;舌回(lingual gyrus)损伤则导致对侧视野上半部失明。与额叶眼区(frontal eye fields)的连接可影响注视方向,而向中脑的投射则协助调控辐辏眼球运动、瞳孔收缩和调节反射——这些现象均发生于眼睛适应近视力时。
颞叶
颞叶(temporal lobe)具有多种功能,包括声音与前庭信息的处理感知,以及高阶视觉处理(见第8章)。例如,其下表面的颞下皮层(infratemporal cortex)参与面部识别。此外,视通路的一部分——迈耶环(Meyer’s loop)——会穿过颞叶。因此,单侧颞叶损伤可导致双眼视野上象限的视力丧失(与损伤部位对侧),称为同向性上象限盲(homonymous superior quadrantanopia,有时称为“空中馅饼”视觉缺损)。需注意,若损伤累及穿过顶叶的上部视通路,则可能引发与损伤对侧的同向性下象限盲(homonymous inferior quadrantanopia)。颞叶另一重要区域是韦尼克区(Wernicke’s area),它对语言理解至关重要。
边缘系统(limbic system)主导内侧颞叶(见图10.4),参与情绪行为以及学习与记忆(见“学习与记忆”章节)。边缘系统通过帕佩兹环路(Papez circuit)影响下丘脑,从而部分调控情绪行为。该环路从扣带回(cingulate gyrus)投射至内嗅皮层(entorhinal cortex)和海马(hippocampus),再经穹窿(fornix)延伸至下丘脑乳头体(mammillary bodies)。随后,乳头丘脑束(mammillothalamic tract)将下丘脑与前丘脑核(anterior thalamic nuclei)连接,后者又投射回扣带回(见图10.4)。此外,海马和杏仁核(amygdala)与前额叶皮层、基底前脑(basal forebrain)及前扣带皮层(anterior cingulate cortex)存在连接。
临床相关
大脑皮层不同叶区的功能已通过以下方面的研究得以确定:疾病引起的损伤效应、治疗人类疾病的手术干预、创伤性脑损伤以及动物实验。其他发现来自对癫痫发作和行为变化的观察,其中引发癫痫发作的脑区(癫痫发作灶)与行为变化相关。例如,运动皮层的癫痫灶可引起对侧肢体运动;具体运动形式与发作灶的躯体定位区相关。起源于躯体感觉皮层的癫痫发作会引起一种癫痫先兆(aura),表现为感知到触觉。类似地,起源于视觉皮层的发作会导致视觉先兆(闪光、色觉),听觉皮层的发作会导致听觉先兆(嗡嗡声、蜂鸣声、铃声),前庭皮层的发作则会引起旋转感。复杂行为可能源于颞叶联合区的癫痫发作;此外,若累及嗅皮层(钩回发作),可能感知到恶臭性先兆。
双侧颞叶损伤可导致克吕弗-布西综合征(Klüver-Bucy syndrome),其特征包括:无法通过视觉线索识别物体意义(视觉失认症,visual agnosia);倾向于用口腔检查所有物体(包括危险物品);对无关刺激过度关注;性欲亢进;饮食习惯改变;以及情感淡漠。虽然该综合征最初被描述为累及大部分或全部颞叶的大范围损伤所致,但近期研究强调了杏仁核(amygdala)的作用。杏仁核负责将恐惧与疼痛刺激建立条件反射,并通过与内侧前额叶皮层及前扣带回的连接,在这些刺激再次出现时触发情绪或回避反应。此外,杏仁核投射至伏隔核(nucleus accumbens)——基底神经节的一个区域,被称为“奖赏中心”。伏隔核通过接收来自脑干腹侧被盖区(ventral tegmental area, VTA)的多巴胺能输入,对愉悦事件产生信号响应。
皮层的电活动
脑电图(electroencephalogram, EEG)是通过置于颅骨表面的电极记录大脑皮层的神经元电活动。EEG波形通常反映由锥体细胞突触电位产生所导致的细胞外电流总和,因此属于场电位(field potential)的一种。由于单个细胞产生的电流过小,无法被颅骨表面的电极检测为离散事件(若要记录单个神经元活动,需将微电极置于距离神经元数微米范围内),EEG波形反映的是大量神经元的协同活动。此外,只有当一组神经元的活动方向一致使其个体电流总和形成可检测的场时,才能在EEG上记录到相关事件。锥体神经元的排列方式(其顶树突平行对齐形成偶极层)特别有利于产生大幅场电位。该偶极层的一极朝向皮质表面,另一极朝向皮质下白质,因此具有相似排列方向的皮质锥体神经元群体产生的电流可叠加形成可测量的场电位。这种叠加需求也解释了为何EEG信号主要反映突触电位而非动作电位:电活动必须在时间上重叠才能叠加,而突触电位的持续时间远长于动作电位。
EEG波的极性可为正或负,但仅凭方向无法判断锥体细胞处于兴奋或抑制状态。例如,颅骨(或皮质)表面记录的负EEG电位可能由顶树突的兴奋或胞体附近的抑制产生;反之,正EEG波可能由顶树突的抑制或胞体附近的兴奋引起。
正常EEG描记包含多种频率的波形。主导频率取决于觉醒状态、受试者年龄、记录电极位置以及是否存在药物或疾病等因素。当正常清醒成人闭眼放松时,顶叶和枕叶记录的EEG主导频率约为8至12Hz,即α节律(alpha rhythm)。若要求受试者睁眼,波形同步性降低,主导频率增至13至30~Hz,称为β节律(beta rhythm)。δ节律(0.5{-}2Hz)和θ节律(3{-}7Hz)见于睡眠期间(参见下文;图10.5)。此外,EEG中确实存在短暂波形,因其形状有时被称为"棘波spikes",但这不意味着其与动作电位相关。
诱发电位(Evoked Potentials)
由刺激引发的脑电图变化称为皮层诱发电位(cortical evoked potential)。皮层诱发电位最易在被激活皮层区域上方的颅骨部位记录到。例如,视觉刺激产生的诱发电位最易在枕骨上方记录到,而体感诱发电位在额骨与顶骨交界处附近记录效果最佳。诱发电位反映大量皮层神经元的活动,也可能反映皮层下结构的活动。
与脑电波相比,诱发电位幅度较小。但通过信号平均(signal averaging)处理可增强其显现效果。该过程中,刺激被重复施加,每次试验记录的脑电图通过电子设备进行平均处理。随着每次刺激重复,诱发电位在刺激后固定时间出现。
当记录被平均时,与刺激随机时间关联的脑电图成分相互抵消,而诱发电位则叠加增强。
临床意义
诱发电位在临床上用于评估感觉通路的完整性,至少可评估至初级感觉接收区水平。这些电位可在昏迷患者以及年龄过小无法进行感觉检查的婴儿中记录。听觉诱发电位的初始部分实际反映脑干活动,因此该诱发电位可用于评估脑干结构功能。
临床意义
睡眠-觉醒周期具有约25小时的内源性周期节律,但通常会被昼夜节律所调控。昼夜节律的起源被认为是下丘脑视交叉上核(suprachiasmatic nucleus)。该核团接收视网膜投射,其神经元形成能适应明暗周期的生物钟。然而,当个体与环境隔离或跨时区(时差反应)时,这种调控会被破坏。视交叉上核损毁会导致包括睡眠-觉醒周期在内的多种生物节律紊乱。
睡眠-觉醒周期
睡眠与觉醒是机体呈现昼夜(约24小时)节律的众多功能之一。脑电图特征性变化与睡眠-觉醒周期中行为状态的改变相关。在清醒警觉的个体中,β波活动占主导,此时脑电图表现为去同步化(desynchronized)状态——显示低电压、高频率活动。闭眼放松的个体,其脑电图以α波(alpha waves)为主(见图10.5)。
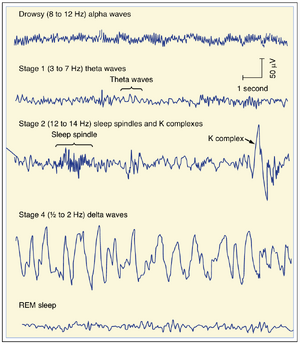
入睡者会在30至45分钟内依次经历四个慢波睡眠阶段(称为第1至4阶段)(见图10.5)。第1阶段中,α波与低频θ波(theta waves)交替出现。第2阶段,脑电波进一步减慢,但慢波活动会被睡眠纺锤波(sleep spindles,即12到14 Hz的突发活动)和大K复合波(K complexes,大幅慢电位)打断。第3阶段睡眠与δ波(delta waves)和偶发纺锤波相关。第4阶段特征为无纺锤波的δ波活动。
在慢波睡眠(slow-wave sleep)期间,身体肌肉放松,但姿势会间歇性调整。心率和血压下降,胃肠蠕动增强。随着个体经历这些睡眠阶段,被唤醒的容易程度逐渐降低。当个体觉醒时,会以相反顺序经历睡眠阶段。
约每90分钟,慢波睡眠会转变为另一种睡眠形式,称为快速眼动睡眠(rapid eye movement sleep,REM sleep)。在REM睡眠中,脑电图(EEG)再次呈现去同步化。REM睡眠的低电压快速活动类似于觉醒状态受试者的EEG表现(见图10.5,底部轨迹)。由于此时EEG与清醒个体相似且难以唤醒睡眠者,故用"异相睡眠(paradoxical sleep)"来表征这种睡眠类型。此时肌肉张力完全丧失,但在多个肌肉(尤其是眼肌)中会出现阶段性收缩。由此产生的快速眼动(REM)正是此类睡眠命名的依据。同时发生多种自主神经变化:体温调节功能丧失,瞳孔缩小(meiosis)发生,阴茎勃起可能出现,心率、血压和呼吸呈现间歇性变化。每夜会发生数次REM睡眠周期。虽然此时难以从外部唤醒睡眠者,但内部觉醒活动频繁。多数梦境发生在REM睡眠期间。
慢波睡眠(非REM睡眠)与REM睡眠的比例随年龄变化。新生儿约有一半睡眠时间处于REM睡眠,而老年人REM睡眠极少。青年人的睡眠中约20%-25%为REM睡眠。
睡眠机制尚未完全阐明。对脑干中被称为网状激活系统(reticular activating system)的大范围区域进行刺激可引起觉醒和低电压快速EEG活动。过去认为睡眠是由网状激活系统活动水平降低所致。然而大量数据(包括下位脑干麻醉会导致觉醒,以及孤束核附近延髓区域的刺激可诱导睡眠等观察结果)表明,睡眠是主动过程。研究者试图寻找睡眠机制与使用特定神经递质(包括血清素(serotonin)、去甲肾上腺素(norepinephrine)和乙酰胆碱(acetylcholine))的脑干神经网络之间的联系;这些递质在大脑中的水平变化可影响睡眠-觉醒周期。但目前尚未建立关于睡眠神经机制的详细神经化学解释。
同样地,睡眠的目的仍不明确。但由于人类生命约三分之一时间用于睡眠,且极度睡眠剥夺可导致死亡,其必然具有重要价值。近期假说认为,在部分睡眠阶段中,清醒时获得并通过海马(hippocampus)和其他颞区活动模式编码的短期记忆会被传递到皮层区域进行巩固和长期储存。具有医学重要性的睡眠-觉醒周期障碍包括:失眠、学习记忆功能破坏、注意力与专注力缺失、遗尿、梦游、睡眠呼吸暂停和发作性睡病。
临床相关
脑电波图(EEG)在多种病理状态下会出现异常。例如,昏迷期间EEG以δ波活动为主。脑死亡的定义标准是持续平坦的EEG波形。
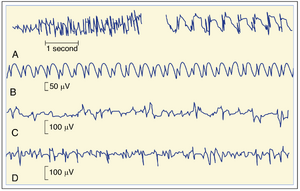
癫痫Epilepsy常引起特定的EEG异常,并可通过这些异常进行诊断。癫痫存在多种形式,图10.6展示了部分癫痫类型的EEG模式。癫痫发作可分为部分性发作和全面性发作。
一种部分性发作起源于运动皮层,导致对侧肌肉局部收缩。这种收缩可能扩散至其他肌肉,其扩散路径遵循运动皮层的躯体定位顺序(见第9章)。这种固定模式的扩散过程称为杰克逊行进(Jacksonian march)。复杂性部分发作(可能发生于精神运动性癫痫)起源于颞叶边缘结构,导致错觉和半目的性运动活动。在发作期间及发作间期,头皮电极记录可显示EEG棘波(见图10.6C,D)。
全面性发作涉及广泛脑区并伴有意识丧失。两种主要类型是失神发作(小发作)和强直-阵挛发作(大发作)。失神癫痫中意识短暂丧失(通常不超过15秒),EEG显示棘慢波活动(见图10.6B)。在强直-阵挛发作中,意识丧失时间更长,患者站立时可能跌倒。发作初期表现为全身肌张力增高(强直期),随后出现节律性抽动(阵挛期)。可能伴随大小便失禁。EEG显示广泛分布的发作活动(见图10.6A)。
在全面发作(seizure)之间出现的EEG尖波被称为发作间期棘波(interictal spikes)。这类事件可通过实验进行研究。这些尖波源于皮质神经元的突然、持久去极化(称为去极化漂移,depolarization shifts),会触发重复动作电位。此类去极化漂移可能反映癫痫病灶(epileptic foci)的多种变化,包括皮质神经元中由再生性钙离子(\mathtt{C a}^{++})介导的树突动作电位,以及皮质回路中抑制性相互作用的减少。过度活跃神经元产生的电场电位以及钾离子(\mathsf{K}^{+})和兴奋性氨基酸的释放,也可能促进皮质兴奋性的增强。
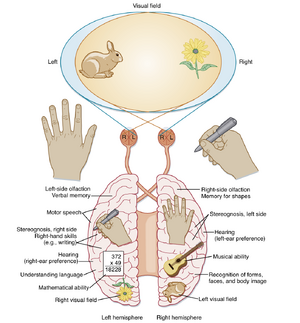
脑半球优势与语言功能
虽然右利手代表左半球的感觉运动优势,左利手代表右半球的感觉运动优势,但语言优势半球(cerebral dominance)被指定为存在语言中心的半球;在人类中,超过90%的右利手和左利手人群的左半球均为优势半球。这种优势性可通过以下方式证明:(1)左半球损伤导致语言功能缺损(失语症);(2)向左颈动脉注射短效麻醉剂时引发短暂性失语症(无法说话或书写)。非优势半球损伤及其麻醉剂注射通常不会显著影响语言功能。
左半球的多个区域参与语言功能。Wernicke区是位于颞上回(superior temporal gyrus)后部的大片区域,从听觉皮层后方延伸至顶叶。另一个重要语言区——Broca区,位于额下回(inferior frontal gyrus)后部,邻近运动皮层的面部代表区。Wernicke区损伤会导致感受性失语症(receptive aphasia),患者难以理解口语和书面语,但言语产生仍保持流畅(尽管内容可能无意义)。相反,Broca区病变会引起表达性失语症(expressive aphasia),患者虽能较好理解语言,但在言语生成和书写方面存在困难。
术语"感觉性失语症(sensory aphasia)"和"运动性失语症(motor aphasia)"常分别与"感受性失语症"和"表达性失语症"混用。但前者具有误导性:感受性失语症患者可能不存在听觉或视觉障碍,而表达性失语症患者的言语或书写相关肌肉运动控制可能正常。失语症并非源于感觉或运动技能缺陷,而是指无法将语言编码的感觉信息解码为概念,或无法将概念编码为语言。不过,优势半球的大范围病变可能导致混合型失语症,同时伴随感觉改变或部分语言表达相关肌肉的瘫痪。例如,运动皮层面部代表区的病变会导致无法控制言语所需的运动器官(声带、颌部、舌、唇),由于构音障碍(dysarthria)——一种机械性缺陷——表现为言语不清。但若上肢相关运动皮层未受累,患者仍可保留书写能力。
半球间通讯与胼胝体
两个大脑半球可相对独立运作(如单手控制),但需要跨半球信息传递以协调身体两侧活动。大部分信息通过胼胝体(corpus callosum)传输,部分则通过其他连合(commissures)传递(如前连合(anterior commissure)或海马连合(hippocampal commissure))。
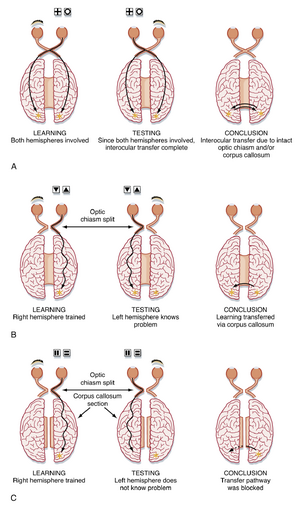
胼胝体(corpus callosum)在脑区间信息传递中的重要性如图10.7A所示。具有完整视交叉(optic chiasm)和胼胝体且左眼被遮挡的动物,能够学会视觉辨别任务(visual discrimination task)(见图10.7A)。信息通过视交叉建立的双侧连接或通过胼胝体,或同时通过这两种途径传递至双侧大脑半球。当动物左眼睁开而右眼被遮挡时进行测试(见图10.7A,中间),任务仍能完成,因为两个半球都已习得该任务。若在动物训练前切断视交叉,结果仍然相同(见图10.7B)。推测信息是通过胼胝体在两个半球间传递的。这一发现可通过在训练前同时切断视交叉和胼胝体来验证(见图10.7C)。此时信息无法传递,每个半球必须独立学习该任务。
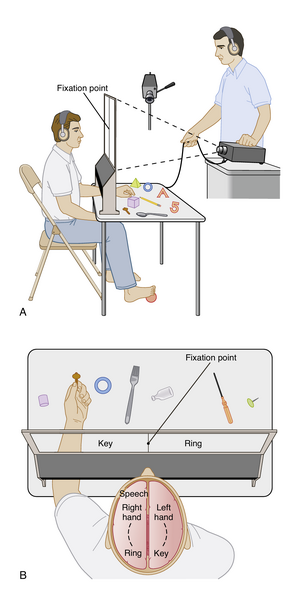
在人类患者中也进行了类似实验,这些患者为防止癫痫(epilepsy)的脑间传播接受了胼胝体手术切断(图10.8)。视交叉保持完整,但通过让患者将视线固定在屏幕中心点,视觉信息被导向某一侧半球。随后在注视点一侧闪现物体图片或名称,使关于图片的视觉信息仅到达对侧半球。屏幕下方的开口允许患者操纵不可见物体,这些物体包括投影图片中显示的内容。正常人能用任一手定位正确物体。然而胼胝体切断患者只能用与投影图像同侧的手(即接收视觉信息半球的对侧手)定位正确物体。要使手部探索并识别正确物体,视觉信息必须能到达皮层的体感(somatosensory)和运动区(motor areas)。当胼胝体被切断后,视觉区和运动区仅在大脑同侧保持相互连接。
另一项测试是要求患者口头识别图片中的物体。对投射在注视点右侧的图片,患者能做出正确言语反应,因为视觉信息仅到达左(语言优势)半球。然而患者无法口头识别呈现在左侧半视野的图片,因为视觉信息仅到达右半球。
临床相关
当使用不同形式的刺激时,在胼胝体(corpus callosum)横断患者中也可以观察到类似现象。例如,当向这类患者发出"抬起右臂"的言语指令时,他们能够毫不费力地执行。左半球的语言中枢将信号传递至同侧运动区,这些信号最终引发右臂运动。然而,这些患者无法响应"抬起左臂"的指令。除非胼胝体完整,否则左侧语言区无法影响右侧运动区。施加于身体右侧的躯体感觉(somatosensory)刺激可被胼胝体横断患者描述,但施加于左侧的相同刺激则无法被描述。若胼胝体被切断,到达右侧皮层躯体感觉区的信息将无法传递至语言中枢。
除语言功能外,通过研究胼胝体横断个体的表现,还可以比较两半球其他功能能力的差异。这类患者用右半球比用左半球更能解决三维拼图,表明右半球在空间任务中具有特殊功能。其他与右半球关联更密切的功能包括面部表情、肢体语言和语调(图10.9)。胼胝体横断患者缺乏正常的半球间协调。例如穿衣时,一只手可能在扣纽扣,而另一只手却在试图解开纽扣。对这些患者的观察表明,当两半球不再相互连接时,它们能够相当独立地运作。然而,一个半球可以通过语言表达自身,而另一个半球只能通过非语言方式交流。
学习与记忆
神经系统高级中枢的主要功能是学习与记忆。学习是一种神经机制,通过该机制,生物体的行为随经验而发生改变。记忆是所学内容的存储机制。
半球间差异的显著例证
半球间差异最为引人注目的例证之一是"半侧空间忽视(Hemispatial neglect)"现象,这是非优势半球(几乎总是右侧半球)顶叶皮层损伤所致。此类病例中,患者会忽视左侧视野内的物体和个体,绘制物体时左侧部分残缺不全,否认自身左臂左腿的存在,且无法完成身体左侧的穿衣动作。患者还会否认存在任何此类功能障碍(病觉缺失,anosognosia)。虽然患者可能对身体左侧的触觉和针刺刺激产生反应,但无法识别放置在左手掌中的物体。该损伤区域邻近第一躯体感觉(SI)皮层和视觉联合皮层,提示该区域在身体意象和近体空间感知中具有特殊作用。优势半球的类似损伤仅导致某些高级躯体感觉功能丧失,如书写触觉缺失(agraphesthesia,无法识别手掌上书写的字符)和实体觉缺失(astereognosis,无法仅通过触觉识别物体)。
记忆与学习的神经机制
哺乳动物的记忆与学习涉及复杂的神经回路系统,研究难度较大。替代性研究途径包括动物实验(特别是研究无脊椎动物的简单神经系统)、损伤后功能后果分析,以及细胞和通路水平的解剖/生理学研究。例如在海洋软体动物aplysia中,研究者成功分离出单个感觉神经元与运动神经元之间的连接,该连接显示出习惯化(habituation,学会不对无意义刺激的重复呈现作出反应)、敏感化(sensitization,在强刺激或伤害性刺激呈现后,对后续无害刺激的反应性增强)甚至联合条件反射(associative conditioning,学会在无关事件与重要事件关联后对前者作出反应)等学习特征。就习惯化而言,连续反应中递质的释放量会逐渐减少。这种变化涉及触发神经递质释放的Ca++电流改变,其原因是反复动作电位导致突触前Ca++通道失活。长期习惯化也可被诱导,此时残留神经末梢的突触终末数量和活性区会减少。
长时程增强
脊椎动物的研究聚焦于突触强度的动态变化机制。具体而言,大量研究关注突触的长时程增强(long-term potentiation, LTP)和长时程抑制(long-term depression, LTD)。
LTP(长时程增强)的研究最为深入的是海马体内的在体(in vivo)和离体(in vitro)海马脑片制备实验。LTP和LTD(长时程抑制)也在中枢神经系统的其他区域被研究,包括新皮层和小脑(LTD是小脑研究的重点;见第9章)。对海马细胞区传入通路进行相对短暂的高频激活,可诱导兴奋性海马神经元突触反应的长时程增强。突触反应的增强(即LTP)在体外可持续数小时,在体内可能持续数天至数周甚至更久。这种突触效能增强的机制主要涉及突触后位点的改变。重复兴奋过程中释放的谷氨酸同时作用于AMPA和NMDA受体。NMDA受体的激活导致Ca++内流进入突触后神经元,从而触发第二信使通路,包括Ca++/钙调蛋白依赖性激酶II、蛋白激酶G和蛋白激酶C。这些激酶引起蛋白质磷酸化及神经递质受体反应性的改变。LTP过程中还会激活即刻早期基因。值得注意的是,突触后代谢型谷氨酸受体(mGluRs)的激活也可通过释放细胞内储存的Ca++诱导LTP和LTD,这一过程由mGluR介导的光滑内质网三磷酸肌醇(IP3)受体激活触发。
记忆
关于记忆存储的阶段划分,区分短期记忆(short-term memory)和长期记忆(long-term memory)是有意义的。近期事件似乎通过持续的神经活动存储于短期记忆中,因为短期记忆仅持续数分钟。例如,短期记忆用于记住从索引中查到的书籍页码。但需注意,短期记忆不应与工作记忆(working memory)混淆,后者指在短时间内(数秒)使用、操纵和应用记忆的能力。工作记忆由前额叶皮层中持续活跃的神经元(在需要该信息的整个期间保持活跃)编码。长期记忆可进一步分为可被破坏的中间形式和难以破坏的持久形式。记忆丧失(即遗忘症)可能由记忆信息本身的丢失引起,也可能源于信息提取机制的干扰。长期记忆可能涉及结构改变,因为即使在破坏短期记忆的事件发生后,长期记忆仍能保持完整。
颞叶似乎对记忆特别重要,因为双侧切除海马结构(hippocampal formation)会严重且永久地破坏近期记忆。现有的长期记忆不受影响,但新的长期记忆无法再形成。因此,这类遗忘症患者能记住手术前的事件,却无法回忆新事件——即使经历多次重复接触,对术后遇到的人也必须反复重新认识。这种陈述性记忆(declarative memory)的丧失涉及对个人事件、地点和普遍历史的有意识回忆。然而,这类患者仍能学习某些任务,因为他们保留了程序性记忆(procedural memory)——一种涉及联想和运动技能的隐性记忆。若让此类患者完成复杂任务(如镜像书写),他们不仅在首次训练中有所进步,在后续几天表现也会更好,尽管他们否认之前有过相关经验。虽然参与程序性记忆的脑结构尚未完全明确,但已知小脑和基底神经节在此类记忆中起重要作用。
神经可塑性
可塑性(plasticity)通常指中枢神经系统改变其连接能力的能力。这种改变可发生于多种情境中,包括学习记忆、损伤和发育过程。中枢神经系统的损伤可诱导神经通路重塑,从而改变行为。可塑性在发育中的大脑最为显著,但成年大脑仍保留一定程度可塑性——这可通过某些干预后的反应证明,如脑部损伤、感觉剥夺甚至经验积累。
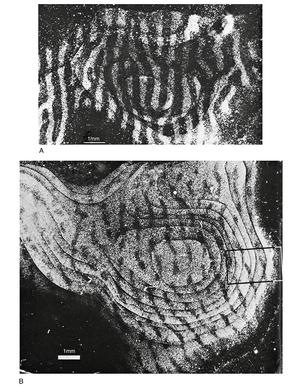
某些神经系统的发育可塑性可能在其关键期(critical period)达到最大。例如,在视觉通路发育期间,通过阻断单眼输入可改变其形成的某些连接,但仅限于发育早期的特定关键期。在此类视觉剥夺动物中,视觉连接会变得异常(图10.10),若在关键期后恢复正常视觉输入,既无法消除异常连接,也无法恢复被剥夺眼的功能性视力。相反,生命后期的类似视觉剥夺不会导致异常连接。此类实验观察到的可塑性变化可能反映了突触连接的竞争机制:功能性较差的连接会被修剪淘汰。
临床相关
传统政策通常延迟对先天性白内障患儿实施矫正手术,直到儿童年龄较大更能承受手术压力。然而,若将矫正推迟至"关键期(critical period)"之后,则功能完全恢复的可能性显著降低。类似地,因单侧眼外肌相对薄弱导致斜视(内斜视(strabismus))而患有弱视(amblyopia)的儿童,往往优先使用未受影响的眼睛。目前对于这两种情况,早期手术已成为常规实践,以便通过双眼的平衡输入正确塑造皮层回路。
细胞水平
对海马体(hippocampus)及其相邻且平行的内嗅皮层(entorhinal cortex)的细胞研究表明,当实验对象进入测试环境中的特定位置时,"位置细胞(place cells)"会产生动作电位。尽管存在大量位置细胞,但它们并不以类似地形图的有序方式分布。位置细胞在幼年动物具备探索能力时即已出现。最新研究揭示了"网格细胞(grid cells)"的存在,这些细胞同样对特定位置产生响应,但以六边形阵列分布,在后侧内嗅皮层形成类似环境空间的有序地图。虽然这种认知地图在任何情境下都是固定的,但环境改变或将个体转移至新测试环境时,网格细胞会生成新的适应该环境的地图。
由于内嗅皮层是海马体的主要输入源,针对伦敦出租车司机的研究显示:经过专业培训的资深司机其后侧海马体体积显著大于新手或普通人群——这些司机在获得执照前必须掌握极其详尽的街道信息和最优路线。临床上常见的"迷路"主诉(通常与失忆症相关),可能与空间记忆能力的丧失有关。
成人脑损伤后仍可发生可塑性改变。受损中枢神经系统(CNS)中确实会出现新轴突的萌芽(sprouting);然而,这些新芽未必能恢复正常功能,且许多神经通路似乎不会产生萌芽。若要改善中枢神经系统疾病和神经创伤后的医疗方案,深入了解成年中枢神经系统神经可塑性的相关知识至关重要。当前研究正在探索人类胚胎干细胞恢复中枢神经系统功能的潜力。
幻肢觉是成人神经可塑性的典型案例。截肢患者常在被截除肢体对应身体区域受刺激时感知到已缺失肢体的感觉。功能成像研究表明,这是由于周围皮质区域的连接向原服务于被截肢体的皮质区域扩散所致。
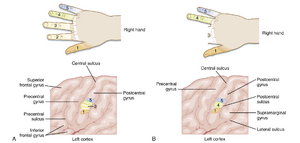
此类重组现象也可见于手部第二、第三指手术截肢后。术前,每个手指在中央后回(SI皮质)具有离散且体表拓扑定位的表征区域。术后,原被截除手指的表征区域现被邻近手指的扩大表征所占据(图10.11)。相反,先天性并指畸形(syndactyly,手部两个或多个手指融合)患者,其SI皮质中这些手指仅存在单一或大部分重叠的表征。矫正手术后,独立手指逐渐形成差异化表征。更值得注意的是,经过需要每日反复使用指尖的感觉辨别任务训练的猴子,其皮质也显示出相应改变:不仅SI皮质中指尖表征区域较训练前扩大,皮质记录到的指尖感受野数量也同步增加。
关键要点
- 大脑皮质可根据脑回和脑沟的模式分为若干叶。各叶通过病变效应可证实其独特功能。左大脑半球在多数个体中主导语言功能。韦尼克区(Wernicke's area,位于颞叶后部)负责语言理解,布罗卡区(Broca's area,位于额叶下部)负责语言表达。
- 新皮质(neocortex)包含锥体细胞(pyramidal cells)和多种中间神经元。特异性丘脑皮质传入纤维主要终止于新皮质第四层;弥散性丘脑皮质传入纤维在Ⅰ层和Ⅵ层形成突触。第五层锥体细胞的轴突是向脊髓、脑干、纹状体和丘脑等皮质下结构输出的主要来源。
- 不同区域的皮质结构存在差异。Brodmann分区系统反映了这些结构差异,并与功能独立的区域相对应。
- 脑电图(EEG)反映了锥体细胞活动产生的电场,其波形随睡眠-觉醒周期状态、疾病和其他因素变化。皮质诱发电位是脑电图中由刺激触发的电位变化,为感觉传导提供重要临床信息。
- 睡眠期间的脑电图模式分为慢波睡眠和快速眼动(REM)睡眠。慢波睡眠经历1-4期的阶段性进展,每期具有特征性脑电图模式。多数梦境发生于REM睡眠期。睡眠由脑干机制主动产生,其昼夜节律性受视交叉上核调控。
- 两半球间的信息传递主要通过胼胝体实现。右半球在空间任务、面部表情、肢体语言和语音语调处理方面更具优势;左半球专门负责语言理解与生成、逻辑推理和数学运算。
- 记忆包括工作记忆(持续数秒)、短时记忆(持续数分钟)和长时记忆(持续数小时至终生)。记忆还可分为陈述性记忆、空间记忆和程序性记忆等不同形式。
- 海马和新皮质参与某些记忆形式(如陈述性记忆)的存储与提取。程序性记忆主要涉及小脑和基底神经节。
- 学习记忆的生物学基础可通过分子和细胞水平研究,使用不同动物及脑切片等多种实验模型。研究聚焦于长时程增强(LTP)和长时程抑制(LTD)等突触强度变化。
- 损毁研究和行为研究表明大脑终生具有可塑性。但生命早期的可塑性更强,"关键期"的突触竞争对神经环路的建立至关重要。
