第五章 动作电位的生成和转导:修订间差异
无编辑摘要 |
自动添加《BERNE & LEVY 生理学 第八版》章节导航 |
||
| 第283行: | 第283行: | ||
# | # | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
2025年8月23日 (六) 17:12的版本
学习目标
完成本章学习后,学生应能回答以下问题:
- 神经膜对小幅度刺激的响应为何类似于由电池、电阻器和电容器组成的被动电路?
- 决定神经膜时间常数和空间常数的因素有哪些?这些常数如何影响神经膜的电响应?
- 动作电位与膜下阈值响应(即被动响应和局部响应)有何不同?
- 构成动作电位的电导变化顺序是怎样的?
- 钠({\mathsf{Na}}^{+})通道和钾({\mathsf{K}}^{+})通道对膜去极化的响应有何相似性?钠通道失活门的存在如何导致两者响应差异?
- 钠通道和钾通道的门控特性如何与动作电位的绝对不应期和相对不应期相关联?
- 动作电位如何实现无衰减传导?决定其传导速度的因素有哪些?
- 髓鞘通过哪些结构特性实现传导速度的提升?
- 鉴于动作电位的"全或无"特性,中枢神经系统如何区分不同刺激的特征?
动作电位是膜电位发生的一种快速、全或无的变化,随后恢复到静息膜电位。本章将阐述动作电位如何由质膜上的电压门控离子通道产生,并沿轴突全长以相同大小和形状传播;同时讨论并解释轴突几何结构、离子通道分布及髓鞘对动作电位的影响。此外,还描述了单个细胞及神经细胞群通过动作电位频率与模式进行信息编码的方式。最后,鉴于神经系统通过特定感觉受体提供外部世界的重要信息,本章亦将介绍感觉转导与编码的基本原理,更详细的感觉机制及系统内容可参见其他章节。
膜电位
膜电位的观测
当将一个尖锐的微电极(尖端直径 <0.5μm)插入神经元的质膜时,可观察到细胞内的微电极尖端与置于细胞外的电极之间存在电位差。内部电极相对于外部电极约负 70~mV,这种差异被称为静息膜电位(resting membrane potential),简称静息电位(详见第1章关于静息电位形成机制的讨论)。(按照惯例,膜电位表示为细胞内电位减去细胞外电位。)神经元的静息电位通常约为 -70~mV。
神经元的标志性特征之一是其能够对适当刺激产生快速膜电位变化。这类响应主要包括动作电位(action potential)和突触电位(synaptic potential),分别在本章和下一章中描述。目前关于动作电位离子机制的认识来源于对多种物种的实验研究。其中研究最深入的是枪乌贼(squid),因为其巨大轴突(直径可达 0.5mm)的尺寸优势,使其成为使用细胞内电极进行电生理研究的理想模型。
被动响应
要理解动作电位(action potential)如何产生及其存在的必要性,就必须先了解神经细胞膜的被动电学特性(passive electrical properties)。所谓被动特性,是指细胞膜各组分的电学行为与电路中的无源元件(passive elements)(包括电池、电阻器和电容器)极为相似。这一特性非常重要,因为这些元件的电学特性已被充分研究。具体而言,含有离子通道的膜片对跨膜电压变化的响应方式,与由电阻和电容并联组成的电路(并联RC电路)非常相似:离子通道相当于电阻器,而脂质双层则起到电容器的作用。当电池首次连接到并联RC电路的两个端子时,所有电流都流经含有电容器的支路,导致其两端电压开始变化(回忆电容公式:Iα dV/dt)。然而随着时间的推移,流经电容器的电流逐渐减少,而流经电阻器的电流逐渐增加。在此过程中,电容器(及电阻器)两端电压的变化速率逐渐减慢,最终趋近稳态值。这种电压变化呈指数时间过程,其具体特征取决于电阻器电阻(R)和电容器电容(C)。此外,该电路的时间常数(time constant) τ可由公式R×C定义,它等于电压以指数方式上升(或下降)至初始值与终值差值的约63%所需的时间。
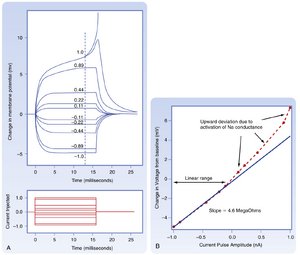
关于轴突对电刺激的实际响应方式,图5.1展示了一个实验的结果。该实验通过向轴突细胞膜施加矩形脉冲的去极化(向上脉冲)或超极化(向下脉冲)电流来改变其膜电位。正电荷的注入具有去极化作用,因为它降低了细胞的负性(即减少了跨膜电位差)。相反,负电荷的注入会使膜电位更负,这种电位变化称为超极化(hyperpolarization)。注入的电流越大,膜电位的变化就越大。由于膜的被动特性,对超极化和小幅度去极化电流脉冲的响应(见图5.1A)都具有相同的基本形态。相比之下,对较大去极化刺激脉冲的响应形态则与上述情况不同,这是因为较大刺激激活了膜中的非被动成分(nonpassive elements)。
对于超极化电流脉冲的响应,当电流脉冲开始后经过足够长时间使膜电压达到平台期(基本为数个\tau时间常数)时,几乎所有注入电流都流经膜电阻。如果将初始电压与稳态电压的差值对电流脉冲幅度作图(见图5.1B),可观察到超极化脉冲呈线性关系,这完全符合欧姆定律对电阻电流的预期。这条直线的斜率称为细胞的输入电阻Rin(input resistance),其测定方法正是前述实验方法。Rin与细胞膜电阻rm相关,但具体关系取决于细胞几何形态,在多数情况下较为复杂。
需注意,虽然电流以具有垂直上升沿和下降沿的矩形脉冲形式注入,但脉冲开始和结束后的膜电压响应却呈现较缓慢的升降过程。此外,仅考虑超极化和小幅度去极化电流脉冲的响应时(见图5.1A),膜电位的升降过程呈现指数曲线形态。这表明膜对这些电流脉冲的响应方式类似于并联RC电路(parallel RC circuit),即刺激不会改变膜电阻或膜电容cm,因此所有情况下电压升降的时程都相同,因为它们受同一膜时间常数τ支配。
电压与电流之间上述关系表明,在一定的刺激范围内,轴突某一区域的细胞膜可被建模为一个被动RC电路。然而,该模型电路仅包含单个电阻器和电容器,未考虑轴突是空间延伸结构这一事实,也未能考虑因此导致的胞内空间电阻在某一区域电活动影响其他区域过程中的重要作用。换言之,若轴突不存在胞内电阻,其胞内空间将呈等电位状态,跨轴突膜某部分发生的电压变化(如前所述)将在所有区域瞬时同步出现。这种情况下,无需特殊机制(即动作电位)来主动沿轴突传播信号。实际上,轴突(及神经元整体)是具有空间延伸性的结构,不同区域间的电流流动存在显著阻力(这也是Rin与rm关系复杂的原因之一)。因此,理解沿轴突某点注入的电流如何影响其他点膜电位至关重要,因为这既有助于解释为何需要动作电位,也能帮助解释其某些特征。
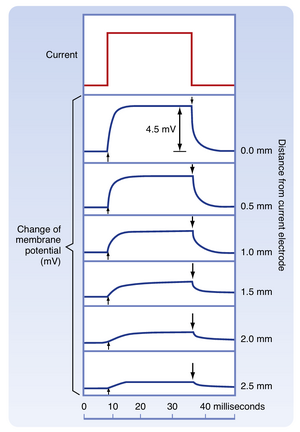
当仅引发被动反应的电流脉冲通过质膜时,记录到的电位变化幅度取决于记录电极与电流通过点之间的距离(图5.2)。记录电极距离电流通过位点越近,电位变化幅度越大且上升速率越快。电位变化幅度随与电流通过位点距离的增加呈指数衰减,这种电位变化称为被动传导或电紧张传导(electrotonic conduction)。此类被动传导的电位变化沿膜扩散距离有限,很快即衰减至可忽略水平。如图5.2所示,电紧张传导的信号在数毫米距离内即完全衰减。电位变化幅度衰减至最大值1/e(37%)时所对应的距离称为长度常数(length constant)或空间常数(space constant)(其中e为自然对数的底数,等于2.7182)。哺乳动物轴突的典型长度常数为1至3mm,而其轴突长度可达一米以上,这明显需要一种机制将胞体产生的电活动信息传递至轴突远端。
空间常数(length constant)
根据电缆理论,空间常数可与轴突的电学特性相关联,因为神经纤维具有许多电缆的电学特性。在理想电缆中,芯导体的绝缘层能完全阻止电流向周围介质流失,因此信号沿电缆传输时强度不会衰减。若将无髓神经纤维(后文讨论)与电缆相比,质膜相当于绝缘层,细胞质作为芯导体,但质膜并非完美绝缘体。因此信号的扩散取决于膜电阻与轴突细胞质轴向电阻ra的比值。当rm与ra的比值较高时,单位轴突长度上通过质膜流失的电流较少,轴突能更好地发挥电缆功能,且信号通过电紧张性传导无显著衰减的距离也更长。一个形象的类比是将轴突视为带孔的花园软管:软管上的孔越多,沿其长度泄漏的水量越大(类似rm较低时电流流失更多),到达喷嘴的水量就越少。
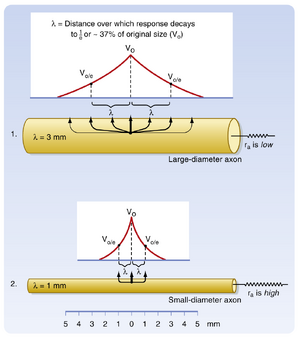
根据电缆理论,空间常数与轴突电阻相关,等于√rm/ra。这一关系式可用于确定轴突直径变化如何影响空间常数,进而揭示电紧张电位衰减的差异。轴突直径增加会同时降低ra和rm。但rm与直径成反比(因其与轴突周长相关),而ra与直径平方成反比(因其与轴突横截面积相关)。因此,随着轴突直径增大,ra比rm下降更快,导致空间常数增加(图5.3)。
综上,在被动域中,膜对电刺激的响应本质上与由被动电学元件组成的电路相同,因此可通过膜的空间常数和时间常数来表征。这两个常数决定了细胞内某点产生的电信号向其他部位扩散的距离和速度。
局部响应(Local Response)
关于图5.1所示的实验,当注入更大的去极化电流脉冲时,膜的电压反应不再类似于被动RC电路的行为。这种现象在引起刚好低于动作电位阈值膜电位或达到阈值但仍未能诱发动作电位的脉冲中最易观察到(轨迹0.89和1.0;阈值膜电位可定义为诱发动作电位的概率为50%时的电压)。在这些情况下,电压反应形态与被动反应不同,因为刺激已使膜电位变化到足以导致大量电压敏感型Na+通道开放(后文详述)。
同时注意I-V曲线中对应点的向上非线性偏离(见图5.1B)。这些电压敏感通道的开放改变了膜的电阻,并允许Na+在其电化学梯度驱动下更易进入。这种正电荷(Na+电流)的进入通过叠加电极传递的电流脉冲增强了去极化。由此产生的去极化称为局部反应(local response)。局部反应源于膜特性的主动变化(特别是其Na+电导),而在被动电紧张反应中,各离子的电导保持恒定。尽管如此,局部反应仍不具备自我再生能力,其振幅同样随距离衰减。膜特性的变化不足以达到产生动作电位所需的条件。
随着去极化电流脉冲振幅的增大,局部反应的幅度会逐渐增加,直至达到阈值膜电位。此时可能出现另一类反应——动作电位(action potential,或称为锋电位)。阈值通常接近-55mV。正常情况下,当膜电位超过该值时,总会触发动作电位。
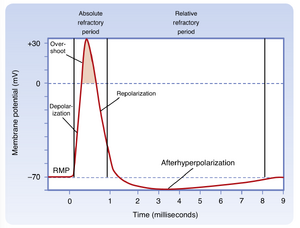
图5.4展示了动作电位的典型形态。当膜去极化超过阈值时,去极化过程呈现爆发性,并出现超射(overshoot),导致膜电位由负转正,接近(但未达到)Na+的能斯特平衡电位(ENa;见第2章)。随后膜电位以几乎与去极化相同的速度返回静息膜电位(复极化),并通常会超极化至静息电位以下(后超极化,afterhyperpolarization)。动作电位的主相位(从起始到返回静息电位)通常持续1-2毫秒,但后超极化可持续数毫秒至100毫秒,具体取决于神经元类型。
动作电位在三个重要方面不同于阈下和被动反应:(1)其振幅大得多,膜电位的极性实际上会超过0~mV(细胞内部相对于外部变为正电位);(2)动作电位通常能在不衰减的情况下沿轴突全长传导(即其大小和形状得以保持,因为它在沿轴突传播时被不断再生);(3)它是全或无反应(all-or-none response),这意味着刺激通常要么产生完整大小的动作电位,要么完全无法引发。这种全或无特性既不同于前文描述的被动和局部反应的等级性特征,也不同于突触反应(见第6章)。
动作电位的离子基础
静息膜电位主要由Na+(能斯特电位ENa)和K+(能斯特电位EK)的加权平均值决定,该关系由弦电导方程(chord conductance equation)定义(见第2章)。加权因子是每种离子的电导\big\langle\mathbf{g}=1/电阻)。静息状态下,\mathrm{K}^{+}的电导(\mathrm{g_{K}})相对于Na+的电导(\mathrm{g_{Na}})较高,因此静息膜电位(\mathrm{V_{r}})更接近EK}(\mathrm{V_{r}}\cong-70~mV)。然而,若这些离子的相对电导发生变化,将引起膜电位的相应改变。例如,\mathrm{g_{K}}增加会使膜超极化,而\mathrm{g_{K}}减少会使膜去极化,因为EK约为\mathrm{-100mV}。相反,\mathrm{g_{Na}}增加会使膜去极化,若增幅足够大,甚至会引发膜电位极性反转,因为ENa约为+65~mV。
离子通道与门控
轴突动作电位实际上是钠电导(gₙₐ)和/或钾电导(gᴋ)快速连续瞬时变化的结果。在所有轴突中,钠电导会短暂上升后回落至基线水平。在某些轴突中,这种gₙₐ变化发生在固定静息钾电导(由非电压门控的渗漏通道所决定,后文将讨论)的背景下。但在更多情况下,gₙₐ和gᴋ会同时发生变化。因此与静息膜电位类似,动作电位的形成也取决于两种相反的作用趋势:(1) 钠离子梯度使膜电位趋向钠离子的能斯特电位;(2) 钾离子梯度使膜电位趋向钾离子的能斯特电位;但不同于神经元静息状态的是,此时gᴋ/gₙₐ比值并非恒定,而是持续变化的。另一个重要区别在于:由于膜电位处于动态变化中,电容电流也会存在,因此在定量描述动作电位期间的膜电位时必须将其纳入考虑(由此可知,弦电导方程仅适用于膜电位恒定的情况,因为此时不存在电容电流)。
动作电位的早期相位(膜电位向Eₙₐ方向的正向偏转)源于钠电导(gₙₐ)的快速增加,从而导致钠电流(Iₙₐ)增强。这些变化使膜电位向钠离子的平衡电位移动。动作电位峰值无法达到Eₙₐ,因为gₙₐ的增加并非无限(即gᴋ/gₙₐ比值不会降为零)。
由于钠离子通道的特性(后文详述),去极化引起的gₙₐ上升是瞬时的。此外,在许多情况下,去极化还会引发gᴋ的上升。这两个因素共同导致gᴋ/gₙₐ比值停止下降并开始回升,从而使膜电位被驱动返回Eᴋ方向,最终复极化至静息值。在复极化过程中涉及钾电导增量(Δgᴋ)的情况下,膜电位会暂时超极化至正常静息值以下(若gᴋ未发生改变,则gₙₐ的下降仅使膜电位回归静息电位)。这种后超极化现象的出现是因为动作电位结束后,gᴋ仍会在一段时间内维持升高状态。随着gᴋ逐渐恢复至基线水平,膜电位也回归其静息值。
上述电导变化可通过钠离子通道和钾离子通道的特性进行解释,下文将对此展开讨论。
动作电位机制的早期研究
关于动作电位产生机制的早期研究表明,离子电流通过细胞膜上具有不同特性的独立Na+和K+通道(channel)流动。后续研究支持了这一解释。目前,通道蛋白的氨基酸序列及其诸多功能与结构特征已得到详尽解析。
电压门控Na+通道(voltage-gated Na+ channel)(图5.5)的结构由四个α亚基和两个β亚基组成。α亚基包含四个重复的结构域,每个结构域由六个跨膜螺旋围绕中央离子孔道形成。孔道壁部分由每个结构域中的六个螺旋构成。大多数电压门控K+通道则由四个独立亚基组成,每个亚基由具有六个跨膜片段的肽链构成,与Na+通道α亚基的结构域类似。
某些通道(如产生动作电位的基础通道)的重要特征是其门控特性受膜电压调控。这些电压门控通道通过感知跨膜电位变化,并根据膜电压水平开启或关闭孔道/闸门。闸门由带电荷的氨基酸残基群构成,Na+和K+通道闸门的电压依赖性能够解释动作电位过程中\mathrm{g_{Na}}和\mathrm{g_{K}}的复杂变化。
Na+和K+通道特性解释动作电位期间的电导变化
通过标准细胞内记录联合电压钳技术,研究者得以描述动作电位相关的离子电流及电导变化特征。对这些记录的详细统计分析还使人们能够对传递Na+和K+电流的通道本质作出重要推论。然而,膜片钳记录技术的发展使得直接观察单个通道的行为成为可能。该技术中,特制微电极(尖端直径1~3 {\upmumm})贴附于细胞表面,并对微电极施加吸力,从而在膜与电极尖端间形成高阻抗封接(图5.6A),可记录封接区域内膜片所含通道的活动。理想条件下,膜片中仅存在单个类型的一个或少数几个离子通道。
• 图5.5 电压门控Na+通道模型。A、红色主体表示四个α亚基,黄色部分为两个β亚基,标注有α蝎毒素(ScTx)和河豚毒素(TM)结合位点。B、显示β1和β2亚基围绕一个α亚基及其跨膜螺旋的排布。(改绘自Catterall WA. Structure and function of voltage-gated sodium channels at atomic resolution. Exp Physiol 2014;99:35-51.)
膜片钳记录显示,许多离子通道会自发地在开放和关闭的传导状态之间切换,仿佛其孔道入口处存在可开闭的门控机制。对于电压门控通道而言,门控系统对跨膜电压敏感,因此门控处于各状态的时间是膜电位(membrane potential)的概率函数(probabilistic function)。对K+通道的膜片钳记录展示了这种概率行为(见图5.6B)。当膜电位被钳制于更去极化(depolarized)的水平时,通道处于开放状态的时间比例增加,这反映了通道开放的电压依赖性(voltage dependence)(见图5.6C)。此外,开放状态的电流幅值随去极化程度增加而增大,这是因为在更去极化的水平下K+的驱动力(driving force)更大(即膜电位离K+的能斯特电位更远)。
Na+通道的行为比K+通道更为复杂。与K+通道类似,它具有电压敏感门控(激活门,activation gate),其开放概率随去极化而增加。然而不同于K+通道的是,在持续去极化条件下,Na+通道仅在去极化初始阶段开放,随后保持关闭状态。这表明Na+通道具有第二道门控(失活门,inactivation gate),其开放概率随着膜去极化而降低。因此,这些通道传导的任何Na+电流都是瞬态的(见图5.6D),因为同一刺激(去极化)既增加激活门开放的概率,也增加失活门关闭的概率。值得注意的是,Na+通道具有两种关闭状态:一种是激活门关闭的状态,此时通道被称为"关闭(closed)";另一种是失活门关闭的状态,此时通道被称为"失活(inactivated)"。当第二道门关闭时通道被称为"失活"的原因是:一旦该门关闭,它将保持此状态直至膜复极化(repolarized)。相比之下,激活门在所有膜电位下均可开闭,只是概率不同。
根据前文讨论的Na+和K+通道门控行为知识,我们可以理解动作电位(action potential)是如何通过这些通道的相互作用产生的(在下文中,我们假设\mathrm{g_{Na}}和\mathrm{g_{K}}在动作电位期间都发生变化)。如前所述,动作电位起始于Na+电导(\mathrm{g_{Na}};Ω图5.7)的快速增加。这种Na+电导的增加反映了去极化作用下大量Na+通道的开放。开放的通道允许Na+离子内流,而该电流的作用是进一步去极化细胞膜。值得注意的是,这是一个正反馈循环,这解释了动作电位的爆发性质:Na+电流使细胞膜去极化,导致更多Na+通道开放,进而增加Na+电流。总之,Na+通道的电压依赖性开放和Na+电流的去极化作用共同导致了动作电位的上升相。
动作电位上升相的终止及其后续的下降相(复极化相)是两个过程共同作用的结果:\mathrm{g_{Na}}的降低和\mathrm{g_{K}}的增加。\mathrm{g_{K}}的升高是细胞膜去极化的直接结果,这会提高K+通道开放的概率。\mathrm{g_{Na}}的降低则源于两个因素:首先,Na+通道因去极化导致失活闸门关闭而进入失活状态。与激活闸门(即使在细胞膜去极化时仍可在不同状态间切换)不同,失活闸门一旦关闭,就会保持关闭状态直至发生显著复极化;其次,随着\mathrm{\Deltag_{K}/g_{Na}}比值的增加(这是Na+通道失活和K+通道开放共同作用的结果),细胞膜开始复极化,这种复极化会关闭Na+通道的激活闸门。
在动作电位下降相期间,电压门控Na+和K+通道的关闭使细胞膜恢复静息状态。如果动作电位期间只有Na+通道开放(某些轴突的情况),细胞膜将直接返回静息电位。如果在动作电位期间电压门控K+通道也开放,则会出现后超极化(afterhyperpolarization),因为这些K+通道对超极化的响应关闭较慢。
在细胞水平
• 图5.6 A,将微量移液管(micropipette)置于细胞膜表面,施加适当吸力使尖端形成单一通道的电隔离。放大器记录通过该通道的电流。B,每条线显示单个K+通道开放时通过的电流。注意当跨膜电压逐渐去极化时(从上至下),通道开放概率和电流幅度均增加。C,通道开放概率与膜去极化程度的关系图。D,显示跨膜电压(下方轨迹,右侧标尺)和Na+通道群体电流密度(current density)(上方轨迹,左侧标尺)的图表,该膜片与A中类似(但含有多个Na+通道)。初始静息电位时无电流流动。当去极化至0mV时出现内向Na+电流,但即使持续去极化该电流仍会衰减,这是由于通道失活门(inactivation gates)的关闭。短暂恢复静息电位后再次去极化至0mV仍可诱发内向电流,但幅度更小且持续时间更短,因为多数慢失活门尚未足够时间重新开放。(B、C、D改绘自http://www.physiologymodels.info/electrophysiology)
• 图5.7 动作电位及其相关的电导和电流随时间变化的关系。注意Na+电导增加({\mathfrak{g}}_{Na})及其内向电流与动作电位的上升支相关,而K+电导(\mathfrak{g}_{K})的缓慢增加及其外向电流则与膜复极化和后超极化相关。动作电位峰值前Na+电流(I_{Na})的减弱(尽管\mathtt{g}_{\mathtt{Na}}仍处于高位)是由于Na+通道的失活。(改绘自Squires LR, Berg D, Bloom F, et al. Fundamental Neuroscience. 2nd ed. San Diego, CA: Academic Press; 2002.)
对通道分子结构的了解加深了人们对其特性基础的理解。例如,大多数通道对特定离子具有高度选择性。首先,如果通道壁带有正电荷或负电荷,则阳离子或阴离子可能被排除;然而,大多数通道对相同电荷的不同离子也表现出差异通透性。这种进一步的选择性似乎源于离子在通过通道最狭窄部分(称为选择性滤器(selectivity filter))时需要脱水。溶液中的离子是水合的(被\mathsf{H}_{2}\mathsf{O}分子壳层包围),这种水合壳(hydration shell)的半径因离子类型而异。在Na+和K+通道中,为了使脱水在能量上可行,通道的孔道内排列着具有特定几何形状的负极化氨基酸取代基,这些取代基替代了水分子。然而,这种替代需要滤器尺寸与离子的水合壳层精确匹配。由于每种离子的水合壳层大小不同,特定通道将最有利于某一种特定离子的通过。
在细胞水平
河豚毒素(Tetrodotoxin, TTX)是已知毒性最强的毒物之一,能特异性阻断Na+通道。TTX结合于钠通道的胞外侧(见图5.5A)。另一种毒物四乙铵(tetraethylammonium, $\left\overline{{\mathsf{T}}\mathsf{EA}^{+}\right$)可阻断$K+$通道。TEA+从胞质侧进入$K+$通道并阻断通道,因为$\mathsf{TEA^{+}}$无法通过该通道。某些河豚(又称刺鲀)的卵巢中含有TTX。在日本,生河豚肉被视为珍馐美味。鉴赏家们享受鱼肉中微量TTX引起的唇部刺痛麻木感。经过安全去除卵巢培训的寿司厨师需获得政府许可才能料理河豚。尽管有这些预防措施,每年仍有数人因食用处理不当的河豚而死亡。
石房蛤毒素(saxitoxin)是另一种Na+通道阻断剂,由引发"赤潮"的红色甲藻产生。贝类摄食这些甲藻后会在组织中富集石房蛤毒素。食用此类贝类的人可能在餐后30分钟内出现危及生命的麻痹症状。
适应性调节
适应现象
当神经被极缓慢去极化时,即使通过正常阈值也可能不会触发动作电位;这种现象称为适应现象(accommodation)。Na+和K+通道均参与适应现象的形成。在膜去极化过程中,\mathrm{g_{Na}}首先增加,随后在短时间内减少。这是由于Na+通道的激活门开启和失活门关闭所导致。通常情况下,膜去极化达到或超过阈值会触发动作电位;然而,只有当临界数量的Na+通道被募集时,动作电位的爆发性去极化才可能发生。因此,若细胞被缓慢去极化,Na+通道可能在未产生动作电位的情况下直接进入失活状态,此时可用未失活Na+通道(即处于关闭状态的通道)的数量可能减少到无法通过刺激募集足够通道来产生动作电位的程度。
导致适应现象的另一个重要因素是K+通道在去极化过程中缓慢开启。\mathrm{g_{K}}的增加会对抗膜的去极化,从而进一步降低触发动作电位的可能性。
不应期
当细胞处于不应期时,它要么完全无法触发动作电位,要么需要比正常更强的刺激。在动作电位的大部分时间内,细胞处于完全不应期状态,此时无论施加多强的刺激都无法触发新的动作电位。这种绝对不应期(见图5.4)发生在大部分Na+通道处于失活状态时,因此在膜复极化前这些通道无法被重新激活。在此期间,产生动作电位所需的临界数量Na+通道无法被募集。
临床关联
在一种名为原发性周期性高钾性麻痹(primary periodic hyperkalemic paralysis)的遗传性疾病中,患者会出现疼痛性自发性肌肉收缩发作,随后受累肌肉进入麻痹期。这些症状伴随血浆和细胞外液中[K+]的升高。部分患者的电压门控\mathsf{N a}^{+}通道存在突变,导致电压依赖性失活速率降低。这会延长骨骼肌细胞动作电位的持续时间,并增加每次动作电位期间的K+外流,从而升高细胞外[K+]。
细胞外[K+]的升高会导致骨骼肌细胞去极化。最初,去极化使肌细胞更接近阈值,因此更容易发生自发性动作电位和收缩。随着细胞去极化程度加剧,越来越多的\mathsf{N a^{+}}通道进入失活状态,导致细胞进入不应期。最终,细胞无法产生动作电位,也无法响应运动轴突的动作电位进行收缩。
动作电位的传导
在动作电位的后期阶段以及后超极化(afterhyperpolarization)期间,细胞能够触发第二个动作电位,但需要比正常更强的刺激。这一时期称为相对不应期(relative refractory period)。在相对不应期的早期,当膜电位尚未恢复到静息电位水平时,部分Na+通道仍处于电压失活状态,但仍有足够数量的通道处于关闭状态(因此当膜去极化时仍可能开放)——若这些通道被刺激开放,仍可支持动作电位的产生。然而,必须施加比正常更强的刺激才能募集到触发动作电位所需的临界数量Na+通道(即通过提高通道开放概率来弥补可用Na+通道总数的减少)。在整个相对不应期内,K+电导持续升高,这对抗膜的进一步去极化。K+电导的增加贯穿整个后超极化阶段,并构成了相对不应期大部分时程的主要原因。
动作电位的传导
神经系统功能的核心是信息沿神经元通路的传递。为实现这一点,神经元产生的动作电位会沿其轴突全长无衰减地传播,从而触发突触前末梢释放神经递质。本节将讨论动作电位如何沿轴突传播,以及轴突特性如何影响这种传播。关于动作电位如何触发递质释放的内容将在第6章详述。
动作电位的传播
被动传导无法将信号从轴突一端传输到另一端,除非轴突非常短(即与其长度常数相当),因为被动传导信号的幅值会随传播距离迅速衰减。存在具有此类短轴突的神经元,例如在视网膜中,神经元之间的距离极小,电紧张性(被动)传导已足够。然而在多数情况下,轴突长度远超其长度常数。事实上,某些轴突可长达1\textrm{m}以上(如运动神经元轴突),是其长度常数的数百倍。尽管如此,若研究者从典型轴突的各个记录点观察,会发现动作电位沿轴突传播至连续位点时,其波形和幅值保持不变。这是因为动作电位在沿纤维传导时会自我再生,因此被称为主动传播。
• 图5.8 去极化电紧张性扩散的机制。A,局部去极化时发生的膜极性反转。B,流动的局部电流使膜的相邻区域去极化并允许去极化的传导。
图5.8展示了在局部反应中,通过膜某部分流入的电流如何作用于邻近膜区域使其去极化。当轴突某处的动作电位(action potential)打开Na+通道时,也会发生同样的情况,只是此时电流强度足以使两侧区域去极化超过阈值,从而在这些相邻区域产生动作电位。这些区域的内向Na+电流随后可提供足够电流使其邻近区域去极化超过阈值,进而依次产生动作电位,以此类推。简而言之,动作电位沿轴突的传播涉及反复的去极化循环,从而为细胞膜相邻区域生成动作电位提供足够的局部电流。因此可以说动作电位沿着轴突向下传播,在其延伸路径上不断生成"新"的动作电位。通过这种方式,动作电位能够在保持相同大小和形状的同时传播至轴突全长。
通常,动作电位首先在轴突起始段(即轴突与神经元胞体或近端树突相连处)产生,随后传导至终末。这是因为起始段具有极高密度的电压门控(voltage-gated)Na+通道,因此其产生动作电位的阈值低于胞体或树突。然而,轴突本质上并非单向导体。例如,如图5.8所示的局部回路所示,由轴突中部去极化产生的动作电位会从其起始点同时向两个方向传导。
为什么起始段产生的动作电位不会双向传导?实际上确实会双向传导。除了沿轴突向下传播外,从起始段回流至胞体的电流可引发胞体产生动作电位,在某些神经元类型中(锥体神经元、中等多棘神经元等;不包括浦肯野细胞),这种信号还会逆向传播进入树突,因为胞体和树突也含有电压门控Na+通道。逆向传入树突的动作电位为树突系统提供了神经元输出的逆行信号。研究还表明,树突动作电位可激活树突中的电压门控Ca++通道,这些通道可能参与突触传递强度的调控(详见第6章)。
轴突不会产生"反向传播"的动作电位
然而,从轴突发出的"反向传播"动作电位不会发生,胞体和树突产生的动作电位也不会引发轴突起始段第二次放电(从而沿轴突发送第二个动作电位并启动重复循环)。这种现象不会出现的原因是膜的不应期(refractory period)特性——任何已产生过动作电位的区域在短时间内无法再次放电。因此,对于从起始段产生并开始沿轴突传导的动作电位,其所在部位的电流流入会使该部位两侧的膜去极化。然而靠近胞体的一侧由于刚刚完成放电,其Na+通道仍处于失活状态,无法对此去极化产生响应。当Na+通道完成去失活(即恢复到关闭状态并能够再次开放)时,该部位的膜去极化已经结束(因为动作电位仅持续约~1毫秒)。因此,Na+通道的失活门(inactivation gate)不仅决定了动作电位的持续时间,还确保了动作电位从起始段开始后仅以单向、单次的形式传播。
动作电位传导速度与轴突直径相关
神经纤维的传导速度取决于细胞质和包裹纤维的质膜(plasma membrane)的电学特性,以及纤维的几何结构。在无髓神经纤维中,传导速度与横截直径的平方根成正比(图5.9)。这种效应与ra(轴向电阻)和rm(膜电阻)随直径的变化有关。随着纤维直径增大,ra与直径平方成反比减小,而rm仅与直径呈正相关增加。这使得轴突纵向电流的阻力减小幅度大于跨膜电流阻力的增加幅度,从而导致长度常数(length constant)增大(见图5.3)。这意味着在某一部位进入的电流会有更大比例传递到轴突相邻区域,使这些区域更快达到阈值,因此动作电位在直径较大的纤维中传导更快。
• 图5.9 猫无髓(蓝色)和有髓(红色)轴突传导速度与直径的关系。实线表示实测数据,虚线表示外推结果,显示髓鞘化相比单纯增加轴突直径在提升传导速度方面的优势。(源自Schmidt-Nielsen K. Animal Physiology: Adaptation and Environment. 5th ed. Cambridge: Cambridge University Press; 1997.)
然而,增加直径也会增大质膜表面积,使得更多内部负电荷与外部正电荷相互束缚。对增大的膜电容进行放电会减慢传导速度,从而部分抵消因直径增大带来的传导速度提升。
髓鞘化显著提高传导速度
脊椎动物的神经髓鞘化
在脊椎动物中,许多神经纤维被髓鞘包裹,这类纤维称为有髓纤维(myelinated)。髓鞘由施万细胞(Schwann cells)(外周神经系统)或少突胶质细胞(oligodendroglia)(中枢神经系统 [CNS])的质膜构成,这些细胞包绕并绝缘神经纤维(图5.10A,B)。髓鞘由数层至超过100层的胶质细胞质膜组成。宽约1至2μm的间隙——称为郎飞结(nodes of Ranvier)——将相邻施万细胞(或少突胶质细胞)形成的髓鞘分隔开。
对于除最细轴突外的所有轴突而言,相同直径的有髓轴突比无髓纤维具有更高的传导速度。这是因为髓鞘能:
- 增加轴突的有效膜电阻
- 降低轴突膜的电容
- 将动作电位的产生限制在郎飞结
简而言之,髓鞘化显著改变了轴突的电学特性。
由于多层膜包裹轴突增加了有效膜电阻rm/ra,长度常数(length constant)也显著增大。膜电阻的增加意味着单位轴突长度上通过膜流失的电流减少,因此传导信号的幅度随轴突距离衰减更小,且需要再生(通过Na+通道开放)的频率降低。
此外,较厚的髓鞘包裹膜使得跨膜电荷分离程度远大于裸露轴突膜。这类似于电容器极板间距增大导致电容减小。由于膜电容的作用会延缓膜电位变化速率,髓鞘轴突的电容降低意味着去极化发生更快。综合这些因素,髓鞘化使传导速度大幅提升,郎飞结处产生的电流能以极高速度传导至下一个结(见图5.10)。
在有髓轴突中,引发动作电位的Na+通道高度集中于郎飞结,结间区不存在此类通道。因此动作电位仅在郎飞结(间隔0.3-2mm)再生,而非像无髓纤维那样沿纤维连续再生。髓鞘多层结构的离子流动阻力极高,跨膜电流主要局限于郎飞结处裸露的质膜短段(见图5.10C)。因此动作电位在每个连续的结上再生。进入结的局部电流几乎完全从一个结传导至下一结,使每个结在约20μsec内达到阈值。这种动作电位看似从一个郎飞结"跳跃"至下一个的现象称为跳跃传导(saltatory conduction,源自拉丁语saltare,"跳跃")(图5.11)。
髓鞘形成的功能影响
通过比较鱿鱼与哺乳动物的轴突,可以突显髓鞘形成的功能影响。尽管人类神经纤维的直径远小于鱿鱼巨轴突,但由于髓鞘的存在,人类轴突的传导速度可与之相当甚至更快。无髓鞘的鱿鱼巨轴突直径为500μm,传导速度约为20m/秒。在哺乳动物中,轴突直径范围约为0.2至20μm,所有直径大于1至2\upmumm的纤维均被髓鞘包裹。哺乳动物的无髓鞘神经纤维(直径小于1至2μm)的传导速度低于2mm/秒(见图5.9),这一结果符合预期,因为其直径相较于鱿鱼巨轴突更小。相比之下,直径为10μm的哺乳动物有髓鞘纤维的传导速度可达50m/秒,是500μm鱿鱼巨轴突的两倍以上,尽管其直径仅为后者的1/50。因此,髓鞘化通过极细的轴突实现的高传导速度,使得中枢神经系统无需大幅增加体积即可显著提升神经元连接性。这无疑是哺乳动物神经系统演化的重要因素之一——其海量神经元既能产生快速反射,也能支持高效而复杂的思维活动。
感觉转导(Sensory Transduction)
临床相关
在某些称为脱髓鞘疾病(demyelinating disorders)的病理状态下,髓鞘会发生退化。多发性硬化症(multiple sclerosis)中,中枢神经系统轴突的散在性进行性脱髓鞘会导致运动控制丧失和感觉缺陷。严重糖尿病(diabetes mellitus)病例中常见的神经病变是由周围轴突脱髓鞘引起的。当髓鞘丢失时,长度常数(length constant)会显著缩短。因此,动作电位在通过电紧张传导(electrotonically conducted)从一个郎飞结到下一个郎飞结时,其振幅会逐渐衰减。若脱髓鞘程度足够严重,动作电位到达下一个郎飞结时可能强度不足,无法在该节点触发新的动作电位,从而导致传导失败(propagation failure)。
细胞水平
(注:原文未提供后续内容,此处保留原章节标题)
• 图5.11 无髓鞘轴突与有髓鞘轴突动作电位传导的比较。初始时刻(A和C),动作电位在每条轴突左侧产生。注意无髓鞘轴突(A)的内向电流使相邻部分去极化,而有髓鞘轴突(C)的内向电流使所有膜结构去极化直至下一个节点。在第二个时刻(B和D),无髓鞘轴突(B)的动作电位已在相邻部分产生,而有髓鞘轴突(D)的动作电位已在后续节点产生,并已使最右侧的节点去极化。(改绘自 Castro A, Neafsey E, Wurster R, Merchut M. Neuroscience: An Outline Approach. Philadelphia: Mosby; 2002.)
临床相关
在某些称为脱髓鞘疾病(demyelinating disorders)的病理状态下,髓鞘会发生退化。多发性硬化症(multiple sclerosis)中,中枢神经系统轴突的散在性进行性脱髓鞘会导致运动控制丧失和感觉缺陷。严重糖尿病(diabetes mellitus)病例中常见的神经病变是由周围轴突脱髓鞘引起的。当髓鞘丢失时,长度常数(length constant)会显著缩短。因此,动作电位在通过电紧张传导(electrotonically conducted)从一个郎飞结到下一个郎飞结时,其振幅会逐渐衰减。若脱髓鞘程度足够严重,动作电位到达下一个郎飞结时可能强度不足,无法在该节点触发新的动作电位,从而导致传导失败(propagation failure)。
细胞水平
髓鞘化轴突的动作电位可能不会出现超极化后电位(hyperpolarizing afterpotential)或延长的相对不应期(relative refractory period),因为其K+通道从郎飞结(nodes)移位至部分暴露的结旁区(paranodes)。这一结构特点提升了这些快速传导轴突的放电频率。髓鞘化轴突在代谢效率上也优于无髓鞘轴突。钠钾泵(Na+/K+-ATPase)通过排出动作电位期间进入细胞的Na+,并促使流出的K+重新积聚。在髓鞘化轴突中,离子电流被限制于郎飞结处的小部分膜表面区域。因此,单位长度纤维膜所通过的离子量大幅减少,维持离子梯度所需的离子泵活动及能量消耗也显著降低。
临床视角
研究者无需穿刺轴突即可记录动作电位:通过在其表面放置两个间隔电极并比较各点的电荷量即可实现。位于动作电位发生区域的电极相较于无动作电位区域的电极会产生轻微的负向信号。当动作电位传导至第二电极时,记录的极性会发生反转。该技术被临床用于评估神经功能。外周神经和许多中枢通路由不同直径的轴突群组成(图5.12);其中部分轴突具有髓鞘,部分则无。因此,动作电位在不同轴突中的传导速度存在差异。使用外部电极记录此类神经时,所获信号并非单一同步峰,而是呈现时间(反映轴突群的传导速度)和幅度(反映各速度群中轴突数量)各异的系列峰。这种现象称为复合动作电位(compound action potential)。此类记录的临床价值在于:在某些疾病状态下可揭示特定功能相关轴突群的功能障碍,同时该技术具有无创性优势——可通过皮肤表面电极实现(表5.1)。
能诱发感觉转导(sensory transduction)的环境事件可以是机械能、热能、化学能或其他形式的能量。然而,特定生物体所利用的信息类型取决于其拥有的感觉受体(sensory receptors)集合。例如,人类无法感知电场或磁场,但其他动物具有此类刺激的感知能力。特别值得注意的是,许多鱼类具有电感受器(electroreceptors),而不同鱼类和鸟类会利用地球磁场进行迁徙定向。
• 图5.12 混合(肌肉)神经(A)与皮神经(B)中轴突尺寸与传导速度的分布特征。注意皮神经中小直径纤维数量增加且缺乏Aα纤维。(改编自Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 3rd ed. Philadelphia: Churchill Livingstone; 2006.)
转导过程随检测的环境刺激类型而变化
图5.13展示了三种刺激如何改变特定感觉受体(负责转导此类刺激)膜特性的示例(这些示例的更多细节将在其他章节中讨论)。图5.13A说明了化学感受器(chemoreceptor)(如用于味觉和嗅觉的感受器)在化学刺激物与感觉受体质膜上的受体分子发生反应时的响应机制。化学刺激物与受体分子结合后,离子通道打开,引发离子内流,从而使感觉受体细胞去极化(这类似于第6章中描述的配体门控通道的情况)。
图5.13B中,机械感受器(mechanoreceptor)(如皮肤中的感受器)的离子通道在膜受到机械力作用时打开,允许离子内流并使感觉受体去极化。图5.13C中,视网膜光感受器细胞(因其对光响应而得名)的离子通道在黑暗中保持开放,而当内部盘状膜上的色素吸收光子时关闭。在这种情况下,黑暗中存在离子内流;光照时电流停止。电流停止后,光感受器发生超极化(由于光子捕获与其影响的离子通道之间存在空间距离,此过程必然涉及细胞内“第二信使”机制)。
受体的性质也可能不同
最简单的受体仅是轴突的特化部分。在这种情况下,刺激转导为受体电位以及该电位转化为动作电位序列(spike train)的过程均发生在同一细胞中。例如,如图5.14A所示,机械刺激(如手指皮肤受压)可使构成机械感受器的轴突膜发生形变。这种形变引发轴突末梢的内向电流,以及轴突邻近部分沿纵向的外向电流。外向电流产生的去极化(即受体电位)可能超过动作电位的阈值(见图5.14B)。若达到阈值,则会引发一个或多个动作电位,并通过该初级传入纤维(primary afferent fiber)传递至中枢神经系统(CNS),从而传递机械刺激的信息。
轴突群的功能特性与其复合动作电位记录的相关性(Correlation of Axon Groups, as Revealed by Compound Action Potential Recordings, With Their 5.1 Functional Properties)
markdown
周围神经的电生理学分类
N{+}A,不适用。改编自 Haines DE. Fundamental Neuroscience for Basic and Clinical Applications. 3rd ed. Philadelphia: Churchill Livingstone; 2006.
• 图5.13 三种类型受体的换能器机制模型。A,化学感受器。B,机械感受器。C,光感受器。
在许多其他情况下,受体由多个细胞组成。此时换能发生在一个细胞中,但动作电位在与其形成突触连接的其他细胞中产生(见第6章)。例如在耳蜗中,初级传入纤维从机械感受性毛细胞获得突触输入。这种排列方式下,感觉器官的感官换能过程可能更为复杂。此外如前所述,光感受器中的受体电位是超极化电位,暗电流的中断是信号事件。这些机制的具体信息将在第8章讨论。
• 图5.14 A,刺激(粗箭头)轴突末端的机械感受器产生的电流流动(细箭头)。细胞内记录电极置于第一个郎飞结。B,由该电流产生的受体电位,以及当第一个郎飞结处超过阈值时叠加在受体电位上的动作电位。
尽管不同刺激类型的感觉换能机制存在差异,但最终结果通常是在受体细胞或初级传入神经元(即感觉通路中的第一个神经元)中产生受体电位(receptor potential),该神经元与受体细胞形成突触连接。
感受野
刺激定位与感觉神经元激活的关系
刺激定位与特定感觉神经元(sensory neuron)激活之间的关系是感觉生理学领域的重要主题。感觉神经元的感受野(receptive field)是指能够通过刺激影响该神经元活动的区域。例如,某个感觉受体(sensory receptor)可能仅因皮肤小区域的凹陷而被激活,该区域即为该感觉受体的兴奋性感受野(excitatory receptive field)。此外,中枢神经系统(CNS)中的神经元可能具有比感觉受体大数倍的感受野,因为它可能接收来自多个感觉受体的信息,而每个感觉受体的感受野略有不同。因此,该CNS神经元的感受野是影响它的所有感觉受体感受野的总和。感受野的位置由负责向感觉神经元传递刺激信息的感受转导装置的位置决定。
一般而言,感觉感受野是兴奋性的。然而,中枢感觉神经元可能具有兴奋性或抑制性感受野,甚至可能具有复杂的感受野,即包含激活区和抑制区。第7章和第8章将讨论此类复杂感受野的实例。
动作电位的信息编码
CNS功能的核心在于神经元间的信息传递。这一过程主要通过动作电位(action potentials)实现:动作电位沿轴突传导至突触前末梢,引发神经递质释放,从而向突触后细胞传递信号。如前所述,动作电位的再生性质使其能够传递信号而不受轴突长度限制,而局部信号(如受体电位或突触电位,见第6章)会随距离衰减,因此不适合此类功能。然而,动作电位的"全或无"特性意味着其波形和幅度通常无法像局部电位的分级变化那样传递信息。取而代之的是,动作电位的频率或时间变化模式似乎主要被用作神经元间信息传递的"编码"。
速率编码(rate coding)指信息通过神经元的放电频率进行编码。放电频率定义为神经元单位时间内产生的锋电位数量,通常以次/秒(spikes/second)表示,也称为赫兹(Hz)。例如,施加于皮肤的机械力强度可通过支配该皮肤的一级传入神经元(primary afferent neuron)的放电频率进行编码:施加于皮肤的力越大,一级传入神经元产生的受体电位越强,从而触发动作电位的频率越高。研究表明,许多神经元采用速率编码,即神经元的放电频率与感觉刺激的特定参数、即将发生的运动或其他行为特征呈现稳定的关联性。
感觉编码
感觉神经元编码关于刺激的信息。在感觉转导过程中,刺激的一个或多个方面必须以能被中枢神经系统(CNS)解读的方式进行编码。这种编码信息是基于以下三个方面的抽象:(1) 被激活的感觉受体类型,(2) 感觉受体对刺激的响应特性,(3) 感觉通路中的信息处理。可被编码的部分刺激参数包括感觉模态(sensory modality)、位置、强度、频率和持续时间。刺激的其他编码特性将在后续章节结合特定感觉系统进行描述。
感觉模态(sensory modality)是指一类特定的感觉体验。例如,施加于皮肤的持续机械刺激会产生触觉或压觉,而瞬时机械刺激可能引发颤动感或振动感。其他皮肤相关模态包括冷觉、温觉和痛觉。视觉、听觉、味觉和嗅觉则属于非皮肤感觉模态的范畴。特定的感觉受体决定了与感觉通路模态相关联的常规能量形式。例如,视觉通路包含光感受器、视网膜神经元、丘脑外侧膝状体(lateral geniculate nucleus)和大脑皮层视觉区(详见第8章)。激活视觉通路的常规方式是光线作用于视网膜,但机械刺激(如压迫眼球)或对视觉通路神经元的电刺激同样能产生视觉感知。因此,视觉系统的神经元可被视为标记线(labeled line)——无论通过何种方式激活,都会产生视觉感知。
速率编码与时间编码
速率编码(rate coding)通过动作电位发放频率来传递信息。这类编码的信息量受多个因素限制。首要限制因素是神经元的发放频率范围:其上限由神经元产生动作电位的最大频率决定(该频率取决于绝对和相对不应期(refractory periods)的持续时间,参见图5.4),鲜有超过1000~Hz的情况;下限自然是0Hz,因为神经元无法以负频率发放。为解决此问题,许多神经元具有自发放电(spontaneous activity)特性。这类自发放电水平可能相当高(例如某些浦肯野细胞(Purkinje cells)能以100Hz自发发放),使得细胞在响应输入时可在相似范围内上调或下调其活动水平。第二限制因素是神经元发放频率的变异性,这决定了神经元信息编码的分辨率。
时间编码(temporal coding)是指通过动作电位发放的精确时序而非总体频率来编码信息的发放模式编码(spike code)。时间编码中一个被广泛研究的类型是跨神经元发放的同步化现象。神经元发放同步化已被证实存在于多个脑区,并在许多功能中发挥重要作用。时间编码的优势在于其信息传递速度优于速率编码,因为它无需耗时的频率平均过程。此外,速率编码与时间编码并不互斥——在保持同步事件叠加的同时,总体发放频率仍可发生变化。这种编码的多路复用(multiplexing)可能提升神经通路的信息传输容量。
刺激的定位与强度编码机制
刺激的定位通过激活特定感觉神经元群来标记,这些神经元的感受野(receptive field)受到刺激影响。此类信息在中枢神经系统(CNS)中可能被编码为神经地图(neural map)。例如:
- 躯体定位图(somatotopic map):由体感皮层中的神经元阵列形成,接收来自体表对应位置的信息(详见第7章)
- 视网膜定位图(retinotopic map):视觉系统中视网膜各点通过神经元阵列表征(详见第8章)
强度编码方式
由于动作电位具有统一幅度,部分感觉神经元通过放电频率(rate coding)编码强度。刺激强度与反应的关系可绘制为刺激-反应函数(stimulus-response function):
- 机械感受器(mechanoreceptor):多呈现分数指数的指数曲线
- 温度感受器(thermoreceptor):具有线性刺激-反应曲线(指数为1)
- 伤害性感受器(nociceptor):呈现线性或正加速刺激-反应函数(指数≥1)。正加速特性解释了疼痛加剧时的紧迫感
其他编码机制
受体激活数量
阈值刺激可能仅激活同类初级传入神经元(primary afferent neuron)中的少数,而强刺激可募集更多同类受体。中枢感觉神经元随传入神经元放电增加而增强活动,从而被感知为更强刺激
受体类型差异
不同阈值机械感受器可扩展编码范围:
- 低阈值受体编码低强度输入
- 高阈值受体编码高强度输入 极高强度可能激活伤害性感受器,改变刺激感知性质
频率编码机制
低频振动可通过动作电位间隔(interspike interval)与刺激间隔对应实现编码,但受限于神经元放电速率。高频编码(如人类听觉系统可达20,000Hz)需依赖神经元群的时空放电模式
关键要点
- 离子通道是具有离子选择性孔道的整合膜蛋白。一个离子通道通常有两种状态:高电导(开放)和零电导(关闭)。离子通道蛋白的不同区域作为门控结构控制通道的开放与关闭。通道在开放和关闭状态间自发切换。
- 对于电压依赖性通道(voltage-dependent channel),通道处于开放状态的时间比例是跨膜电位差的函数。
- 动作电位的产生依赖于电压依赖性Na+通道的快速开放及其随后的电压失活(voltage inactivation),以及电压依赖性K+通道的延迟开放与关闭。
- 绝对不应期和相对不应期由Na+通道的电压失活以及膜复极化时K+通道的延迟关闭所导致。这些不应期限制了动作电位的发放频率。
- 阈下信号和动作电位通过局部回路电流(local circuit currents)沿细胞长度传导。阈下信号仅通过电紧张方式传导,因此会随距离衰减。
- 动作电位是被传播而非单纯传导的;它在沿轴突移动过程中不断再生。通过这种方式,动作电位在轴突上传导时保持相同的大小和形状。
- 大直径轴突具有更高的传播速度,因为增加的轴突直径可降低轴向电阻,使更多电流能够流向轴突远端。
- 髓鞘化显著提高神经轴突的传导速度,因为髓鞘增加了膜电阻并降低膜电容。髓鞘化使动作电位能够从一个郎飞结(node of Ranvier)快速传导至下一个结。这种传导方式使动作电位看似在结间跳跃式传导(saltatory conduction)。
- 感受器优先响应特定形式的刺激能量。其感受野(receptive field)是指感觉领域中能够影响该感受器的能量作用区域。
• 图5.15 慢适应和快适应机械感受器对皮肤位移的响应。A至C为初级传入纤维在D图所示的斜坡-保持刺激(ramp-and-hold stimulus)期间的放电模式。A:指示位移幅度和持续时间的慢适应感受器响应。B:输出信号反映位移速度的快适应感受器响应。C:对加速度响应的另一种快适应感受器响应。p表示位移;R表示响应;t表示时间。
事件持续时间及其起始与终止由不同感觉神经元群体编码。例如,皮肤中的慢适应感受器在持续刺激期间会产生重复放电,而快适应感受器仅在相同刺激的起始(或终止)时产生动作电位。图5.15展示三类感受器对皮肤缓慢偏转的响应(见底部图示)。其功能意义在于:刺激的不同时间特征可通过具有不同适应速率的感受器进行信号传递。
关键点
- 离子通道(ion channels)是具有离子选择性孔道的整合膜蛋白。一个离子通道通常具有两种状态:高电导(开放)和零电导(关闭)。离子通道蛋白的不同区域作为门控结构(gates)控制通道的开放与关闭。通道在开放和关闭状态间自发切换。
- 对于电压依赖性通道(voltage-dependent channel),通道处于开放状态的时间比例是跨膜电位差的函数。
- 动作电位由电压依赖性Na+通道的快速开放及随后的电压失活(voltage inactivation),以及电压依赖性K+通道的延迟开放与关闭所共同产生。
