第二十九章 饮食综合反应 胃期:修订间差异
自动添加《BERNE & LEVY 生理学 第八版》章节导航 |
|||
| 第173行: | 第173行: | ||
# 胃的核心分泌物是胃酸和胃蛋白酶原,二者共同启动蛋白质消化。 | # 胃的核心分泌物是胃酸和胃蛋白酶原,二者共同启动蛋白质消化。 | ||
# H⁺通过壁细胞顶质膜上的H⁺,K⁺-ATP酶分泌至胃腔。 | # H⁺通过壁细胞顶质膜上的H⁺,K⁺-ATP酶分泌至胃腔。 | ||
{{:BERNE & LEVY 生理学 第八版}} | |||
2025年8月23日 (六) 17:13的版本
学习目标
完成本章学习后,应能回答以下问题:
- 胃的主要功能有哪些?
- 胃的宏观功能分区如何划分?
- 胃上皮在消化和吸收中起什么作用?
- 质子泵在壁细胞功能中起什么作用?
本章将讨论食物在胃内时胃肠道(GI)的生理活动(即消化的胃期)。这包括胃功能及其调节,以及胃肠道更远端区域发生的功能变化。胃的主要功能是作为食物的临时储存库,并通过分泌酸和酶原(胃蛋白酶原)启动蛋白质消化。其他功能列于Box 29.1。
食物从食管进入胃后,通过平滑肌的扩张和牵张对胃壁产生机械刺激。食物(主要是寡肽和氨基酸)在胃腔内时也会产生化学刺激。胃期胃功能的调节依赖于内分泌、旁分泌和神经通路。这些通路由机械和化学刺激激活,引发内在和外在神经反射通路,这些通路对胃功能的调节至关重要。通过迷走神经(以及较小程度上通过脊髓)从胃肠道传递到中枢神经系统的传入神经元,会对这些机械和化学刺激作出反应,并激活副交感神经传出。
内分泌通路包括刺激胃酸分泌的胃泌素(gastrin)释放,以及抑制胃分泌的生长抑素(somatostatin)释放。重要的旁分泌通路包括刺激胃酸分泌的组胺释放。这些通路激活引发的反应包括分泌反应和运动反应:分泌反应包括酸、胃蛋白酶原、黏液、内因子、胃泌素、脂肪酶和HCO3-的分泌。总体而言,这些分泌物启动蛋白质消化并保护胃黏膜。运动反应(平滑肌活动的变化)包括抑制近端胃运动(容受性舒张)和刺激远端胃运动,从而引发胃窦蠕动。这些运动变化在食物的储存、与分泌物的混合中起重要作用,并参与调节胃内容物的排出。
胃的功能解剖学(Functional Anatomy of the Stomach)
胃可分为三个解剖区域:贲门(cardia)、胃体(corpus,亦称fundus或body)和胃窦(antrum)(图29.1)。然而在讨论胃的生理功能时,将其划分为两个功能性区域更为合理:胃的近端部分和远端部分。胃近端部分(因其位于最颅侧而得名)与胃远端部分(离口腔最远)在餐后反应中具有截然不同的功能,后文将对此进行详细阐述。
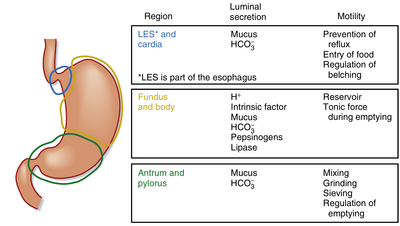
胃黏膜表面覆盖着折叠形成胃小凹(gastric pits)的柱状上皮,每个小凹都是一个导管的开口,一个或多个胃腺(gastric glands)通过此导管排空分泌物(图29.2)。胃小凹构成了胃黏膜总表面积的重要组成部分。根据腺体结构的差异,胃黏膜可分为三个特征性区域:位于食管下括约肌(LES)正下方的小型贲门腺区,其主要由黏液分泌腺细胞组成;其余胃黏膜则分为泌酸腺(oxyntic或parietal gland,即胃酸分泌腺)区和幽门腺区——前者位于胃切迹(gastric notch)上方(相当于胃的近端部分),后者位于切迹下方(相当于胃的远端部分)。
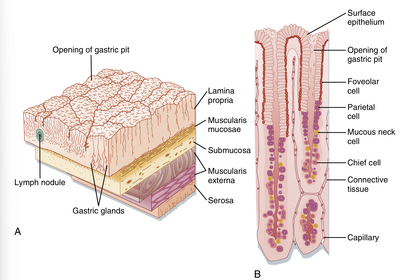
图29.2展示了泌酸腺区胃腺的结构。表面上皮细胞略微延伸至导管开口处。腺体开口称为峡部(isthmus),由表面黏液细胞和少量壁细胞(parietal cells)构成。黏液颈细胞(mucous neck cells)位于腺体的狭窄颈部。分泌HCl和内因子(参与维生素B₁₂吸收)的壁细胞(亦称泌酸细胞),以及分泌胃蛋白酶原的主细胞(chief cells,亦称peptic cells)位于腺体更深处。泌酸腺还含有分泌组胺的肠嗜铬样细胞(enterochromaffin-like cells, ECL cells)和分泌生长抑素(somatostatin)的D细胞。胃底部腺体中壁细胞数量尤为丰富,而黏液分泌细胞在幽门腺(胃窦腺)区更为密集。此外,幽门腺含有分泌胃泌素(gastrin)的G细胞。壁细胞腺体还可细分为颈部(含黏液颈细胞和壁细胞)与基底部(含主细胞和壁细胞)。内分泌细胞分散分布于各腺体中。
框29.1 胃的功能
贮存——作为食物的临时储存库
分泌H⁺以杀灭微生物并将胃蛋白酶原(pepsinogen)转化为活性形式
分泌内因子(intrinsic factor)以促进维生素B₁₂(钴胺素)的吸收
分泌黏液和HCO₃⁻以保护胃黏膜 分泌水分用于润滑并提供营养物的水性悬浮液
通过运动活性将分泌物(H⁺和胃蛋白酶)与摄入食物混合
通过协调运动活性调节内容物向十二指肠的排空
胃分泌功能
胃液是胃表面上皮细胞和胃腺细胞分泌物的混合物。其中最重要的成分之一是H+,其分泌逆浓度梯度进行。因此,胃壁黏膜(parietal mucosa)分泌H+是一个高能耗过程。壁细胞(parietal cell)的细胞质中密集分布着线粒体,估计占细胞体积的30%至40%。H+的一个主要功能是将无活性的胃蛋白酶原(pepsinogen)(胃的主要酶产物)转化为胃蛋白酶(pepsins),后者启动胃内的蛋白质消化。此外,H+对于防止随食物摄入的细菌和其他病原体入侵并定植于肠道至关重要。胃还会分泌大量HCO3-和黏液,这对保护胃黏膜免受酸性及含胃蛋白酶的管腔环境影响非常重要。胃上皮还分泌内因子(intrinsic factor),这是维生素B12吸收所必需的。
胃分泌物的组成
胃分泌物由无机成分、有机成分和水共同组成。胃液中的重要成分包括HCl、盐类、胃蛋白酶、内因子、黏液和HCO3-。餐后所有这些成分的分泌均会增加。
胃分泌物的无机成分
胃分泌物的离子组成取决于分泌速率。分泌速率越高,H+离子浓度越高。在低分泌速率下,[H+]降低而[Na+]升高。胃液中的[K+]始终高于血浆水平,因此长期呕吐可能导致低钾血症。无论分泌速率如何,Cl-始终是胃液中的主要阴离子。胃HCl可将胃蛋白酶原激活为胃蛋白酶,并提供胃蛋白酶活性所需的酸性pH环境。
不同个体的胃H+分泌速率差异显著。人类在基础(未受刺激)状态下,胃H+生成速率通常为1至5毫当量/小时(mEq/hr)。在最大刺激状态下,HCl生成量可升至6至40毫当量/小时。基础速率在夜间较高,清晨最低。正常个体胃中壁细胞总数差异很大,这是基础及刺激状态下HCl分泌速率范围宽泛的部分原因。
胃分泌物的有机成分
胃分泌物中最主要的有机成分是胃蛋白酶原(pepsinogen),即胃蛋白酶(pepsin)的非活性酶原。胃蛋白酶(pepsins,常统称为"pepsin")是一组由胃腺主细胞(chief cells)分泌的蛋白酶。胃蛋白酶原储存在主细胞膜结合的酶原颗粒(zymogen granules)中。当主细胞受到刺激分泌时,酶原颗粒通过胞吐作用释放其内容物(表29.1)。胃蛋白酶原通过酸敏感键的裂解转化为活性胃蛋白酶。胃蛋白酶还能通过蛋白水解作用作用于胃蛋白酶原以形成更多胃蛋白酶。胃蛋白酶在pH3及以下时具有最强的蛋白水解活性。胃蛋白酶可消化典型膳食中多达20%的蛋白质,但其并非消化所必需,因为其功能可被胰蛋白酶(pancreatic proteases)替代。当十二指肠腔的pH被中和时,胃蛋白酶会因中性pH而失活。
内因子(intrinsic factor)是胃壁细胞(parietal cells)分泌的一种糖蛋白,为维生素B12的正常吸收所必需。其释放由与刺激壁细胞分泌HCl相同的刺激因素所引发。
胃酸分泌的细胞机制
壁细胞具有独特的超微结构(图29.3)。分支状的分泌小管(secretory canaliculi)贯穿细胞质,并通过共同开口与细胞腔面相连。分泌小管表面被微绒毛覆盖。未受刺激的壁细胞质中含有大量称为小管泡系统(tubulovesicular system)的管状和囊泡结构。小管泡膜含有负责将H+和Cl-分泌到腺腔的转运蛋白。当壁细胞受刺激分泌HCl时(见图29.3),小管泡膜与分泌小管的质膜融合。这种广泛的膜融合显著增加了分泌小管质膜中H+/K+逆向转运体的数量。当壁细胞以最大速率分泌胃酸时,H+泵运输需要克服约100万倍的浓度梯度(壁细胞胞质pH为7,胃腺腔pH为1)。
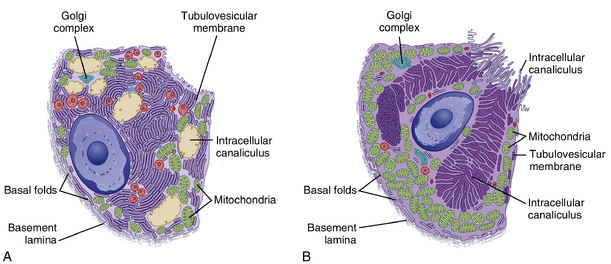
壁细胞分泌H+的细胞机制
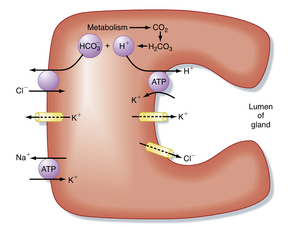
壁细胞分泌H+的细胞机制如图29.4所示。Cl-通过基底侧膜进入细胞,与碳酸酐酶(carbonic anhydrase)作用生成的HCO3-进行交换——该酶能催化产生HCO3-和H+。H+通过管腔膜上的H+,K+-ATP酶以K+交换的方式分泌。K+通过管腔膜上的K+通道进行循环。Cl-通过位于管腔膜的离子通道(一种氯离子通道[CLC家族Cl-通道])进入管腔。
细胞内Ca++和环磷酸腺苷(cAMP)水平的升高会刺激管腔膜对Cl⁻和K+的传导性。K+传导性增加会使管腔膜电位超极化,从而增强Cl-跨管腔膜外流的驱动力。基底侧膜上的K+通道也介导通过H+,K+-ATP酶活性在壁细胞内积累的K+外流。此外,cAMP和Ca++能促进Cl-通道向管腔膜的运输,以及含有H+,K+-ATP酶的胞质管状囊泡与分泌小管膜的融合(见图29.3和29.4)。壁细胞分泌H+的同时,还会将HCO3-转运入血液以维持细胞内pH。
HCO3-的分泌
表面上皮细胞也分泌一种水性液体,其Na+和Cl-浓度与血浆相似,但K+和HCO3-浓度更高。HCO3-会被覆盖在胃表面的粘稠黏液捕获;因此,静息状态下黏膜分泌的黏液会在胃内形成一层粘性碱性涂层。在餐后阶段,黏液和HCO3-的分泌速率都会增加。
黏液的分泌
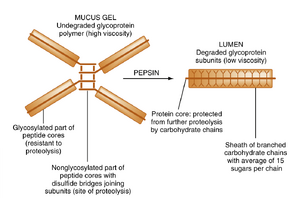
含有黏蛋白(mucins)的分泌物具有粘稠特性,统称为黏液。黏蛋白由位于胃腺颈部的颈黏液细胞和胃表面上皮细胞分泌。黏液以大型颗粒形式储存在颈黏液细胞和表面上皮细胞的顶端胞质中,并通过胞吐作用释放。
胃黏蛋白的糖含量约占重量的80%,由四个相似单体(每个约500,000 Da)通过二硫键连接组成(图29.5)。这种四聚体黏蛋白形成黏性凝胶,可黏附在胃表面。该凝胶易被胃蛋白酶水解,释放出无法形成凝胶的片段,从而溶解保护性黏液层。维持保护性黏液层需要持续合成新的四聚体黏蛋白,以替代被胃蛋白酶水解的黏蛋白。
静息状态的胃会以显著速率分泌黏液。黏液分泌受某些与促进胃酸和胃蛋白酶原分泌相同的刺激因素调节,特别是副交感神经末梢释放的乙酰胆碱。
胃分泌的调节
通过迷走神经(vagus nerve)的副交感神经支配是胃H+分泌最强的刺激因素。外源性传出纤维终止于支配主细胞(parietal cells)、分泌旁分泌介质组胺(histamine)的ECL细胞,以及分泌激素胃泌素(gastrin)的内分泌细胞的内在神经元。此外,迷走神经刺激可引发胃蛋白酶原、黏液、HCO3-和内因子(intrinsic factor)的分泌。副交感神经系统的激活也发生在摄食的头期和口腔期。然而,胃期对餐后胃分泌的刺激作用最大(图29.6)。
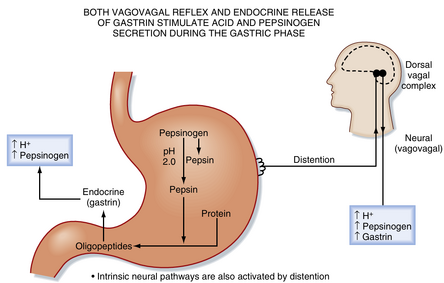
胃酸分泌的刺激是"前馈"(feed-forward)级联反应的典型范例,涉及内分泌、旁分泌和神经通路。迷走神经传出活动激活内在神经元,导致神经末梢释放乙酰胆碱,进而激活胃上皮细胞。主细胞表达毒蕈碱受体(muscarinic receptors),在迷走神经传出活动作用下被激活分泌H+。此外,副交感神经激活通过内在神经元释放胃泌素释放肽(gastrin-releasing peptide),促使胃窦部胃腺中的G细胞释放胃泌素(见图29.6)。胃泌素进入血液循环后,通过内分泌机制进一步刺激主细胞分泌H+。主细胞表达胃泌素的胆囊收缩素B型(CCKB)受体。组胺也响应迷走神经刺激而分泌,ECL细胞表达毒蕈碱受体和胃泌素受体。因此,胃泌素和迷走神经传出活动诱导组胺释放,从而增强胃泌素和乙酰胆碱对主细胞的作用。因此激活胃的副交感(迷走)神经输出能高效刺激主细胞分泌胃酸(图29.7和29.8)。
胃期迷走-迷走反射与胃泌素的内分泌释放共同促进胃酸和胃蛋白酶原分泌
乙酰胆碱、胃泌素和组胺共同刺激壁细胞
• 图29.7 壁细胞受神经、激素和旁分泌途径调控。迷走神经副交感节前纤维对胃的激活通过三种方式刺激胃酸分泌:1)通过肠神经元释放乙酰胆碱(A)直接神经支配并激活壁细胞,该递质通过毒蕈碱受体作用于壁细胞;2)ECL细胞(enterochromaffin-like cells)的神经激活促进组胺(H)释放,通过旁分泌途径刺激壁细胞;3)胃窦胃腺中的G细胞(G cells)被肠神经元释放的胃泌素释放肽(GRP)激活,进而释放胃泌素(G),后者通过体液途径作用于壁细胞。
胃部还存在重要的负反馈机制:当胃远端(胃窦)存在胃酸时,会通过反馈环路抑制壁细胞活性,使餐后H+分泌不会无限制进行。当胃腔H+浓度达到特定阈值(pH <3)时,胃窦黏膜的内分泌细胞会释放生长抑素(somatostatin)。生长抑素通过旁分泌作用抑制邻近G细胞释放胃泌素,从而减少胃酸分泌(图29.9)。
壁细胞膜上的乙酰胆碱、促胃液素和组胺受体及其细胞内第二信使作用机制如图29.10所示。组胺是H+分泌的最强激动剂(agonist),而促胃液素(gastrin)和乙酰胆碱(acetylcholine)的激动作用较弱。然而,组胺、乙酰胆碱和促胃液素在壁细胞(parietal cell)上具有相互增强作用。组胺H2受体拮抗剂(如西咪替丁[cimetidine, Tagamet])可阻断促分泌素(secretagogues)刺激的胃酸分泌。因此,促胃液素的大部分效应是通过刺激组胺释放实现的。促胃液素还具有重要的营养效应(trophic effects);其水平升高会导致肠嗜铬样细胞(ECL cells)体积增大、数量增加。
组胺与壁细胞质膜上的H2受体结合后,激活腺苷酸环化酶(adenylyl cyclase)并提高胞质cAMP浓度。这些过程通过激活基底外侧膜K+通道和顶端膜Cl−通道,以及促使更多H+,K+-ATP酶分子和Cl-通道插入顶端质膜(参见图29.4),从而刺激H+分泌。乙酰胆碱与\mathrm{M}_{3}毒蕈碱受体(muscarinic receptors)结合后,开启顶端质膜的Ca++通道。此外,乙酰胆碱通过促进胞内钙库释放Ca++以升高胞内[Ca++],从而增强H+分泌——其机制同样涉及基底外侧膜K+通道的激活,以及更多H+,K+-ATP酶分子和Cl-通道向顶端质膜的插入。促胃液素通过与CCKB受体结合促进胃酸分泌(见图29.10)。
迷走神经激活通过神经递质引发多细胞反应
• 图29.8 生长抑素(somatostatin)释放及其对胃窦部\textcircled{\scriptsize{1}}细胞作用的胃酸分泌负反馈调节。胃窦部黏膜的内分泌细胞感知H+存在后分泌生长抑素,后者作用于\textcircled{\scriptsize{1}}细胞特定受体以抑制促胃液素释放,从而实现胃酸分泌的抑制。
胃内消化
胃内会发生部分营养物质的消化,但这并非完成一餐消化所必需——肠道消化已足够。碳水化合物在胃内可发生淀粉酶(amylase)介导的消化。虽然淀粉酶对pH敏感且在低pH下会失活,但由于底物保护(substrate protection)作用,当碳水化合物占据淀粉酶活性位点时能保护酶免遭降解,因此部分淀粉酶在胃的酸性环境中仍保持活性。
• 图29.9 通过肠神经系统实现的迷走神经副交感神经对胃分泌的刺激作用。迷走神经节前神经元支配肌间神经丛和黏膜下神经丛。迷走神经节前神经元的末梢支配众多肠神经元,从而引发如图29.7所述的功能变化。ACh,乙酰胆碱;GRP,胃泌素释放肽。
脂质消化同样起始于胃部。胃动力的混合模式导致脂质与胃脂肪酶形成乳剂,后者附着于乳剂中脂滴表面,将膳食甘油三酯水解为游离脂肪酸和单酰甘油。然而,甘油三酯的水解程度约为10%,且胃内水解作用对膳食脂质的正常消化吸收并非必需。此外,如后续章节所述,由于胃腔低pH环境,脂解产物无法在胃内被吸收。
胃黏膜保护与防御机制
黏液和HCO3-共同保护胃表面免受H+和胃蛋白酶的影响。在胃腔表面形成的保护性黏液凝胶层及其捕获的碱性分泌物共同构成胃黏膜屏障,可防止胃内容物对黏膜造成损伤(图29.11)。厚度约0.2毫米的黏液凝胶层有效隔离了富含\mathrm{HCO}_{3}^{-}的表面上皮细胞分泌液与酸性胃内容物。该黏液层使得上皮细胞pH值可维持在近中性水平,而胃腔pH值约为2。黏液还延缓了酸和胃蛋白酶向上皮细胞表面的扩散。胃上皮的保护依赖于黏液和HCO3-的共同分泌。
胃肠道运动
理解胃肠道运动需先回顾平滑肌功能的某些特性。肠壁的运动调控着管腔内容物沿消化道推进,主要运动模式包括混合运动(分节运动)和推进运动(蠕动)。此外,胃和结肠的平滑肌活动还承担储存功能。
胃肠道平滑肌的功能解剖
胃肠道平滑肌在结构上与体内其他平滑肌相似。梭形细胞聚集形成束状结构,外包结缔组织鞘。缝隙连接使平滑肌细胞在功能上相互偶联,从而实现肌束的同步收缩。Cajal间质细胞(interstitial cells of Cajal, ICCs)是肠壁中特化的细胞群,参与将信息从肠神经元传递至平滑肌细胞(图29.12)。目前认为ICCs还具有"起搏"功能,能够产生基础电节律(basic electrical rhythm)或慢波活动(slow-wave activity),这是胃肠道平滑肌的固有特征(图29.13)。
IN THE CLINIC
有时胃黏膜屏障会失效。不累及黏膜下层的胃肠道表层破损称为糜烂(erosion),通常无需干预即可愈合。相反,累及肌层及更深层次的胃肠道破损称为溃疡(ulcer)。胃和十二指肠糜烂及溃疡的发生是由于黏膜保护机制与破坏性因子之间的失衡所致。健康的胃/十二指肠对H+的破坏作用具有充分的天然保护。能增强H+对胃/十二指肠的有害效应或独立于H+发挥作用的因素包括胃蛋白酶、胆汁、幽门螺杆菌(Helicobacter pylori)以及被称为非甾体抗炎药(NSAIDs)的药物类别。事实上,随着人口老龄化和对NSAIDs(用于关节炎等非胃肠道疾病)需求的增加,溃疡病的发病率正逐渐升高。酒精、烟草和咖啡因也是溃疡的危险因素。病原体也可引起胃炎(胃上皮的炎症)。H. pylori是一种螺旋形细菌,现已被广泛认为是导致胃炎、溃疡形成以及人类胃癌的因素之一。H. pylori能在胃内存活是因为它能分泌脲酶(urease),将尿素转化为NH3,后者通过形成NH4+来缓冲H+。积极的抗生素治疗方案(有时联合H+K+-ATP酶抑制剂)通常可根除感染,随后胃炎和溃疡症状会得到改善。
• 图29.11 胃表面受胃黏膜屏障保护。富含HCO3-的分泌物和黏液层的高黏度使细胞表面的pH值保持在7左右,而胃腔内容物的pH值为2。
CAJAL间质细胞(ICC)是肠道的起搏器
• 图29.12 \textcircled{7}道平滑肌壁中Cajal间质细胞网络的示意图。
胃肠道平滑肌的电生理学
胃肠道平滑肌静息膜电位的周期性变化称为基本电节律(basic electrical rhythm)或慢波(slow wave)。胃中的慢波频率为每分钟3至5次,小肠中约为每分钟12至20次;在结肠中则降至每分钟6至8次。慢波的频率由胃肠道不同区域的起搏区设定(见图29.13)。慢波的振幅(在较小程度上包括频率)可通过内在神经和外在神经的活动,以及激素和旁分泌物质进行调节。若慢波的去极化超过阈值,则可能在慢波峰值期间触发动作电位序列。
动作电位的上升相由同时传导Ca++和Na+的离子通道开放引起,这些通道开启相对缓慢。动作电位期间进入细胞的Ca++会引发收缩。某些激素、旁分泌激动剂以及兴奋性肠神经末梢释放的神经递质(如乙酰胆碱和P物质)可增强细胞的去极化程度和动作电位频率。抑制性激素和神经效应物质(如血管活性肠肽和一氧化氮)则使平滑肌细胞超极化,可能减少或消除动作电位峰。
未伴随动作电位的慢波仅引起平滑肌细胞微弱或几乎无收缩。动作电位的存在会引发更强烈的收缩。慢波峰值期间产生的动作电位数量越多,平滑肌的收缩强度越大。由于平滑肌收缩速度较慢(约为骨骼肌细胞的十分之一),动作电位序列中每个动作电位引起的单独收缩不会形成明显颤搐,而是通过时间总和产生逐渐增强的张力。
在动作电位序列的间歇期,胃肠道平滑肌产生的张力会下降但不归零。这种非零的静息或基线张力称为张力(tone)。胃肠道平滑肌张力受神经递质、激素、旁分泌物质和药物影响。张力在括约肌以及具有内容物储存功能的区域(如胃和结肠)中尤为重要。
• 图29.13 慢波振幅决定肌肉收缩强度。当慢波达到阈值振幅时,会引发平滑肌收缩。慢波振幅通过肠神经元释放的神经递质进行调节。
在细胞水平
胃肠道中的Cajal间质细胞(interstitial cells of Cajal)
胃肠道中存在两种类型的Cajal间质细胞(ICCs):c-Kit+细胞和血小板衍生生长因子受体(PDGFR)α+细胞。这些细胞来源于间充质,具有多个突起,与平滑肌细胞形成缝隙连接(gap junctions)。ICCs与平滑肌细胞之间的电耦联形成了合胞体结构(syncytium),使得一种细胞类型的电导变化会影响另一种细胞的兴奋性。ICCs是胃肠道平滑肌的起搏细胞(pacemaker cells),这一功能依赖于细胞内钙库(intracellular stores)释放的钙离子(Ca²⁺)。它们定位于平滑肌层内,与肌间神经丛(myenteric plexus)紧密相连,并与平滑肌层中运动神经元的膨体(varicosities)密切接触,提示ICCs接受神经支配。因此,神经信号通过ICCs和合胞体结构调节肌组织的兴奋性。在缺乏ICCs发育的突变小鼠中进行的研究证实了这些细胞在产生胃肠道平滑肌慢波(slow waves)中的必要作用。人类有多种运动功能障碍被报道与ICCs有关,包括糖尿病性胃病(diabetic gastropathy)、特发性胃轻瘫(idiabetic gastroparesis)、假性肠梗阻(intestinal pseudo-obstruction)和慢传输型便秘(slow transit constipation)。
特殊运动模式
蠕动(peristalsis)是推动内容物沿胃肠道移动的环形收缩波。它涉及神经介导的双层肌肉(纵行肌和环行肌)的收缩与舒张。蠕动发生于咽、食管、胃窦以及小肠和大肠。
节段性收缩(segmental contractions)在松弛肠段之间形成狭窄的收缩区域。这种运动使管腔内容物与胃肠道分泌物混合,并增加与吸收黏膜表面的接触。节段性运动主要发生于小肠和大肠。
还存在特征性的病理性运动模式。痉挛(spasm)时,最大收缩活动以失调方式持续发生。肠梗阻(ileus)时,收缩活动显著减弱或消失;其常见原因为腹膜刺激,如手术、腹膜炎和胰腺炎等情况。
胃运动功能
胃的功能解剖
如前所述,胃被分为两个功能区域——近端和远端,两端均有括约肌。食管下括约肌(LES)和贲门(cardia,定义为紧邻LES周围的胃区域)具有重要功能。LES和贲门的松弛允许食物从食管进入胃腔以及气体的排出(称为嗳气)。通过维持张力,可有效防止胃内容物反流至食管。
胃近端(胃底与胃体)产生与其储库功能相适应的张力缓慢变化。该区域对食物的接收储存以及与胃液的混合具有重要作用(表29.2)。胃近端张力的产生也是调节胃排空的重要驱动力。低张力及由此产生的低胃内压与胃排空延迟相关,而该区域张力的增加是发生胃排空的必要条件。
markdown
29.2 食物的化学特性
胃的远端部分对混合胃内容物以及推动其通过幽门进入十二指肠至关重要。胃窦(antrum)区域的肌层比胃近端区域厚得多,因此胃窦能够产生强烈的时相性收缩。由慢波引发的收缩起始于胃中部并向幽门方向推进。这些收缩的强度在餐后阶段会发生变化。在胃相(gastric phase)期间,幽门通常处于关闭状态,此时胃窦的收缩作用主要是混合胃内容物并减小固体颗粒的尺寸(研磨作用)。然而,最终这些胃窦收缩对排空胃内容物也起重要作用。
幽门括约肌(pyloric sphincter)是胃十二指肠交界处,由增厚的环形肌构成。该区域通过强直性平滑肌收缩产生高压,对调节胃排空至关重要。
胃相(Gastric Phase)中胃动力的调控
胃动力受到高度调控和协调,以实现储存和混合功能。将内容物排入小肠的调控是胃运动功能的重要组成部分,这将在第30章关于餐后十二指肠相(duodenal phase)的讨论中详细阐述。
由胃内食物存在引起的胃动力调控刺激既包括机械性(如扩张)也包括化学性(如蛋白质消化产物的存在,即氨基酸和小肽)。调控这些过程的通路主要为神经通路,包括由终止于肌肉和黏膜的外源性迷走神经传入纤维引发的迷走-迷走反射(vagovagal reflexes)。黏膜传入神经对化学刺激作出反应,而机械敏感性传入神经则对平滑肌的扩张和收缩产生应答。这种传入刺激会导致迷走神经传出(副交感)通路的反射性激活,以及支配平滑肌的肠神经元的激活。
肠神经元的激活对胃平滑肌产生抑制性和兴奋性双重效应,具体效应因胃的不同区域而异。因此,胃壁扩张会导致胃近端平滑肌抑制并引发后续的反射性适应,使得食物在胃内压最小增幅的条件下完成摄入和储存过程。
相比之下,在餐后胃期(gastric phase),胃远端部分的主要运动模式是激活平滑肌以产生并加强幽门窦(antrum)收缩。幽门窦收缩的频率由胃起搏器(gastric pacemaker)设定;然而,收缩的强度由肠神经系统神经元释放的神经递质调节,包括P物质(substance P)和乙酰胆碱(acetylcholine),它们通过增加平滑肌去极化水平来增强收缩强度。在此阶段,幽门(pylorus)通常处于关闭状态。因此,幽门窦收缩会将内容物推向幽门,但由于幽门关闭,内容物会被反向推送至胃的近端区域,从而实现胃内容物的混合。此外,幽门窦收缩可导致管腔闭塞,从而使较大颗粒被分散(图29.14)。
• 图29.14 胃近端、远端平滑肌及幽门括约肌的协调活动导致胃窦内的混合与研磨。蠕动波沿胃体和胃窦向幽门推进。若幽门关闭,胃窦内容物会被逆向推送回胃的近端区域。这种运动模式通过食物与胃壁分泌物的反复研磨混合,最终减小颗粒尺寸并产生可排入十二指肠的消化产物。
逆向推送的驱动力来源于幽门窦末端收缩接近关闭的幽门时产生的压力升高。
临床视角
胃轻瘫(Gastroparesis)是以胃排空延迟为特征的疾病,症状常发生于进食中或进食后,包括餐后饱胀感、恶心、呕吐和食欲减退。糖尿病是胃轻瘫最常见的原因,可能涉及胃神经支配损伤导致幽门窦强力收缩失效或幽门松弛障碍。该病也可能是腹部手术后并发症(如减重手术)或使用抑制肌肉收缩药物(如阿片类药物)所致。轻度胃轻瘫在普通人群中较为常见。其确切细胞机制尚不明确,但可能与导致Cajal间质细胞(interstitial cells of Cajal, ICCs)丢失的炎症过程及神经炎症相关。治疗包括营养干预和促动力药物(如兼具胆碱能和多巴胺拮抗作用的甲氧氯普胺)。实验性治疗手段包括胃电刺激(gastric electrical stimulation, GES),即通过起搏器刺激神经和肌肉。
核心概念
- 胃的主要功能是储存食物和启动蛋白质消化。
- 胃功能的调节依赖外源性和内源性神经通路,以及关键体液因子(胃泌素)和旁分泌介质(组胺)。
- 胃的核心分泌物是胃酸和胃蛋白酶原,二者共同启动蛋白质消化。
- H⁺通过壁细胞顶质膜上的H⁺,K⁺-ATP酶分泌至胃腔。
