G蛋白偶联受体及其信号转导:修订间差异
创建页面,内容为“== MAPK信号转导 == MAPK会被MAPKK在T-X-Y基序上进行T和Y的双位点磷酸化。 哺乳动物MAPK分为三个亚家族: * 胞外信号调节激酶(ERK,p42/44MAPK):ERK1,ERK2,活性位点TEY * 应激激活的MAPK(JNK):JNK1,2,3,活性位点TPY * 丝裂原激活的蛋白激酶(p38MAPK):p38α/β/γ/δ,活性位点TGY MAPK的停泊位点非常重要,有两种: * 共同停泊区CD:所有MAPK的C端都有,富含酸性…” |
加入G蛋白偶联受体(未完成) |
||
| 第1行: | 第1行: | ||
= G蛋白偶联受体及其信号转导 = | |||
== 结构 == | |||
[[文件:Beta2Receptor-with-Gs.png|缩略图|由β2肾上腺素所激活的G蛋白偶联受体与G<sub>s</sub>蛋白复合体的晶体结构(PDB 3SN6)。红色部分显示的是受体,绿色的是G<sub>α</sub>亚基,青色的是G<sub>β</sub>亚基,而黄色的是G<sub>γ</sub>亚基。可以看到G<sub>α</sub>亚基的C端处于一个由第五和第六跨膜螺旋之间的膜内环向外移动所产生的空穴之中。]] | |||
=== 受体结构 === | |||
G蛋白偶联受体均是膜内在蛋白(Integral membrane protein),每个受体内包含七个α螺旋组成的跨膜结构域,这些结构域将受体分割为膜外N端(N-terminus),膜内C端(C-terminus),3个膜外环(Loop)和3个膜内环。受体的膜外部分经常带有糖基化修饰。膜外环上包含有两个高度保守的半胱氨酸残基,它们可以通过形成二硫键稳定受体的空间结构。有些光敏感通道蛋白(Channelrhodopsin)和G蛋白偶联受体有着相似的结构,也包含有七个跨膜螺旋,但同时也包含有一个跨膜的通道可供离子通过。 | |||
与G蛋白偶联受体相似,PAQR家族蛋白(包括两种脂联素受体ADIPOR1和2)也包含七个跨膜域,但是它们以相反的方向跨于膜上(即N端在膜内而C端在膜外),并且它们也不与G蛋白相互作用。 | |||
=== 构象变化 === | |||
在静息状态下,G蛋白偶联受体在膜上与由G<sub>α</sub>、G<sub>β</sub>和G<sub>γ</sub>三个亚基组成的异三聚体G蛋白结合形成复合物。其中G<sub>α</sub>亚基上结合有GDP分子。当有配体结合到受体上时会引起后者的构象发生变化,变成具有鸟苷酸交换因子活性的“激活构象”。激活的受体会催化G<sub>α</sub>亚基捕获GTP分子来交换其上结合着的GDP。GTP与G<sub>α</sub>亚基的结合会使受体与G蛋白的复合物解离,受体、GTP-G<sub>α</sub>和G<sub>β</sub>-G<sub>γ</sub>二聚体三者相互分开。其中后两者可以进一步与其它蛋白相互作用从而使信号继续传递下去,而自由的受体可以重新结合上一个新的G蛋白来开始下一轮信号转导过程。 | |||
== 类型与效应器 == | |||
{| class="wikitable" | |||
|+ | |||
!G<sub>α</sub>类型 | |||
!效应器 | |||
!第二信使 | |||
!受体 | |||
|- | |||
|G<sub>sα</sub> | |||
|腺苷酸环化酶 | |||
|cAMP↑ | |||
|β肾上腺素受体、胰高血糖素受体 | |||
|- | |||
| rowspan="2" |G<sub>iα</sub> | |||
|腺苷酸环化酶 | |||
|cAMP↓ | |||
|α<sub>2</sub>肾上腺素受体 | |||
|- | |||
|K<sup>+</sup>通道(G<sub>βγ</sub>激活) | |||
|超极化(I<sub>K-ACh</sub>) | |||
|M型乙酰胆碱受体(心房肌等) | |||
|- | |||
|G<sub>olfα</sub> | |||
|腺苷酸环化酶 | |||
|cAMP↑ | |||
|鼻腔嗅觉受体 | |||
|- | |||
|G<sub>qα</sub> | |||
|磷脂酶C | |||
|IP<sub>3</sub>、DAG↑ | |||
|α<sub>1</sub>肾上腺素受体 | |||
|- | |||
|G<sub>oα</sub> | |||
|磷脂酶C | |||
|IP<sub>3</sub>、DAG↑ | |||
|M型乙酰胆碱受体(内皮细胞) | |||
|- | |||
|G<sub>tα</sub> | |||
|cGMP磷酸二酯酶 | |||
|cGMA↓ | |||
|视杆细胞视紫红质 | |||
|} | |||
== 激活离子通道的G蛋白偶联受体 == | |||
=== 心肌M型Ach受体:通过G<sub>βγ</sub>激活 === | |||
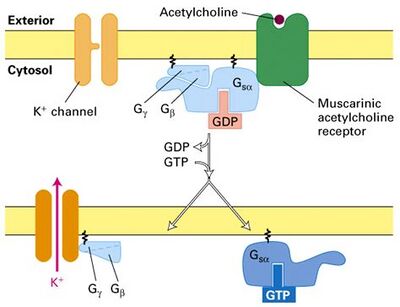
[[文件: ACh-K.jpeg|400px]] | |||
注意,此图片将误将G<sub>iα</sub>写成G<sub>sα</sub>,但描述较清晰,故使用此图片 | |||
=== 视杆细胞G<sub>t</sub>诱发cGMP-门控阳离子通道关闭 === | |||
[[文件: Light-activated-rhodopsin-pathway.jpg|缩略图|视杆细胞G<sub>t</sub>诱发cGMP-门控阳离子通道关闭机制]] | |||
==== 组成 ==== | |||
* 结合视紫红质的GPCR-G<sub>tα</sub>(GDP)-G<sub>tβγ</sub> | |||
* 具γ亚基(抑制亚基)的失活态cGMP磷酸二酯酶(PDE) | |||
* 对Na<sup>+</sup>、Ca<sup>2+</sup>通透的阳离子通道,是静息电位略微去极化 | |||
* 鸟苷酸环化酶(GC): 维持胞内cGMP浓度,以维持阳离子通道的通透性 | |||
==== 信号转导 ==== | |||
光→G<sub>tα</sub>结合GTP→从GPCR解离→G<sub>tα</sub>(GTP)结合PDE的γ亚基→PDE激活水解cGMP→cGMP↓→阳离子通道关闭→膜超极化 | |||
RGS(G蛋白信号调节蛋白): 结合G<sub>tα</sub>的GTP,调控其水解,以调控受体效应强度 | |||
== 激活或抑制腺苷酸环化酶的G蛋白偶联受体 == | |||
R<sub>s</sub>→G<sub>s</sub>→AC↑→cAMP↑→PKA激活; | |||
R<sub>i</sub>→G<sub>i</sub>→AC↓→cAMP↓→PKA抑制 | |||
* 腺苷酸环化酶(AC): 以Mg<sup>2+</sup>为辅基催化 ATP → 3',5'-cAMP + PPi | |||
* 蛋白激酶A(PKA) | |||
[[文件: PKARII.png|缩略图|PKA的激活和失活机制]] | |||
= 酶联受体及其信号转导 = | |||
== MAPK信号转导 == | == MAPK信号转导 == | ||
MAPK会被MAPKK在T-X-Y基序上进行T和Y的双位点磷酸化。 | MAPK会被MAPKK在T-X-Y基序上进行T和Y的双位点磷酸化。 | ||
2025年5月15日 (四) 22:35的版本
G蛋白偶联受体及其信号转导
结构

受体结构
G蛋白偶联受体均是膜内在蛋白(Integral membrane protein),每个受体内包含七个α螺旋组成的跨膜结构域,这些结构域将受体分割为膜外N端(N-terminus),膜内C端(C-terminus),3个膜外环(Loop)和3个膜内环。受体的膜外部分经常带有糖基化修饰。膜外环上包含有两个高度保守的半胱氨酸残基,它们可以通过形成二硫键稳定受体的空间结构。有些光敏感通道蛋白(Channelrhodopsin)和G蛋白偶联受体有着相似的结构,也包含有七个跨膜螺旋,但同时也包含有一个跨膜的通道可供离子通过。
与G蛋白偶联受体相似,PAQR家族蛋白(包括两种脂联素受体ADIPOR1和2)也包含七个跨膜域,但是它们以相反的方向跨于膜上(即N端在膜内而C端在膜外),并且它们也不与G蛋白相互作用。
构象变化
在静息状态下,G蛋白偶联受体在膜上与由Gα、Gβ和Gγ三个亚基组成的异三聚体G蛋白结合形成复合物。其中Gα亚基上结合有GDP分子。当有配体结合到受体上时会引起后者的构象发生变化,变成具有鸟苷酸交换因子活性的“激活构象”。激活的受体会催化Gα亚基捕获GTP分子来交换其上结合着的GDP。GTP与Gα亚基的结合会使受体与G蛋白的复合物解离,受体、GTP-Gα和Gβ-Gγ二聚体三者相互分开。其中后两者可以进一步与其它蛋白相互作用从而使信号继续传递下去,而自由的受体可以重新结合上一个新的G蛋白来开始下一轮信号转导过程。
类型与效应器
| Gα类型 | 效应器 | 第二信使 | 受体 |
|---|---|---|---|
| Gsα | 腺苷酸环化酶 | cAMP↑ | β肾上腺素受体、胰高血糖素受体 |
| Giα | 腺苷酸环化酶 | cAMP↓ | α2肾上腺素受体 |
| K+通道(Gβγ激活) | 超极化(IK-ACh) | M型乙酰胆碱受体(心房肌等) | |
| Golfα | 腺苷酸环化酶 | cAMP↑ | 鼻腔嗅觉受体 |
| Gqα | 磷脂酶C | IP3、DAG↑ | α1肾上腺素受体 |
| Goα | 磷脂酶C | IP3、DAG↑ | M型乙酰胆碱受体(内皮细胞) |
| Gtα | cGMP磷酸二酯酶 | cGMA↓ | 视杆细胞视紫红质 |
激活离子通道的G蛋白偶联受体
心肌M型Ach受体:通过Gβγ激活
注意,此图片将误将Giα写成Gsα,但描述较清晰,故使用此图片
视杆细胞Gt诱发cGMP-门控阳离子通道关闭

组成
- 结合视紫红质的GPCR-Gtα(GDP)-Gtβγ
- 具γ亚基(抑制亚基)的失活态cGMP磷酸二酯酶(PDE)
- 对Na+、Ca2+通透的阳离子通道,是静息电位略微去极化
- 鸟苷酸环化酶(GC): 维持胞内cGMP浓度,以维持阳离子通道的通透性
信号转导
光→Gtα结合GTP→从GPCR解离→Gtα(GTP)结合PDE的γ亚基→PDE激活水解cGMP→cGMP↓→阳离子通道关闭→膜超极化 RGS(G蛋白信号调节蛋白): 结合Gtα的GTP,调控其水解,以调控受体效应强度
激活或抑制腺苷酸环化酶的G蛋白偶联受体
Rs→Gs→AC↑→cAMP↑→PKA激活; Ri→Gi→AC↓→cAMP↓→PKA抑制
- 腺苷酸环化酶(AC): 以Mg2+为辅基催化 ATP → 3',5'-cAMP + PPi
- 蛋白激酶A(PKA)

酶联受体及其信号转导
MAPK信号转导
MAPK会被MAPKK在T-X-Y基序上进行T和Y的双位点磷酸化。
哺乳动物MAPK分为三个亚家族:
- 胞外信号调节激酶(ERK,p42/44MAPK):ERK1,ERK2,活性位点TEY
- 应激激活的MAPK(JNK):JNK1,2,3,活性位点TPY
- 丝裂原激活的蛋白激酶(p38MAPK):p38α/β/γ/δ,活性位点TGY
MAPK的停泊位点非常重要,有两种:
- 共同停泊区CD:所有MAPK的C端都有,富含酸性和疏水,可以与MAPKK结合。
- 富含谷氨酸、天冬氨酸区ED
MAPK的底物蛋白含有MAPK停泊位点的目标区,调控MAPK底物的特异性结合。
- 如D停泊区,含有疏水和碱性残基。
- 如FXFP结构域,对ERK的底物而言是必要的。