第三十六章 钾、磷、钙的稳态
学习目标
完成本章学习后,学生应能回答以下问题:
- 机体如何维持钾(K⁺)稳态?
- K⁺在机体各腔室中的分布如何?这种分布为何重要?
- 调节血浆K⁺水平的激素和因子有哪些?这种调节为何重要?
- 不同肾单位节段如何转运K⁺?决定尿钾排泄量的机制是什么?
- 为何远端小管和集合管在调节K⁺排泄中起重要作用?
- 血浆K⁺水平、醛固酮、血管加压素、小管液流速和酸碱平衡如何影响K⁺排泄?
- 钙(Ca²⁺)和无机磷酸盐(Pi)的生理重要性是什么?
- 机体如何维持Ca²⁺和Pi的稳态?
- 肾脏、胃肠道和骨骼在维持血浆Ca²⁺和Pi水平中起什么作用?
- 调节血浆Ca²⁺和Pi水平的激素和因子有哪些?
- 沿肾单位进行Ca²⁺和Pi重吸收的细胞机制是什么?
- 哪些激素调节肾脏对Ca²⁺和Pi的排泄?
- 钙敏感受体(calcium-sensing receptor)的作用是什么?
- Ca²⁺和Pi稳态的常见临床紊乱有哪些?
- 肾脏在维生素D代谢中的作用是什么?
- 袢利尿剂和噻嗪类利尿剂对Ca²⁺排泄有何影响?
- 慢性饮食钾缺乏对血压有何影响?
- 慢性全身性钾耗竭对肾功能有何影响?
K⁺稳态
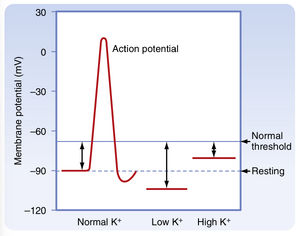
钾离子(K+)是体内含量最丰富的阳离子。体内绝大部分的钾离子(98%)位于细胞内,其浓度([K+])为150mEq/L。仅有2%的钾离子存在于细胞外液(extracellular fluid, ECF)中,浓度约为4mEq/L。细胞膜两侧巨大的钾离子浓度梯度(146mEq/L)由Na+,K+-ATP酶维持。这种浓度梯度对维持细胞膜电位差至关重要,它直接影响神经和肌细胞的兴奋性,以及心肌、骨骼肌和平滑肌细胞的收缩功能(图36.1)。
骨骼肌是体内最大的单一钾离子储存库。在成年人体内,骨骼肌中的钾离子含量约为所有细胞外腔室总和的225倍。此外,由于骨骼肌细胞含有大量Na+、K+-ATP酶泵和K+通道,其具备极强的钾离子交换能力。尽管膳食钾摄入量存在显著波动,但细胞内液(intracellular fluid, ICF)和ECF中的[K+]仍能保持高度稳定。当ECF中的[K+]超过5.0mEq/L时称为高钾血症(hyperkalemia);反之,当ECF中的[K+]低于3.5mEq/L时则称为低钾血症(hypokalemia)。低钾血症发生时,骨骼肌细胞会释放钾离子以维持ECF中的[K+],从而导致全身钾离子总量减少。
临床知识
钾水平通常通过静脉血样本测定。传统上使用凝血后的血清进行检测,但现在更多采用肝素抗凝的血浆进行测量。血清钾水平通常比血浆高0.2~0.4mEq/L。不当的采血技术会影响检测结果:体力活动后ECF中的钾水平会升高(见后文),因此应在静息数分钟后采血;采血过程中或采血后的红细胞溶血会释放钾至血浆中,导致样本中[K+]假性升高。为防止溶血,必须使用经认证的专用针头、采血管和管接头,并选择大静脉(如肘静脉)进行穿刺,避免握拳动作和长时间使用止血带。
假性高钾血症(pseudohyperkalemia)指采血管中钾浓度>5mmol/L而患者实际血钾水平正常的情况。除导致假性高钾血症外,检测误差还可能掩盖真实存在的低钾血症。
临床关联
低钾血症(hypokalemia)可能发生于长期使用利尿剂、滥用泻药、呕吐、进食障碍或腹泻性疾病患者。Gitelman综合征(远端肾小管细胞顶膜Na^+/Cl^-协同转运体的遗传缺陷)也可引起低钾血症(详见第34章)。高钾血症(hyperkalemia)可见于肾功能衰竭患者,或作为血管紧张素转换酶(ACE)抑制剂和保钾利尿剂在潜在肾病患者(肾脏排钾能力下降)中的副作用,亦可见于糖尿病患者(细胞内钾转移能力下降)。
临床关联
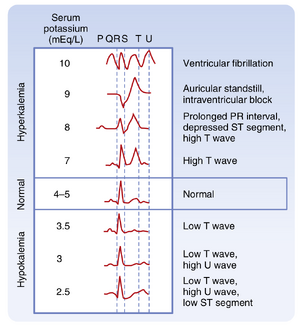
心律失常可由高钾血症和低钾血症引发。心电图(ECG;图36.2)(另见第16章)可监测心脏电活动,是快速判断血浆[K+]变化是否影响心脏功能的可靠方法。高钾血症的首个征象是ECG出现高尖T波。血浆[K+]进一步升高会延长PR间期、压低ST段并增宽ECG的QRS波群。当血浆[K+]接近10 mEq/L时,P波消失,QRS波群增宽,ECG呈正弦波形,心室出现纤维性颤动(即心肌纤维快速、无协调性收缩)。低钾血症会延长QT间期,导致T波倒置和ECG的ST段压低。
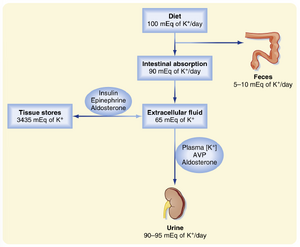
从胃肠道(GI)吸收的K+在数分钟内进入ECF(图36.3)。若正常饮食摄入的K+(约33 mEq)全部存留于ECF腔室(14 L),则血浆[K+]将升高2.4 mEq/L(33 mEq加入14 L ECF中):
33 mEq/14L = 2.4 mEq/L
钾离子(K+)的快速(数秒至数分钟)细胞内摄取对于预防危及生命的高钾血症(hyperkalemia)至关重要。肾脏对K+的排泄相对缓慢(数小时)。维持全身K+浓度恒定需要胃肠道(GI tract)吸收的几乎所有K+最终通过肾脏排出。结肠负责剩余的小部分K+排泄,对于终末期肾病(end-stage kidney disease)患者,结肠可能增加粪便中K+的排泄量。
血浆[K+]的调节
包括肾上腺素(epinephrine)、胰岛素(insulin)和醛固酮(aldosterone)在内的多种激素通过刺激骨骼肌、肝脏、骨骼和红细胞中的Na+,K+ -ATPase以及Na+/K+/2Cl-和Na+/Cl-共转运体,增加这些细胞对K+的摄取(见Box 36.1;图36.3)。K+摄取的急性刺激(即几分钟内)是由现有Na+,K+ -ATPase以及Na+/K+/2Cl-和Na+/Cl-共转运体活性增加介导的,而K+摄取的慢性增加(即几小时到几天内)则是由Na+,K+ -ATPase数量的增加介导的。胃肠道吸收K+后血浆[K+]的升高会刺激胰腺分泌胰岛素、肾上腺皮质释放醛固酮以及肾上腺髓质分泌肾上腺素(见图36.3)。相反,血浆[K+]的降低会抑制这些激素的释放。胰岛素和肾上腺素在几分钟内发挥作用,而醛固酮则需要大约一小时才能刺激细胞摄取K+。
肾上腺素
儿茶酚胺通过激活α-和β2 -肾上腺素能受体影响K+在细胞膜上的分布。α -肾上腺素能受体的刺激会释放K+,尤其是在肝脏中,而β2 -肾上腺素能受体的刺激则会促进细胞摄取K+。
例如,运动后β2 -肾上腺素能受体的激活对预防高钾血症很重要。如果患者在摄入富含K+的餐食前接受了β\mathbf{\cdot} -肾上腺素能受体拮抗剂(如普萘洛尔)的预处理,血浆[K+]的升高会更大。此外,应激(如心肌缺血)期间肾上腺素的释放可以迅速降低血浆[K+]。
胰岛素
胰岛素是摄入膳食K+后促使K+进入细胞的最重要激素。胰岛素和葡萄糖输注可用于纠正危及生命的高钾血症。在糖尿病患者(即胰岛素缺乏)中,摄入富含K+的膳食后血浆[K+]的升高幅度大于健康人。在慢性肾病患者中,尽管胰岛素刺激的葡萄糖进入细胞的能力受损,但胰岛素刺激K+进入细胞的能力仍然保留。
醛固酮
醛固酮与儿茶酚胺和胰岛素一样,也促进K+进入细胞。醛固酮水平升高(如原发性醛固酮增多症)会导致低钾血症,而醛固酮水平下降(如Addison病)会导致高钾血症。正如后面讨论的以及图36.3所示,醛固酮还刺激尿液中K+的排泄。因此,醛固酮通过作用于K+进入细胞的摄取和改变尿液中K+的排泄来改变血浆[K+]。
血浆[K+]的变化
当K+的量(无论是肠内来源的,如膳食或胃肠道出血,还是肠外来源的,如静脉注射或溶血)超过细胞内摄取和肾脏排泄K+的能力时,通常会发生高钾血症(见框36.1)。当细胞内K+摄取和肾脏K+丢失超过K+摄入(膳食或静脉注射)时,通常会发生低钾血症(见框36.1)。在某些情况下(见后文),仅ECF和ICF之间K+分布的变化就可能导致血浆[K+]的急性且具有临床意义的紊乱。
酸碱平衡
代谢性酸中毒会增加血浆[K+],而代谢性碱中毒会降低血浆[K+]。呼吸性碱中毒会导致低钾血症。相比之下,呼吸性酸中毒对血浆[K+]几乎没有影响。由无机酸(如HCl、H2SO4)引起的代谢性酸中毒比由有机酸(如乳酸、乙酸、酮酸)积累引起的同等酸中毒更能增加血浆[K+]。降低的pH(即增加的[H+])促进H+进入细胞,同时K+从细胞中移出以维持电中性。酸中毒的这种效应部分是由于酸中毒抑制了细胞内积累K+的转运蛋白,包括Na+,K+ -ATP酶和Na+/K+/2Cl-共转运蛋白。此外,H+进入细胞的过程也发生在细胞缓冲ECF中[H+]变化时(见第37章)。当H+跨细胞膜移动时,K+向相反方向移动,因此阳离子在细胞膜上既没有增加也没有减少。代谢性碱中毒具有相反的效果;血浆[K+]随着K+进入细胞和H+离开细胞而降低。
尽管有机酸会导致代谢性酸中毒(metabolic acidosis),但它们不会引起显著的高钾血症(hyperkalemia)。对于有机酸引起高钾血症能力降低的原因,有两种解释。首先,有机阴离子可能与H+一起进入细胞,从而消除了跨膜\mathrmK+-H+}交换的需要。其次,有机阴离子可能刺激胰岛素分泌,从而将K+移入细胞。这种移动可能抵消酸中毒的直接效应,后者会将K+移出细胞。
血浆渗透压(Plasma Osmolality)
血浆的渗透压(osmolality)也会影响K+在细胞膜两侧的分布。细胞外液(ECF)渗透压的增加会促进细胞释放K+,从而增加细胞外K+的浓度。血浆渗透压每增加10mOsm/kg H2O,血浆K+浓度可能增加0.4到0.8mEq/L。在不使用胰岛素的糖尿病患者中,血浆K+浓度通常升高,部分原因是缺乏胰岛素,部分原因是血浆[葡萄糖]的增加(即从正常值100mg/dL}增加到某些情况下高达1200mg/dL),这会增加血浆渗透压。低渗透压则具有相反的作用。与渗透压变化相关的血浆K+浓度的变化与细胞体积的变化有关。例如,随着血浆渗透压的增加,由于跨膜渗透梯度的存在,水会离开细胞(见第1章)。水会离开细胞,直到细胞内渗透压与细胞外液相等。这种水的流失会使细胞收缩,并导致细胞内K+浓度上升。细胞内K+浓度的上升为K+从细胞中流出提供了驱动力。这一过程会增加血浆K+浓度。血浆渗透压的下降则具有相反的效果。
细胞溶解(Cell Lysis)
细胞溶解会导致高钾血症,因为细胞内K+被释放到细胞外液中。严重的创伤(如烧伤)、肿瘤溶解(即化疗或自然过程导致的肿瘤细胞破坏)和横纹肌溶解(即骨骼肌细胞的破坏)会破坏细胞,并将K+和其他细胞内容物释放到细胞外液中。
运动(Exercise)
在高强度运动或体力消耗期间,骨骼肌中的重复动作电位导致肌肉细胞中的K+流失,随后在血浆和间质液(ECF腔室)之间重新分布。由于骨骼肌含有体内主要的K+池,血浆K+水平可能增加到8mEq/L,并且在运动期间可能维持这一水平。体能训练或锻炼通过增加骨骼肌细胞中Na,K-ATPase泵的数量来减少运动引起的高钾血症。运动停止后,恢复中的肌肉细胞通过Na,K-ATPase介导的K+摄取重新获得丢失的K+,随后在几分钟内血浆K+水平恢复正常,这可能会先出现K+水平的暂时性下降和短暂的低钾血症。运动期间K+水平的变化伴随着肌肉细胞体积的变化。收缩的肌肉细胞在失去K+时会膨胀。运动停止后,水迅速从肌肉细胞移动到间质空间,然后缓慢重新分布到血管内空间。然而,K+的移动似乎对控制肌肉细胞体积并不重要。
肾脏的K+排泄
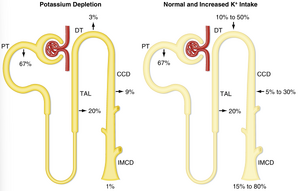
肾脏在维持K+平衡中起主要作用。如图36.3所示,肾脏排泄了从饮食中摄入的90%至95%的K+。即使摄入量增加多达10倍,排泄量也等于摄入量。尿液排泄和饮食摄入之间的这种平衡强调了肾脏在维持K+稳态中的重要性。尽管每天有少量K+通过粪便和汗液流失(约5%-10%的饮食摄入K+),除了严重腹泻期间,这一量基本上是恒定的,不受调节,因此相对于肾脏排泄的K+来说不那么重要。远端小管(DT)和集合管系统的细胞将K+从血液分泌到管腔液是决定尿K+排泄的关键因素(图36.4)。
由于K+不与血浆蛋白结合,它可以在肾小球自由滤过,并且几乎完全在近端小管(通过旁细胞途径,与Na+和水成比例)和Henle袢升支(此处跨细胞的K+转运由顶膜Na+/K+/2Cl-共转运体介导)被重吸收。K+的重吸收部分与K+的摄入量无关。尿液中K+的排泄主要来源于沿醛固酮敏感的远端肾单位(ASDN)的分泌,该单位包括远端小管(DT)的最后部分、连接小管和皮质集合管(CCD)。饮食中K+摄入量的增加会促进K+的分泌(见图36.4,右图)。相反,低K+饮食会激活沿ASDN的K+重吸收(见图36.4,左图)。
临床意义
运动引起的血浆[K+]变化通常不会产生症状,并在休息几分钟后恢复正常。然而,剧烈运动可能导致危及生命的高钾血症,尤其是在以下个体中:(1) 患有影响胰岛素、肾上腺素(一种β -肾上腺素能激动剂)或醛固酮释放的内分泌疾病;(2) 排泄K+的能力受损(例如,肾功能衰竭);或(3) 服用某些药物,如β1-肾上腺素能阻滞剂。例如,在剧烈运动期间,服用β1 -肾上腺素能受体拮抗剂治疗高血压的个体,血浆[|K+]可能增加至少2至4mEq/L。心脏在运动停止时也可能面临K+水平的急剧下降(见前文)。这种下降似乎与心脏复极受损有关,可能诱发心律失常和心源性猝死,尤其是在已有低钾血症、缺血性心脏病、心力衰竭、室性心律失常或遗传性或获得性长QT综合征的个体中。
临床意义
在患有终末期肾病的个体中,肾脏无法排泄摄入的K+,导致血浆[K+]升高。由此产生的高钾血症(hyperkalemia)会降低静息膜电位(resting membrane potential)(即电压变得不那么负)。膜电位的降低通过使快速Na+通道失活来减少神经元、心脏细胞和肌肉细胞的兴奋性,这些通道对于动作电位(action potential)的去极化阶段至关重要(见图36.1)。血浆[K+]的急剧升高可能导致心脏骤停和死亡。相反,在使用利尿剂的患者中,尿液中K+的排泄量通常超过饮食中K+的摄入量。因此,K+平衡为负值,导致低钾血症(hypokalemia)的发生。细胞外[K+]的下降会使静息细胞膜超极化(hyperpolarizes)(即电压变得更负),并降低神经元、心脏细胞和肌肉细胞的兴奋性。严重的低钾血症可能导致心律失常、瘫痪和死亡。低钾血症还可能损害肾脏浓缩尿液的能力,并刺激肾脏产生NH4+,从而影响酸碱平衡(见第37章)。因此,维持细胞内高[K+]、细胞外低[K+]以及跨细胞膜的高[K+]梯度对于细胞功能至关重要。
远端小管和集合管中主细胞和闰细胞的K+转运的细胞机制
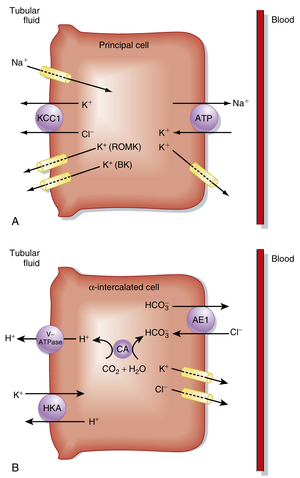
图36.5A展示了主细胞(principal cells)分泌K+的细胞机制。K+从血液分泌到管腔的过程分为两步:(1) K+通过Na+,K+ -ATPase从血液跨过基底外侧膜(basolateral membrane)进入细胞;(2) K+通过肾外髓K+通道(renal outer medullary K+ channel, ROMK)和大K+通道(Big K+ channel, BK)从细胞进入管腔液。顶膜(apical membrane)上的K+/Cl-共转运体(cotransporter, KCC1)也参与K+的分泌。Na+,K+ -ATPase在细胞内建立了高K+浓度,为K+通过K+通道跨过顶膜提供了化学驱动力。尽管基底外侧膜上也存在K+通道,K+优先通过顶膜离开细胞并进入管腔液。K+选择这一途径的原因有两个:首先,顶膜两侧的K+电化学梯度有利于其顺梯度进入管腔液;其次,顶膜对K+的通透性高于基底外侧膜。因此,K+优先通过顶膜扩散进入管腔液。K+通过K+/Cl-共转运体跨过顶膜的分泌是由细胞与管腔液之间K+的有利浓度梯度驱动的。控制主细胞在远端小管(distal tubule, DT)和皮质集合管(cortical collecting duct, CCD)中K+分泌速率的三个主要因素包括:(1) Na+,K+ -ATPase的活性;(2) K+跨过顶膜运动的驱动力(K+通道的电化学梯度和K+/Cl-共转运体的化学浓度梯度);(3) 顶膜K+通道对K+的通透性。在DT和CCD中,α -间细胞(α -intercalated cells)通过位于顶膜的H+-K+ -ATPase(HKA)转运机制重吸收K+(见图36.5B)。该转运体介导K+跨过顶膜进入细胞,同时排出H+。K+从间细胞进入血液的过程由K+通道介导。K+的重吸收在低K+饮食时被激活。
DT和CCD中的K+排泄
K+ 的排泄由 ASDN(aldosterone-sensitive distal nephron,醛固酮敏感性远端肾单位)决定,其影响因素包括血浆 [K+]、Na+ 的输送和管腔液流量(即 K+ 感知)、醛固酮、精氨酸加压素(arginine vasopressin, AVP)、糖皮质激素水平以及酸碱状态。
血浆 [K+]
血浆 [K+] 是 DT(distal tubule,远端小管)和 CCD(cortical collecting duct,皮质集合管)分泌 K+ 的重要决定因素。高钾血症(hyperkalemia)在几分钟内通过多种机制刺激 K+ 的分泌。首先,高钾血症刺激 Na+ , K+ -ATPase,从而增加 K+ 通过基底外侧膜的摄取。这种摄取提高了细胞内 [K+],并增加了 K+ 通过顶膜排出的电化学驱动力。其次,高钾血症还增加了顶膜对 K+ 的通透性。第三,高钾血症刺激肾上腺皮质分泌醛固酮,正如后文所述,醛固酮与血浆 [K+] 协同作用,刺激 K+ 的分泌。第四,高钾血症还增加了管腔液的流速,正如后文所述,这会刺激 DT 和 CCD 分泌 K+。
低钾血症(hypokalemia)通过与高钾血症相反的作用减少 K+ 的分泌。因此,低钾血症抑制 Na+ , K+ -ATPase,降低 K+ 通过顶膜排出的电化学驱动力,减少顶膜对 K+ 的通透性,并降低血浆醛固酮水平。
在细胞水平
ROMK是主细胞顶膜上的主要通道,介导组成性(与流量刺激相对)的K+分泌。ROMK在生理条件下具有低电导和高开放概率。此外,Ca++激活的BK通道也在顶膜上表达。BK通道具有较大的单通道电导,在基础状态下处于静息状态,并在前述的流量增加条件下介导K+分泌。有趣的是,敲除编码ROMK通道的KCNJ1基因会导致肾脏增加NaCl和K+的排泄,从而导致ECFV减少和低钾血症。尽管这一效应有些令人困惑,但需要注意的是,ROMK也在Henle袢粗升支(TAL)的顶膜上表达,在那里它在K+跨顶膜的再循环中起着非常重要的作用,这一效应对NaKCC共转运体的运作至关重要。在没有ROMK的情况下,TAL对NaCl的重吸收减少,导致尿液中NaCl的丢失。TAL对NaCl重吸收的减少也降低了正跨上皮管腔电压,这是该肾单位段重吸收K+的驱动力。因此,TAL对旁细胞K+重吸收的减少增加了尿液中K+的排泄,即使由于缺乏ROMK通道,皮质集合管无法分泌正常量的K+。然而,即使在ROMK敲除小鼠中,CCD仍然通过主细胞顶膜上表达的流量和Ca++依赖的BK通道分泌K+。
临床相关
慢性低钾血症([K+]<3.5 mEq/L)可能发生在接受利尿剂治疗、滥用泻药、严重呕吐或腹泻、进行鼻胃抽吸或患有醛固酮增多症的患者中。低钾血症的发生是因为肾脏K+排泄超过了饮食中K+的摄入。呕吐、鼻胃抽吸、利尿剂和腹泻都会减少ECF体积,进而刺激醛固酮的分泌(见第35章)。由于醛固酮刺激肾脏排泄K+,其作用有助于低钾血症的发展。低钾性肾病是一种慢性疾病,患者体内K+总量减少,其特征是体积减少和醛固酮增多症。它通常是一种进展性慢性肾脏疾病,可能导致终末期肾病。
慢性高钾血症([K+]>5.0\mathsf{m E q}/\mathsf{L})最常见于尿流量减少、血浆醛固酮水平低和肾病患者,其中肾小球滤过率(GFR)低于正常值的20%。在这些个体中,高钾血症的发生是因为肾脏K+排泄低于饮食中K+的摄入。较少见的高钾血症原因发生在胰岛素或醛固酮分泌不足的人或由无机酸引起的代谢性酸中毒的人中。
Na+输送和管状液流量(肾上皮细胞的K+感知)
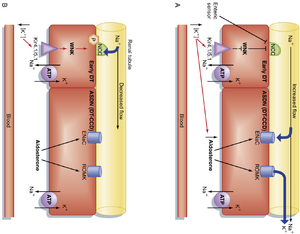
K+ 的分泌是由增加的 Na+ 输送和管状液体流向 ASDN(aldosterone-sensitive distal nephron,醛固酮敏感性远端肾单位)所诱导的。这一效应始于远端小管(distal tubule, DT)的早期部分,其中 Na+ 的转运由噻嗪类敏感的 Na+/Cl- 共转运体(cotransporter)驱动。增加的 K+ 血浆浓度由位于 DT 早期段基底外侧膜上的 K+ 传感器 Kir 4.1/5.1 通道检测到(图 36.6A)。Kir 4.1/5.1 对增加的 K+ 血浆浓度的感知启动了一个信号级联反应,该反应使 Na+/Cl- 共转运体去磷酸化并抑制其活性。Na+/Cl- 共转运体的抑制导致更多的 Na+ 输送和管状液体流向 ASDN,从而增加肾脏的 K+ 排泄。摄入减少和 K+ 血浆浓度降低会激活 DT 早期的 Na+/Cl- 共转运体,并通过减少 Na+ 输送和流向 ASDN 来限制 K+ 的分泌(图 36.6B)。
肾小管液流量的增加(例如,使用利尿剂治疗、ECF扩张)会在几分钟内刺激K+的分泌,而由出血、严重呕吐或腹泻引起的ECF收缩则会减少ASDN对K+的分泌。随着饮食中K+摄入量的增加,肾小管液流量的增加对刺激K+分泌的效果更为显著。流量的增加会使主细胞中的初级纤毛弯曲,从而激活多囊蛋白(PKD)1/PKD2 Ca++传导通道复合物。这使得更多的Ca++进入主细胞,并增加细胞内[Ca++]。[Ca++]的增加激活了顶膜上的BK K+通道,从而增强了K+从细胞向肾小管液的分泌。随着流量的增加,例如在使用利尿剂后或由于ECF的增加,肾小管液中的[Na+]也会增加。[Na+]的增加促进了Na+通过ASDN细胞顶膜的进入,从而降低了细胞内部的负膜电位。细胞膜电位的去极化增加了电化学驱动力,促进了K+通过顶膜向肾小管液的分泌。此外,Na+进入细胞的增加激活了基底外侧膜上的Na+,K+ -ATP酶,从而增加了K+通过基底外侧膜的摄取,进而提高了细胞内[K+]。需要注意的是,在水利尿期间流量的增加对K+的排泄没有显著影响,这很可能是因为在水利尿期间,肾小管液中的[Na+]不会随着流量的增加而增加。
临床意义
自农业革命以来,人类的饮食从高钾(K+)低钠(Na+)转变为低钾(K+)高钠(Na+)饮食。成年人适宜的钾(K+)摄入量建议通常在90至100 mEq/天(3500-4000 mg/天)之间。在全球范围内的分析中,钾(K+)摄入量(通过成年人尿钾排泄量估算)比推荐摄入量低40%至50%。低钾(K+)饮食与心血管不良事件风险增加相关,包括高血压和低钾性肾病。低钾(K+)饮食会增加远曲小管(DT)中钠(Na+)/氯(Cl-)共转运体的活性。这在生理学上是合理的,因为通过钠(Na+)/氯(Cl-)共转运体增加钠的重吸收,减少了钠(Na+)向下游分泌钾(K+)的肾单位节段的输送,从而有助于保留钾(K+)。低钾(K+)饮食通过减少肾脏的钠(Na+)排泄,与盐敏感性高血压的发病机制有关。在钾(K+)缺乏时,肾脏保留钾(K+)和钠(Na+)的反应可能是由于早期人类可能同时面临饮食中钾(K+)和钠(Na+)的缺乏。在当今饮食中钠(Na+)摄入量高而钾(K+)摄入量低的情况下,肾脏保留钾(K+)和钠(Na+)的反应可能导致盐敏感性高血压。
醛固酮(Aldosterone)
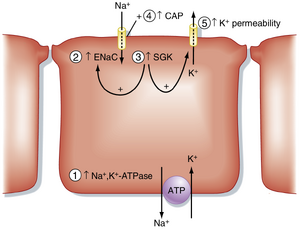
长期升高(≥24小时)的血浆醛固酮水平增强了ASDN(醛固酮敏感远端肾单位)主细胞的K+分泌(图36.7):(1) 通过增加基底外侧膜上的Na+,K+ -ATPase数量;(2) 通过增加顶膜上的上皮钠通道ENaC的表达;(3) 通过提高SGK1(血清糖皮质激素刺激激酶)水平,这也增加了顶膜上Na+ ENaC通道的表达并激活K+通道;(4) 通过刺激CAP1(通道激活蛋白酶,也称为prostatin),直接激活ENaC;(5) 通过刺激顶膜对K+的通透性。醛固酮通过增加膜上K+通道的数量来增加顶膜对K+的通透性。然而,参与这一反应的细胞机制尚不完全清楚。Na+,K+ -ATPase表达的增加促进了K+通过基底外侧膜进入细胞的摄取,从而提高了细胞内[K+]。Na+通道数量和活性的增加增强了Na+从管腔液进入细胞的量,这一效应使顶膜电压去极化。顶膜的去极化和细胞内[K+]的增加增强了K+从细胞分泌到管腔液的电化学驱动力。总的来说,这些作用增加了K+通过基底外侧膜进入细胞的摄取,并增强了K+通过顶膜从细胞的排出。醛固酮的分泌在高钾血症和血管紧张素II(在肾素-血管紧张素系统激活后)的作用下增加。醛固酮的分泌在低钾血症和心脏释放的利钠肽作用下减少。
尽管醛固酮水平的急性(几小时内)增加增强了Na+,K+ -ATPase的活性,但K+的排泄并不会立即增加。这种延迟是由于醛固酮对Na+重吸收和管腔流量的影响。醛固酮刺激的Na+和水重吸收减少了管腔流量,从而减少了K+的分泌(稍后将详细讨论)。然而,长期刺激Na+重吸收会增加ECF(细胞外液)体积,从而使管腔流量恢复正常。这些作用使醛固酮对ASDN的直接刺激效应能够增强K+的排泄。
AVP
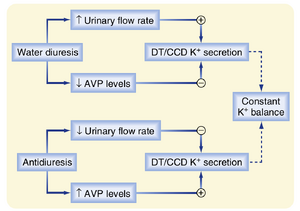
尽管AVP(抗利尿激素)不影响尿中K+的排泄,但这种激素通过ASDN(远端肾单位)促进K+的分泌(图36.8)。AVP通过刺激主细胞顶膜的Na+摄取,增加了K+跨顶膜外出的电化学驱动力。Na+摄取的增加降低了跨顶膜的电势差(即细胞内部变得不那么负)。尽管有这种效应,AVP并不改变这些肾单位段的K+分泌。这与AVP对管腔液流动的影响有关。AVP通过刺激水的重吸收减少了管腔液的流动。管腔液流动的减少反过来又减少了K+的分泌(稍后解释)。管腔液流动减少的抑制作用抵消了AVP对K+跨顶膜外出的电化学驱动力的刺激作用(见图36.8)。如果AVP没有增加有利于K+分泌的电化学梯度,随着AVP水平的增加和尿流率的减少,尿中K+的排泄将会下降。因此,K+平衡将随着水平衡的变化而变化。因此,AVP对K+跨顶膜外出的电化学驱动力和肾小管流动的影响使得尿中K+的排泄在水排泄大幅波动的情况下保持恒定。
糖皮质激素
糖皮质激素增加尿中K+的排泄。这种效应部分是通过增加GFR(肾小球滤过率)来介导的,GFR的增加提高了尿流率,这是K+排泄的强有力刺激因素,同时通过刺激SGK1活性(见前文)来实现。
如前所述,尿中K+的排泄速率通常由激素水平、酸碱平衡或肾小管液流动速率的同时变化决定(表36.1)。流动的强大效应常常增强或抵消ASDN对激素和酸碱平衡变化的反应。这种相互作用在高钾血症的情况下是有益的,因为流动的增加增强了K+的排泄,从而恢复了K+的稳态。然而,这种相互作用也可能是有害的,例如在代谢性碱中毒的情况下,流动和酸碱状态的变化会改变K+的稳态。
酸碱状态
急性(几分钟到几小时内)和慢性(几天内)的酸碱紊乱对ASDN的K+处理和肾脏K+排泄都有复杂的影响。代谢性酸中毒对肾脏K+排泄的影响是时间依赖性的。如图36.9所示,急性酸血症(即血浆pH低于正常)通过两种机制减少K+的分泌:(1)抑制Na+,K+ -ATP酶,从而降低细胞内[K+]和K+跨顶膜外出的电化学驱动力;(2)通过降低顶膜对K+的通透性。急性碱血症(即血浆pH高于正常)具有相反的效果,增加K+的分泌。
| 条件 | 远曲小管与集合管(ASDN)K⁺分泌 | 小管液流速 | 肾脏K⁺排泄 | 血浆[K⁺]变化 |
|---|---|---|---|---|
| 高钾血症 | 增加 | 增加 | 增加 | 降低 |
| 醛固酮 | ||||
| 急性 | 增加 | 降低 | 无变化 | 降低 |
| 慢性 | 增加 | 无变化 | 增加 | 降低 |
| 糖皮质激素 | 增加 | 增加 | 增加 | 降低 |
| 抗利尿激素(AVP) | 增加 | 降低 | 无变化 | 降低 |
| 酸中毒 | ||||
| 急性 | 减少 | 无变化 | 减少 | 增加 |
| 慢性 | 减少 | 大幅增加 | 增加 | 降低 |
| 碱中毒 | 增加 | 增加 | 大幅增加 | 降低 |
| ASDN,醛固酮敏感性远端肾单位。改编自Field MJ等。见:Narins R,编。《肾脏学教科书:体液和电解质代谢的临床紊乱》。第5版。纽约:McGraw-Hill;1994年。 | ||||
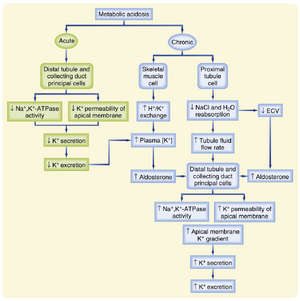
慢性酸血症促进肾脏K+排泄,导致K+负平衡(见图36.9)。这是因为慢性代谢性酸中毒通过抑制近端小管中的Na+,K+ -ATP酶,减少了水和溶质(如NaCl)的重吸收。因此,肾小管液流量在ASDN中增加。近端小管对水和NaCl重吸收的抑制也减少了ECF容量,从而刺激醛固酮的分泌。此外,由无机酸引起的慢性酸中毒增加了血浆[K+],这进一步刺激了醛固酮的分泌。肾小管液流量、血浆[K+]和醛固酮水平的升高抵消了酸中毒对细胞[K+]和顶膜通透性的影响,K+分泌增加。因此,代谢性酸中毒可能抑制或刺激K+的排泄,这取决于紊乱的持续时间。如前所述,急性代谢性碱中毒刺激K+的排泄。慢性代谢性碱中毒,尤其是与ECF收缩相关时,由于醛固酮水平的增加,显著增加了肾脏K+的排泄。
酸血症(acidemia)和碱血症(alkalemia)对K+排泄的方向性影响在呼吸性酸碱紊乱中与代谢性紊乱相似,但呼吸性紊乱对K+排泄的影响通常小于代谢性酸碱紊乱。由过度通气引起的急性呼吸性碱中毒(acute respiratory alkalosis)与α-肾上腺素能刺激相关,这种刺激通过抑制细胞内K+的摄取来增加血浆[K+]。急性呼吸性碱中毒是临床中常见的酸碱紊乱,常见于胸痛、焦虑、药物、低氧血症和感染等情况。慢性呼吸性碱中毒通常会增加肾脏K+的排泄并降低血浆[K+]。
在细胞水平
最近阐明了饮食中K+含量和酸碱状态通过ASDN(aldosterone-sensitive distal nephron)早期段调节K+分泌的细胞机制。K+摄入增加通过多种机制增加K+的分泌。高钾血症(hyperkalemia)增加了主细胞(principal cells)顶膜(apical plasma membrane)上ROMK通道的活性。此外,高钾血症抑制了近端小管(proximal tubule)对NaCl和水的重吸收,从而增加了ASDN的流速,这是K+分泌的强有力刺激(图36.6)。高钾血症还增加了醛固酮(aldosterone)水平,醛固酮通过三种机制增加K+的分泌。首先,醛固酮增加了顶膜上K+通道的数量。其次,醛固酮通过增加基底外侧膜(basolateral membrane)上{Na+},{\mathsfK+}}-ATPase泵的数量,刺激K+的摄取,从而增强了驱动K+跨顶膜分泌的电化学梯度。第三,醛固酮增加了Na+跨顶膜的运动,使顶膜电压去极化,从而增加了电化学梯度,促进了K+的分泌。低K+饮食通过增加酪氨酸激酶(tyrosine kinase)的活性显著减少了ASDN对K+的分泌,酪氨酸激酶导致ROMK通道从顶膜内吞,从而减少了K+的分泌。伴有酸血症的代谢性酸中毒(metabolic acidosis)通过抑制ROMK通道的活性减少了K+的分泌,而伴有碱血症的代谢性碱中毒(metabolic alkalosis)则通过增强ROMK通道的活性刺激了K+的分泌。
钙和无机磷酸盐稳态概述
Ca++和无机磷酸盐Pi是多价离子,承担着许多复杂而重要的功能。Ca++是酶促反应的辅因子,也是许多信号通路中的第二信使,对稳态至关重要。Pi是代谢过程中必不可少的物质,包括三磷酸腺苷(ATP)的形成,并且它是核苷酸、核苷和磷脂的重要组成部分。蛋白质的磷酸化是细胞信号传导的重要机制,Pi是细胞、血浆和尿液中的重要缓冲物质。Ca++和Pi是细胞外基质、软骨、牙齿和骨骼的关键元素。
肾脏通过排泄胃肠道吸收的Ca++和Pi的量来调节全身的Ca++和Pi(正常的骨重塑不会导致Ca++和Pi的净增加或从骨骼中释放)。如果血浆中的Ca++和Pi浓度显著下降,肠道吸收、骨吸收(即从骨骼中丢失Ca++和Pi)以及肾小管重吸收会增加,从而使血浆中的Ca++和Pi浓度恢复到正常水平。在生长和怀孕期间,肠道吸收超过尿液排泄,这些离子会在新形成的胎儿组织和骨骼中积累。相反,骨骼疾病(如骨质疏松症)或瘦体重的下降会增加尿液中的Ca++和Pi丢失,而肠道吸收没有变化。这些情况会导致体内Ca++和Pi的净丢失。最后,在慢性肾功能衰竭期间,Pi会在体内积累,因为Pi的肠道吸收超过尿液排泄,导致Pi在体内积累和骨重塑(参见“临床讨论”中关于终末期肾病的讨论)。
这段简短的介绍揭示了肾脏与胃肠道和骨骼共同作用,在维持血浆Ca++和Pi水平以及Ca++和Pi稳态方面起着重要作用(参见第40章)。因此,本章的这一部分将讨论肾脏对Ca++和Pi的处理,重点介绍调节尿液排泄的激素和因素。
钙
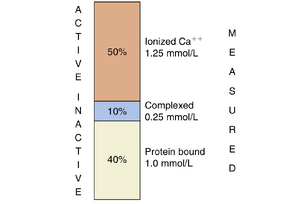
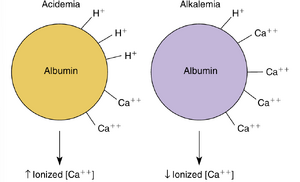
Ca++在细胞过程中扮演重要角色,包括骨骼形成、细胞分裂和生长、止血、激素-反应偶联以及电刺激-反应偶联(例如肌肉收缩、神经递质释放)。近99%的Ca++储存在骨骼和牙齿中,约1%存在于细胞内液(ICF)中,0.1%存在于细胞外液(ECF)中。血浆中总[Ca++]为10mg/dL (2.5~mM或5mEq/L),其浓度通常维持在非常狭窄的范围内。血浆中约50%的Ca++是离子化的(即游离的),40%与血浆蛋白(主要是白蛋白)结合,10%与几种阴离子形成复合物,包括PO4、HCO3-、柠檬酸和SO4(图36.10)。血浆的pH会影响这种分布(图36.11)。测量的总血浆[Ca++]并不能反映生理上相关的离子化[Ca++]。酸血症会增加离子化[Ca++],而以与蛋白质结合的Ca++为代价,而碱血症则通过增加与蛋白质结合的Ca++来减少离子化[Ca++]。碱血症患者容易发生强直性痉挛(强直性肌肉痉挛),而酸血症患者即使血浆总Ca++水平降低,也不容易发生强直性痉挛。代谢性酸中毒患者中[H+]的增加导致更多的H+与血浆蛋白、PO4、HCO3-、柠檬酸和SO4结合,从而取代Ca++。这种取代增加了血浆中离子化的[Ca++]。在碱血症中,血浆的[H+]减少。一些H+离子从血浆蛋白、PO4、HCO3-、柠檬酸和SO4中解离,以交换Ca++,从而减少离子化的[Ca++]。血浆白蛋白浓度也影响[Ca++]。低白蛋白血症会降低总[Ca++],可能无法准确反映离子化的[Ca++],而高白蛋白血症对总[Ca++]有相反的影响。在临床实践中,普遍认为血清白蛋白浓度每下降1g/dL,总[Ca++]下降0.8~mg/dL(0.2mmol/L)。
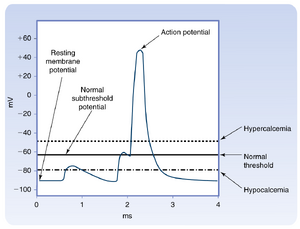
低离子化[Ca++]会增加神经和肌肉细胞的兴奋性,并可能导致低钙血症性手足搐搦。与低钙血症相关的手足搐搦发生的原因是低钙血症导致阈值电位向更负的值移动(即更接近静息膜电位)(图36.12)。升高的离子化[Ca++]可能会降低神经肌肉的兴奋性或导致心律失常、嗜睡、定向障碍甚至死亡。高钙血症的这种效应发生的原因是升高的离子化[Ca++]导致阈值电位向较不负的值移动(即远离静息膜电位)。[Ca++]在一个非常狭窄的范围内被调节,主要由甲状旁腺激素(PTH)和维生素D的活性代谢物骨化三醇(1,25-二羟基维生素D3)调节。
细胞内Ca++被隔离在内质网和线粒体中,或与蛋白质结合。因此,细胞内离子化[Ca++]非常低(100nM)。细胞膜两侧[Ca++]的大浓度梯度由所有细胞中的Ca++-ATPase泵(PMCa1b)和一些细胞中的3Na+/Ca++交换器(NCX1)维持。
钙稳态概述
Ca++稳态取决于:(1)从胃肠道吸收的Ca++,(2)Ca++在骨骼和细胞外液(ECF)之间的分布,以及(3)肾脏对Ca++排泄的调节。全身Ca++含量由从胃肠道吸收的Ca++量和肾脏排泄的Ca++量决定(图36.13)。胃肠道通过一种主动的载体介导的转运机制吸收Ca++,这种机制受到肾脏近曲小管产生的骨化三醇的刺激。从胃肠道净吸收的Ca++约为200mg/day,但当骨化三醇水平升高时,可以增加到600mg/day。肾脏每日排泄的Ca++量等于胃肠道吸收的量(200~mg/day),并且与肠道吸收同步变化。因此,Ca++平衡得以维持,因为平均饮食中摄入的Ca++量1000mgday等于粪便中丢失的量800mg/day加上尿液中排泄的量(200mg/day)。
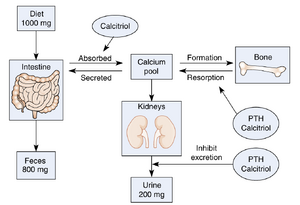
Ca++在骨骼和细胞外液(ECF)之间的分布调控由甲状旁腺激素(PTH)和骨化三醇(calcitriol)介导(见图36.13)。PTH由甲状旁腺分泌,以响应血浆[Ca++]的降低(即低钙血症)。PTH通过以下方式增加血浆[Ca++]:(1) 刺激骨吸收,(2) 增加肾脏远曲小管(DT)对Ca++的重吸收,以及(3) 刺激骨化三醇的产生,骨化三醇进而增加胃肠道(GI)对Ca++的吸收。肾脏中骨化三醇的产生由低钙血症和低磷血症刺激。骨化三醇主要通过刺激胃肠道对Ca++的吸收来增加血浆[Ca++]。它还通过增加肾脏中Ca++结合和转运蛋白的表达来增强肾脏对Ca++的重吸收(具体细节将在后面讨论)。血浆Ca++是钙感应受体(CaSR)的激动剂,CaSR表达在参与Ca++稳态的细胞表面:分泌PTH的甲状旁腺细胞、分泌降钙素的甲状腺细胞、产生骨化三醇的近曲小管细胞和TAL细胞(将在后面讨论)。CaSR被离子化[Ca++]的增加激活,抑制甲状旁腺释放PTH和近曲小管产生骨化三醇。CaSR激活的净效应是减少肾脏对Ca++的重吸收、降低血浆[Ca++]以及减弱PTH介导的磷酸尿效应(减少肾脏Pi的排泄)。CaSR通过立即响应血浆[Ca++]的微小变化,在稳态血浆[Ca++]中起主要作用。降钙素由甲状腺C细胞(滤泡旁细胞)分泌,其分泌由高钙血症刺激。降钙素主要通过刺激骨形成(即Ca++在骨中的沉积)来降低血浆[Ca++]。尽管降钙素在低等脊椎动物的Ca++稳态中起重要作用,但在人类的Ca++稳态中仅起次要作用,因此不再进一步讨论。
临床意义
降低甲状旁腺激素(PTH)水平的情况(例如,因腺瘤切除甲状旁腺后导致的甲状旁腺功能减退)会降低血浆中的[Ca++],这可能导致低钙性手足抽搐(间歇性肌肉收缩)。在严重情况下,低钙性手足抽搐可能因窒息导致死亡。高钙血症可能引发致命的心律失常并降低神经肌肉的兴奋性。临床上,高钙血症最常见的原因是原发性甲状旁腺功能亢进和恶性肿瘤。原发性甲状旁腺功能亢进是由于甲状旁腺良性肿瘤过度分泌PTH所致。相比之下,恶性肿瘤如癌会分泌一种类似PTH的激素,称为甲状旁腺激素相关肽(PTHrP)。PTH和PTHrP水平的升高会导致高钙血症和高钙尿症(尿钙排泄增加)。
沿肾单位的钙转运
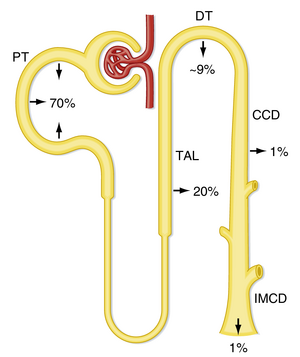
可用于肾小球滤过的Ca++包括离子化部分和与阴离子结合的Ca++。因此,血浆中约60%的Ca++可用于肾小球滤过。正常情况下,滤过的Ca++中有99%被肾单位重吸收(图36.14)。近端小管重吸收约50%至60%的滤过Ca++。另外15%在Henle袢(主要是TAL的皮质部分)重吸收,约10%至15%由远曲小管(DT)重吸收,不到1%由集合管重吸收。约1%(200毫克/天)通过尿液排出。这部分等于胃肠道每天净吸收的量。
近端小管对Ca++的重吸收主要通过细胞旁途径进行。这种被动的细胞旁重吸收由近端小管后半段的管腔正跨上皮电压和有利的Ca++浓度梯度驱动,这两者都是由近端小管前半段的跨细胞Na+和水重吸收建立的(见第34章)。
Henle袢对Ca++的重吸收也主要通过细胞旁途径进行。与近端小管类似,TAL中的Ca++和Na+重吸收是平行的。这些过程之所以平行,是因为Ca++通过细胞旁途径被动重吸收,而Na+重吸收产生了管腔正电压。袢利尿剂抑制Henle袢TAL的Na+重吸收,从而降低管腔正电压的幅度(见第34章)。这一作用反过来抑制了通过细胞旁途径的Ca++重吸收。因此,袢利尿剂可用于增加高钙血症患者的肾脏Ca++排泄。
在细胞水平
紧密连接蛋白claudin-16(CLDN16)的突变会降低细胞旁途径对Ca++和\mathsf{M g}^{++}的通透性,从而减少Ca++和\mathsf{M g}^{++}在Henle袢粗升支(TAL)中通过紧密连接的扩散性重吸收。家族性低镁高钙尿症是由claudin-16的突变引起的,claudin-16是TAL细胞中紧密连接的组成部分。这种疾病的特征是由于TAL中细胞旁途径对这些离子的被动重吸收减少,导致Ca++和\mathsf{M g}^{++}的排泄增加。受影响的个体尿液中Ca++水平较高,可能导致肾结石(nephrolithiasis)的形成。
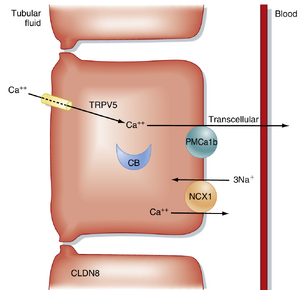
在远曲小管(DT)中,由于管腔内的电压相对于血液为负电性,Ca++的重吸收完全是主动的,因为Ca++是逆其电化学梯度被重吸收的(图36.15)。因此,DT对Ca++的重吸收完全是跨细胞的。Ca++通过Ca++通透性离子通道(TRPV5)穿过顶膜进入细胞。在细胞内,Ca++与calbindinD28K结合。calbindin-Ca++复合物携带Ca++穿过细胞,并将其递送到基底外侧膜,在那里主要通过3Na+/1Ca++反向转运体(NCX1)将Ca++排出细胞;然而,质膜Ca++ -ATPase同工酶1b(PMCA1b)也可能参与其中。尿液中Na+和Ca++的排泄通常呈平行变化。然而,这些离子的排泄并不总是平行变化,因为DT对Ca++和Na+的重吸收是独立且差异调节的。例如,噻嗪类利尿剂抑制DT对Na+的重吸收,但刺激该节段对Ca++的重吸收。因此,噻嗪类利尿剂的净效应是增加尿液中Na+的排泄并减少尿液中Ca++的排泄。由于噻嗪类利尿剂减少了尿液中Ca++的排泄,它们常被用于减少产生含Ca++肾结石的个体的尿钙排泄。
尿钙排泄的调节
多种激素和因素影响尿中 Ca++ 的排泄。PTH 发挥最强的调控作用(表 36.2)。PTH 刺激肾脏对 Ca++ 的重吸收(即抑制肾脏 Ca++ 的排泄)。尽管 PTH 抑制 Na+ 和水的重吸收,从而抑制近端小管对 Ca++ 的重吸收,但它刺激 Henle 袢的 TAL 和 DT 对 Ca++ 的重吸收。因此,PTH 的净效应是增强肾脏对 Ca++ 的重吸收。
血浆 [Ca++] 的变化也调节尿中 Ca++ 的排泄,高钙血症增加排泄,低钙血症减少排泄。高钙血症通过以下方式增加尿中 Ca++ 的排泄:(1)减少近端小管对 Ca++ 的重吸收(由于间质液 [Ca++] 增加导致旁细胞重吸收减少);(2)通过激活位于这些细胞基底外侧膜的 CaSR 抑制 Henle 袢 TAL 对 Ca++ 的重吸收(Na+ 重吸收减少,从而降低管腔正电位的幅度);(3)通过降低 PTH 水平抑制 DT 对 Ca++ 的重吸收。因此,尿中 Ca++ 的排泄增加。低钙血症对尿中 Ca++ 的排泄有相反的影响,主要是通过增加近端小管和 TAL 对 Ca++ 的重吸收。Calcitriol 增强 DT 对 Ca++ 的重吸收,但其效果不如 PTH。
影响肾脏Ca++排泄的因素有多种。血浆[Pi]的增加(例如,由于饮食中Pi负荷增加或肾功能下降引起)通过降低血浆离子化[Ca++]并随后刺激PTH分泌来抑制肾脏Ca++排泄。血浆[Pi]的下降(例如,由于饮食中Pi缺乏引起)则具有相反的效果(注:在肾功能正常的情况下,饮食中Pi摄入量在七倍范围内的变化对血浆[Pi]没有影响)。TAL中表达的CaSR直接增加肾脏Ca++排泄以响应血浆离子化[Ca++]的升高(如前所述)。相反,血浆[Ca++]的下降会导致TAL对Ca++的吸收增加,并相应地减少尿中Ca++的排泄。血浆[Ca++]对TAL中CaSR的直接影响与PTH并行作用,PTH通过调节DT对Ca++的吸收并控制尿中Ca++排泄以维持其稳态。ECF(细胞外液)体积的变化主要通过影响近端小管对Na+和水的重吸收来改变Ca++排泄。ECF收缩会增加近端小管对Na+和水的重吸收,从而增强Ca++的重吸收。因此,尿中Ca++排泄减少。ECF扩张则具有相反的效果。酸血症会增加Ca++排泄,而碱血症则会减少排泄。pH对Ca++重吸收的调节主要发生在DT。碱中毒会刺激顶端膜Ca++通道(TRPV5),从而增加Ca++重吸收。相反,酸中毒会抑制同一通道,从而减少Ca++重吸收。如前所述,袢利尿剂抑制TAL对Ca++的重吸收,而噻嗪类利尿剂则刺激DT对Ca++的重吸收。
| 因素/激素 | 近曲小管 | 髓袢粗上升支(TAL) | 远曲小管 |
|---|---|---|---|
| 甲状旁腺激素(PTH/PTHrP) | 降低 | 增加 | 增加 |
| 骨化三醇(活性维生素D) | 增加 | ||
| 容量扩张 | 降低 | 无变化 | 降低 |
| 高钙血症 | 降低 | 降低(通过CaSR) | 降低(通过PTH) |
| 低钙血症 | 增加 | 增加 | |
| 高磷血症 | 增加(通过PTH) | ||
| 低磷血症 | 降低 | 降低(通过PTH) | |
| 酸中毒(酸血症) | 降低 | ||
| 碱中毒(碱血症) | 增加 | ||
| 袢利尿剂(如呋塞米) | 降低 | ||
| 噻嗪类利尿剂 | 增加 | ||
| 注:PTH抑制近端小管对Ca++的重吸收,但刺激TAL(厚升支)和远端小管的重吸收。总体而言,净效应是增加Ca++的重吸收,从而减少尿中Ca++的排泄。CaSR,钙感受受体;P T H_{i},甲状旁腺激素;P T H r P,甲状旁腺激素相关肽;TAL,厚升支。改编自Mount DB, Yu A. 无机溶质的运输:钠、氯、钾、镁、钙和磷酸盐。见:Brenner BM, 编. Brenner和Rector的肾脏学。第8版。费城:Saunders;2008。 | |||
临床相关
CaSR基因编码的突变会导致Ca++稳态的紊乱。家族性低尿钙性高钙血症(FHH)是由CaSR基因失活突变引起的单倍体不足状态。高钙血症是由于Ca++调节的PTH分泌改变(即Ca++调节的PTH分泌的设定点发生偏移)所致,使得在任何血浆[Ca++]水平下PTH水平都升高,并且不受高钙血症的抑制。由于PTH水平升高和CaSR对肾脏Ca++运输的调节缺陷,TAL和DT中Ca++重吸收增强,导致低尿钙。常染色体显性低甲状旁腺功能减退症是由CaSR基因的激活突变引起的。CaSR的激活改变了Ca++调节的PTH分泌的设定点,使得在任何血浆[Ca]水平下PTH水平都降低。PTH水平降低和CaSR调节的肾脏Ca++运输缺陷导致高尿钙。CaSR通过WNK(无\mathsf{K}=赖氨酸)激酶信号通路激活DT早期段的噻嗪类敏感的Na+/\mathsf{Cl-共转运体(见第34章)。Na+/\mathsf{Cl-共转运体的激活减少了Ca++的重吸收,导致高尿钙。共转运体的失活增加了Ca++的重吸收,高尿钙得以缓解。因此,CaSR的激活增加了Na+/\mathsf{C l}^{-}共转运体的活性,导致NaCl重吸收增加,肾脏Ca++排泄加剧,以及高尿钙。
磷酸盐
Pi是许多重要细胞组分的重要组成部分,包括DNA、RNA、ATP、核苷酸、核苷、磷脂和代谢途径的中间产物。与Ca++一样,它是骨骼的主要成分。其在血浆中的浓度是骨形成和吸收的重要决定因素。此外,尿中的Pi是维持酸碱平衡的重要缓冲剂(即它是许多可滴定酸之一)(见第37章)。大约85%的Pi位于骨骼和牙齿中,14%位于细胞内液(ICF)中,1%位于细胞外液(ECF)中。正常血浆[Pi]为3至4~mg/dL(1{-}1.5mM)。血浆Pi以离子化形式存在(45%)、复合形式存在(30%)或与蛋白质结合(25%)。Pi缺乏会导致肌肉无力、横纹肌溶解和骨矿化减少,从而导致儿童佝偻病和成人骨软化症。
磷酸盐稳态概述
Pi(磷酸盐)的稳态依赖于:(1) 胃肠道(GI tract)对Pi的吸收,(2) Pi在骨骼和细胞外液(ECF)之间的分布,以及(3) 肾脏对Pi排泄的调节(见图36.16)。
全身Pi水平由胃肠道吸收的Pi量和肾脏排泄的Pi量决定。胃肠道对Pi的吸收通过主动和被动机制进行;随着膳食中Pi的增加,Pi的吸收也随之增加,并且这一过程受到骨化三醇(calcitriol)的刺激。尽管成年人每日Pi摄入量在800至1500毫克之间波动,但在稳态下,肾脏通过尿液排泄与胃肠道吸收的Pi量相等的Pi,从而维持全身Pi平衡的恒定(正常的骨骼重塑不会导致骨骼中Pi的净增加或释放)。相比之下,在生长期间,Pi会在体内积累。肾脏对Pi的排泄是身体调节Pi平衡和稳态的主要机制。
• 图36.16 Pi稳态的概述。P T H,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 第5版. 费城: Elsevier; 2013.)
血浆中的[Pi](磷酸盐浓度)由甲状旁腺激素(PTH)、骨化三醇和成纤维细胞生长因子-23(FGF-23)调控。PTH从骨骼中释放Pi(见图36.16)。肾脏对Pi的排泄由PTH增加,而骨化三醇则抑制这一过程。
维持血浆中的[Pi]对于最佳的Ca++(钙离子)- Pi复合物形成至关重要,这是骨骼矿化所必需的,同时避免了\mathrm{Ca^{++}–P_{i}}在血管和其他软组织中的沉积。血浆[Pi]的升高直接刺激PTH的合成和释放,并降低离子化的[Ca++],后者通过与钙敏感受体(CaSR)的相互作用刺激PTH的释放。PTH通过抑制近端小管对Pi的重吸收来增强尿液中Pi的排泄。高磷血症还会减少近端小管对骨化三醇的产生,从而导致胃肠道对Pi吸收的减少。PTH的增加和骨化三醇的减少都会降低血浆中的[Pi]。
磷酸盐在肾单位中的转运
图36.17总结了肾单位各段对Pi的转运。近端小管重吸收了肾小球滤过的Pi的80%;亨利氏袢、远端小管(DT)和皮质集合管(CCD)重吸收的Pi量可以忽略不计。因此,大约20%的肾小球毛细血管滤过的Pi通过尿液排出。
Pi 在近端小管的重吸收是通过跨细胞途径进行的(图 36.18)。Pi 通过近端小管顶膜上的两种 Na+/Pi 共转运体(IIa 和 IIc)被摄取。Na+/Pi IIa 转运 3 个 Na+ 和一个二价 Pi \mathrm{(HPO_{4}}^{2-}),并将正电荷带入细胞内。Na+/Pi IIc 转运 2 个 Na+ 和一个单价 Pi \left(\mathrm{H}_{2}\mathrm{PO}_{4}\right),并且是电中性的。Pi 通过基底外侧膜上的一个尚未被表征的 Pi -无机阴离子反向转运体离开细胞。
• 图 36.17 Pi 沿肾单位的转运。Pi 主要由近端小管重吸收。百分比表示每个肾单位段重吸收的滤过 Pi 的量。大约 20% 的滤过 Pi 被排泄。CCD,皮质集合管;D T_{:},远端小管;IMCD,内髓集合管;P T_{:},近端小管;T A L,粗升支。
成纤维细胞生长因子 23 (FGF-23) 增加肾脏 Pi 的排泄,从而有助于调节血浆 [Pi](见图 36.16)。FGF-23 由骨细胞和成骨细胞分泌,并抑制近端小管对 Pi 的重吸收和骨化三醇的产生。FGF-23 的分泌受到持续高磷血症、PTH 和骨化三醇的刺激。FGF23 基因的激活突变会导致低磷血症、低血浆骨化三醇和佝偻病/骨软化症,而失活突变则会导致高磷血症、高骨化三醇水平和软组织钙化。
• 图 36.18 近端小管 Pi 重吸收的细胞机制。顶膜转运途径包含两种 {\mathsf{N a}}^{+/{\mathsf{P}}_{\mathrm{i}}} 同向转运体,一种转运 3 个 Na+ 对应一个 \mathsf{P_{i}}(I I a),另一种转运 2 个 Na+ 对应一个 \mathsf{P_{i}}(I I C)。Pi 通过未知机制穿过基底外侧膜离开细胞。A T P,三磷酸腺苷。
临床相关
在终末期肾病患者中,肾脏无法排泄磷(Pi)。由于消化道(\textcircled{7} tract)持续吸收Pi,Pi在体内积累,血浆中的Pi浓度上升。过量的Pi与Ca++形成复合物,降低了血浆中的离子化[Ca++]浓度。Pi的积累还会减少骨化三醇(calcitriol)的产生。这一反应减少了消化道对Ca++的吸收,进一步降低了血浆中的[Ca++]浓度。血浆[Ca++]的降低增加了甲状旁腺激素(PTH)的分泌和骨骼中Ca++的释放。这些作用导致肾性骨营养不良(即骨吸收增加,纤维组织替代骨组织,使骨骼更容易发生骨折)。
在终末期肾病期间,慢性甲状旁腺功能亢进(即由于血浆Pi升高导致的PTH水平升高)可能导致转移性钙化,其中Ca++和Pi在动脉、软组织和内脏中沉淀。Ca++和Pi在心脏中的沉积可能导致心肌衰竭。预防和治疗甲状旁腺功能亢进及Pi潴留的措施包括低Pi饮食和在饮食中使用“磷酸盐结合剂”(即一种形成不溶性Pi盐的物质,从而使Pi无法从消化道吸收)。此外,还会开具骨化三醇补充剂以抑制PTH的释放。
尿磷排泄的调节
多种激素和因素调节尿中Pi的排泄(表36.3和图36.19)。血浆Pi浓度升高会降低[Ca++]浓度,从而增加PTH水平,进而增加肾脏对Pi的排泄。PTH通过抑制近端小管对Pi的重吸收来增加Pi的排泄。PTH通过刺激近端小管细胞刷状缘膜上的Na+/Pi共转运体的内吞移除来减少Pi的重吸收。血浆Pi浓度升高还会增加FGF-23的水平,FGF-23抑制近端小管对Pi的重吸收和骨化三醇的产生。血浆Pi浓度升高直接抑制骨化三醇的产生,从而减少肠道对Pi的重吸收。饮食中的Pi摄入也通过不依赖于PTH水平变化的机制调节Pi的排泄。Pi负荷增加会增加排泄,而Pi耗竭则会减少排泄。饮食中Pi摄入的变化通过改变近端小管顶膜上Na+/Pi IIa和IIc共转运体的转运速率和数量来调节Pi的转运。
影响近端小管\mathsf{P_{i}}重吸收的激素和因素总结 36.3
FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。
• 图36.19 对血浆[Pi]升高的反应。FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。虚线表示负反馈。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
细胞外液(ECF)体积影响Pi的排泄。ECF扩张通过以下方式增强Pi的排泄:(1)增加肾小球滤过率(GFR),从而增加Pi的滤过量;(2)减少Na+/P_{i}}耦合重吸收,从而减少ECF体积;(3)降低血浆[Ca++],从而增加PTH,PTH抑制近端小管对Pi的重吸收。酸碱平衡也影响Pi的排泄。慢性酸血症增加Pi的排泄,而慢性碱血症则减少其排泄。酸碱状态的影响,类似于PTH的作用,是通过改变顶膜上Na+/Pi共转运体的表达来介导的。代谢性酸中毒增加糖皮质激素的分泌,糖皮质激素抑制近端小管对Pi的重吸收,并增加肾脏对Pi的排泄。这种抑制作用,加上酸中毒对近端小管Pi重吸收的直接影响,使得远曲小管(DT)和集合管能够分泌更多的H+作为可滴定酸,并生成更多的HCO3-,因为Pi是重要的尿液缓冲剂。生长激素减少Pi的排泄。
临床相关
Klotho在肾脏的早期远曲小管(DT)中高度表达。Klotho基因敲除小鼠表现出类似于慢性肾脏病(CKD)的表型,包括软组织钙化、高磷血症和血浆FGF-23水平升高。Klotho以膜结合和可溶性蛋白的形式存在。膜结合形式是FGF-23的共受体,因此Klotho促进肾脏对Pi的排泄,并降低血清中骨化三醇的水平。可溶性循环Klotho影响离子转运、Wnt信号传导和FGF-23依赖的PTH合成,并抑制肾素-血管紧张素轴。Klotho可能是CKD的生物标志物,其缺乏可能促进CKD的发展。此外,实验数据还表明,Klotho治疗可能减缓CKD的进展。
甲状旁腺激素和骨化三醇对\mathbb{C}\mathsf{a}^{++}和{\sf P}_{\mathrm{i}}稳态的综合综述
如图36.20所示,PTH(甲状旁腺激素)调节Ca++和Pi的稳态。低钙血症是PTH分泌的主要刺激因素。PTH引起骨吸收,增加尿中Pi的排泄,减少尿中Ca++的排泄,并刺激骨化三醇的产生,骨化三醇则促进肠道对Ca++和Pi的吸收。由于骨、胃肠道和肾脏对Pi的处理变化趋于平衡,PTH增加了血浆[Ca++],而对血浆[Pi]的影响较小。总体而言,PTH水平因低钙血症而升高,使血浆[Ca++]恢复正常。高钙血症则产生相反的效果。
骨化三醇在Ca++和Pi的稳态中起重要作用(图36.21)。骨化三醇的净效应是增加血浆[Ca++]和[Pi]。因此,骨化三醇产生的主要刺激因素是低钙血症和低磷血症。骨化三醇的主要作用是刺激胃肠道对Ca++和Pi的吸收。在较小程度上,骨化三醇与PTH共同作用,减少肾脏对Ca++的排泄。在Ca++缺乏的饮食中,骨化三醇可能增强PTH的骨吸收效应,从而从骨中释放Ca++和Pi。
临床相关
在缺乏糖皮质激素的情况下(例如,Addison病),Pi的排泄受到抑制,肾脏排泄可滴定酸和生成新的{\mathsf{H C O}}_{3}^{-}的能力也下降。生长激素增加近端小管对Pi的重吸收。因此,儿童处于Pi的正平衡状态,血浆[Pi]高于成人,而升高的[Pi]对骨形成和生长至关重要。
• 图36.20 对血浆[Ca++]下降的反应。虚线表示负反馈。FGF-23,成纤维细胞生长因子23;PTH,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
• 图36.21 维生素D代谢及其对Ca++}和Pi稳态的影响。低钙血症(通过PTH)和低磷血症是肾脏中骨化二醇代谢为骨化三醇的主要刺激因素。骨化三醇的净效应是增加血浆Ca++和[Pi]。P T H,甲状旁腺激素。(来自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
关键概念
- K+的稳态由肾脏维持,肾脏调整K+的排泄以匹配饮食中的K+摄入,胰岛素、肾上腺素、醛固酮、AVP和糖皮质激素则调节K+在细胞内液(ICF)和细胞外液(ECF)之间的分布以及肾脏对K+的排泄。其他条件,如细胞溶解、运动、酸碱平衡和血浆渗透压的变化,也会影响K+的稳态和血浆[K+]。
- 肾脏对 K+ 的排泄取决于DT(远端小管)和CCD(皮质集合管)对 K+ 的转运速率和方向。这些肾小管段对 K+ 的分泌受血浆 [K+]、醛固酮和AVP(抗利尿激素)的调节。肾小管液流量和酸碱平衡的变化会改变肾脏对 K+ 的排泄。在 K+ 缺乏状态下,DT和CCD会抑制 K+ 的分泌并增加其重吸收。
- 肾脏与胃肠道和骨骼共同调节血浆 [Ca++] 和 [Pi]。4. 血浆 \left[\mathrm{Ca}^{++}}\right] 受PTH(甲状旁腺激素)和骨化三醇的调节。降钙素在人类中不是主要的调节激素。肾脏对 Ca++ 的排泄受PTH、血浆 [Ca++] 和骨化三醇的调节,并受酸碱状态、ECF(细胞外液)容量和血浆 Pi 变化的影响。5. Ca++ 的重吸收由PTH和骨化三醇在TAL(髓袢升支粗段)和DT中作用以及血浆 \left[\mathrm{Ca}^{++}}\right] 升高所刺激。6. 血浆 [Pi] 受PTH、FGF-23(成纤维细胞生长因子23)和骨化三醇的调节。Pi 的排泄受PTH、FGF-23、膳食 Pi 和生长激素的调节,并受酸碱失调、ECF扩张和糖皮质激素的影响。
37 肾脏在酸碱平衡调节中的作用
学习目标
完成本章学习后,学生应能够回答以下问题:
- {\mathsf{H C O}}_{3}^{-} 如何作为缓冲剂发挥作用,为什么它是细胞外液的重要缓冲剂?
- 食物代谢如何产生酸和碱,饮食成分对全身酸碱平衡有何影响?
- 挥发性酸和非挥发性酸之间的区别是什么,什么是净内源性酸产生(NEAP)?
- 肾脏和肺如何参与全身酸碱平衡的调节,什么是肾脏净酸排泄(RNAE)?
- 为什么肾脏排泄酸需要尿液缓冲剂?
- 肾单位各段中 H+ 转运的机制是什么,这些机制如何被调节?
- 肾单位各段如何参与过滤的 {\mathsf{H C O}}_{3}{\mathsf{!}} 的重吸收过程?
- 肾脏如何产生新的 {\mathsf{H C O}}_{3}{\boldsymbol{?}}
- 肾脏如何产生铵,其排泄如何促进肾脏的酸排泄?
- 身体防御酸碱平衡变化的主要机制是什么?
- 单纯代谢性和呼吸性酸碱紊乱之间的区别是什么,如何通过动脉血气测量来区分它们?
体液中 H+ 的浓度与其他离子相比较低。例如,Na+ 的浓度约为 H+ 的300万倍(\mathrm{[Na^{+}]=140m E q/L};\mathrm{[H+]=40n E q/L})。由于体液中 [H+] 较低,通常用负对数或 pH 表示。
几乎所有细胞、组织和器官的生理过程都对pH敏感。事实上,生命无法在细胞外液(extracellular fluid, ECF)pH范围6.8至7.8(H+浓度为160{-}16~\mathrm{nEq/L})之外存在。正常情况下,ECF的pH维持在7.35至7.45之间。细胞内液(intracellular fluid, ICF)的pH$略低(7.1–7.2),但也受到严格调控。
每天,酸和碱通过饮食摄入。此外,细胞代谢产生许多对体液pH有影响的物质。如果没有适当的机制来处理这些日常的酸碱负荷并维持酸碱平衡,许多生命必需的过程将无法进行。本章将回顾全身酸碱平衡的维持。虽然重点在于肾脏在这一过程中的作用,但也考虑了肺和肝脏的作用。此外,还介绍了饮食和细胞代谢对酸碱平衡的影响。最后,讨论了酸碱平衡紊乱,主要是为了说明相关的生理过程。在本章中,酸被定义为任何向体液中添加H+的物质,而碱被定义为从体液中去除H+的物质。
{\mathsf{H C O}}_{3}^{-}缓冲系统
碳酸氢根(bicarbonate, \mathrm{HCO}_{3}^{-})是ECF的重要缓冲物质。在正常血浆中,[\mathrm{HCO}_{3}^{-}]为23至25mEq/L,体积为14\mathrm{~L~}(以70公斤个体为例),ECF可以缓冲350~\mathrm{mEq}的H+。HCO3-缓冲系统与身体的其他缓冲系统(如磷酸盐)不同,因为它受到肺和肾脏的共同调节。通过以下反应可以更好地理解这一点:
方程 37.1
$$
\mathrm{CO}_{2}+\mathrm{H}_{2}\mathrm{O}\leftrightarrow\mathrm{H}_{2}\mathrm{CO}_{3}\leftrightarrow\mathrm{H}^{+}+\mathrm{HCO}_{3}^{-}
$$
如所示,第一个反应(\mathrm{CO}_{2}的水合/脱水)是限速步骤。这个通常较慢的反应在碳酸酐酶存在下大大加速。第二个反应,{\mathrm{H}}_{2}{\mathrm{CO}}_{3}电离为H+和HCO3-,几乎是瞬间完成的。
• 图 37.1 酸碱平衡概述。肺和肾脏共同作用以维持酸碱平衡。肺排出\mathrm{CO}_{2}(挥发性酸),肾脏排出酸(肾脏净酸排泄 [renal net acid excretion, RNAE]),其量等于净内源性酸产生(net endogenous acid production, NEAP),反映了饮食摄入、细胞代谢以及体内酸碱的损失(如粪便中的{\mathsf{H C O}}_{3}^{-}损失)。详见正文。(摘自Koeppen BM, Stanton BA. Renal Physiology. 5th ed. Philadelphia: Elsevier; 2013.)
Henderson-Hasselbalch方程用于量化\mathrm{CO}_{2}和HCO3-的变化如何影响pH:
方程 37.2
$$
pH=\mathrm{pKH}+\log{\frac{\left[\mathrm{HCO}_{3}^{-}\right]}{\mathrm{oPCO}_{2}}}
$$
或
方程 37.3
$$
pH=6.1+\log\frac{\left[\mathrm{HCO}_{3}^{-}\right]}{0.03\mathrm{PCO}_{2}}
$$
在这些方程中,\mathrm{CO}_{2}的量由\mathrm{CO}_{2}的分压({\mathrm{Pco}}_{2})及其在溶液中的溶解度(α)决定。对于37°C的血浆,α的值为0.03。此外,\mathrm{pK^{\prime}}是方程37.1中反应的总解离常数的负对数,对于37°C的血浆,其值为6.1。或者,HCO3-和\mathrm{CO}_{2}对[H+]的关系可以如下确定:
方程 37.4
$$
[H+]=\frac{24\times\mathrm{PCO}_{2}}{\left[\mathrm{HCO}_{3}^{-}\right]}
$$
通过检查方程37.3和37.4可以看出,当[\mathrm{HCO}_{3}^{-}]或\mathrm{Pco}_{2}发生变化时,pH和[H+]也会发生变化。由于[\mathrm{HCO}_{3}^{-}]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于\mathrm{Pco}_{2}变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。这些紊乱将在后续章节中详细讨论。肾脏主要负责调节ECF中的[\mathrm{HCO}_{3}^{-}],而肺则控制\mathrm{Pco}_{2}。
酸碱平衡概述
人类的饮食中含有许多酸性或碱性的成分。此外,细胞代谢也会产生酸和碱。最后,每天通常会有碱通过粪便排出。正如后面所述,尽管这些过程依赖于饮食,但其净效应是向体液中添加酸。为了维持酸碱平衡,酸的排泄速率必须与其添加速率相等。如果酸的添加超过排泄,就会导致酸中毒。相反,如果酸的排泄超过添加,就会导致碱中毒。
如图37.1所示,饮食中的主要成分是碳水化合物和脂肪。当组织灌注充足、\mathrm{O}_{2}可供组织使用且胰岛素水平正常时,碳水化合物和脂肪会代谢为\mathrm{CO}_{2}和_{\mathrm{H}_{2}\mathrm{O}}。每天通过这一过程会产生15到20摩尔的\mathrm{CO}_{2}。通常,这一大量的\mathrm{CO}_{2}会通过肺有效地从体内排出。因此,这种代谢产生的\mathrm{CO}_{2}对酸碱平衡没有影响。\mathrm{CO}_{2}通常被称为挥发性酸,因为它有潜力在与_{\mathrm{H}_{2}\mathrm{O}}水合后生成H+(见方程37.1)。不直接来自\mathrm{CO}_{2}水合的酸称为非挥发性酸(例如乳酸)。
其他膳食成分的细胞代谢也会对酸碱平衡产生影响。例如,含硫氨基酸(sulfur-containing amino acids)如半胱氨酸(cysteine)和甲硫氨酸(methionine)在代谢时会产生硫酸,而赖氨酸(lysine)、精氨酸(arginine)和组氨酸(histidine)的代谢则会产生盐酸。这部分非挥发性酸(nonvolatile acid)负荷的一部分通过天冬氨酸(aspartate)和谷氨酸(glutamate)的代谢产生的HCO3-来抵消。平均而言,膳食氨基酸的代谢会产生净的非挥发性酸。某些有机阴离子(organic anions)(如柠檬酸(citrate))的代谢会产生HCO3-,这在一定程度上抵消了非挥发性酸的产生。总体而言,在摄入含肉饮食的个体中,酸的生成超过了HCO3-的生成。相比之下,素食饮食产生的非挥发性酸较少。除了代谢产生的酸和碱外,摄入的食物中也含有酸和碱。例如,摄入食物中的磷酸盐(\mathrm{H}_{2}\mathrm{PO}_{4}^{-})会增加膳食酸负荷。最后,在消化过程中,部分HCO3-通常会随粪便排出。这种损失相当于向体内添加了非挥发性酸。在摄入含肉饮食的个体中,膳食摄入、细胞代谢和粪便中HCO3-的损失导致每天向体内添加约0.7至1.0\mathrm{mEq/kg}体重的非挥发性酸(大多数成年人每天50{-}100\mathrm{mEq})。这种酸被称为净内源性酸生成(net endogenous acid production, NEAP),会导致体内HCO3-的等量损失,必须进行补充。
临床相关
当胰岛素水平正常时,碳水化合物和脂肪会完全代谢为\mathrm{CO}_{2}+\ H_{2}\mathrm{O}。然而,如果胰岛素水平异常低(如糖尿病(diabetes mellitus)),细胞代谢会导致几种有机酮酸(organic ketoacids)的产生(例如,脂肪酸代谢产生的β -羟基丁酸(β -hydroxybutyric acid)和乙酰乙酸(acetoacetic acid))。
在缺乏足够的\mathrm{O}_{2}(缺氧(hypoxia))的情况下,细胞的厌氧代谢(anaerobic metabolism)也会导致有机酸(如乳酸(lactic acid))的产生,而不是\mathrm{CO}_{2}+\ H_{2}\mathrm{O}。这种情况在正常个体进行剧烈运动时经常发生。组织灌注不良(如心输出量减少时)也会导致细胞的厌氧代谢,从而导致酸中毒(acidosis)。在这些情况下,有机酸会积累,体液的pH值下降(酸中毒)。治疗(例如,在糖尿病的情况下给予胰岛素)或改善组织灌注(例如,在组织灌注不良的情况下)会导致这些有机酸代谢为\mathrm{CO}_{2}+\ H_{2}\mathrm{O},这会消耗\Join^{+},从而有助于纠正酸碱紊乱。
非挥发性酸不会在全身循环,而是立即被ECF中的HCO3-中和。
公式 37.5
$$
H2SO4+2\mathrm{NaHCO}_{3}\leftrightarrow\mathrm{Na}_{2}\mathrm{SO}_{4}+2\mathrm{CO}_{2}+2\mathrm{H}_{2}\mathrm{O}
$$
公式 37.6
$$
\mathrm{HCl}+\mathrm{NaHCO}_{3}\leftrightarrowNaCl+\mathrm{CO}_{2}+\mathrm{H}_{2}\mathrm{O}
$$
这一中和过程产生了强酸的Na+盐,并从细胞外液(ECF)中移除了HCO3-。因此,HCO3-最大限度地减少了这些强酸对ECF的pH的影响。如前所述,ECF中大约含有350~\mathrm{{mEq}}的HCO3-。如果这些HCO3-没有得到补充,每天产生的非挥发性酸(\approx70\mathrm{mEq/}天)将在5天内耗尽ECF中的HCO3-。为了维持酸碱平衡,肾脏必须补充因中和非挥发性酸而损失的HCO3-,这一过程称为肾脏净酸排泄(RNAE)。
肾脏的净酸排泄
在稳态条件下,NEAP必须等于RNAE以维持酸碱平衡。尽管NEAP在个体之间以及同一个体在不同天之间有所变化,但它并不受调节。相反,肾脏通过调节RNAE来匹配NEAP,并在此过程中补充因中和非挥发性酸而损失的HCO3-(新的\mathbf{HCO}_{3}^{-\dagger})。此外,肾脏还必须防止HCO3-在尿液中的丢失。后一项任务在数量上更为重要,因为HCO3-的滤过负荷约为4320\mathrm{mEq/day}(24mEq/L\times180~\mathrm{L/day}=4320~\mathrm{mEq/day}),而平衡NEAP仅需要50到100~\mathrm{{mEq}/\Omega}天。
滤过的HCO3-的重吸收和酸的排泄都是通过肾单位的H+分泌来完成的。因此,在一天内,肾单位必须向肾小管液中分泌大约4390\mathrm{mEq}的H+。大部分分泌的H+用于重吸收滤过的HCO3-负荷。只有50到100~\mathrm{{mEq}}的H+,相当于NEAP的量,被排泄到尿液中。由于这种酸的排泄,尿液通常是酸性的。
肾脏不能排泄比\mathrm{pH4.0}到4.5更酸的尿液。即使在pH为4.0时,也只能排泄0.1mEq/L的H+。因此,为了排泄足够的酸,肾脏通过尿液缓冲剂如磷酸盐(Pi)来排泄H+。尿液中的其他成分也可以作为缓冲剂(例如肌酐),尽管它们的作用不如Pi重要。这些尿液缓冲剂统称为可滴定酸。这一术语来源于实验室中定量这些缓冲剂的方法。通常,向尿液样本中加入碱(OH−)以将其pH滴定至血浆的pH(即7.4)。加入的碱量等于这些尿液缓冲剂所滴定的H+量,称为可滴定酸。
H+作为可滴定酸(titratable acid)的排泄不足以平衡NEAP(非挥发性酸净产量)。肾脏通过合成和排泄铵离子\left(\mathbf{NH}_{4}^{\mathrm{~+~}}\right)来维持酸碱平衡,这是另一个重要的机制。本章后面将更详细地讨论这一过程所涉及的机制。关于肾脏对酸碱平衡的调节,尿液中每排泄一个\mathrm{NH_{4}}^{+},就会有一个HCO3-返回到体循环中,从而补充在非挥发性酸中和过程中丢失的HCO3-。因此,\mathrm{NH_{4}}^{+}的产生和排泄,就像可滴定酸的排泄一样,相当于肾脏排泄酸。
简而言之,肾脏通过重吸收过滤的HCO3-并排泄与NEAP等量的酸来维持酸碱稳态。这一过程可以量化如下:
公式 37.7
$$
\mathrm{RNAE}=\Bigg(\mathrm{U}_{\mathrm{NH_{4}^{+}}}\times\dot{\mathrm{V}}\Bigg)+\Bigg(\mathrm{U}_{\mathrm{TA}}\times\dot{\mathrm{V}}\Bigg)-\Bigg(\mathrm{U}_{\mathrm{HCO_{3}^{-}}}\times\dot{\mathrm{V}}\Bigg)
$$
其中\left(\mathrm{U}_{\mathrm{NH+}}+\dot{\mathrm{V}}\right)和(\mathrm{U_{TA}}+\dot{\mathrm{V}})分别是\mathrm{NH_{4}}^{+}和可滴定酸(TA)的排泄速率(\mathrm{mEq}/\mathrm{day}),而(\mathrm{U}_{.\mathrm{HCO}_{3}^{-}}+\mathrm{V})是尿液中丢失的HCO3-量(相当于向体内添加H+)。再次强调,维持酸碱平衡意味着净酸排泄必须等于非挥发性酸的产生。在大多数情况下,尿液中排泄的HCO3-非常少。因此,净酸排泄基本上反映了可滴定酸和\mathrm{NH_{4}}^{+}的排泄。从数量上看,可滴定酸约占RNAE的三分之一,而\mathrm{NH_{4}}^{+}占三分之二。
沿肾单位的{\mathsf{H C O}}_{3}^{-}重吸收
如公式37.7所示,当尿液中排泄的HCO3-很少或没有时,净酸排泄达到最大值。事实上,在大多数情况下,尿液中出现的HCO3-非常少。由于HCO3-在肾小球自由过滤,每天大约有4320\mathrm{mEq}被输送到肾单位并被重吸收。图37.2总结了每个肾单位段对过滤的HCO3-重吸收的贡献。
• 图37.2 {\mathsf{H C O}}_{3}^{-}的节段重吸收。图中显示了肾单位各段对过滤的{\mathsf{H C O}}_{3}^{-}重吸收的比例。通常情况下,过滤的{\mathsf{H C O}}_{3}^{-}全部被重吸收,尿液中几乎没有或没有{\mathsf{H C O}}_{3}^{-}出现。CCD,皮质集合管;D T,远端小管;IMCD,内髓集合管;P T,近端小管;T A L,厚升支。
近端小管重吸收了滤过的HCO3-的最大部分。图37.3总结了涉及的主要转运过程。H+通过Na+/H+}反向转运体和H+ -ATPase(V型)分泌到细胞的顶膜。Na+/H+}反向转运体(NHE3)是H+分泌的主要途径(约占HCO3-重吸收的三分之二),并利用管腔到细胞的[Na+]梯度来驱动这一过程(即H+的次级主动分泌)。在细胞内,H+和HCO3-在碳酸酐酶(CA-II)催化的反应中产生。H+被分泌到管腔液中,而HCO3-通过基底外侧膜离开细胞并返回到管周血液中。HCO3-通过基底外侧膜离开细胞的过程与其他离子耦合。大多数HCO3-通过一个将Na+与HCO3-外流耦合的同向转运体(碳酸氢钠同向转运体,NBC1)离开细胞。一些HCO3-通过其他转运体离开细胞,但它们不如Na+/H C O_{3}^{-}}同向转运体重要。如图37.3所示,碳酸酐酶(CA-IV)也存在于细胞的刷状缘和基底外侧膜中。刷状缘酶催化管腔液中的\mathrm{H}_{2}\mathrm{CO}_{3}脱水,而位于基底外侧膜的酶则促进HCO3-离开细胞。\mathrm{CO}_{2}进出细胞的运动通过AQP1进行,AQP1位于管腔和基底外侧膜。
• 图37.3 近端小管细胞重吸收滤过的{\mathsf{H C O}}_{3}^{-}的细胞机制。仅显示了主要的H+和{\mathsf{H C O}}_{3}^{-}转运体。ATP,三磷酸腺苷;CA,碳酸酐酶。
Henle袢厚升支(TAL)重吸收HCO3-的细胞机制与近端小管非常相似。H+通过Na+/H+}反向转运体和H+ -ATPase分泌。与近端小管一样,Na+/H+}反向转运体(NHE3)是H+分泌的主要途径。HCO3-离开细胞涉及Na+/ HCO3-同向转运体(NBC1)和\mathrm{Cl^{-}/H C O_{3}^{-}}反向转运体(阴离子交换体,AE-2)。一些\mathrm{HCO}_{3}^{-}也可能通过基底外侧膜中的Cl-通道离开细胞。
远端小管和集合管重吸收了近端小管和Henle袢未能重吸收的少量HCO3-。图37.4显示了位于这些节段中的间质细胞的\mathrm{H+/H C O_{3}^{-}}转运的细胞机制(另见第34章)。
一种类型的闰细胞分泌H+(重吸收{\mathrm{HCO}}_{3}{\mathrm{^{-})}},被称为A-或α-闰细胞。在这种细胞内,H+和HCO3-通过\mathrm{CO}_{2}的水合作用产生;该反应由碳酸酐酶(CA-II)催化。H+通过两种机制分泌到管腔液中。第一种机制涉及顶膜上的H+-ATPase(V型)。第二种机制通过H+-K+-ATPase将H+的分泌与K+的重吸收耦合,这种ATPase类似于在胃和结肠中发现的\mathrm{HK}α1和\mathrm{HK}\alpha2。HCO3-通过基底膜上的\mathrm{Cl^{-}/H C O}_{3}^{-}反向转运体(AE-1)与Cl-交换,离开细胞并进入管周毛细血管血液。
第二种类型的闰细胞将HCO3-而不是H+分泌到管腔液中(也称为B\cdot或β-闰细胞)。在这些细胞中,H+-ATPase(V型)位于基底膜上,而\mathrm{Cl^{-}/H C O_{3}^{-}}反向转运体位于顶膜上(见图37.4)。
然而,顶膜上的\mathrm{Cl^{-}/H C O}_{3}^{-}反向转运体与H+分泌闰细胞基底膜上的不同,已被鉴定为pendrin。在代谢性碱中毒期间,当肾脏必须排泄过量的HCO3-时,HCO3-分泌闰细胞的活性增加。然而,在大多数情况下(例如,摄入含肉饮食),H+的分泌在这些节段中占主导地位。
集合管细胞的顶膜对H+的渗透性不高,因此管腔液的pH值可以变得相当酸性。实际上,沿着肾单位的最酸性管腔液\mathrm{(pH=4.0-4.5)}是在这里产生的。相比之下,近端小管对H+和HCO3-的渗透性要高得多,该节段中的管腔液pH仅降至6.5。正如后面所解释的,集合管降低管腔液pH的能力对于排泄尿液可滴定酸和\mathrm{NH_{4}}^{+}至关重要。
H+分泌的调节
许多因素影响H+的分泌,从而影响肾单位细胞对过滤的HCO3-的重吸收。从生理学角度来看,调节肾单位H+分泌的主要因素是全身酸碱平衡的变化。因此,酸中毒刺激RNAE,而碱中毒期间RNAE减少。
在细胞水平
肾脏细胞表达监测酸碱状态的受体,因此在调节肾小管中的H⁺和{\mathsf{H C O}}_{3}{\mathrm{^{-}}}转运体中起关键作用(图37.5)。例如,一种G蛋白偶联的\Join^{+}受体(GPCR–GPR4)已被定位到集合管。细胞外液(ECF)中[H+]的增加激活该受体,刺激\Join^{+}的分泌。同样在集合管中,分泌{\mathsf{H C O}}_{3}^{-}的闰细胞(B-或β -ICs)表达一种基底外侧的胰岛素相关受体(IRR),它是一种酪氨酸激酶。该受体被ECF中[\mathrm{HCO}_{3}^{-}]的增加激活,并刺激细胞分泌{\mathsf{H C O}}_{3}^{-}。一种由细胞内{\mathsf{H C O}}_{3}^{-}调节的可溶性腺苷酸环化酶(sAC)似乎也在调节集合管的H+分泌中起作用。在近端小管中,基底外侧膜的受体酪氨酸激酶(ErbB1和ErbB2)感知ECF中\mathsf{P C O}_{2}的变化。\mathsf{P C O}_{2}的增加激活这些受体,导致血管紧张素II的生成,后者通过AT-1A受体从管腔侧作用,刺激H+分泌/{\mathsf{H C O}}_{3}^{-}重吸收。同样在近端小管中,非受体酪氨酸激酶(Pyk2)感知细胞内[H+]的变化。当细胞内[H+]的增加激活该激酶时,\Join^{+}分泌/H \mathrm{dCO}_{3}^{-}重吸收被刺激。最后,几种离子通道(例如,肾外髓质K+通道[ROMK])的门控受到ECF或细胞内液(ICF)pH变化的影响。这些通道也有可能作为细胞酸碱传感器。
• 图37.4 远端小管和集合管闰细胞重吸收和分泌{\mathsf{H C O}}_{3}{\mathrm{^{-}}}的细胞机制。仅显示了主要的H+和{\mathsf{H C O}}_{3}^{-}转运体。A T P, 三磷酸腺苷;C A_{i},碳酸酐酶;H K A,\Join^{+} \mathsf{f}^{+}{-}K+ -ATP酶。
肾脏对酸碱平衡变化的反应包括膜上转运体活性和/或数量的即时变化,以及转运体合成的长期变化。例如,在代谢性酸中毒时,H+分泌通过多种机制被刺激,具体取决于肾小管的不同节段。首先,酸中毒时细胞内pH的降低将产生更有利的细胞到管腔液的H+梯度,从而使H+跨顶膜的分泌在能量上更为有利。其次,pH的降低可能导致转运蛋白的变构变化,从而改变其动力学。最后,转运体可能从细胞内囊泡转运到膜上。在长期酸中毒的情况下,转运体的丰度增加,这可能是通过适当转运体基因的转录增加或转运体mRNA的翻译增加实现的。
• 图37.5 细胞\Join^{+}和{\mathsf{H C O}}_{3}^{-}传感器的示例。ATP,三磷酸腺苷;C A M P,环磷酸腺苷;G P C R,\textcircled{7}蛋白偶联受体;IRR,胰岛素受体相关受体;Pyk2,非受体酪氨酸激酶;sAC,可溶性腺苷酸环化酶。(改编自:Levin LR, Buck J. Annu Rev Physiol; 2015;77:347。)
在细胞水平
在近端小管中,代谢性酸中毒增加了\mathsf{N a^{+}/H+}反向转运体(NHE3)的转运动力学,并增加了\mathsf{N a^{+}/H+}反向转运体、\Join^{+}-ATP酶以及基底外侧Na+/3\mathsf{H C O_{3}}^{-}同向转运体(NBCe1)在顶膜的表达。在集合管中,酸中毒导致\Join^{+}-ATP酶通过胞吐作用插入到间质细胞的顶膜中。长期酸中毒会增加近端小管(NHE3和NBCe1)和集合管间质细胞中关键酸碱转运体的丰度(\mathbb{H}^{+}-ATP酶和AE1)。最后,酸中毒会减少在{\mathsf{H C O}}_{3}^{-}分泌型间质细胞中\mathrm{Cl^{-}/H C O_{3}}^{-}反向转运体pendrin的表达。
尽管上述一些效应可能直接归因于酸中毒,但许多细胞H+转运的变化是由激素或其他因素介导的。已知的三种介导肾脏对酸中毒反应的介质是内皮素、皮质醇和血管紧张素II。内皮素(ET-1)由内皮细胞和近端小管细胞产生。在酸中毒时,ET-1的分泌增强。在近端小管中,ET-1刺激Na+/H+}反向转运体的磷酸化并随后插入到顶膜中,以及Na+/3\mathrm{HCO_{3}}^{-}同向转运体插入到基底外侧膜中。ET-1也可能在其他肾单位节段中介导对酸中毒的反应。酸中毒还刺激肾上腺皮质分泌糖皮质激素皮质醇。皮质醇增加了近端小管中Na+/\mathrm{H{+}}$反向转运体和$\mathrm{Na{+}}/3\mathrm{HCO}{3}{-}$同向转运体的丰度。血管紧张素II在近端小管细胞中响应酸中毒而产生。它被分泌到管腔液中,在那里与血管紧张素I受体结合,从而刺激近端小管的$\mathrm{H{+}}分泌/$\mathrm{HCO{3}}{-}$重吸收。皮质醇和血管紧张素II还刺激近端小管产生和分泌$\mathrm{NH_{4}}{+}$,这将在后面描述,是肾脏对酸中毒反应的重要组成部分。
酸中毒还刺激甲状旁腺激素(PTH)的分泌。PTH抑制近端小管对磷酸盐(Pi)的重吸收(见第36章)。通过这种方式,更多的Pi被输送到远端肾单位,在那里它作为尿液缓冲剂,从而增加了肾脏排泄可滴定酸的能力。
肾脏对碱中毒的反应尚未得到充分表征。RNAE减少是由于尿中HCO3-排泄增加以及可滴定酸和\mathrm{NH_{4}}^{+}排泄减少。调节这种反应的因素尚未得到充分表征。
其他不一定与维持酸碱平衡相关的因素也可能影响肾单位(nephron)细胞分泌H+。由于肾单位中一个重要的H+转运体是Na+/H+}反向转运体(antiporter),因此改变Na+重吸收的因素会间接影响H+的分泌。例如,在容量收缩(负Na+平衡)时,肾单位对Na+的重吸收增加(见第35章),包括通过Na+/H+}反向转运体重吸收Na+。结果,H+的分泌增强。这是通过几种机制实现的。一种机制涉及由容量收缩激活的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system)。如前所述,血管紧张素II(angiotensin II)作用于近端小管,刺激顶端膜(apical membrane)的Na+/H+}反向转运体以及基底外侧膜(basolateral membrane)的Na+/3\mathrm{HCO}_{3}^{-}同向转运体(symporter)。在较小程度上,血管紧张素II刺激亨利袢(Henle’s loop)的粗升支(thick ascending limb, TAL)和远端小管(distal tubule)早期部分的H+分泌,这一过程也由Na+/H+}反向转运体介导。醛固酮(aldosterone)对远端小管和集合管(collecting duct)的主要作用是刺激主细胞(principal cells)重吸收Na+(见第34章)。然而,它也刺激这些节段中的闰细胞(intercalated cells)分泌H+。这种效应既有间接的,也有直接的。通过刺激主细胞重吸收Na+,醛固酮使跨上皮电压(transepithelial voltage)超极化(hyperpolarize)(即管腔(lumen)变得更负)。这种跨上皮电压的变化随后促进了闰细胞分泌H+。除了这种间接效应外,醛固酮(和血管紧张素II)还直接作用于闰细胞,通过H+ -ATPase和H+-K+ -ATPase刺激H+分泌。
细胞外液(extracellular fluid, ECF)容量(ECFV)收缩增强H+分泌(\mathrm{HCO}_{3}^{-}重吸收)的另一种机制是通过改变管周毛细血管(peritubular capillary)的Starling力(Starling forces)。如第34章和第35章所述,ECFV收缩改变了管周毛细血管的Starling力,从而增强了近端小管的整体重吸收。随着这种增强的重吸收,更多的滤过负荷(filtered load)的HCO3-被重吸收。
钾平衡(potassium balance)影响近端小管分泌H+。低钾血症(hypokalemia)刺激H+分泌,而高钾血症(hyperkalemia)抑制H+分泌。据认为,K+诱导的细胞内pH变化至少部分导致了这种效应。低钾血症使细胞酸化,因为细胞内K+与H+交换,而高钾血症使细胞碱化,因为细胞内H+与K+交换。低钾血症还刺激集合管分泌H+。这是由于闰细胞中H+-K+ -ATPase的表达增加所致。
新{\mathsf{H C O}}_{3}^{-}的形成
如前所述,重吸收滤过的HCO3-(碳酸氢根)对于最大化RNAE(净酸排泄)至关重要。然而,仅靠HCO3-的重吸收并不能补充代谢过程中产生的非挥发性酸中和过程中丢失的HCO3-。为了维持酸碱平衡,肾脏必须用新的HCO3-来替代这些丢失的HCO3-。新的HCO3-的生成通过可滴定酸的排泄以及\mathrm{NH_{4}}^{+}(铵离子)的合成和排泄来实现。
图37.6展示了由于可滴定酸排泄而产生新的HCO3-的过程。由于近端小管和Henle袢对HCO3-的重吸收,到达远端小管和集合管的液体通常含有很少的HCO3-。因此,当H+(氢离子)被分泌时,它将与非{\cdot}\mathrm{HCO}_{3}{}^{-}缓冲剂(主要是\mathrm{P_{i,\ell}^{\cdot}}(磷酸盐))结合,并以可滴定酸的形式排泄。由于H+是由\mathrm{CO}_{2}(二氧化碳)水合作用在细胞内产生的,因此也会产生一个HCO3-。
• 图37.6 H+与非{\cdot}\mathrm{HCO}_{3}{}^{-}尿缓冲剂(可滴定酸)排泄的一般机制。主要的尿缓冲剂是磷酸盐(\mathsf{H P O}_{4}^{2-})。图中展示了一个\Join^{+}(氢离子)分泌的间质细胞。为简化起见,仅展示了\Join^{+} -ATPase(氢离子-钾离子ATP酶)。\Hat{H}^{+}通过H+,K+ -ATPase的分泌也会滴定管腔缓冲剂。ATP,三磷酸腺苷;CA,碳酸酐酶。
• 图37.7 肾单位对NH4+的产生、转运和排泄。谷氨酰胺在近端小管中代谢为NH4+和{\mathsf{H C O}}_{3}{\mathrm{^{-}}}。NH4+被分泌到管腔中,而{\mathsf{H C O}}_{3}{\mathrm{^{-}}}进入血液。分泌的NH4+在Henle袢(主要是粗升支)中被重吸收,并在髓质间质中积累。\mathsf{N H}_{3}(氨)通过rhesus糖蛋白由集合管分泌,\Join^{+}的分泌将NH4+捕获在管腔中。每排泄一个NH4+分子,就会有一个“新的”\mathsf{H C O}_{3}^{-}分子被添加到ECF(细胞外液)中。C A,碳酸酐酶。
这个HCO3-作为新的HCO3-返回到ECF。如前所述,Pi(磷酸盐)的排泄在酸中毒时增加。然而,即使有更多的Pi可用于形成可滴定酸,这种反应仍不足以生成所需量的新的HCO3-。剩余的新的HCO3-生成是通过\mathrm{NH_{4}}^{+}的生成和排泄来实现的。
\mathrm{NH_{4}}^{+}由肾脏产生,其合成和随后的排泄为ECF添加了HCO3-。重要的是,这一过程会根据身体的酸碱需求进行调节。
\mathrm{NH_{4}}^{+} 通过谷氨酰胺的代谢在肾脏中产生。肾脏主要代谢谷氨酰胺,排出 \mathrm{NH_{4}}^{+},并向体内添加 HCO3-。然而,通过这一过程形成新的 HCO3- 取决于肾脏将 \mathrm{NH_{4}}^{+} 排泄到尿液中的能力。如果 \mathrm{NH_{4}}^{+} 未被排泄到尿液中,而是进入体循环,它会被肝脏转化为尿素。这一转化过程会产生 H+,随后被 HCO3- 缓冲。因此,由肾脏生成的 \mathrm{NH_{4}}^{+} 转化为尿素会消耗 HCO3-,并抵消了通过肾脏合成和排泄 \mathrm{NH_{4}}^{+} 形成 HCO3- 的过程。然而,正常情况下,肾脏会将 \mathrm{NH_{4}}^{+} 排泄到尿液中,从而产生新的 HCO3-。
肾脏排泄 \mathrm{NH_{4}}^{+} 的过程是复杂的。图 37.7 展示了这一过程的关键特征。\mathrm{NH_{4}}^{+} 在近端小管细胞中由谷氨酰胺产生,这一过程称为氨生成(ammoniagenesis)。每个谷氨酰胺分子产生两个 \mathrm{NH_{4}}^{+} 分子和二价阴离子 2-氧代戊二酸(2-oxoglutarate2−)。该阴离子的代谢最终提供两个 HCO3- 分子。HCO3- 通过基底外侧膜离开细胞,并作为新的 HCO3- 进入管周血液。\mathrm{NH_{4}}^{+} 通过顶膜离开细胞,进入小管液。\mathrm{NH_{4}}^{+} 分泌到小管液中的主要机制涉及 Na+/H+} 反向转运体,\mathrm{NH_{4}}^{+} 替代 H+。此外,一些 \mathrm{NH}_{3} 可以扩散出细胞进入小管液,在那里被质子化为 \mathrm{NH_{4}}^{+}。
近端小管分泌的大部分 \mathrm{NH_{4}}^{+} 被 Henle 袢重吸收。TAL(厚升支)是 \mathrm{NH_{4}}^{+} 重吸收的主要部位,\mathrm{NH_{4}}^{+} 替代 K+ 结合到 1Na+/1K+/2Cl- 同向转运体上。此外,该节段的管腔正跨上皮电压驱动 \mathrm{NH_{4}}^{+} 的旁细胞重吸收。
被 Henle 袢 TAL 重吸收的 \mathrm{NH_{4}}^{+} 在髓质间质中积累。随后,它被集合管分泌到小管液中。
集合管细胞表达两种 \mathrm{NH}_{3} 膜转运蛋白,称为 Rhesus (Rh) 糖蛋白(RhBG 和 RhCG)。RhBG 存在于 \mathrm{H+} 分泌的间细胞和主细胞的基底外侧膜中,而 RhCG 存在于这些细胞的顶膜和基底外侧膜中。如图 37.7 所示,\mathrm{NH}_{3} 通过集合管转运,这一过程传统上称为非离子扩散。分泌的 \mathrm{NH}_{3} 由于间细胞分泌的 H+ 而在小管腔中被质子化。由于顶膜对 \mathrm{NH_{4}}^{+} 的通透性较低,它被有效地困在小管腔中,这一过程传统上称为扩散捕获。
集合管(collecting duct)分泌的H+对于\mathrm{NH_{4}}^{+}的排泄至关重要。如果集合管的H+分泌受到抑制,Henle袢(TAL)重吸收的\mathrm{NH_{4}}^{+}将无法通过尿液排出。相反,\mathrm{NH_{4}}^{+}会返回到体循环中,如前所述,它会被肝脏转化为尿素,并在此过程中消耗HCO3-。因此,近端小管(proximal tubule)细胞在谷氨酰胺代谢过程中会产生新的HCO3-。然而,只有当\mathrm{NH_{4}}^{+}被排出时(即防止肝脏将\mathrm{NH_{4}}^{+}转化为尿素),整个过程才算完成。最终,每排出尿液中的一个\mathrm{NH_{4}}^{+},就会有一个新的HCO3-返回到体循环中。因此,尿液中的\mathrm{NH_{4}}^{+}排泄量可以作为近端小管谷氨酰胺代谢的标志物。
临床意义
评估肾脏的\mathrm{NH}_{4}^{+}排泄通常是通过间接方法进行的,因为尿液中NH4+的测定并不常规进行。例如,考虑代谢性酸中毒(metabolic acidosis)的情况,此时肾脏的适当反应是增加净酸排泄。因此,尿液中几乎不会出现{\mathsf{H C O}}_{3}^{-},尿液呈酸性,且NH4+排泄量会增加。为了评估这一点,特别是NH4+的排泄量,可以通过测量尿液中的Na+、K+和Cl-浓度来计算“尿净电荷”或“尿阴离子间隙”:
$$
\mathsf{U r i n e a n i o n g a p}=\left(\left[Na+\right]+\left[\mathsfK+}\right]\right)-\left[\mathsf{Cl-\right]
$$
在代谢性酸中毒期间,尿阴离子间隙的概念假设尿液中的主要阳离子是Na+、K+和\mathrm{NH}_{4}^{+},而主要阴离子是Cl-(尿液\mathsf{p H}<6.5时,几乎不存在{\mathsf{H C O}}_{3}^{-})。电中性原则指出,尿液中的阳离子和阴离子的总和应相等。因此,当未测定的阳离子NH4+被排泄时,尿阴离子间隙将产生负值。需要注意的是,实际上并不存在阴离子间隙——阳离子和阴离子的数量是相等的。计算出的阴离子间隙仅反映了所测定的参数,而\mathrm{NH}_{4}^{+}通常不被测定。事实上,尿阴离子间隙的缺失或正值的存在表明肾脏在NH4+的产生和排泄方面存在缺陷。
肾脏\mathrm{NH_{4}}^{+}系统的一个重要特征是它受到全身酸碱平衡的调节。如前所述,酸中毒时皮质醇水平升高,近端小管腔内的血管紧张素II分泌也增加。皮质醇和血管紧张素II都刺激氨生成(即从谷氨酰胺生成\mathrm{NH_{4}}^{+})。在全身酸中毒期间,近端小管细胞中负责谷氨酰胺代谢的酶被激活。这涉及新酶的合成,并且需要几天时间才能完全适应。随着这些酶水平的增加,\mathrm{NH_{4}}^{+}的生成增加,从而增强了新的HCO3-的产生。相反,碱中毒时谷氨酰胺代谢减少。酸中毒还增加了集合管中RhBG和RhCG的丰度,因此分泌\mathrm{NH_{4}}^{+}的能力也增强。
对酸碱紊乱的反应
ECF(细胞外液)的pH维持在一个非常狭窄的范围内(7.35-7.45)。通过检查方程37.3可以看出,当[\mathrm{HCO}_{3}^{-}]或\mathrm{Pco}_{2}发生变化时,ECF的pH会发生变化。如前所述,由于ECF中[\mathrm{HCO}_{3}^{-}]变化引起的酸碱平衡紊乱称为代谢性酸碱紊乱,而由于\mathrm{Pco}_{2}变化引起的酸碱平衡紊乱称为呼吸性酸碱紊乱。肾脏主要负责调节[\mathrm{HCO}_{3}^{-}],而肺则调节\mathrm{Pco}_{2}。
当酸碱紊乱发生时,身体使用几种机制来防御ECF pH的变化。这些防御机制并不能纠正酸碱紊乱,而只是最小化紊乱引起的pH变化。将血液pH恢复到正常值需要纠正导致酸碱紊乱的根本过程。身体有三种一般机制来防御酸碱紊乱引起的体液pH变化:(1)细胞外和细胞内缓冲,(2)通过改变肺的通气速率来调整血液\mathrm{Pco}_{2},(3)调整RNAE(净酸排泄)。
细胞外和细胞内缓冲
防御酸碱紊乱的第一道防线是细胞外和细胞内缓冲。细胞外缓冲的反应几乎是瞬时的,而细胞内缓冲的反应较慢,可能需要几分钟。
由于向体液中添加非挥发性酸或碱而引起的代谢紊乱在细胞外和细胞内都被缓冲。HCO3-缓冲系统是主要的ECF缓冲系统。当向体液中添加非挥发性酸(或从体内丢失碱)时,HCO3-在中和酸负荷的过程中被消耗,ECF的[\mathrm{HCO}_{3}^{-}]减少。相反,当向体液中添加非挥发性碱(或从体内丢失酸)时,H+被消耗,导致更多的HCO3-从{\mathrm{H}}_{2}{\mathrm{CO}}_{3}的解离中产生。因此,[\mathrm{HCO}_{3}^{-}]增加。
尽管\mathrm{HCO}_{3}^{-}缓冲系统是主要的细胞外液(ECF)缓冲系统,Pi和血浆蛋白也提供了额外的细胞外缓冲作用。\mathrm{HCO}_{3}^{-}、{\mathrm{P}}_{\mathrm{i}}和血浆蛋白的缓冲过程共同作用,约占非挥发性酸负荷缓冲的50%和非挥发性碱负荷缓冲的70%。在这两种情况下,剩余的缓冲作用发生在细胞内。细胞内缓冲涉及H+进入细胞(在非挥发性酸缓冲期间)或H+离开细胞(在非挥发性碱缓冲期间)。H+在细胞内被HCO3-、Pi和蛋白质上的组氨酸基团滴定。
• 图37.8 通气速率对肺泡\mathsf{P C O}_{2}及动脉血\mathsf{P C O}_{2}的影响。
骨骼是细胞外缓冲的另一个来源。然而,在酸中毒时,骨骼的缓冲作用会导致其脱矿质化。
当发生呼吸性酸碱紊乱时,体液的pH会因\mathrm{Pco}_{2}的变化而改变。几乎所有呼吸性酸碱紊乱的缓冲作用都发生在细胞内。当\mathrm{Pco}_{2}升高(呼吸性酸中毒)时,\mathrm{CO}_{2}进入细胞,与_{\mathrm{H}_{2}\mathrm{O}}结合形成\mathrm{H}_{2}\mathrm{CO}_{3}。\mathrm{H}_{2}\mathrm{CO}_{3}随后解离为H+和HCO3-。部分H+被细胞蛋白缓冲,而HCO3-离开细胞并提高ECF中的[\mathrm{HCO}_{3}^{-}]。当\mathrm{Pco}_{2}降低(呼吸性碱中毒)时,这一过程会逆转。在这种情况下,\mathrm{Pco}_{2}的降低使水合反应(\mathrm{H}_{2}\mathrm{O}+\mathrm{CO}_{2}\mathrm{H}_{2}\mathrm{CO}_{3})向左移动。结果,解离反应(\mathrm{H}_{2}\mathrm{CO}_{3}\mathrm{OH}^{+}+\mathrm{HCO}_{3}^{-})也向左移动,从而降低ECF中的[\mathrm{HCO}_{3}^{-}]。
呼吸代偿
肺是抵御酸碱紊乱的第二道防线。正如Henderson-Hasselbalch方程(见公式37.2)所示,\mathrm{Pco}_{2}的变化会改变血液的pH:升高会降低pH,而降低会增加pH。
通气速率决定了\mathrm{Pco}_{2}。通气增加会降低\mathrm{Pco}_{2},而通气减少则会增加\mathrm{Pco}_{2}(图37.8)。血液中的\mathrm{Pco}_{2}和pH是通气速率的重要调节因素。位于脑干(延髓腹侧表面)和外周(颈动脉体和主动脉体)的化学感受器感知\mathrm{Pco}_{2}和[H+]的变化,并相应地调整通气速率。因此,当代谢性酸中毒发生时,[H+]的升高(pH降低)会刺激通气速率。相反,在代谢性碱中毒期间,[H+]的降低(pH升高)会减少通气速率。在最大程度的过度通气时,\mathrm{Pco}_{2}可以降低到大约10mM\mathrm{Hg}。由于缺氧是通气的强效刺激因素,而缺氧也会随着通气不足而发展,因此\mathrm{Pco}_{2}可以增加的程度是有限的。在正常个体中,通气不足不能使\mathrm{Pco}_{2}超过60\mathrm{mmHg}。对代谢性酸碱紊乱的呼吸反应可能在几分钟内启动,但可能需要几个小时才能完成。
肾脏代偿
对抗酸碱紊乱的第三道也是最后一道防线涉及肾脏。响应血浆pH和\mathrm{Pco}_{2}的变化,肾脏会适当调整RNAE(净酸排泄)的排泄。肾脏反应可能需要几天时间才能完成,因为增加近端小管酶(参与\mathrm{NH_{4}}^{+}生成)的合成和活性需要数小时到数天的时间。在酸中毒([H+]或\mathrm{Pco}_{2}增加)的情况下,肾单位的H+分泌受到刺激,并且所有过滤的HCO3-负荷都被重吸收。可滴定酸排泄增加,\mathrm{NH_{4}}^{+}的生成和排泄也受到刺激,因此RNAE增加(图37.9)。在净酸排泄过程中生成的新HCO3-被添加到体内,血浆[\mathrm{HCO}_{3}^{-}]增加。
当存在代谢性碱中毒([H+]降低)时,HCO3-的过滤负荷增加(血浆[\mathrm{HCO}_{3}^{-}]升高)。在呼吸性碱中毒(\mathrm{Pco}_{2}降低)时,血浆[\mathrm{HCO}_{3}^{-}]降低,因此过滤负荷减少。在这两种情况下,肾单位的H+分泌受到抑制。结果,HCO3-排泄增加。同时,可滴定酸和\mathrm{NH_{4}}^{+}的排泄减少。因此,RNAE减少,HCO3-出现在尿液中。此外,一些HCO3-通过远端小管和集合管的HCO3-分泌性间质细胞分泌到尿液中。随着HCO3-排泄的增加,血浆[\mathrm{HCO}_{3}^{-}]降低。
临床实践
胃内容物从体内流失(例如呕吐、鼻胃管抽吸)会导致继发性代谢性碱中毒,这是由于HCl的流失所致。如果胃液流失严重,会发生ECFV(细胞外液容量)收缩。在这种情况下,肾脏无法排泄足够量的{\mathsf{H C O}}_{3}^{-}来代偿代谢性碱中毒。肾脏无法排泄{\mathsf{H C O}}_{3}^{-}的原因是,为了纠正ECFV收缩,需要减少Na+的排泄。如前所述(详见第35章),肾脏对容量收缩的反应是降低肾小球滤过率,从而减少\mathsf{H C O}_{3}^{-}的滤过负荷,并增加肾单位对Na+的重吸收。由于大量的Na+重吸收是通过\mathsf{N a^{+}/H+}反向转运体进行的,这导致近端小管增加\Join^{+}分泌(\mathrm{HCO_{3}^{-}}重吸收)。在这种情况下,所有滤过的\mathsf{H C O}_{3}^{-}都会被重吸收,甚至可能增强新的{\mathsf{H C O}}_{3}^{-}生成。后一种反应的发生是因为醛固酮(在容量收缩时其水平升高)不仅刺激远端Na+的重吸收,还刺激间质细胞的H+分泌。这种\Join^{+}分泌的刺激通过增加可滴定酸和\mathrm{NH_{4}}^{+}排泄来生成新的\mathsf{H C O}_{3}^{-}。因此,在胃内容物流失的个体中,通常会出现代谢性碱中毒和反常的酸性尿液。只有在恢复正常血容量时,碱中毒才能得到纠正。
• 图37.9 肾单位对酸中毒的反应。CCD,皮质集合管;D T, 远端小管;IMCD,内髓集合管;P_{\mathfrak{p}} 磷酸盐;P T, 近端小管;P T H, 甲状旁腺激素;Rhbg & Ṙhcg,恒河猴糖蛋白;R N A E, 肾脏净酸排泄;T A_{:} 可滴定酸;T A L, 粗升支;\dot{\mathsf{V}}, 尿流率。
简单酸碱紊乱的特征 37.1
<html><body><table><tr><td>紊乱</td><td>血浆pH</td><td>主要改变</td><td>防御机制</td></tr><tr><td>代谢性酸中毒</td><td></td><td>↓ECF [HCO]</td><td>ICF和ECF缓冲 过度通气 (↓Pco2) ↑RNAE</td></tr><tr><td>代谢性碱中毒</td><td></td><td>↑ECF [HCO]</td><td>ICF和ECF缓冲 通气不足 (↑Pco2) ↓RNAE</td></tr><tr><td>呼吸性酸中毒</td><td></td><td>↑PcO2</td><td>ICF缓冲 ↑RNAE</td></tr><tr><td>呼吸性碱中毒</td><td></td><td>↓PcO2</td><td>ICF缓冲 ↓RNAE</td></tr></table></body></html>
ECF,细胞外液;I C F, 细胞内液;RNAE,肾脏净酸排泄
简单酸碱紊乱
表37.1总结了各种简单酸碱紊乱的主要改变及其随后的代偿或防御机制。在所有酸碱紊乱中,代偿反应并不能纠正潜在的紊乱,而只是减少了pH变化的幅度。纠正酸碱紊乱需要治疗其病因。
酸碱紊乱的类型
代谢性酸中毒
代谢性酸中毒的特征是细胞外液(ECF)中[\mathrm{HCO}_{3}^{-}]和pH的降低。它可以通过向体内添加非挥发性酸(如糖尿病酮症酸中毒)、非挥发性碱的丢失(如由腹泻引起的HCO3-丢失)或肾脏未能排出可滴定酸和\mathrm{NH_{4}}^{+}(如肾功能衰竭)而发展。如前所述,H+的缓冲发生在ECF和细胞内液(ICF)中。当pH下降时,呼吸中枢受到刺激,通气速率增加(呼吸代偿)。
最后,在代谢性酸中毒中,净酸排泄量(RNAE)增加。这是通过从尿液中排出所有HCO3-(增强过滤的HCO3-的重吸收)以及通过增加可滴定酸和\mathrm{NH_{4}}^{+}的排泄(增强新的{\mathrm{HCO}}_{3}{\mathrm{~)}}的产生)来实现的。如果引发酸碱紊乱的过程得到纠正,增强的RNAE最终将使pH和[\mathrm{HCO}_{3}^{-}]恢复正常。在pH纠正后,通气速率也会恢复正常。
临床中的应用
当非挥发性酸被添加到体液中时,如糖尿病酮症酸中毒,[H+]增加(pH降低),[\mathsf{H C O}_{3}{}^{-}]减少。此外,与非挥发性酸相关的阴离子浓度增加。这种阴离子浓度的变化提供了一种方便的方法,通过计算所谓的阴离子间隙来分析代谢性酸中毒的原因。阴离子间隙代表主要ECF阳离子\left(Na+\right)与主要ECF阴离子\mathrm{(Cl^{-}}和\mathsf{H C O}_{3}{}^{-})之间的差异:
在正常情况下,阴离子间隙范围为8至16mEq/L。重要的是要认识到阴离子间隙实际上并不存在。所有阳离子都由阴离子平衡。这个间隙仅仅反映了测量的参数。实际上:
$$
\mathsf{A n i o n g a p}=\left[Na+\right]-\left(\left[\mathsf{Cl-\right]+\left[\mathsf{H C O_{3}^{-}}\right]\right)
$$
$$
\begin{array}{r l}&{\left[Na+\right]+\left[\mathsf{U n m e a s u r e d c a t i o n s}\right]}\ &{\quad=\left[\mathsf{C l}^{-}\right]+\left[\mathsf{H C O}_{3}^{-}\right]+\left[\mathsf{U n m e a s u r e d a n i o n s}\right]}\end{array}
$$
如果非挥发性酸的阴离子是Cl-,阴离子间隙将是正常的(即[\mathsf{H C O}_{3}{}^{-}]的减少与[Cl-]的增加相匹配)。与腹泻或肾小管酸中毒(即肾脏\Join^{+}分泌缺陷)相关的代谢性酸中毒具有正常的阴离子间隙。相反,如果非挥发性酸的阴离子不是Cl-(如乳酸,β -羟基丁酸),阴离子间隙将增加(即[\mathsf{H C O}_{3}{}^{-}]的减少不与\left[\bigcirc\right]-]的增加相匹配,而是与未测量阴离子浓度的增加相匹配)。在代谢性酸中毒相关的酮症酸中毒(如糖尿病)中,阴离子间隙增加,伴有肾功能衰竭、乳酸酸中毒或摄入毒素或某些药物(如大量阿司匹林)。因此,计算阴离子间隙是临床环境中识别代谢性酸中毒病因的有用方法。
白蛋白(albumin)是一种带负电荷的大分子,它对“未测定的阴离子”有相当大的贡献。因此,对于血清[白蛋白]异常的患者,必须调整阴离子间隙(anion gap)。血清[白蛋白]每变化19/\mathrm{dL},阴离子间隙需要同方向调整2.5mEq/L。
代谢性碱中毒(Metabolic Alkalosis)
代谢性碱中毒的特征是细胞外液(ECF)中[\mathrm{HCO}_{3}^{-}]和pH的增加。它可以通过向体内添加非挥发性碱(例如,摄入抗酸剂)、由于容量收缩(例如,出血)或更常见的是由于非挥发性酸的丢失(例如,由于长期呕吐导致的胃HCl丢失)而发生。缓冲作用主要发生在细胞外液(ECF),在细胞内液(ICF)中程度较轻。pH的增加抑制了呼吸中枢,从而降低了通气率,因此\mathrm{Pco}_{2}升高(呼吸代偿)。
肾脏对代谢性碱中毒的代偿反应是通过减少沿肾单位的重吸收来增加HCO3-的排泄。通常这种情况发生得相当迅速(几分钟到几小时)且有效。只要初始酸碱紊乱的根本原因得到纠正,肾脏排泄HCO3-的增加最终会使pH和[\mathrm{HCO}_{3}^{-}]恢复正常。当pH得到纠正时,通气率也会恢复正常。
呼吸性酸中毒(Respiratory Acidosis)
呼吸性酸中毒的特征是\mathrm{Pco}_{2}升高和细胞外液(ECF)pH降低。它是由于肺泡气体交换减少所致,原因可能是通气不足(例如,药物引起的呼吸中枢抑制)或气体扩散受损(例如,肺水肿,如心血管和肺部疾病中发生的情况)。与代谢性紊乱不同,呼吸性酸中毒期间的缓冲作用几乎完全发生在细胞内液(ICF)中。\mathrm{Pco}_{2}的增加和pH的降低刺激了肾单位对HCO3-的重吸收以及可滴定酸和\mathrm{NH_{4}}^{+}的排泄(肾脏代偿)。这些反应共同增加了RNAE并生成了新的HCO3-。肾脏的代偿反应需要几天时间才能发生。因此,呼吸性酸碱紊乱通常分为急性和慢性阶段。在急性阶段,肾脏代偿反应的时间不足,身体依靠细胞内液(ICF)缓冲来最小化pH的变化。在慢性阶段,肾脏代偿发生。纠正基础疾病后,\mathrm{Pco}_{2}恢复正常,RNAE降至初始水平。
呼吸性碱中毒(Respiratory Alkalosis)
呼吸性碱中毒(Respiratory alkalosis)的特征是\mathrm{Pco}_{2}降低和ECF(细胞外液)pH升高。它通常是由于肺部气体交换增加引起的,通常由呼吸中枢受到刺激(例如通过药物或中枢神经系统疾病)导致的通气增加引起。过度通气(Hyperventilation)也发生在高海拔地区,以及由于焦虑、疼痛或恐惧引起。缓冲作用主要发生在ICF(细胞内液)区室。与呼吸性酸中毒一样,呼吸性碱中毒也有急性和慢性阶段,反映了肾脏代偿所需的时间。呼吸性碱中毒的急性阶段反映了细胞内缓冲作用,而慢性阶段反映了肾脏代偿。在肾脏代偿过程中,升高的pH和降低的\mathrm{Pco}_{2}抑制了肾单位对HCO3-的重吸收,并减少了可滴定酸和\mathrm{NH_{4}}^{+}的排泄。由于这些效应,RNAE(净酸排泄量)减少。纠正基础疾病后,\mathrm{Pco}_{2}恢复正常,肾脏的酸排泄量也随之恢复到初始水平。
酸碱紊乱的分析
酸碱紊乱的分析旨在确定基础病因,以便启动适当的治疗。患者的病史和相关体格检查通常为酸碱紊乱的性质和起源提供有价值的线索。此外,通常需要分析动脉血样本。如果系统地进行分析,这种分析是直接的。例如,考虑以下数据:通过这些值或任何其他值集所代表的酸碱紊乱可以使用以下三步法确定:
- 检查pH。当首先考虑pH时,基础紊乱可以分类为酸中毒或碱中毒。身体的防御机制本身无法纠正酸碱紊乱。因此,即使防御机制完全运作,pH的变化也表明了酸碱紊乱。在提供的例子中,pH为7.35表明酸中毒。
37.2 伴有代偿的简单酸碱紊乱
- 代谢性与呼吸性紊乱的鉴别。简单的酸碱紊乱要么是代谢性的,要么是呼吸性的。为了确定存在哪种紊乱,临床医生接下来必须检查ECF(细胞外液)中的[\mathrm{HCO}_{3}^{-}](碳酸氢根离子浓度)和\mathrm{Pco}_{2}(二氧化碳分压)。如前所述,酸中毒可能是由于[\mathrm{HCO}_{3}^{-}]的降低(代谢性)或\mathrm{Pco}_{2}的升高(呼吸性)引起的。相反,碱中毒可能是由于ECF中[\mathrm{HCO}_{3}^{-}]的升高(代谢性)或\mathrm{Pco}_{2}的降低(呼吸性)引起的。对于提供的例子,ECF中的[\mathrm{HCO}_{3}^{-}]从正常值(正常值为24mEq/L)降低,\mathrm{Pco}_{2}也从正常值(正常值为40mmHg)降低。因此,这种紊乱必须是代谢性酸中毒;它不可能是呼吸性酸中毒,因为\mathrm{Pco}_{2}降低了。
- 代偿反应的分析。代谢性紊乱会导致通气量的代偿性变化,从而影响\mathrm{Pco}_{2},而呼吸性紊乱则会导致RNAE(肾净酸排泄)的代偿性变化,从而影响ECF中的[\mathrm{HCO}_{3}^{-}](表37.2)。在适当代偿的代谢性酸中毒中,\mathrm{Pco}_{2}降低,而在代偿性代谢性碱中毒中,\mathrm{Pco}_{2}升高。在呼吸性酸中毒中,代偿导致[\mathrm{HCO}_{3}^{-}]升高。
相反,ECF中的[\mathrm{HCO}_{3}^{-}]在呼吸性碱中毒中会降低。在这个例子中,\mathrm{Pco}_{2}从正常值降低,且降低的幅度(ECF中[\mathrm{HCO}_{3}^{-}]降低8mEq/L,\mathrm{Pco}_{2}降低10mmHg)符合预期(见表37.2)。因此,这种酸碱紊乱是一种伴有适当呼吸代偿的单纯代谢性酸中毒。
混合性酸碱紊乱反映了酸碱失衡存在两种或更多潜在原因。例如,考虑以下数据:
当遵循三步法时,可以明显看出这种紊乱是一种酸中毒,既有代谢性成分(ECF中[\mathrm{HCO}_{3}^{-}]<24mEq/L),也有呼吸性成分(\mathrm{Pco}_{2}>40\mathrm{mmHg})。因此,这种紊乱是混合性的。混合性酸碱紊乱可能发生在例如有慢性肺病(如肺气肿,即慢性呼吸性酸中毒)病史并发展为急性胃肠道疾病(如腹泻)的个体中。因为腹泻液中含有HCO3-,其从体内的丢失会导致代谢性酸中毒的发生。
当患者的\mathrm{Pco}_{2}和ECF中的[\mathrm{HCO}_{3}^{-}]值异常但pH正常时,也提示存在混合性酸碱紊乱。这种情况可能发生在摄入了大量阿司匹林的患者中。水杨酸(阿司匹林中的活性成分)会引起代谢性酸中毒,同时刺激呼吸中枢,导致过度通气和呼吸性碱中毒。因此,患者的ECF中[\mathrm{HCO}_{3}^{-}]降低,\mathrm{Pco}_{2}也降低。(注意:\mathrm{Pco}_{2}低于代谢性酸中毒的正常呼吸代偿水平。)
关键概念
- 肾脏通过排泄与代谢产生的非挥发性酸和饮食中摄入的酸量相等的酸来维持酸碱平衡(称为肾脏净酸排泄 [RNAE])。肾脏还通过重吸收几乎所有在肾小球滤过的 HCO3- 来防止 HCO3- 在尿液中的丢失。滤过的 HCO3- 的重吸收和酸的排泄都是通过肾小管分泌 H+ 来完成的。肾脏以可滴定酸(主要是 \mathrm{P_{i,\ell}^{\cdot}})和 \mathrm{NH_{4}}^{+} 的形式排泄酸。可滴定酸和 \mathrm{NH_{4}}^{+} 的排泄都会生成新的 HCO3-,从而补充在非挥发性酸中和过程中丢失的细胞外液(ECF)中的 HCO3-。
- 人体通过三道防线来最小化酸碱紊乱对体液 pH 的影响:(1)细胞外液(ECF)和细胞内液(ICF)缓冲,(2)呼吸代偿,(3)肾脏代偿。
- 代谢性酸碱紊乱是由于细胞外液(ECF)中 [\mathrm{HCO}_{3}^{-}] 的初始改变引起的,这种改变又源于体内酸的增加或碱的丢失。在代谢性酸中毒的情况下,肺通气增加,从而降低 \mathrm{Pco}_{2}。肺对代谢性酸碱紊乱的反应在几分钟内发生。RNAE 也会增加,但这需要几天时间。ECF 中 [\mathrm{HCO}_{3}^{-}] 的增加会导致碱中毒。这会迅速(几分钟到几小时)减少肺通气,从而升高 \mathrm{Pco}_{2} 作为代偿反应。RNAE 也会减少,但这需要几天时间。
- 呼吸性酸碱紊乱是由于 \mathrm{Pco}_{2} 的初始改变引起的。\mathrm{Pco}_{2} 的升高会导致酸中毒,肾脏通过增加 RNAE 来应对。相反,\mathrm{Pco}_{2} 的降低会导致碱中毒,RNAE 也会减少。肾脏对呼吸性酸碱紊乱的反应需要几小时到几天的时间。
