第八章 厚壁组织
术语**厚壁组织(sclerenchyma)**指的是由具有次生壁(secondary walls)的细胞组成的组织,这些细胞通常木质化(lignified),其主要功能是机械支持(mechanical or support)。这些细胞被认为能够使植物器官承受各种应变(strain),如拉伸、弯曲、重量和压力,而不会对薄壁的柔软细胞造成过度损伤。该词源自希腊语“skleros”,意为“坚硬”,以及“enchyma”,意为“注入”;它强调了厚壁组织壁的硬度。厚壁组织的单个细胞被称为**厚壁细胞(sclerenchyma cells)**。除了构成厚壁组织外,厚壁细胞与薄壁细胞(parenchyma cells)一样,可能单独或成组出现在其他组织中。在前一章(第7章)中提到,薄壁细胞和厚角细胞(collenchyma cells)都可能发生硬化(sclerified)。在这方面特别值得注意的是次生木质部()的薄壁细胞,其输水细胞(管状分子(tracheary elements))也具有次生壁。因此,次生壁并非厚壁细胞所独有,因此典型的厚壁细胞与硬化的薄壁细胞或厚角细胞之间的界限,以及管状分子之间的界限,并不十分明确。厚壁细胞在成熟时可能保留也可能不保留其原生质体(protoplasts)。这种变异性增加了区分厚壁细胞和硬化薄壁细胞的难度。
厚壁细胞通常分为两类:**纤维**和**石细胞(sclereids)**。纤维被描述为长细胞,而石细胞则被描述为相对较短的细胞。然而,石细胞可能从短到明显伸长不等,不仅在不同的植物中如此,在同一植物个体中也是如此。同样,纤维也可能较短或较长。一般认为,石细胞的壁上有比纤维更明显的纹孔(pitting),但这种差异并不恒定。有时,这两类细胞的起源被认为是区分特征:石细胞通常被认为是通过薄壁细胞的次生硬化形成的,而纤维则来自早期被确定为纤维的分生组织细胞(meristematic cells)。然而,这一标准并不完全成立。一些石细胞从早期被个体化为石细胞的细胞分化而来(如*Camellia*,Foster,1944;*Monstera*,Bloch,1946),在某些植物中,韧皮部的薄壁细胞仅在不再参与传导的组织部分分化为纤维状细胞(第14章;Esau,1969;Kuo-Huang,1990)。当难以将细胞分类为纤维或石细胞时,可以使用术语**纤维-石细胞(fiber-sclereid)**。
❙ 纤维
纤维通常是长而纺锤形的细胞,具有或多或少加厚的次生壁,并且通常以束状存在(图8.1)。这些束构成了商业上的“纤维”。在从植物中提取纤维的过程中,使用的沤麻(rotting的技术形式)过程导致纤维束与相关的非纤维细胞分离。在一个束内,纤维相互重叠,这一特征赋予了纤维束强度。与厚角组织细胞的加厚初生壁不同,纤维壁的含水量不高。因此,它们比厚角组织壁更硬,并且具有弹性而非塑性。纤维在不再伸长的植物部分中充当支持元素。木质化程度各不相同,通常简单或略微有缘纹孔的孔相对较少且呈狭缝状。许多纤维在成熟时仍保留其原生质体。
纤维在植物体中广泛分布
纤维以单独的束或圆柱体形式存在于皮层和韧皮部中,作为与维管束相关的鞘或束帽,或以群集或分散的形式存在于木质部和韧皮部中。在单子叶植物和真双子叶植物的茎中,纤维以几种特征性模式排列(Schwendener, 1874; de Bary, 1884; Haberlandt, 1914; Tobler, 1957)。在许多禾本科植物中,纤维形成一个具有肋状空心圆柱体形状的系统,肋与表皮相连(图8.2A)。在*Zea*、*Saccharum*、*Andropogon*、*Sorghum*(图8.2B)以及其他相关属中,维管束具有显著的纤维鞘,外围的维管束可能不规则地相互融合或通过硬化薄壁组织联合成一个厚壁组织圆柱体。皮下薄壁组织可能被
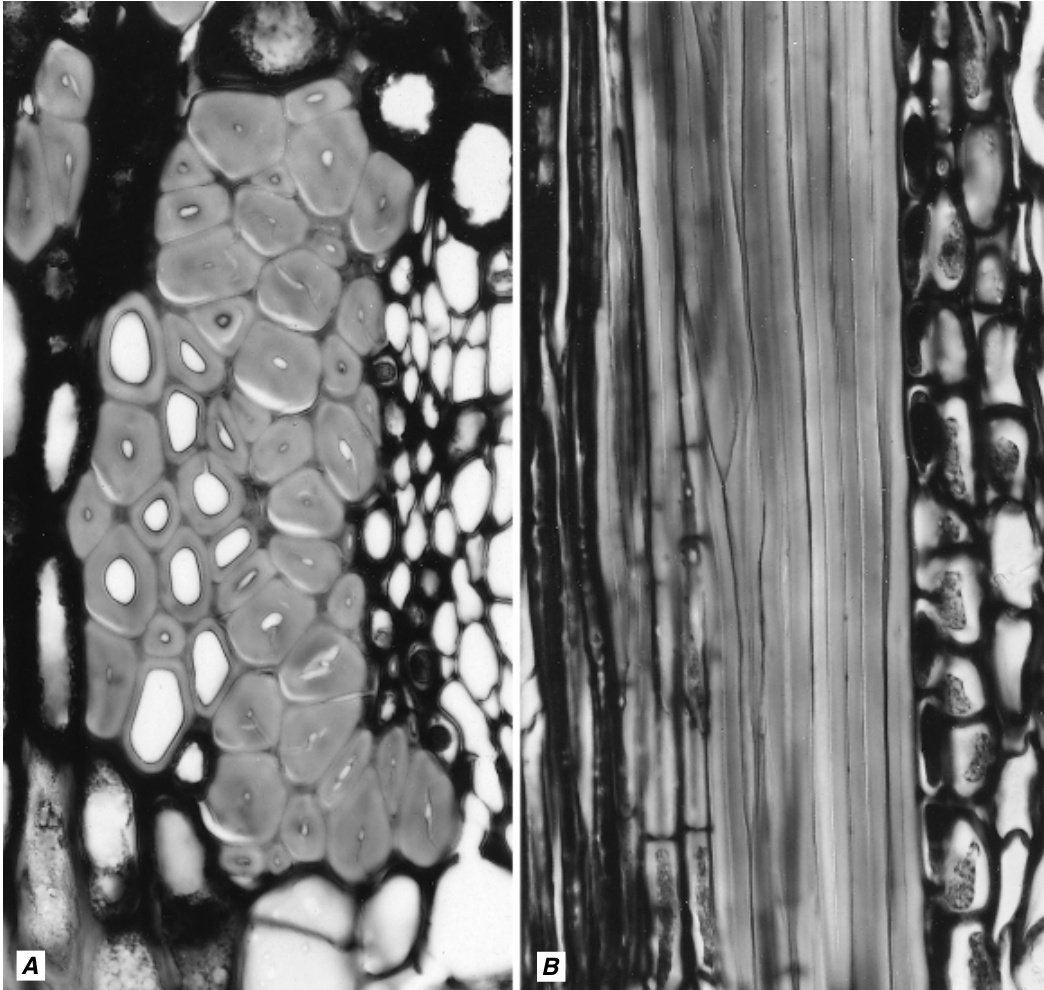
图8.1
来自椴树(*Tilia americana*)茎的初生韧皮部纤维,此处显示为(A)横切面和$\mathbf{(B)}$纵切面。这些长而厚壁的纤维的次生壁含有相对不明显的纹孔。在$\mathbf{(B)}$中只能看到部分纤维。(A, $\times620$ ; B, $\times375.$)
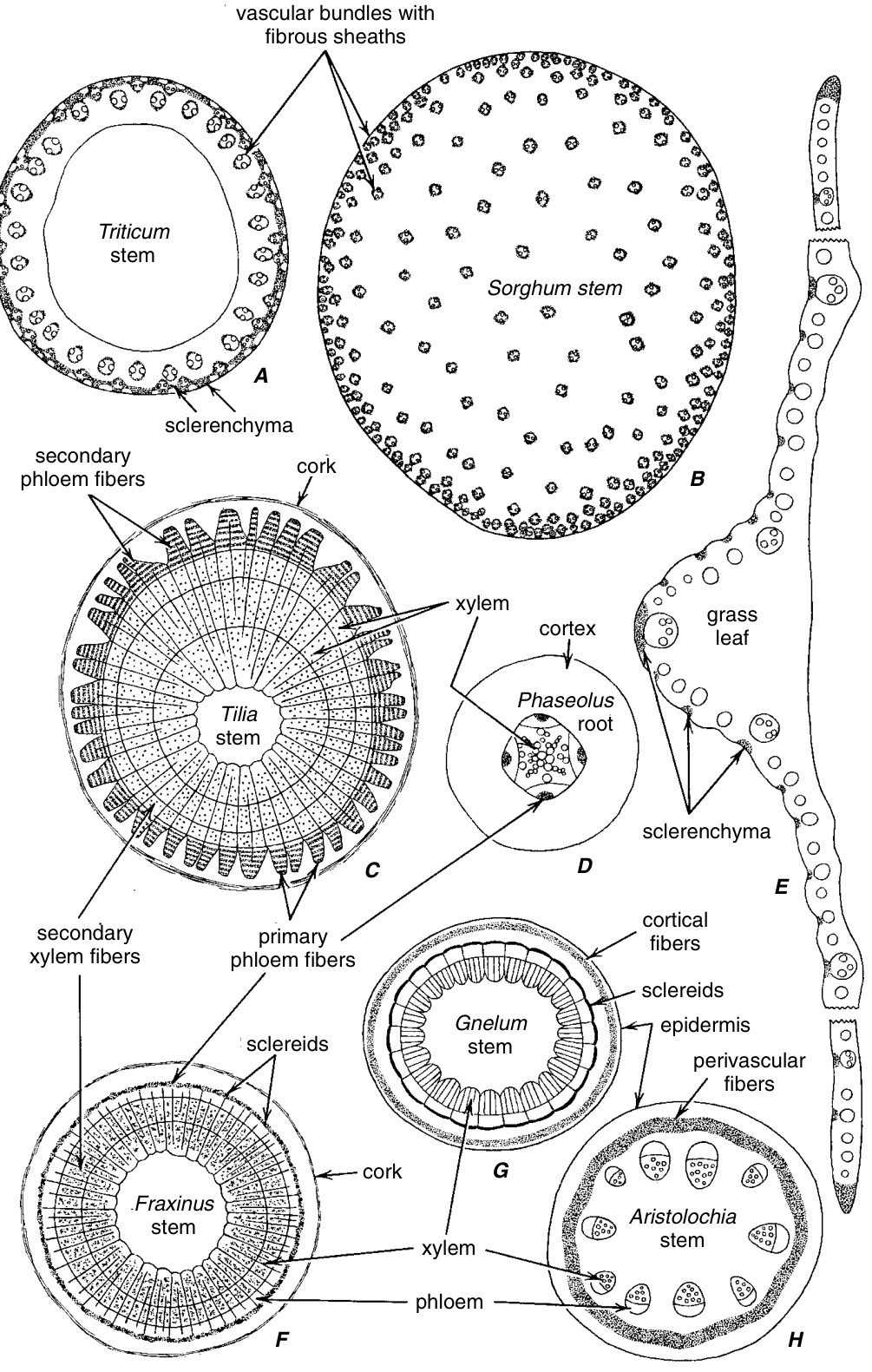
图8.2
各种植物器官的横切面,显示厚壁组织(点状)的分布,主要是纤维,以及维管组织的分布。A, *Triticum*茎,厚壁组织包围维管束并在茎的外围部分形成层。B, *Sorghum*茎,厚壁组织在维管束周围的纤维鞘中。C, *Tilia*茎,纤维在初生和次生韧皮部以及次生木质部中。D, *Phaseolus*根,纤维在初生韧皮部中。E, 禾本科植物叶,厚壁组织在背面表皮下的束中和叶片边缘。F, *Fraxinus*茎,纤维在初生韧皮部和次生木质部中;韧皮部纤维与石细胞交替排列。G, *Gnetum gnemon*茎,纤维在皮层中,石细胞在维管周围位置。H, *Aristolochia*茎,纤维圆柱体位于淀粉鞘内部的维管周围位置(A, G, $\times14$ ; B, C, F, $\times7$ ; D, $\times9.5$ ; E, $\times29.5$ ; H, $\times13.$)
强烈硬化的(Magee, 1948)。在*Zea mays*中记录到含有长纤维的下皮层(hypodermis),一些纤维长度超过$1\mathrm{mm}$(Murdy, 1960)。(下皮层由位于表皮(epidermis)下方的一层或多层细胞组成,与基本组织(ground tissue)的其他邻近细胞不同。)在棕榈植物中,中央柱(central cylinder)由可能宽达数英寸的硬化区(sclerotic zone)界定(Tomlinson, 1961)。它由具有大量径向延伸的纤维鞘的维管束(vascular bundles)组成。相关的基本薄壁组织(ground parenchyma)也会硬化。此外,纤维束出现在皮层(cortex)中,少数出现在中央柱中。在其他单子叶植物中可能会发现不同的模式,并且在同一植物的茎的不同水平上模式可能会有所不同(Murdy, 1960)。纤维在单子叶植物的叶子中可能很突出(图8.2E)。在这里,它们形成鞘,包围维管束或束,延伸在表皮和维管束之间,或与维管束无关的表皮下束。
在被子植物(angiosperms)的茎中,纤维经常出现在初生韧皮部(primary phloem)的最外层,形成或多或少广泛的吻合束或切向板(图8.2C, F)。在一些植物中,韧皮部中除了外围纤维(初生韧皮部纤维)外没有其他纤维(*Alnus*, *Betula*, *Linum*, *Nerium*)。其他植物也在次生韧皮部(secondary phloem)中发育纤维,少数(*Nicotiana*, *Catalpa*, *Boehmeria*)或许多(*Clematis*, *Juglans*, *Magnolia*, *Quercus*, *Robinia*, *Tilia*, *Vitis*)。一些真双子叶植物(eudicots)具有完整的纤维柱,要么靠近维管组织(*Geranium*, *Pelargonium*, *Lonicera*, 一些Saxifragaceae, Caryophyllaceae, Berberidaceae, Primulaceae),要么远离它们,但仍位于皮层最内层的内侧(图8.2H; *Aristolochia*, *Cucurbita*)。在没有次生生长的真双子叶植物茎中,孤立的维管束可能在内外两侧都伴有纤维束(*Polygonum*, *Rheum*, *Senecio*)。具有木质部内部韧皮部的植物可能具有与该韧皮部相关的纤维(*Nicotiana*)。最后,被子植物中纤维的一个高度特征性位置是初生和次生木质部,它们在那里有各种排列(第11章)。根的纤维分布与茎相似,可能在初生(图8.2D)和次生体中具有纤维。针叶树(conifers)通常在初生韧皮部中没有纤维,但可能在次生韧皮部中具有纤维(*Sequoia*, *Taxus*, *Tbuja*)。皮层纤维有时出现在茎中(图8.2G)。
纤维可分为两大类,木质部纤维和木质部外纤维
木质部纤维(xylary fibers)是木质部的纤维,木质部外纤维(extraxylary fibers)是位于木质部外部的纤维。在木质部外纤维中有韧皮部纤维(phloem fibers)。韧皮部纤维出现在许多茎中。亚麻(*Linum usitatissimum*)
茎中仅有一束纤维,深度上有多层,位于维管柱的外围(图8.3)。这些纤维起源于初生韧皮部(原生韧皮部)的最早部分,但在该部分韧皮部停止传导功能后成熟为纤维(图8.4)。因此,亚麻纤维是初生韧皮部纤维或原生韧皮部纤维。*Sambucus*(接骨木)、*Tilia*(椴树)、*Liriodendron*(鹅掌楸)、*Vitis*(葡萄藤)、*Robinia pseudoacacia*(刺槐)以及许多其他植物的茎中既有初生韧皮部纤维,也有次生韧皮部纤维,后者位于次生韧皮部内(图8.2C)。
在双子叶植物的茎中,还常见另外两类木质部外纤维:皮层纤维和维管周纤维。皮层纤维,顾名思义,起源于皮层(图8.2G)。维管周纤维位于维管柱的外围,位于最内层皮层内部(图8.2H;*Aristolochia* 和 *Cucurbita*)。它们并非起源于韧皮部组织,而是起源于其外部。维管周纤维通常被称为周韧纤维。然而,周韧这一术语也常用于指代初生韧皮部纤维(Esau, 1979)。(关于周韧术语的评估,参见Blyth, 1958。)木质部外纤维还包括
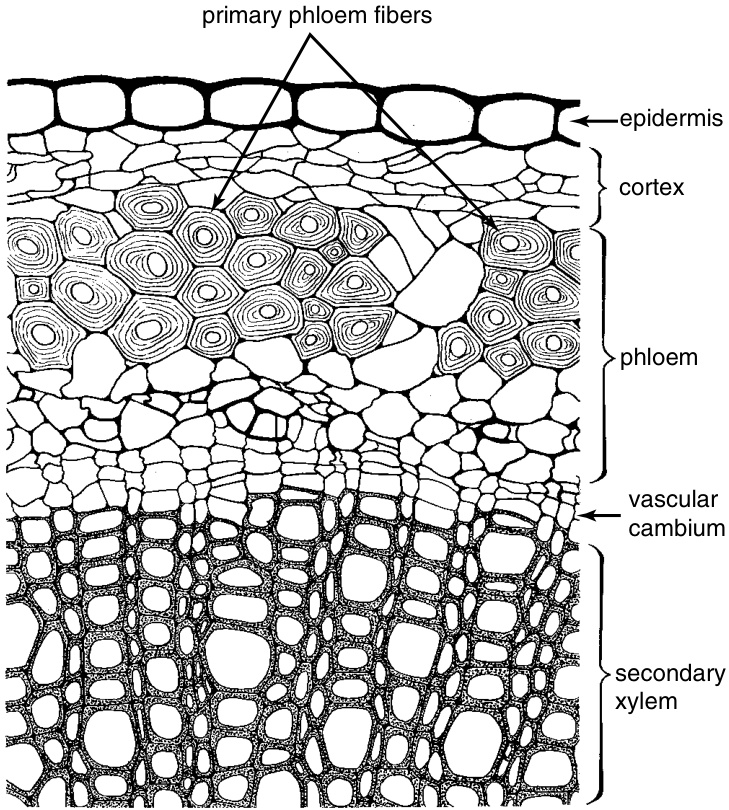
图8.3
*Linum usitatissimum* 茎的横切面,显示初生韧皮部纤维的位置。$(\times320.)$
图8.4
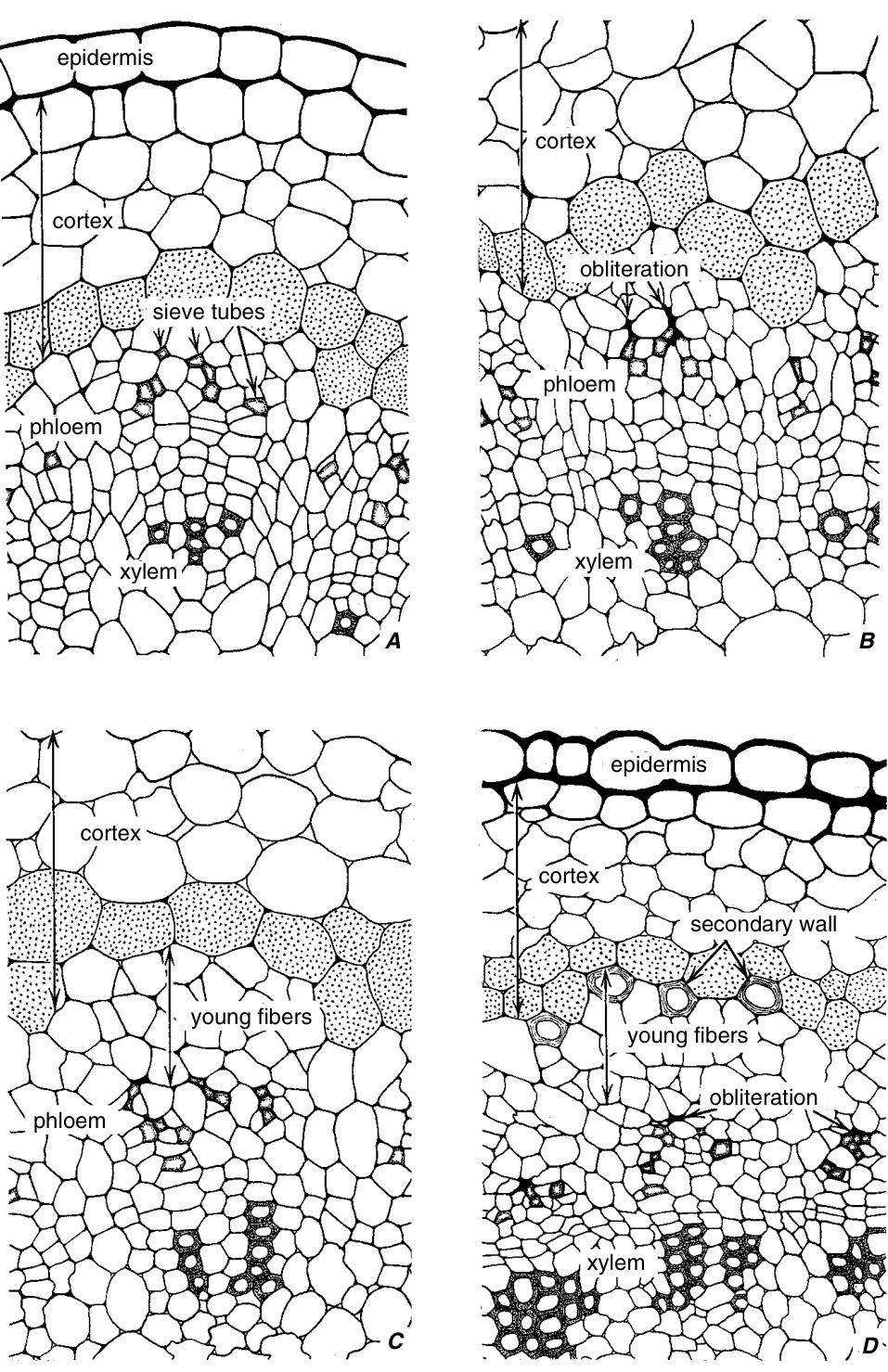
*Linum perenne* L. 初生韧皮部纤维的发育。A,第一批初生筛管成熟。B、C,新的筛管分化,而较老的筛管被堵塞。D,筛管堵塞后剩余的细胞开始发育出亚麻纤维特有的次生壁。(A-C, $\times745$ ; D, $\times395.$ )
单子叶植物中的纤维,无论是否与维管束相关。
木质部外纤维的细胞壁通常非常厚。在亚麻的韧皮部纤维中,次生壁可能占细胞横截面积的$90\%$(图8.3)。这些木质部外纤维的次生壁具有明显的多层结构,各层的厚度从0.1到$0.2\upmu\mathrm{m}$不等。
并非所有木质部外纤维都具有这种壁结构。在成熟的竹秆中,一些纤维壁显示出高度的多层结构,而另一些则没有清晰可见的层(Murphy和Alvin, 1992)。此外,大多数木本被子植物和针叶树的次生韧皮部纤维的次生壁仅由两层组成,一层薄的外层$(\mathsf{S}_{1})$和一层厚的内层$(\mathbf{S}_{2})$(Holdheide, 1951; Nanko等, 1977)。
一些木质部外纤维的壁木质化;而另一些的壁则含有少量或不含木质素(亚麻、大麻、苎麻)。一些木质部外纤维,尤其是单子叶植物的纤维,强烈木质化。
木材纤维通常分为两大类:韧型纤维(libriform fibers)和纤维管胞(fiber-tracheids)(图8.5B,C),这两类纤维的细胞壁通常都木质化(lignified)。韧型纤维类似于韧皮部纤维(phloem fibers)。Libriform一词源自拉丁语liber,意为“内树皮”,即韧皮部。尽管长期以来,这两类木材纤维的区分主要基于韧型纤维中具有单纹孔(simple pits)而纤维管胞中具有具缘纹孔(bordered pits)(IAWA命名委员会,1964),但纤维壁中真正的单纹孔极为罕见(Baas,1986)。这两类木材纤维的极端类型很容易区分,但它们之间存在难以察觉的渐变。纤维管胞也与具有明显具缘纹孔的管胞(tracheids)相互渐变(图8.5A)。通常,壁的厚度按管胞、纤维管胞和韧型纤维的顺序增加。此外,在给定的木材样本中,管胞通常较短,而纤维较长,其中韧型纤维达到最大长度。
尽管通常认为木材纤维在成熟时为死细胞,但在许多木本植物中,韧型纤维和纤维管胞中保留了活的原生质体(protoplasts)(Fahn和Leshem,1963;Wolkinger,1971;Dumbroff和Elmore,1977)。(在超过九年的竹秆中发现了具有活原生质体的纤维;Murphy和Alvin,1997。)这些纤维通常含有大量淀粉粒(starch grains);因此,除了支持作用外,它们还具有储存碳水化合物的功能。木材纤维的次生壁(secondary walls)与韧皮部纤维的不同之处在于,它们由三层组成,分别称为$\mathrm{S}_{1}$、$\mathbf{S}_{2}$和${\bf S}_{3}$,分别代表外层、中层和内层(第4章)。此外,木材纤维的壁通常木质化。
木质部和木质部外纤维可能具有隔膜或胶质
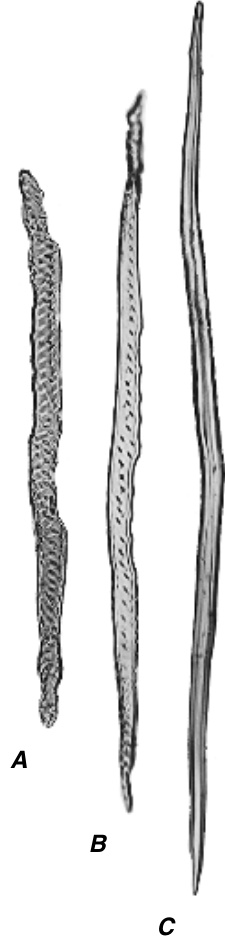
图8.5
一些真双子叶植物的韧皮部和/或木质部纤维在次生壁沉积后经历有规律的有丝分裂(mitotic divisions),并被横壁或隔膜(septae)分割成两个或更多个隔间(图8.6A)(Parameswaran and Liese, 1969; Chalk, 1983; Ohtani, 1987)。这种纤维被称为隔膜纤维(septate fibers),也出现在一些单子叶植物中,它们的起源是非维管性的(在Palmae和Bambuscoideae中;Tomlinson, 1961; Parameswaran and Liese, 1977; Gritsch and Murphy, 2005)。(石细胞(sclereids)也可能被隔膜分割;图8.6B;Bailey, 1961。)隔膜由中层(middle lamella)和两个初生壁(primary walls)组成,显然,它们可能被木质化(lignified)或不被木质化。隔膜与次生壁接触但不融合,并被次生壁与纤维的原始初生壁分开。显然,隔膜的初生壁继续覆盖在纤维次生壁的内表面的一部分或全部(Butterfield and Meylan, 1976; Ohtani, 1987)。分裂后可能会形成额外的次生壁,并覆盖隔膜(图8.6B)。在竹子中,隔膜纤维的特征是具有厚的多层状次生壁。除了中层和初生壁层外,这些纤维的隔膜还具有次生壁层,这些层次继续延伸到纤维的纵向壁上(Parameswaran and Liese, 1977)。原生质体通过纤维的隔膜相互连接,这些纤维在成熟时是活的。通常在隔膜纤维中发现淀粉,表明这些细胞除了支持作用外,还具有储存功能。一些隔膜纤维还含有草酸钙晶体(Purkayastha, 1958; Chalk, 1983)。
A,管胞(tracheid),B,纤维管胞(fiber-tracheid),和C,红橡树(*Quercus rubra*)次生木质部或木材中的韧型纤维(libriform fiber)。这些细胞的斑点状外观是由于壁上的纹孔(pits);在C中纹孔不可见。(全部,$\times172.$)
另一种既不是严格木质部也不是木质部外的纤维是胶质纤维(gelatinous fiber)。胶质纤维通过存在所谓的胶质层来识别。
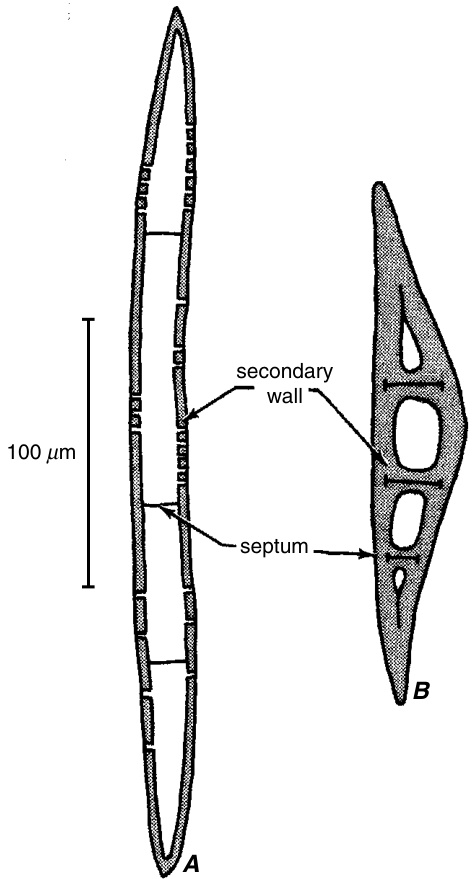
图8.6
A,葡萄藤(*Vitis*)茎韧皮部的隔膜纤维。隔膜与具纹孔的次生壁接触。B,来自*Pereskia*(仙人掌科Cactaceae)韧皮部的隔膜石细胞,其中隔膜被次生壁物质覆盖。(来自Esau, 1977;B,根据Bailey, 1961。)
胶质纤维
胶质层(G-layer)是最内层的次生壁层,由于其高纤维素含量和缺乏木质素(lignin),可以与外部的次生壁层区分开来(图8.7)。G层的纤维素微纤维平行于细胞的长轴排列,因此在偏振光下观察横切面时,该层是各向同性的或略微双折射的(Wardrop, 1964)。由于具有吸湿性,G层能够吸收大量水分。在膨胀时,G层可能会阻塞细胞的腔室;在干燥时,它通常会从壁的其他部分脱离。胶质纤维已在真双子叶植物(eudicots)的根、茎和叶的木质部和韧皮部中发现(Patel, 1964; Fisher and Stevenson, 1981; Sperry, 1982),并在单子叶植物(monocot)叶片的非维管组织中发现(Staff, 1974)。它们在张力木(tension wood)中被研究得最为广泛(第11章)。胶质纤维也被称为更通用的术语——反应纤维(reaction fiber),据推测,胶质纤维在发育过程中会收缩,产生足够的收缩力,最终使倾斜或弯曲的茎干朝向更正常的位置弯曲(Fisher and Stevenson, 1981)。
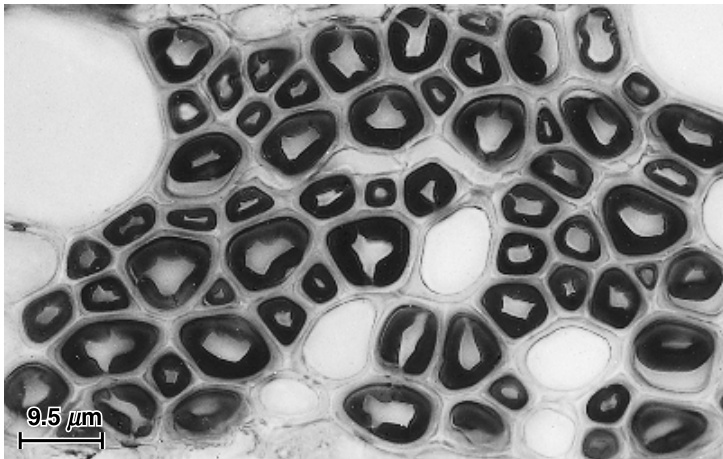
图8.7
在*Fagus* sp. 木材的横切面中观察到的胶质纤维。在大多数这些纤维中,深染的胶质层已从壁的其他部分脱离。(由Susanna M. Jutte提供)
叶片中的胶质纤维可能有助于维持叶片相对于重力的方向,并有助于小叶向太阳展示(Sperry, 1982)。
商业纤维分为软纤维和硬纤维
真双子叶植物的韧皮部纤维代表了商业上的韧皮纤维(bast fibers)(Harris, M., 1954; Needles, 1981)。这些纤维被归类为软纤维,因为无论是否木质化,它们都相对柔软且柔韧。一些著名的韧皮纤维来源及其用途包括:大麻(*Cannabis sativa*),用于绳索;黄麻(*Corchorus capsularis*),用于绳索、粗纺织品;亚麻(*Linum usitatissimum*),用于纺织品(如亚麻布)、线;以及苎麻(*Boebmeria nivea*),用于纺织品。一些真双子叶植物的韧皮纤维用于造纸(Carpenter, 1963)。
单子叶植物的纤维——通常称为叶纤维,因为它们是从叶片中获得的——被归类为硬纤维。它们的壁高度木质化,坚硬且僵硬。叶纤维的来源和用途的例子包括:马尼拉麻(*Musa textilis*),用于绳索;虎尾兰(*Sansevieria*,整个属),用于绳索;剑麻和西沙尔麻(*Agave* 属),用于绳索、粗纺织品;新西兰麻(*Phormium tenax*),用于绳索;以及菠萝纤维(*Ananas comosus*),用于纺织品。单子叶植物的叶纤维(与木质部一起)用作造纸的原材料(Carpenter, 1963):玉米(*Zea mays*)、甘蔗(*Saccharum officinarum*)、西班牙草(*Stipa tenacissima*)等。
不同物种中单个纤维细胞的长度差异很大。可以从M. Harris(1954)的手册中引用一些长度范围的例子(以毫米为单位)。韧皮纤维:黄麻,0.8-6.0;大麻,5-55;亚麻,9-70;苎麻,50-250。叶纤维:西沙尔麻,0.8-8.0;虎尾兰,1-7;马尼拉麻,2-12;新西兰麻,2-15。
在商业中,术语“纤维”(fiber)通常用于指代那些在植物学意义上包含除纤维外的其他类型细胞,甚至根本不是纤维的结构。事实上,从单子叶植物叶片中获得的纤维代表了维管束及其相关的纤维。棉花纤维是*Gossypium*种子的表皮毛(第9章);raffia由*Raphia*棕榈的叶片片段组成;rattan则由*Calamus*棕榈的茎制成。
❙ 石细胞 (Sclereids)
石细胞通常是具有厚次生壁的短细胞,强烈木质化,并具有许多单纹孔。然而,一些石细胞的次生壁相对较薄,可能难以与硬化薄壁细胞区分。另一方面,厚壁形式的石细胞可能与薄壁细胞形成强烈对比:它们的壁可能非常厚,几乎堵塞了细胞腔,其显著的纹孔通常呈分枝状(图8.8)。次生壁通常呈现多层结构,反映了其螺旋构造(Roland等,1987,1989)。在某些物种中,晶体嵌入次生壁中(图8.9)(Kuo-Huang,1990)。许多石细胞在成熟时仍保留活的原生质体。
根据形状和大小,石细胞可分为多种类型
最常见的石细胞类型包括:(1) 短石细胞 (brachysclereids) 或石细胞 (stone cells),大致等径或稍长的细胞,广泛分布于茎的皮层、韧皮部和髓部,以及果实的果肉中(图8.8和8.10A–D);(2) 长石细胞 (macrosclereids),细长且柱状(棒状)的细胞,如豆科植物种皮中形成栅栏状表皮层的石细胞(见图8.14);(3) 骨石细胞 (osteosclereids),骨细胞,也是柱状但末端膨大,如某些种皮的亚表皮层中(见图8.14E);(4) 星状石细胞 (astrosclereids),星形细胞,具有从中央体分出的裂片或臂(图8.10L),常见于真双子叶植物的叶片中。其他较少被识别的类型包括毛状石细胞 (trichosclereids),薄壁石细胞,形似毛发,具有分枝突出。
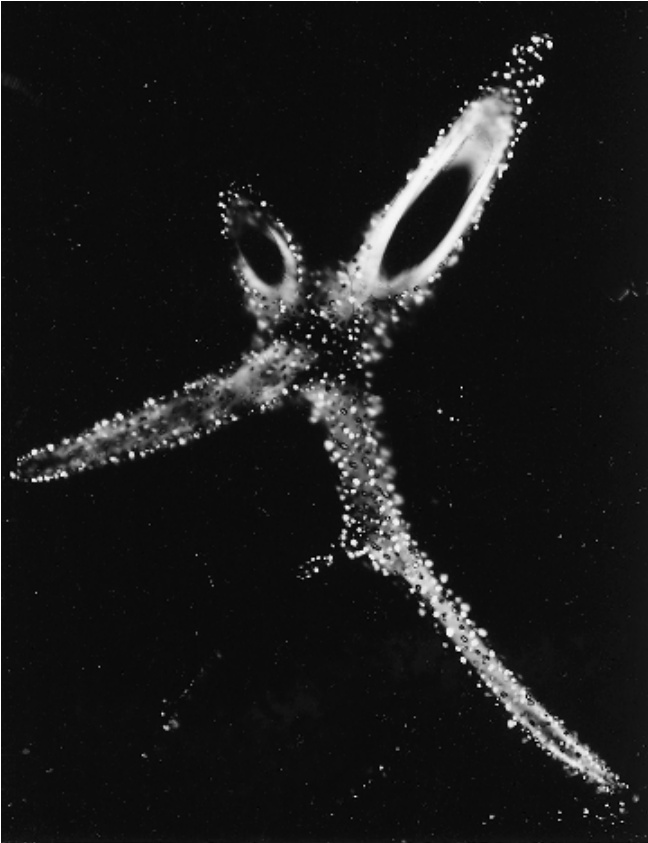
图8.9
在偏振光下观察到的睡莲 (*Nymphaea odorata*) 叶片中的分枝石细胞。该石细胞壁中嵌入了许多小角状晶体。$(\times230.)$
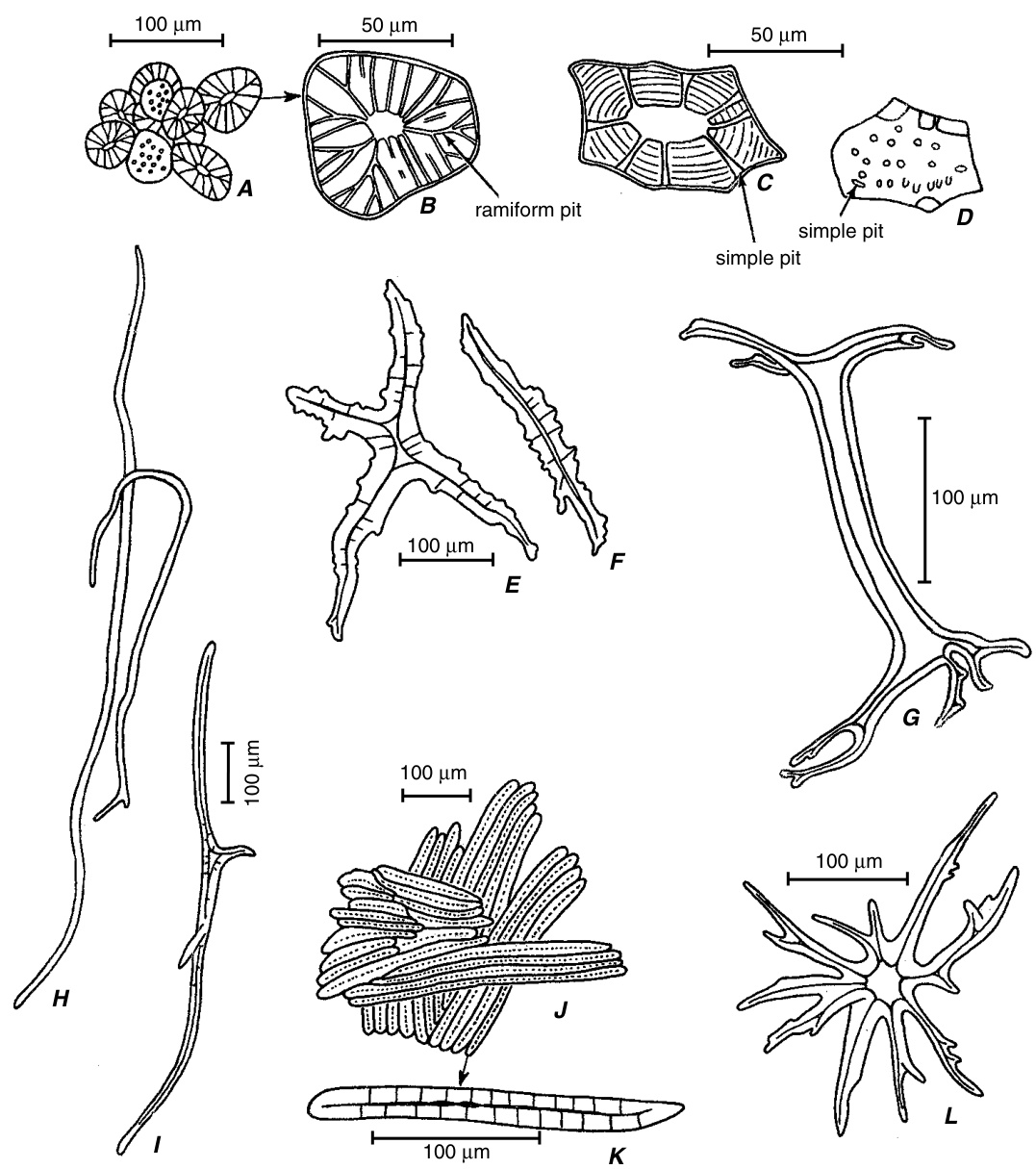
图8.10
石细胞 (Sclereids)
A, B, 梨 (*Pyrus*) 果肉中的石细胞 (stone cells)。C, D, 蜡花 (*Hoya*) 茎皮层中的石细胞,分别为横切面 (C) 和表面 (D) 视图。E, F, 山茶 (*Camellia*) 叶柄中的石细胞。G, 具有分枝末端的柱状石细胞,来自 *Hakea* 的栅栏叶肉。H, I, 橄榄 (*Olea*) 叶肉中的丝状石细胞 (filiform sclereids)。J, K, 苹果 (*Malus*) 果实内果皮中的石细胞。L, *Trochodendron* 茎皮层中的星状石细胞 (astrosclereid)。(引自 Esau, 1977)
石细胞可以延伸到细胞间隙中,丝状石细胞 (filiform sclereids) 是长而细的细胞,类似于纤维(图 8.10H, I;另见图 8.13)。星状石细胞 (astrosclereids) 和毛状石细胞 (trichosclereids) 在结构上相似,而毛状石细胞与丝状石细胞之间存在过渡形态。骨状石细胞 (osteosclereids) 的末端可能分枝(如图 8.10G 所示),因此它们类似于毛状石细胞。这种分类相当随意,并未涵盖所有已知的石细胞形态(Bailey, 1961; Rao, T. A., 1991)。此外,这种分类的实用性有限,因为正如所指出的,各种形态之间经常存在过渡。
石细胞像纤维一样广泛分布于植物体中
石细胞在其他细胞中的分布对于植物细胞分化问题特别有意义。它们可能出现在较为广泛的层或簇中,但经常以孤立的形式出现在其他类型的细胞中,这些细胞可能因其厚壁和通常奇特的形状而与石细胞明显不同。作为孤立的细胞,它们被归类为异形细胞 (idioblasts)(Foster, 1956)。异形细胞的分化提出了许多尚未解决的问题,涉及植物组织模式发育中的因果关系。
石细胞出现在表皮 (epidermis)、基本组织 (ground tissue) 和维管组织 (vascular tissues) 中。在以下段落中,石细胞将通过植物体不同部位的示例进行描述,不包括出现在维管组织中的石细胞。
茎中的石细胞
在 *Hoya carnosa* 茎的维管区域外围,存在一个连续的石细胞柱,而在 *Hoya* 和 *Podocarpus* 茎的髓部中存在石细胞群。这些石细胞具有中等厚度的壁和许多纹孔(图 8.10C, D)。在形状和大小上,它们类似于邻近的薄壁细胞 (parenchyma cells)。这种相似性通常被认为是这些石细胞起源于硬化薄壁细胞的证据。然而,它们的硬化程度已经很高,因此可以将它们归类为石细胞而不是薄壁细胞。这种简单的石细胞类型是石细胞 (stone cell) 或短石细胞 (brachysclereid) 的典型代表。在 *Trochodendron* 茎的皮层中发现了高度分枝的星状石细胞(图 8.10L)。在花旗松 (*Pseudotsuga taxifolia*) 的皮层中,存在分枝较少的石细胞。
叶片中的石细胞 (Sclereids)
叶片是石细胞形态多样性特别丰富的来源,尽管它们在单子叶植物 (monocots) 的叶片中较为罕见 (Rao, T. A., and Das, 1979)。在叶肉 (mesophyll) 中,石细胞主要有两种分布模式:一种是末端分布,石细胞仅局限于小脉的末端(图 8.11;*Arthrocnemum*、*Boronia*、*Hakea*、*Mouriria*);另一种是弥散分布,石细胞单独或成组分散在整个组织中,与脉末端没有任何空间关系(*Olea*、*Osmanthus*、*Pseudotsuga*、*Trochodendron*)(Foster, 1956; Rao, T. A., 1991)。在一些保护性的叶结构中,例如大蒜(*Allium sativum*)的鳞片,石细胞构成了整个表皮 (epidermis) 的一部分(图 8.12)。
具有明确分支或仅具有小刺(短、圆锥形或不规则突起)的石细胞出现在山茶(*Camellia*)叶柄的基本组织 (ground tissue) 中(图 8.10E, F)以及*Trochodendron*叶片的叶肉中。*Osmanthus*和*Hakea*的叶肉中含有柱状石细胞,两端分叉,即骨状石细胞 (osteosclereids)(图 8.10G)。在*Hakea suaveolens*的叶片中,末端石细胞显然具有支撑和水分传导的双重功能。当将一段离体的枝条通过切口端吸收荧光染料硫酸小檗碱 (berberine sulfate) 溶液时,叶片中观察到的荧光模式表明,小檗碱溶液从脉末端扩大的管胞 (tracheoids) 通过石细胞的弱木质化壁移动到上表皮细胞的壁(HeideJørgensen, 1990)。从表皮,溶液向下移动到栅栏组织 (palisade parenchyma) 的壁中。
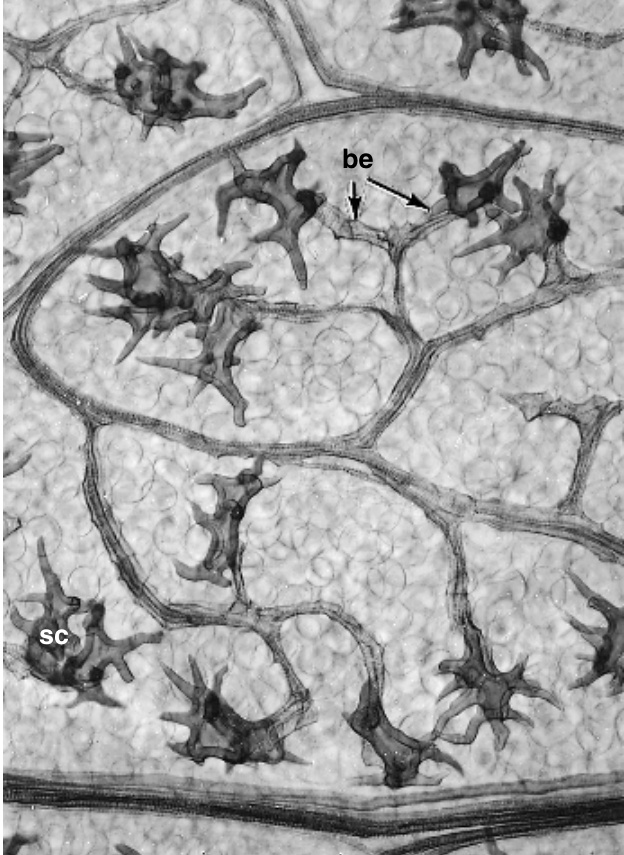
图 8.11
透明的*Boronia*叶片。石细胞 (sc) 位于束末端 (be)。$(\times93$。来自 Foster, 1955。)
显然,石细胞作为脉的延伸部分,将水分传导到表皮,并为栅栏细胞提供快速的水分供应。*Monstera deliciosa*、*Nymphaea*(睡莲)和*Nuphar*(黄睡莲)具有典型的毛状石细胞 (trichosclereids),其分支延伸到大的细胞间隙或气室中,这是这些物种叶片的特征。小的棱柱状石细胞嵌入*Nymphaea*石细胞的壁中(图 8.9;Kuo-Huang, 1992)。分枝的石细胞可能出现在针叶树如*Pseudotsuga taxifolia*的叶片中。
橄榄(*Olea europaea*)叶片的丝状石细胞 (filiform sclereids) 起源于栅栏组织和海绵组织 (spongy parenchyma),平均长度为 1 毫米,并以密集的网络或垫状形式渗透到叶肉中(图 8.13)。部分网络由 T 形石细胞组成,其基部从上表皮和栅栏组织延伸到下方的海绵组织中。网络的其余部分由分枝的“多态”石细胞组成,这些石细胞横穿叶肉层,呈现出一种被描述为混乱的模式(Karabourniotis et al., 1994)。研究表明,T 形石细胞能够将光从上表皮传导到海绵组织,表明它们可能具有传导光的功能。
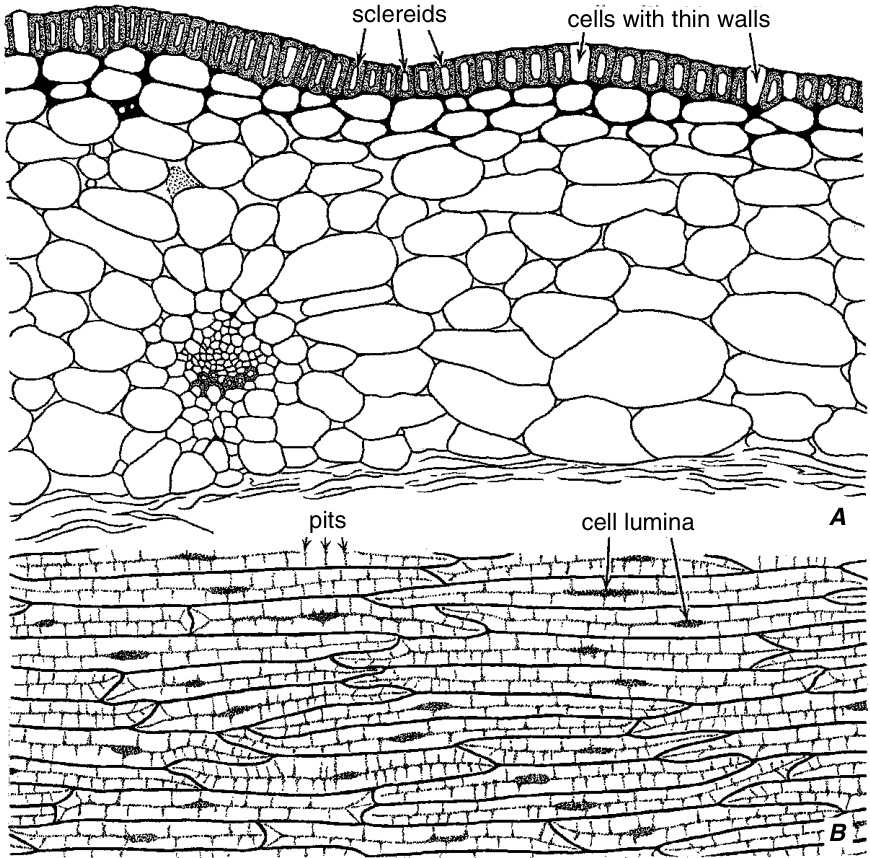
图 8.12
*Allium sativum*(大蒜)保护性鳞片中的表皮石细胞。A,鳞片切片,石细胞壁用点状表示。B,鳞片表面观,显示相互重叠的坚实表皮石细胞层。(两者,$\times99$。来自Esau, 1977;根据Mann, 1952。Hilgardia 21 (8), 195–251。$\copyright$ 1952 Regents, University of California。)
类似于合成光纤,可能有助于改善这种厚实且紧密的硬叶叶片中叶肉内的光微环境(Karabourniotis等,1994)。常绿硬叶植物*Phillyrea latifolia*叶片中的骨状石细胞显然在叶肉内起着类似的光导作用(Karabourniotis, 1998)。
**果实中的石细胞** 石细胞出现在果实的各个部位。在梨(*Pyrus*)和榅桲(*Cydonia*)中,单个或成簇的石细胞(短石细胞)散布在果实的肉质部分(图8.8和8.10A, B)。石细胞簇赋予梨其特有的砂质感。在簇形成过程中,细胞分裂围绕早期形成的一些石细胞同心发生(Staritsky, 1970)。成熟石细胞簇周围的薄壁细胞辐射模式与这种发育方式有关。梨和榅桲的石细胞通常显示出由于壁增厚过程中一个或多个腔融合而形成的分枝状纹孔。
苹果(*Malus*)提供了果实中石细胞的另一个例子。包裹种子的软骨状内果皮由斜向排列的伸长石细胞层组成(图8.10J, K)。石细胞也构成了坚果状果实的硬壳和核果(核果类)的坚硬内果皮。在广泛分布于南部非洲稀树草原地区的树脂树*Ozoroa paniculosa*(漆树科)的核果中,内果皮由连续的大石细胞、骨状石细胞、短石细胞和含晶石细胞层组成(Von Teichman和Van Wyk, 1993)。
**种子中的石细胞** 种子成熟过程中种皮的硬化通常是由于表皮及其下方一层或多层细胞中次生壁的发育所致。豆科种子提供了这种硬化的良好例子。在豆(*Phaseolus*)、豌豆(*Pisum*)和大豆(*Glycine*)的种子中,柱状大石细胞构成表皮,而棱柱状石细胞或骨状石细胞出现在表皮下方(图8.14)。在豌豆种皮发育过程中,大石细胞的前体细胞经历广泛的垂周分裂,随后细胞伸长,然后形成次生壁(Harris, 1983)。前体
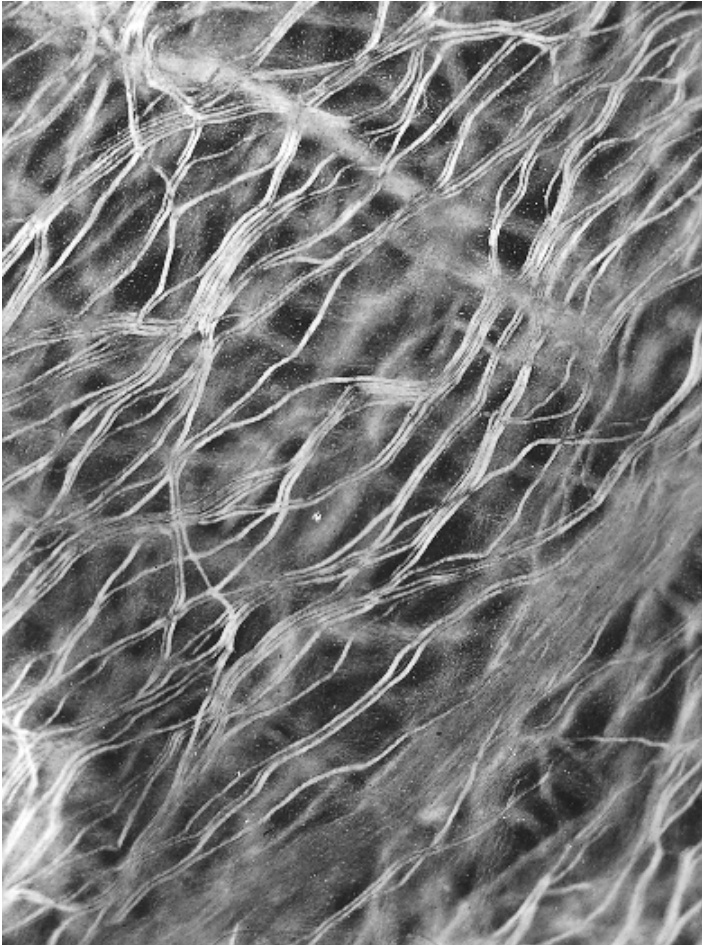
图8.13
*Olea*(橄榄)的丝状石细胞,在偏振光下呈双折射,如透明叶片中所见。$(\times57.)$
骨状石细胞(osteosclereids)既进行垂周分裂(anticlinal division)又进行平周分裂(periclinal division),但在大石细胞(macrosclereids)沉积厚次生壁之前,它们不会开始分化成骨状细胞(Harris, W. M., 1984)。次生壁的形成首先发生在发育中的骨状石细胞的中部,阻止了该部位的进一步扩展,而细胞末端薄的原生壁则继续扩展。显然,豌豆种皮中的大石细胞和骨状石细胞都没有木质化(lignified)。它们的壁上的纹孔(pitting)不明显。椰子(Cocos nucifera)的种皮含有具有大量分枝状纹孔(ramiform pits)的石细胞(sclereids)。
❙ 纤维和石细胞的起源与发育
正如它们在植物体中的广泛分布所表明的那样,纤维起源于各种分生组织(meristems):木质部和韧皮部的纤维来自原形成层(procambium)和维管形成层(vascular cambium);除韧皮部纤维外的大多数木质部外纤维(extraxylary fibers)来自基本分生组织(ground meristem);而一些禾本科(Poaceae)和莎草科(Cyperaceae)植物的纤维来自原表皮(protoderm)。石细胞也起源于不同的分生组织:维管组织的石细胞来自原形成层和形成层细胞的衍生物;嵌入木栓组织(cork tissue)中的石细胞(stone cells)来自木栓形成层(cork cambium)或木栓形成层(phellogen);种皮的大石细胞来自原表皮;还有许多其他石细胞来自基本分生组织。
通常较长的纤维以及分枝和长石细胞的发育涉及显著的细胞间调整。特别令人感兴趣的是
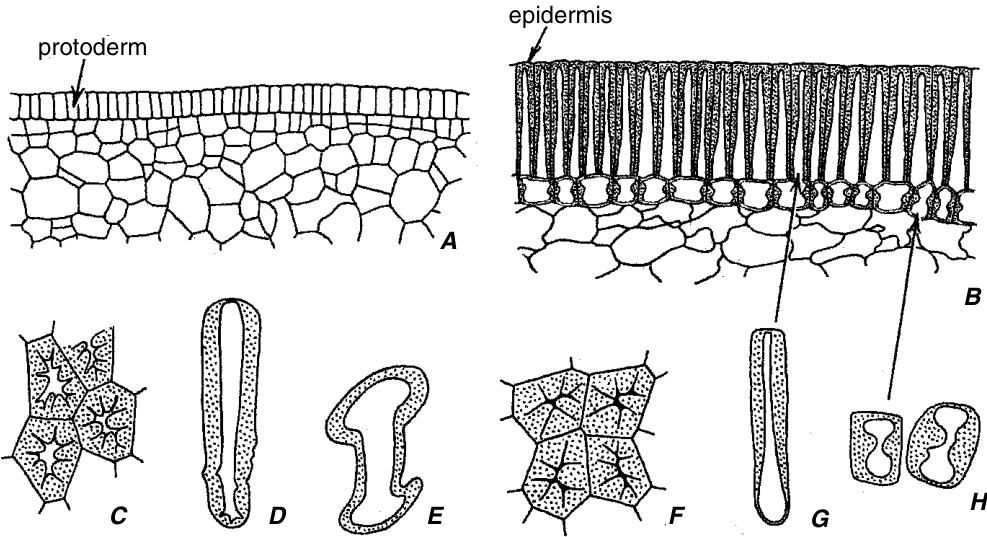
图8.14
豆科植物种皮的石细胞。A、B,来自两个发育阶段种子横切面的菜豆(Phaseolus)种皮的外部。B,表皮,一层实心的大石细胞。表皮下石细胞的大部分壁加厚集中在垂周壁(anticlinal walls)上。C-E,豌豆(Pisum)的石细胞;F-H,菜豆的石细胞。C、F,从表面看到的表皮石细胞群。D、G,表皮石细胞;E、H,表皮下石细胞。(A、B,$\times240$;C、F,$\times595$;D、E、G、H,$\times300$。)
初生植物体中纤维达到的巨大长度。初生木质部外纤维在器官伸长之前就已经开始发育,它们可以通过与生长器官中的其他组织同步伸长而达到相当的长度。在这个生长期间,相邻细胞的壁被调整,使得壁之间不会发生分离。这种生长方法被称为协调生长(coordinated growth)(第5章)。年轻的纤维原基(fiber primordium)在不改变细胞接触的情况下增加长度,无论相邻的薄壁组织细胞(parenchymatous cells)是否在分裂。初生木质部外纤维与生长器官中的其他组织同步生长,导致较长的器官中通常发现较长的纤维(Aloni and Gad, 1982)。
一些初生木质部外纤维(primary extraxylary fibers)达到的极大长度并不仅仅是协调生长(coordinated growth)的结果。稍后,纤维原基(fiber primordium)通过侵入生长(intrusive growth)获得额外的长度(第5章)。在侵入生长过程中,伸长的细胞在其顶端(apical intrusive growth)生长,通常在两端之间穿过其他细胞的细胞壁。在伸长过程中,由于重复的核分裂而没有形成新的细胞壁,纤维可能变成多核的。这种情况在初生韧皮部纤维(primary phloem fibers)中尤为明显。当纤维仍然存活时,其细胞质表现出旋转流动(rotational streaming),这种现象显然与细胞间物质运输(intercellular transport of materials)有关(Worley, 1968)。
顶端侵入生长(apical intrusive growth)已在亚麻纤维(flax fibers)中进行了详细研究(Schoch-Bodmer and Huber, 1951)。通过测量年轻和老化的节间(internodes)以及这些节间中包含的纤维,作者计算出仅通过协调生长,纤维就可以达到1到$1.8\mathrm{cm}$的长度。实际上,他们发现纤维的长度在0.8到$7.5\mathrm{cm}$之间。因此,超过$1.8\mathrm{cm$的长度必须是通过顶端侵入生长实现的。从活体茎中解剖出的年轻纤维的生长尖端显示出薄壁,含有密集的细胞质(图8.15A-C)和叶绿体,并且不可质壁分离(plasmolyzable)。当尖端停止生长时,它们被次生壁物质(secondary wall material)填满(图8.15D-F)。
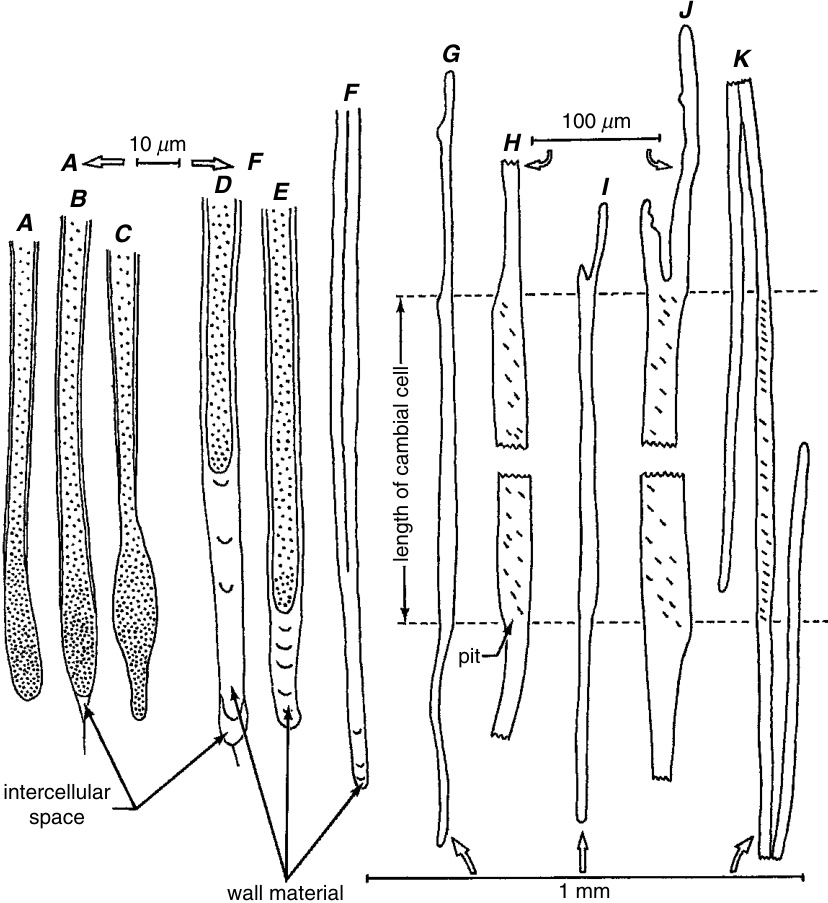
图8.15
茎中纤维的顶端侵入生长。A-F,来自亚麻(flax, *Linum perenne*)的韧皮部,$\mathbf{G}\mathbf{-}\mathbf{J}$,来自木质部,K,来自Sparmannia (Tiliaceae)的韧皮部。H, J,分别是$\mathbf{G}$和I的局部放大图。A–C,侵入生长的纤维尖端(下方)具有薄壁和密集的细胞质。D-F,纤维尖端在生长完成后被壁物质填满。G-K,纤维从形成层的原始位置(虚线之间)向两个方向延伸。纹孔(pits)仅出现在原始形成层部分。韧皮部纤维$\mathbf{\eta}(\mathbf{K})$明显长于木质部纤维$(\mathbf G,\mathbf I)$。(来自Esau, 1977; A–F,改编自Schoch-Bodmer and Huber, 1951; G–K,改编自Schoch-Bodmer, 1960。)
与同时经历协调生长和侵入生长的初生纤维不同,次生纤维(secondary fibers)起源于已经停止伸长的器官部分,它们只能通过侵入生长增加长度(Wenham and Cusick, 1975)。次生韧皮部纤维(secondary phloem fibers)和次生木质部纤维( fibers)的长度取决于形成层初始细胞(cambial initials)的长度以及源自这些初始细胞的纤维原基中侵入生长的量。如果存在初生和次生韧皮部纤维,前者明显更长。例如,在大麻(*Cannabis*, hemp)中,初生韧皮部纤维的平均长度约为$13\mathrm{mm}$,次生韧皮部纤维约为$_{2\bf m m}$(Kundu, 1942)。
在茎和根的横切面中,可以通过在纤维原基较宽且不伸长的部分中出现的小细胞——生长尖端的横切面——来识别侵入生长(intrusive growth)。*Sparmannia*(椴树科Tiliaceae)的次生维管组织为这一现象提供了生动的图示(图8.16;Schoch-Bodmer和Huber,1946)。在形成层中看到的细胞有序的径向排列被韧皮部轴向系统中的镶嵌模式所取代。在给定的横切面中,通过侵入伸长,每个纤维原基的较宽中部部分(在图8.16A中用斜线表示)增加了三到五个生长中的纤维尖端。木质部轴向系统中的径向排列受到的影响较小,因为木质部纤维的伸长不如韧皮部纤维(图8.15G-K)。如径向纵切面所示,纤维的双极顶端生长使这些细胞延伸到它们起始的形成层细胞的水平之上和之下(图8.16B)。
当在侵入生长过程中,纤维尖端被其他细胞阻挡时,尖端会弯曲或分叉(图8.15I,J)。因此,纤维(和石细胞)中的弯曲和分叉末端是侵入生长的额外证据。侵入生长的部分通常不会在其次生壁中发育纹孔,因此可以作为顶端伸长量的衡量标准(图8.15G-K;Schoch-Bodmer,1960)。
纤维和一些石细胞的长期顶端侵入生长使得这些细胞壁的次生加厚成为一个相当复杂的现象。如前所述,次生壁通常在初生壁停止扩展后在其上发育(第4章)。在侵入生长的纤维和石细胞中,细胞的较老部分停止生长,而顶端继续伸长。细胞的较老部分(通常是中部部分)在尖端生长完成之前开始形成次生壁层。从细胞的中部部分开始,次生加厚向尖端推进,并在尖端停止生长后完成。
在苎麻(*Boehmeria nivea*)快速生长的茎中,较长的初生韧皮部纤维(40-55厘米)在其扩大的后期阶段延伸通过已经停止伸长的节间(Aldaba,1927)。这些纤维的长度增加(最初约为20微米)约为2,500,000%,这一渐进过程显然需要数月才能完成。次生壁的形成从细胞的基部开始,并继续向上向伸长的尖端推进,形成一系列同心层。当纤维完成其伸长时,内管状壁层继续向上生长,在连续的间隔中到达细胞的尖端。
石细胞(sclereids)要么直接起源于早期分化为石细胞的细胞,要么通过普通薄壁细胞(parenchyma cells)的晚期硬化(sclerosis)形成。在*Mouriria huberi*叶片中,末端石细胞的原基(primordia)或起始细胞(initials)在叶肉(mesophyll)中出现细胞间隙之前和小叶脉完全处于原形成层(procambial)阶段时就已经明显可见(Foster, 1947)。它们起源于与原形成层束相同的细胞层。*Monstera*气生根的毛状石细胞(trichosclereids)由皮层细胞(cortical cells)中通过不等、极化的分裂早期分离出来的细胞发育而来(Bloch, 1946)。相比之下,*Osmanthus*叶片的石细胞在叶片长到5-6厘米时才首次显现,此时叶片已接近其全长的一半(图8.17; Griffith 1968)。在这个阶段,主要叶脉的木质部和韧皮部的大部分已经成熟,与叶脉相关的纤维可以区分,但没有明显的加厚。次生韧皮部(secondary phloem)中薄壁细胞的硬化通常发生在非传导韧皮部(nonconducting phloem)中,即不再参与长距离运输的韧皮部部分(第14章; Esau, 1969; Nanko, 1979)。例如,在栎属(*Quercus*)中,石细胞在几年生的韧皮部中分化,首先出现在射线(rays)中,随后出现在扩张组织(dilatation tissue)(参与树皮周长增加的组织)中,形成大小不一的簇。在一些木本被子植物的非传导韧皮部中,纤维状石细胞(fiber-sclereids)由纺锤形薄壁细胞(fusiform parenchyma cells)或薄壁束的单个细胞发育而来。*Pyrus communis*(Evert, 1961)和*Pyrus malus*(*Malus domestica*)(Evert, 1963)次生韧皮部中的纤维状石细胞起源于从维管形成层(vascular cambium)衍生出来的薄壁束,在第二个生长季形成。此时,束中的单个细胞经历强烈的侵入生长(intrusive growth),然后形成次生壁(secondary walls)。在*Pereskia*(仙人掌科Cactaceae)的非传导次生韧皮部中,一些具有多层次生壁的石细胞被隔膜(septa)分隔成多个小室,每个小室都分化成一个具有多层次生壁的石细胞(图8.6B; Bailey, 1961)。这种石细胞让人联想到竹子中的分隔纤维(septate fibers)(Parameswaran and Liese, 1977)。
石细胞原基在外观上可能与邻近的薄壁细胞没有区别。通常,异形石细胞(idioblastic sclereids)的原基可以通过其大而明显的细胞核与邻近细胞区分开来,并且通常
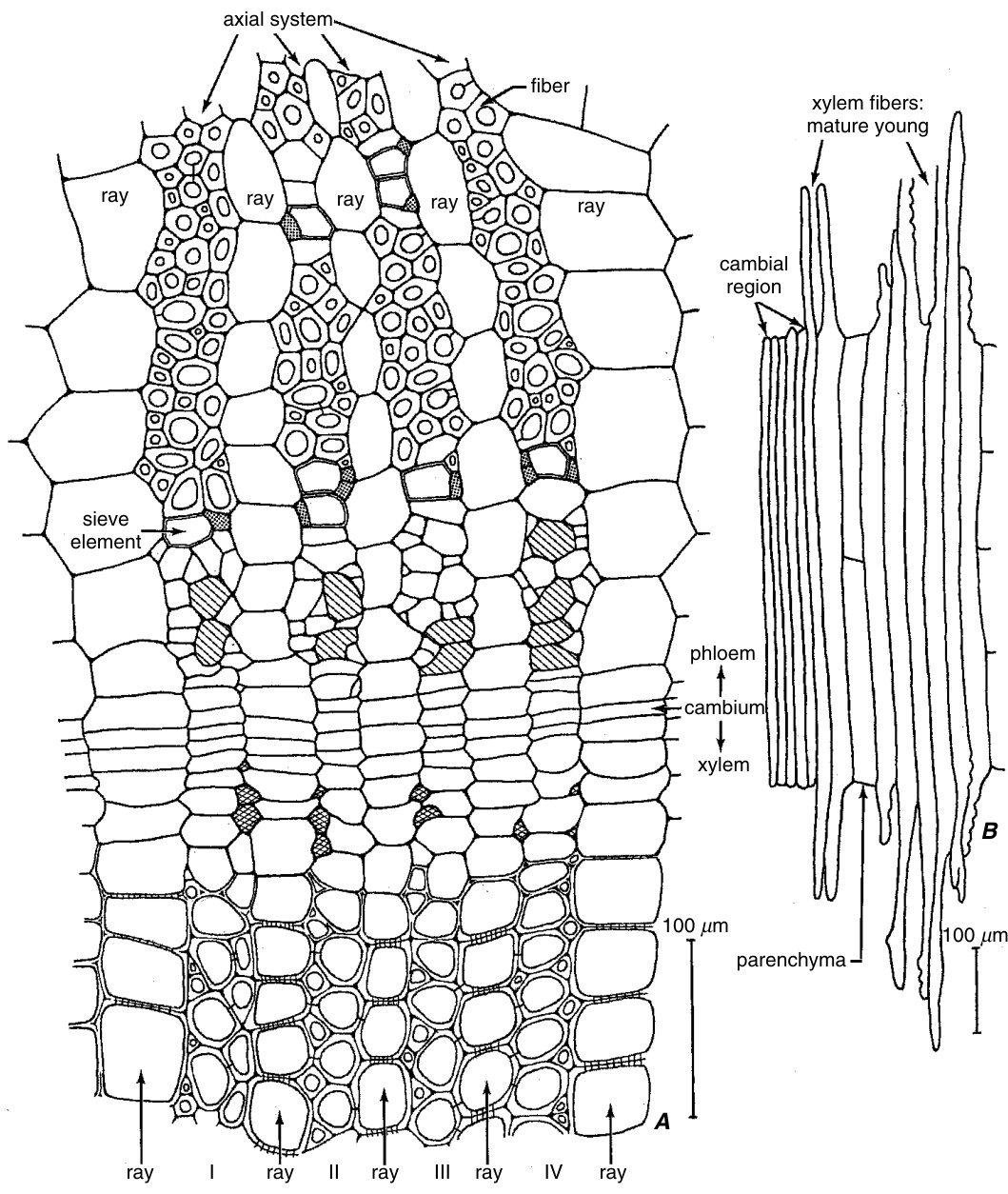
图8.16
图8.17
*Sparmannia*(椴树科)次生韧皮部和木质部中纤维的发育,如茎的横切面(A)和径向纵切面(B)所示。在A中,I-IV是轴向(纵向)系统中的细胞列。这些细胞列与射线交替排列。靠近形成层的韧皮部和木质部尚未成熟。成熟的木质部具有次生壁。在成熟的韧皮部中,点状的伴细胞用于识别筛管分子;次生壁标志着纤维。带有对角线的细胞是幼嫩纤维细胞的中间部分。它们伴随着小细胞,这些小细胞大多是侵入性生长的纤维尖端。木质部一侧的交叉阴影细胞是木质部纤维的侵入性生长尖端。B中,木质部纤维在形成层区域的两侧延伸。(来自Esau, 1977;改编自Schoch-Bodmer和Huber, 1946。)
致密的细胞质(Boyd等, 1982; Heide-Jørgensen, 1990)。
❙ 控制纤维和石细胞发育的因素
控制纤维和石细胞发育的因素已成为众多实验研究的对象。Sachs(1972)和Aloni(1976, 1978)的研究表明,纤维束的发育依赖于幼叶原基产生的刺激。在*Pisum sativum*中,早期移除原基会阻止纤维分化;实验性地改变叶片的位置也会改变纤维束的位置(Sachs, 1972)。*Pisum*研究的结果在*Coleus*中得到了证实,其中还表明初生韧皮部纤维的诱导是一个
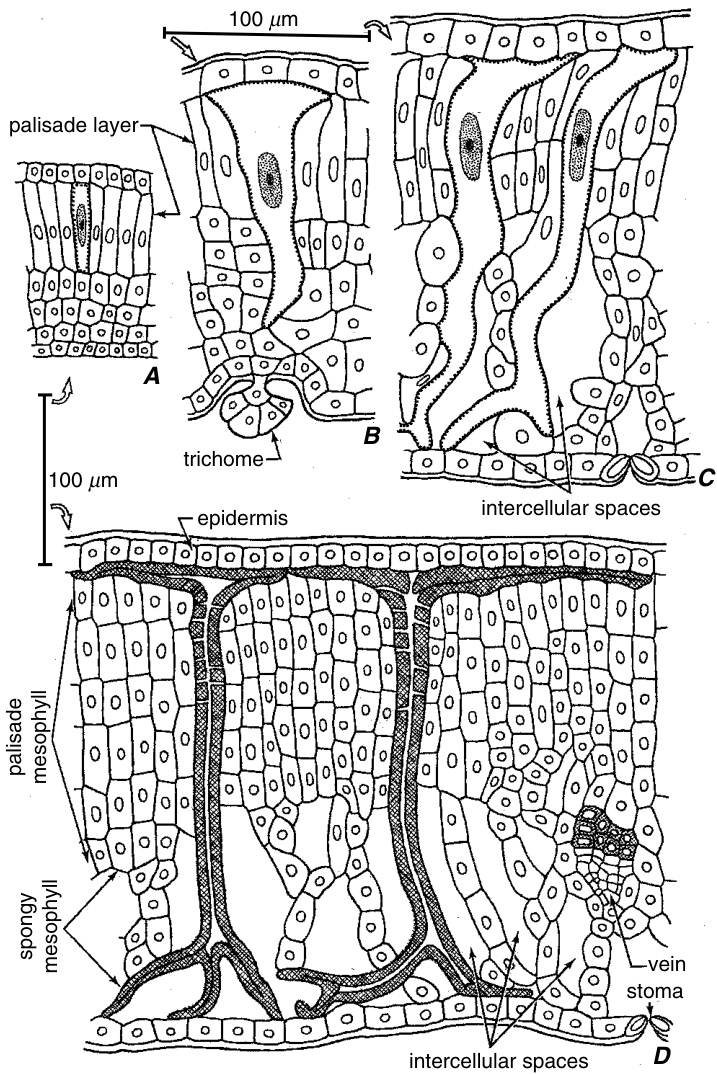
图8.17
*Osmanthus fragrans*(木犀科)叶片中石细胞的发育。A–C,分化的石细胞,由大核和沿壁的点表示;D,成熟的石细胞,由交叉阴影的次生壁表示。在所有图中,叶肉和表皮细胞用圆圈或椭圆形标记。栅栏组织特有的狭窄细胞间隙已被省略。A,未来的石细胞象征性地表示;它尚未从其他栅栏细胞中分化出来(来自23毫米长的原基的绘图)。B,幼嫩的石细胞已延伸至栅栏层之外(叶片约5.5厘米长)。C,两个幼嫩的石细胞通过海绵状叶肉生长到达下表皮(叶片10-12厘米长)。石细胞的扩大涉及协调生长和顶端侵入性生长。叶片厚度在石细胞启动后翻倍;因此,石细胞的部分生长与栅栏组织同步发生。然而,分支和与海绵状叶肉接触的壁部分的生长涉及顶端侵入性生长。这些石细胞中次生壁的沉积是均匀且迅速的,直到叶片达到完全大小时才发生。D,成熟的石细胞有一些分支与表皮平行延伸,另一些则伸入细胞间隙。次生壁中的纹孔位于石细胞在生长过程中不与相邻细胞断开连接的部分。(来自Esau, 1977;改编自Griffith, 1968。)
严格极性的,从叶片向根部方向向下(Aloni, 1976, 1978)。此外,研究表明,叶片对*Coleus*初生韧皮部纤维分化的影响可以通过外源施用生长素(auxin, IAA)与赤霉素(gibberellin, ${\bf G A}_{3}$)的组合来替代(Aloni, 1979)。单独施用IAA仅诱导少量纤维的分化;单独施用$\mathbf{GA_{3}}$对纤维分化没有影响。当两种激素以不同组合施用时,高浓度的IAA刺激了厚壁纤维的快速分化,而高浓度的$\mathbf{GA}_{3}$则导致长而薄壁的纤维形成。这两种激素也是*Populus*次生木质部纤维发育所必需的(Digby and Wareing, 1966)。源自根部的细胞分裂素(cytokinin)似乎也在次生木质部纤维的发育中起到调节作用(Aloni, 1982; Saks et al., 1984)。
已发现几种影响花序茎束间区域纤维发育的*Arabidopsis*突变体(Turner and Somerville, 1997; Zhong et al., 1997; Turner and Hall, 2000; Burk et al., 2001)。特别引人注目的是*interfascicular fiberless1 (ifl1)*突变体,其中束间(木质部外)纤维未能发育(Zhong et al., 1997),这表明*INTERFASCICULAR FIBERLESS1 (IFL1)*基因(被发现与*REVOLUTA (REV)*基因相同,Ratcliffe et al., 2000)对于束间纤维的正常分化至关重要。它也是次生木质部正常发育所必需的。*IFL1/REV*基因在纤维分化的束间区域以及维管区域中表达(Zhong and Ye, 1999)。生长素极性运输的测定显示,*ifl1*突变体中沿花序茎的生长素流动显著减少。此外,生长素运输抑制剂改变了野生型植物花序茎中束间纤维的正常分化(Zhong and Ye, 2001)。*ifl1*突变体中生长素极性流动减少与纤维分化改变之间的明显相关性表明,*IFL1/REV*基因可能参与控制沿束间区域的生长素流动。另一项实验研究的结果(Little et al., 2002)清楚地表明,改变生长素供应后,*Arabidopsis*花序茎中束间纤维的壁增厚和木质化需要IAA。
在叶片(*Camellia japonica*,Foard,1959;*Magnolia thamnodes*,*Talauma villosa*,Tucker,1975)中进行切割,这些叶片通常具有边缘石细胞(sclereids),切割后诱导了石细胞沿“新”边缘的分化。当双子叶植物茎的厚壁组织(sclerenchyma)圆柱体因节间一侧被切割而中断时,圆柱体的连续性通过伤口愈伤组织(wound callus)内石细胞的分化得以恢复(Warren Wilson等,1983)。这些实验的结果被解释为石细胞发育的位置控制(positional control)的证据。在叶片中,通常会成为专门进行光合作用的叶肉细胞(mesophyll cells)的细胞,当被带到边缘附近时,被诱导发育成石细胞。在茎中,再生的石细胞的排列往往反映了未受伤茎中原始厚壁组织(主要是或大部分是纤维)圆柱体的结构。对激素因素的研究表明,叶片中的生长素(auxin)水平影响石细胞的发育(Al-Talib和Torrey,1961;Rao, A. N.和Singarayar,1968)。当生长素浓度高时,发育受到抑制,而在低浓度生长素下,细胞壁保持薄且不木质化(lignified)。有趣的是,通过移除正在发育的花序,诱导了拟南芥(*Arabidopsis thaliana*)髓部(pith)中石细胞的分化(Lev-Yadun,1997)。成熟对照植物的髓部没有石细胞。
