第三十章 饮食综合反应 小肠期
学习目标
完成本章学习后,你应能回答以下问题:
- 调节胃排空以匹配小肠消化吸收能力的机制是什么?
- 胰腺外分泌的特征性分泌产物有哪些?它们来源于哪些细胞类型?分泌如何被调节?
- 胆汁的生理作用是什么?
- 三大宏量营养素(碳水化合物、蛋白质和脂质)如何通过小肠被机体同化?
- 调控体液和电解质进出肠腔的机制有哪些?
- 进食状态与空腹状态下肠道运动模式的特征及其产生机制是什么?
小肠是消化道中营养物质同化的关键部位。在此部位,食物与多种分泌物混合以完成消化吸收,其运动功能确保肠内容物(食糜)充分混合并接触吸收表面。小肠具有许多使其高效执行功能的特化结构,其中最显著的特征是黏膜层巨大的表面积。这一特征通过多种方式实现:小肠本质上是盘曲于腹腔内的长管状结构,黏膜层和黏膜下层形成全层皱襞,黏膜层具有指状突起(绒毛),最后每个上皮细胞顶膜表面还具有微绒毛。因此,消化吸收过程发生在一个巨大的表面积之上。
餐后反应的小肠阶段主要特征是控制胃内容物向小肠的输送,以匹配肠道的消化吸收能力。此外,这一阶段还进一步刺激胰液和胆汁分泌,并将这些分泌物排入小肠。因此,该区域的功能受到激素、旁分泌和神经通路反馈机制的高度调控。
- 胃还分泌内因子(intrinsic factor),其参与维生素B12的吸收。
- 胃上皮分泌HCO3-和黏液形成凝胶状黏膜屏障,保护自身免受酸性胃液和蛋白水解性内容物的侵蚀。
- 肠壁平滑肌发生膜电位的周期性变化,称为基本电节律(basic electrical rhythm)或慢波(slow wave)。
- Cajal间质细胞(interstitial cells of Cajal)是肠壁起搏细胞,负责设定慢波频率。
- 胃近端部分发生与储存功能相适应的张力性缓慢变化。
- 胃远端部分发生时相性收缩,其强度可有显著变化。
- 胃排空由迷走-迷走反射(vagovagal reflexes)调节。
调节这些过程的刺激既有机械性也有化学性,包括肠壁扩张以及肠腔内增加的[H+]浓度、高渗透压和营养物质的存在。这些刺激引发一系列变化,代表餐后反应的小肠期:(1)胰液分泌增加,(2)胆囊收缩增强,(3)奥狄氏括约肌松弛,(4)胃排空调节,(5)胃酸分泌抑制,(6)迁移运动复合体(migrating motor complex,MMC)中断。本章的目标是讨论这些变化如何产生,以及它们最终如何导致营养物质的同化。餐后食物通过小肠后发生的小肠功能变化也将被讨论。
小肠期中的胃排空
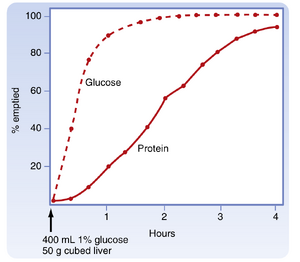
餐后当下,胃内可容纳多达1升的内容物,这些内容物缓慢排入小肠。胃排空速率取决于食物的宏量营养素组成及其所含固体物质的数量。液体排空迅速,但固体物质在经过一个滞后期后才开始排空,这意味着固体餐后会出现一段几乎没有排空发生的时间(图30.1)。
胃排空的调节通过近端胃(胃底和胃体)与远端胃(胃窦和幽门)以及十二指肠运动的改变实现。这些区域的运动功能高度协调。回顾可知,在食道相和胃相中,主要的反射反应是容受性舒张。同时,胃远端(胃窦)的蠕动运动使胃内容物与胃分泌物混合。幽门括约肌基本处于关闭状态。即使它周期性开放,由于近端胃处于松弛状态且胃窦泵( antral pump,即胃窦的收缩)力量较弱,排空量也极少。随后,胃排空的发生依赖于近端胃张力(腔内压)的增加、胃窦收缩力(胃窦泵强度)的增强、幽门开放允许内容物通过,以及同时发生的十二指肠分节运动抑制。液体和半流质食糜沿着压力梯度从胃流向十二指肠。
临床视角
胃肠道(GI)通过激活连接其他信号(如脂肪能量储存与利用)的神经和内分泌通路,在感知和传递摄入营养素信号中发挥重要作用,共同调节能量稳态。来自胃肠道的饱腹信号参与进食的短期调节,例如餐量和进食时长。例如,管腔内容物激活迷走神经传入通路,导致餐量减少。此外,营养素释放的多种胃肠激素也会影响食物摄入。胆囊收缩素(CCK)是一种被充分描述的饱腹激素;它由营养素释放,外源性给药后可减少食物摄入。此类其他胃肠激素包括胰高血糖素样肽-1(GLP-1)和肽YY(PYY)。在瘦型和肥胖人群中,外源性注射PYY均可抑制食物摄入。GLP-1类似物利拉鲁肽已被批准作为人类体重控制药物。
随着食糜进入小肠,其通过神经和激素通路进行反馈调节,根据食糜的化学和物理组成调控胃排空速率。当食糜进入十二指肠时,主要起源于迷走神经的传入神经元会对营养物质、[H+]和食糜的高渗成分产生反应。迷走神经传出通路的反射性激活会减弱胃窦收缩强度、收缩幽门并降低近端胃动力(伴随胃内压下降),从而导致胃排空速率减缓。这一相同通路还负责抑制当营养物质存在于十二指肠腔时胃酸的分泌。
胆囊收缩素(Cholecystokinin, CCK)由十二指肠黏膜的内分泌细胞响应上述营养物质而释放。除了在神经通路中的作用,该激素在生理上对调节胃排空、胆囊收缩、Oddi括约肌(sphincter of Oddi)松弛及胰腺分泌具有重要作用。最新证据表明,CCK既可直接抑制胃排空,也可通过刺激迷走神经传入纤维放电,产生由迷走-迷走反射(vagovagal reflex)介导的间接性胃排空减缓。
那么面对这些抑制通路,胃排空如何得以进行?随着食糜进入小肠深处的空肠,十二指肠内的食糜量逐渐减少;因此,当营养物质对十二指肠感受机制的激活作用减弱时,肠道反馈抑制的强度也逐渐消退。此时,胃近端的内压升高,从而将内容物推入胃窦并导向幽门泵。胃窦的蠕动收缩再次增强,最终导致幽门开放,胃内容物释放进入十二指肠。
临床视角
肥胖的外科治疗(即减重手术)可实现显著且持久的体重减轻,并有助于改善相关健康问题如胰岛素抵抗、高脂血症和高血压。最初的手术方式是空肠回肠旁路术,即切除大部分吸收性小肠,但该手术会导致吸收不良及后续不良后遗症如腹泻。目前已设计出多种改良的肥胖手术方式,包括Roux-en-Y胃旁路术和垂直袖状胃切除术,其中许多可通过腹腔镜完成。这些手术被认为成功的机制在于残留胃囊体积小(因早饱而减少餐量),以及旁路术对胃肠道激素谱的有益影响。最新数据表明,手术对胆汁酸和微生物组的影响可能同时促进体重减轻和代谢获益。
胰岛分泌
人类摄入的大部分营养物质以大分子化学形式存在。然而,这些分子体积过大,无法通过肠道上皮细胞被吸收,因此必须通过化学和酶消化过程分解为更小的组分。胰腺分泌的消化液在数量上是食物酶消化过程中最主要的贡献者。胰腺还提供对正常消化功能至关重要的其他产物,包括调控其他胰腺产物功能或分泌(或两者)的物质,以及水和碳酸氢根离子。后者参与中和胃酸,使小肠腔的pH接近7.0。这一过程至关重要,因为高酸度会使胰腺酶失活,同时胃酸的中和可降低胃酸与胃蛋白酶共同作用损伤小肠黏膜的可能性。尽管胆管小管和十二指肠上皮细胞也参与其中,但胰腺是提供中和胃酸所需碳酸氢根离子的最大来源。
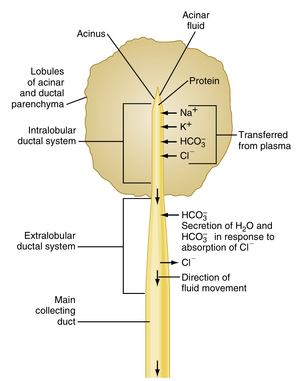
与唾液腺类似,胰腺的结构由导管和腺泡(acini)组成。胰腺腺泡细胞(acinar cells)排列在分支导管系统的盲端,这些导管最终汇入主胰管,并在Oddi括约肌(sphincter of Oddi)的调控下排入小肠。与唾液腺的共同点还在于,腺泡首先产生初级分泌液(译者自拟译名,primary secretion),随后在流经胰管时发生成分改变。总体而言,腺泡细胞提供的胰液有机成分来自初级分泌液,其离子组成与血浆相似;而导管在重吸收氯离子(Cl⁻)的同时稀释并碱化胰液(图30.2)。成人每日分泌约1.5升胰液,其主要成分列于表30.1。该表也概括了胰腺分泌产物的功能。胰腺产生的许多消化酶(尤其是蛋白水解酶)以无活性的前体形式存在。以无活性形式储存这些酶,对防止胰腺自我消化至关重要。
胰腺腺泡细胞的分泌产物
- 蛋白酶前体
- 胰蛋白酶原
- 糜蛋白酶原
- 弹性蛋白酶原
- 羧肽酶A原
- 羧肽酶B原
- 淀粉消化酶
- 淀粉酶
- 脂质消化酶或前体
- 脂肪酶
- 非特异性酯酶
- 磷脂酶A₂原
- 核酸酶
- 脱氧核糖核酸酶
- 核糖核酸酶
- 调节因子
- 辅脂酶Procolipase
- 胰蛋白酶抑制剂
- 监测肽(Monitor peptide)
细胞水平
胰腺炎的发生源于胰腺腺泡细胞分泌的酶类在抵达小肠腔相应作用位点前被蛋白水解激活。事实上,胰液中含有多种胰蛋白酶抑制剂以降低过早激活的风险,因为胰蛋白酶正是胰液中其他酶原的激活剂。第二层防护机制在于胰蛋白酶可被其他胰蛋白酶分子降解。尽管存在这些防御体系,部分人群仍易患遗传性胰腺炎——该病症可在无已知诱发因素时自发产生。这类患者中,某些个体的胰蛋白酶存在基因突变,使其对其他胰蛋白酶分子的降解作用产生抵抗;另一些则存在胰蛋白酶抑制剂突变,导致抑制剂失活。无论何种情况,若其他防御机制被突破致使胰蛋白酶过早激活,将引发酶激活的恶性循环,胰腺炎随即发作。
导管分泌的特征与调控
本节将探讨胰腺导管细胞如何在餐后时期(postprandial period)调控胰液(pancreatic juice)的流量与成分。胰腺导管可视为一种pH调节系统的效应器分支,其功能是响应小肠腔内的酸性环境,分泌适量的碳酸氢盐(bicarbonate)以将pH恢复至中性(图30.3)。这一调节功能还需具备感知管腔pH的机制,并将此信息传递至胰腺以及其他能分泌碳酸氢盐的上皮组织(如胆管小管和十二指肠上皮本身)。
pH感知机制由位于小肠上皮内的特化内分泌细胞——S细胞(S cells)实现。当管腔pH降至约4.5以下时,S细胞会因[H⁺]升高而被激活,释放促胰液素(secretin)。这一调节环路(regulatory loop)的组成部分构成一个自我限制系统:随着促胰液素引发碳酸氢盐分泌,小肠管腔内的pH将升高,从而终止S细胞释放促胰液素的信号。
• 图30.3 促胰液素与HCO₃⁻分泌参与经典的负反馈环路(negative-feedback loop),响应十二指肠管腔pH下降。
当胰腺腺泡细胞(pancreatic acinar cells)分泌的酶在抵达小肠管腔的作用位点前被蛋白水解激活时,可能引发胰腺炎(pancreatitis)。实际上,胰液中含有多种胰蛋白酶抑制剂(trypsin inhibitors),以降低过早激活的风险——因为胰蛋白酶(trypsin)是胰液中其他酶原(pro-forms of enzymes)的激活因子。第二层保护机制在于胰蛋白酶可被其他胰蛋白酶分子降解。尽管如此,某些个体仍易患遗传性胰腺炎(hereditary pancreatitis),该病可在无已知风险因素的情况下自发发生。部分患者的胰蛋白酶存在突变,使其对其他胰蛋白酶分子的降解产生抗性;另一些患者的胰蛋白酶抑制剂发生突变,导致抑制剂失活。无论何种情况,若其他防御机制被突破且胰蛋白酶过早激活,将引发酶激活的恶性循环(vicious cycle),导致胰腺炎发作。
在细胞水平,促胰液素(secretin)刺激上皮细胞将碳酸氢盐分泌至小管腔,水则通过细胞旁途径(paracellular route)随之进入以维持渗透平衡。促胰液素通过增加小管细胞内的cAMP水平,从而打开囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator, CFTR)Cl⁻通道(图30.4),并引起Cl⁻外流进入导管腔。这一过程继而驱动邻近逆向转运体的活性,该转运体将氯离子与碳酸氢盐进行交换。CFTR对碳酸氢盐也具有一定通透性。因此,碳酸氢盐分泌过程依赖于CFTR,这解释了囊性纤维化(CFTR突变所致)疾病中胰腺功能缺陷的机制。
该分泌过程所需的碳酸氢盐来源于两个途径。部分通过基底侧膜的NBC-1同向转运体(钠-碳酸氢盐协同转运蛋白1型)摄取。需注意的是,胃酸分泌过程会导致循环中碳酸氢根离子的增加,这些离子可作为胰腺分泌碳酸氢盐的来源。此外,碳酸氢盐也可通过碳酸酐酶(carbonic anhydrase)的活性在细胞内生成。最终效应是将HCO₃⁻转运至管腔,从而提高胰液的pH值和分泌量。
• 图30.4 胰腺导管细胞的离子转运途径。CA,碳酸酐酶;CFTR,囊性纤维化跨膜传导调节因子;NBC-1,钠/碳酸氢盐协同转运蛋白1型;NHE-1,钠-氢逆向转运蛋白1型。
腺泡分泌的特性与调控
与以促胰液素为最重要生理激动剂的胰腺小管不同,缩胆囊素(CCK)在腺泡细胞水平发挥主导作用。因此,理解进餐反应的小肠阶段中CCK释放的调控机制至关重要。
临床相关
囊性纤维化(Cystic Fibrosis, CF)
囊性纤维化(Cystic Fibrosis, CF)是一种遗传性疾病,影响包括肺、肠道、胆道系统和胰腺在内的多种上皮器官功能。过去,由于严重呼吸道感染,该病在青春期几乎普遍致命。但通过改进抗生素、促进肺部黏液清除的药物、纠正胰腺功能不全和营养不良,以及近期FDA批准的针对突变型CFTR的药物(如Kalydeco和Orkambi),患者生存期已可延长至50岁甚至更久。CF由CFTR基因突变引起,导致管腔内容物水合与碱化能力受损。具体到胃肠系统,可引发肠梗阻、十二指肠黏膜损伤、肝胆系统损伤及胰腺损伤。多数CF患者外分泌胰腺功能异常,需补充消化酶以维持正常营养消化。其他携带较温和突变的患者可能在成年后出现胰腺炎而无典型CF症状,推测与消化酶滞留胰腺有关。随着对CF肺部并发症的诊治水平提高,肝衰竭、胆汁流量减少、胰腺炎、梗阻及营养消化/吸收不良等胃肠道症状的管理在成人患者中愈发重要,常需多学科医疗团队协作。
胆囊收缩素(Cholecystokinin, CCK)
CCK由分布于小肠上皮的I细胞分泌。当管腔内出现特定食物成分(尤其是游离脂肪酸和某些氨基酸)时,这类经典肠内分泌细胞(enteroendocrine cells)会将CCK释放至细胞间隙。脂肪酸或氨基酸可直接与I细胞相互作用触发CCK释放。此外,两种管腔活性释放因子也参与调控I细胞:
- CCK释放肽(CCK-releasing peptide, CCK-RP):由上皮内旁分泌细胞响应脂肪和蛋白质消化产物分泌至小肠管腔
- 监测肽(monitor peptide):由胰腺腺泡细胞分泌至胰液(图30.5)
CCK-RP和监测肽也可响应神经信号释放,这对头期(cephalic phase)和胃期(gastric phase)启动胰液分泌尤为重要,使消化系统在食糜进入小肠前即做好准备。
• 图30.5 十二指肠I细胞释放胆囊收缩素(CCK)的调控机制。ACh:乙酰胆碱;CCK-RP:CCK释放肽;GRP:胃泌素释放肽。实线箭头表示刺激作用,虚线箭头表示抑制作用。(改编自Barrett KE. Gastrointestinal Physiology. New York: McGraw-Hill; 2006.)
这些CCK释放因子(cholecystokinin-releasing factors)的意义是什么?它们的主要作用是使CCK的释放以及由此产生的胰酶可用性,与小肠腔中消化膳食所需的酶量相匹配。由于这些释放因子是肽类物质,它们会像膳食蛋白质一样受到胰蛋白酶(pancreatic trypsin)等酶的蛋白水解降解。然而当摄入膳食蛋白质时,肠腔中的蛋白质含量远高于释放因子,从而与释放因子"竞争"蛋白水解降解。其净效应是:当食物存在于小肠时,释放因子将受到保护免于分解,因此能够持续刺激I细胞释放CCK。然而一旦食物被消化吸收,释放因子即被降解,CCK释放的信号随即终止。
CCK通过两种方式诱发胰腺腺泡细胞分泌。首先,它是通过血液循环作用于腺泡细胞CCKA受体的经典激素。其次,CCK还能刺激与胰腺相关的神经反射通路。小肠壁的迷走传入神经末梢表达CCKA受体。如前所述CCK对胃排空的作用机制,CCK的结合可激活迷走-迷走反射(vagovagal reflex),通过激活胰腺肠神经元并释放乙酰胆碱(acetylcholine)、胃泌素释放肽(gastrin-releasing peptide)和血管活性肠肽(vasoactive intestinal polypeptide, VIP)等一系列神经递质,进一步增强腺泡细胞分泌。
• 图30.6 胰腺腺泡细胞受体及其分泌调节。黑色粗箭头表明\mathsf{Ca}^{++}依赖性信号通路起主要作用。ACh,乙酰胆碱;CCK,胆囊收缩素;CCK-A,CCK A型受体;GRP,胃泌素释放肽;M_{3},{\sf M}_{3}毒蕈碱受体;VIP,血管活性肠肽。(改绘自Barrett KE. Gastrointestinal Physiology. New York: McGraw-Hill; 2006.)
胰腺腺泡细胞的分泌产物主要在聚集于细胞顶端的分泌颗粒中合成和储存(图30.6)。对腺泡细胞分泌最有效的刺激物(包括CCK、乙酰胆碱和胃泌素释放肽)通过动员细胞内\mathrm{Ca^{++}}发挥作用。刺激腺泡细胞会导致细胞质中一系列调节蛋白和结构蛋白发生磷酸化,使分泌颗粒向顶膜移动并与之融合。随后颗粒内容物被排入腺泡腔,先通过连接腺泡细胞的紧密连接渗出的血浆冲洗,再经导管分泌物排出。在餐间期,腺泡细胞会重新合成颗粒成分并储存,直至下次消化需要时使用。重新合成过程可能由引发初始分泌反应的相同激动剂刺激。
胆汁分泌
另一种与食糜在小肠腔中混合的重要消化液是胆汁。胆汁由肝脏产生,其生成机制及具体成分将在第32章详细讨论。然而,就当前讨论而言,胆汁的作用是帮助脂质的消化和吸收。从肝脏流出的胆汁在胆囊中储存并浓缩,直到摄食后释放。胆囊收缩和Oddi括约肌松弛主要由CCK(胆囊收缩素)诱发。
当考虑食糜同化的小肠阶段时,我们最关注的胆汁成分是胆汁酸(bile acids)。这些酸形成称为微胶粒(micelles)的结构,用于将脂质消化的疏水性产物与肠腔的水环境隔离。胆汁酸本质上是生物洗涤剂,最佳脂质吸收需要大量胆汁酸——每天高达1至2\mathrm{g}。大多数胆汁酸池通过肠肝循环(图30.7)在每餐后从肠道循环回肝脏。因此,胆汁酸以共轭形式合成,这种形式限制了其被动穿过肠上皮的能力,使其保留在肠腔参与脂质同化(见后文)。然而,当食糜到达回肠末端(脂质吸收完成后),共轭胆汁酸通过顶膜\mathbf{Na}^{+}依赖性胆汁酸转运体(apical \mathbf{Na}^{+}-dependent bile acid transporter, asbt)的同向转运体被重吸收,该转运体特异性与钠离子协同摄取共轭胆汁酸。在健康状态下,仅有少量胆汁酸池溢出至结肠,在此处胆汁酸被解离并进行被动重吸收(见图30.7)。其净效应是使大部分胆汁酸池随餐后信号每日在肝肠之间循环。胆汁酸还通过与全身多种细胞类型的细胞表面及核受体结合,发挥除洗涤剂作用外的生物学功能。通过这种方式,它们调控自身合成及其他代谢过程。
• 图30.7 胆汁酸的肠肝循环。共轭胆汁酸的主动摄取通过顶膜钠依赖性胆汁酸转运体asbt实现。
碳水化合物同化(Carbohydrate Assimilation)
小肠对营养物质的同化作用
小肠最重要的生理功能是吸收摄入营养物质的消化产物。从数量上看,最重要的营养物质(宏量营养素)可分为三类:碳水化合物(carbohydrates)、蛋白质(proteins)和脂类(lipids)。小肠不仅对营养物质进入体内的吸收过程至关重要,还负责将这些物质最终消化为足够简单的分子以通过肠上皮运输。我们将依次讨论这三类营养物质的同化过程,首先从碳水化合物开始。碳水化合物的消化分为两个阶段:在肠腔内进行,随后通过称为刷状缘消化(brush border digestion)的过程在肠上皮细胞表面完成。后者在可吸收部位生成简单的可吸收单糖,这种时空特异性限制了这些单糖暴露于小肠腔内少量细菌的机会,否则这些细菌可能会利用单糖作为营养源。
碳水化合物的消化
膳食碳水化合物由几种不同的分子类别组成。淀粉(starch)是第一类,是直链和支链葡萄糖聚合物的混合物。直链聚合物称为直链淀粉(amylose),支链分子称为支链淀粉(amylopectin)(图30.8)。淀粉是重要的热量来源(尤其在发展中国家),主要存在于谷物制品中。双糖(disaccharides)是第二类碳水化合物营养素,包括蔗糖(sucrose,由葡萄糖和果糖组成)和乳糖(lactose,由葡萄糖和半乳糖组成),后者是婴儿重要的热量来源。然而,肠道只能吸收单糖(monosaccharides)而不能吸收更大分子的碳水化合物,这是关键原则。最后,许多植物源性食物含有膳食纤维(dietary fiber),这类碳水化合物聚合物无法被人源酶消化,其主要通过结肠腔内的细菌进行分解(见第31章),从而回收其热量价值。
图30.8 支链淀粉的结构及淀粉酶的作用机制。蓝色圆圈表示通过α-1,4键连接的葡萄糖单体。黑色圆圈表示在分支点通过α-1,6键连接的葡萄糖单元。
刷状缘碳水化合物水解酶 30.2
【注:表格中"α-limit dextrins"暂译为"α-极限糊精",需确认专业术语准确性】
临床关联
乳糖不耐症在特定族群的成年人中相对常见,如亚洲人、非裔美国人和西班牙裔。该疾病反映了肠细胞表达乳糖酶(lactase)的正常发育性下降现象,特别是当乳糖未持续存在于饮食中时。这类人群摄入含大量乳糖的食物(如牛奶和冰淇淋)可能导致腹部绞痛、胀气和腹泻。这些症状反映了相对无法消化乳糖的情况;因此乳糖滞留于肠腔并导致水分潴留。部分乳糖不耐症患者在摄入乳制品前服用细菌来源的乳糖酶可获益。
淀粉的消化分两个阶段进行。第一阶段发生于肠腔,起始于口腔中唾液淀粉酶(salivary amylase)的活性作用(参见第28章)。然而唾液淀粉酶并非淀粉消化的必需因素,尽管在新生儿或胰腺酶分泌因疾病受损的患者中可能发挥更重要作用。从数量上看,对肠腔淀粉消化贡献最大的是胰淀粉酶(pancreatic amylase)。两种酶均可水解直链淀粉(amylose)和支链淀粉(amylopectin)内部的α-1,4糖苷键,但不能水解末端键,也不能水解支链淀粉分子分支点形成的α-1,6键(见图30.8)。因此淀粉经淀粉酶的消化必然是不完全的,会产生葡萄糖短链寡聚体,包括二聚体(麦芽糖)和三聚体(麦芽三糖),以及最简单的分支结构——称为α-极限糊精(α-limit dextrins)。因此,为使组成淀粉的单糖被吸收,淀粉还必须经历刷状缘消化过程。
在刷状缘,直链葡萄糖寡聚体可通过水解酶葡萄糖淀粉酶(glucoamylase)、蔗糖酶(sucrase)或异麦芽糖酶(isomaltase)进行消化(表30.2)。这些酶最终都会产生游离的葡萄糖单体,随后通过后文讨论的机制被吸收。对于α-极限糊精(α-limit dextrins)而言,异麦芽糖酶的活性尤为关键,因为它是唯一能够水解构成分支点的α-1,6键以及α-1,4键的酶。
碳水化合物的吸收
消化产生的水溶性单糖必须穿过肠上皮细胞疏水的质膜进行转运。钠/葡萄糖协同转运蛋白1(sodium/glucose transporter 1, SGLT1)是一种同向转运体(symporter),通过将葡萄糖(和半乳糖)的转运与Na⁺的转运相偶联,逆浓度梯度摄取这些糖分子(图30.9)。进入胞质后,葡萄糖和半乳糖可被保留用于上皮细胞的代谢需求,或通过基底外侧膜的GLUT2转运体排出细胞。相比之下,果糖通过GLUT5穿过顶膜被摄取。然而,由于果糖的转运不与Na⁺偶联,其吸收效率相对较低,若摄入大量含该糖的食物容易超出转运能力。由此产生的症状与乳糖不耐症患者摄入乳糖后的体验相似。
• 图30.9 小肠对葡萄糖、半乳糖和果糖的吸收。GLUT:葡萄糖转运蛋白;SGLT1:钠/葡萄糖协同转运蛋白1。
蛋白质的同化
蛋白质也是水溶性多聚体,必须消化为更小的组分才能被吸收。其吸收过程比碳水化合物更复杂,因为蛋白质含有20种不同的氨基酸,且这些氨基酸的短链寡聚体(二肽、三肽甚至四肽)也可被肠上皮细胞转运。机体(尤其是肝脏,见第32章)具有根据需求相互转化各种氨基酸的强大能力。然而,某些氨基酸(称为必需氨基酸)无法由机体合成,必须从膳食中获取(图30.10)。
细胞层面
一种罕见的遗传性疾病会导致肠道无法吸收葡萄糖或半乳糖。该疾病已被定位为SGLT1基因的多种突变,导致蛋白质缺陷或表达缺失,更常见的是蛋白质无法正确运输至肠上皮细胞的顶膜。携带此类突变的患者中,未被吸收的葡萄糖会导致腹泻等症状。尽管该疾病罕见,但其重要性在于揭示了肠上皮转运的关键机制。
• 图30.10 天然膳食氨基酸。方框内为人类无法合成的必需氨基酸,必须通过膳食获取。(改绘自Barrett KE. Gastrointestinal Physiology. New York: McGraw-Hill; 2006.)
蛋白质的消化
蛋白质的酶促消化
蛋白质仅通过胃腔内酸性pH环境即可发生水解生成长肽链。然而要将蛋白质同化为机体成分,需要经历三个阶段的酶促消化过程(图30.11)。与酸水解类似,第一阶段发生于胃腔,由胃腺主细胞产物——胃蛋白酶(pepsin)介导。当胃液分泌被激活时,胃蛋白酶以前体形式胃蛋白酶原(pepsinogen)从主细胞释放。在酸性pH条件下,该前体通过自催化裂解产生活性酶。胃蛋白酶高度特异地作用于胃内环境,因其活性依赖于低pH条件。该酶通过裂解中性氨基酸位点的肽键来水解蛋白质,尤其偏好作用于具有芳香族或大脂肪族侧链的氨基酸。由于此类氨基酸在特定蛋白质中相对罕见,胃蛋白酶无法将蛋白质完全消化为可被肠道吸收的形式,其产物为完整蛋白质、大分子肽段(主要成分)及少量游离氨基酸的混合物。
当部分消化的蛋白质进入小肠后,将遭遇胰蛋白酶类。值得注意的是,这些酶均以非活性形式分泌。那么它们如何被激活以启动蛋白质消化过程?实际上,蛋白酶激活过程被延迟至酶类进入肠腔后才会发生,这归因于激活酶——肠激酶(enterokinase)仅定位于小肠上皮细胞刷状缘的局部存在(图30.12)。肠激酶通过裂解胰蛋白酶原(trypsinogen)产生活性胰蛋白酶(trypsin)。随后,胰蛋白酶依次激活所有其他胰腺分泌的蛋白酶前体,从而形成能够几乎完全消化绝大多数膳食蛋白质的酶混合物。作为内肽酶(endopeptidase),胰蛋白酶仅裂解肽链内部的化学键,而非从链末端释放单个氨基酸。该酶特异性切割碱性氨基酸位点,产生一组C端带有碱性氨基酸的短肽链。另外两种胰腺内肽酶——糜蛋白酶(chymotrypsin)和弹性蛋白酶(elastase)具有相似作用机制,但特异性切割中性氨基酸位点。
内肽酶作用产生的肽链随后被胰腺外肽酶(ectopeptidase)进一步分解。这些酶从肽链末端逐个裂解氨基酸,胰液中的外肽酶对位于C端的中性氨基酸(羧肽酶A(carboxypeptidase A))或碱性氨基酸(羧肽酶B(carboxypeptidase B))具有特异性。因此,经胃液和胰液消化后的蛋白质产物包括中性及碱性氨基酸,以及C端带有酸性氨基酸而无法被羧肽酶A或B降解的短肽链(图30.13)。
肽与氨基酸的吸收
蛋白质消化的最后阶段发生在刷状缘。成熟的肠上皮细胞(enterocyte)表达多种膜结合肽酶(membrane peptidase),包括氨基肽酶(aminopeptidase)和羧基肽酶(carboxypeptidase),这些酶产生的产物适合通过顶膜(apical membrane)被吸收(见图30.11)。但需注意的是,即使存在大量活性蛋白水解酶的补充,某些膳食肽(dietary peptide)仍对水解作用具有相对或完全的抵抗性。特别是含有脯氨酸(proline)或甘氨酸(glycine)的肽类,其消化速度非常缓慢。幸运的是,肠道除了能吸收单个氨基酸外,还能吸收短肽。以完整形式被吸收进入肠上皮细胞的大部分肽,将在细胞质中经历消化的最后阶段,释放其组成氨基酸以供细胞或机体其他部位利用(图30.14)。不过,部分二肽和三肽也可能以完整形式被转运入血。
• 图30.11 胃和小肠中参与膳食蛋白质消化的蛋白酶(protease)与肽酶的层级作用。蛋白质以单个氨基酸(70%)或短肽(30%)形式被吸收。(改编自Van Dyke RW. 见:Sleisenger MH, Fordtran JS, 编. Gastrointestinal Disease. 第4版. Philadelphia: Saunders; 1989.)
• 图30.12 胰液中无活性酶原(proenzyme)通过胰蛋白酶(trypsin)作用转化为活性酶的过程。十二指肠和空肠上皮细胞表面表达的肠激酶(enterokinase)通过蛋白水解作用将胰液中的胰蛋白酶原(trypsinogen)转化为活性胰蛋白酶。如图所示,胰蛋白酶随后激活其他酶原。
• 图30.13 胃部部分蛋白水解作用产生的肽在肠腔中的消化过程。AA,氨基酸。(重绘自Barrett KE. Gastrointestinal Physiology. New York: McGraw-Hill; 2006.)
机体还拥有一系列质膜转运蛋白(plasma membrane transporters),能够促进水溶性蛋白质消化产物的摄取。由于氨基酸种类繁多,存在数量相对较多的特异性转运蛋白(参见图30.11和30.14)。氨基酸转运蛋白具有临床意义,因为在多种遗传性疾病中,这些转运蛋白的缺失会导致相关一种或多种氨基酸的转运能力下降。不过这类突变通常不会表现出临床症状(至少从营养学角度而言),因为所涉及的氨基酸可通过其他具有重叠特异性的转运蛋白或以肽的形式被同化吸收。但这并不排除该转运蛋白在通常表达的其他器官系统中出现病理改变的可能性(例如胱氨酸尿症,cysteinuria)。总体而言,氨基酸转运蛋白具有较宽泛的特异性,通常转运某一亚类的氨基酸(如中性、阴离子或阳离子氨基酸),但对特定氨基酸的亲和力存在部分重叠。此外,部分(并非全部)氨基酸转运蛋白属于同向转运体(symporter),可与其底物氨基酸共同转运\mathrm{Na^{+}}。
小肠对短肽的摄取能力也值得关注(参见图30.14)。主要负责此类摄取的是PepT1(peptide transporter 1,肽转运蛋白1),这是一种质子偶联同向转运体(proton-coupled symporter),可协同质子转运肽类。肠上皮细胞不需要的这些肽段水解产生的氨基酸,会通过基底外侧膜转运至血液毛细血管,经由门静脉输送至肝脏。PepT1的临床价值还体现在其可介导类肽药物(peptidomimetic drugs)的吸收,这类药物包括多种抗生素和化疗药物。氨基酸和类肽药物离开肠上皮细胞的具体机制尚未完全阐明,推测可能涉及其他转运蛋白。
• 图30.14 多种二肽和三肽通过刷状缘膜上的质子偶联同向转运体——肽转运蛋白1(PepT1)被摄取。顶膜上的钠/氢交换体(NHEs)负责建立质子梯度。肽段主要在胞质内消化为组成氨基酸后输出至机体,但少量可能以完整形式输出。
AT THE CELLULAR LEVEL
蛋白质消化产物吸收机制的冗余性
蛋白质消化产物吸收机制的冗余性强调了这一过程的重要性,同时也意味着肠道对特定氨基酸(amino acid)同化缺陷的情况相对罕见。然而,在某些情况下,负责特定氨基酸转运的蛋白质突变可能导致其他器官的病理改变。例如胱氨酸尿症(cystinuria),这是一种分子异质性疾病,涉及多种能够转运胱氨酸(cysteine)的氨基酸转运体突变。由于胱氨酸还可以以肽的形式在肠道被同化,因此即使缺乏肠道吸收机制也不会出现营养缺乏。相比之下,胱氨酸在胱氨酸尿症患者的尿液中几乎无法被重吸收,且由于这种氨基酸相对难溶,可能形成肾结石。
病理生理学改变也可能继发于SLC6A19(一种钠离子(\mathsf{N a^{+}})非依赖性中性氨基酸转运体)突变,导致称为Hartnup病的病症。该病症会引起中性氨基酸(neutral amino acids)随尿液流失、精神问题、智力发育迟缓、身材矮小、头痛和步态不稳,但本身不会导致营养缺乏。
脂质同化
脂质(lipid)被定义为在有机溶剂中比在水中更易溶解的物质,是构成人类饮食的第三大类宏量营养素。按单位重量计算,脂质提供的热量高于蛋白质或碳水化合物,因此具有重要营养意义,但过量摄入也会导致肥胖倾向。脂质还能溶解挥发性化合物,这些化合物有助于食物的风味和香气。
人类饮食中脂质的主要形式是甘油三酯(triglyceride),存在于油脂和其他脂肪中。这些甘油三酯大多含有酯化到甘油骨架上的长链脂肪酸(long-chain fatty acids)(碳链长于12个碳)。其他脂质以磷脂(phospholipid)和胆固醇(cholesterol)形式存在,主要来源于细胞膜。如第32章将详细讨论的,肠道还会通过胆汁分泌接受来自肝脏的脂质。实际上,除极端嗜蛋者外,胆汁提供的胆固醇量超过每日膳食摄入量。最后,虽然仅以微量存在,但脂溶性维生素(A、D、E和K)是必须通过饮食摄入以避免疾病的必需营养素。这些物质几乎完全不溶于水,因此需要特殊处理以促进其吸收。
脂质的乳化与增溶
当摄入含脂肪膳食时,脂质在体温下液化并漂浮在胃内容物表面。这会限制胃内容物水相与脂相之间的界面面积,从而限制脂解酶(作为蛋白质存在于水相中)对脂质进行分解的能力。因此,脂质同化的早期阶段是乳化(emulsification)。胃的混合作用将膳食脂质搅打成微小液滴的悬浮液,这极大增加了脂相的表面面积。
脂质的吸收还通过胆汁分泌中提供的胆汁酸形成微胶粒溶液(micellar solution)而得到促进。该过程的细节将在后续讨论。
脂质的消化
脂质消化起始于胃。胃脂肪酶(gastric lipase)由胃主细胞释放;它吸附在分散于胃内容物中的脂肪滴表面,将甘油三酯(triglycerides)水解为二酰甘油(diglycerides)和游离脂肪酸(free fatty acids)。然而,由于胃腔酸性pH导致释放的游离脂肪酸发生质子化(protonation),胃内几乎无法进行脂质同化。胃内的脂解作用也不完全,因为尽管胃脂肪酶在酸性pH下具有最佳催化活性,但它无法水解甘油三酯酯键的第二位,这意味着分子无法完全分解为可被机体吸收的成分。胆固醇酯或脂溶性维生素酯在此处也几乎没有分解。实际上,由于胰腺酶存在显著过量,胃脂解作用对健康个体并非必需。
在健康状态下,大部分脂解作用发生在小肠。胰液含有三种重要的脂解酶,它们在中性pH条件下活性最佳。首先是胰脂肪酶(pancreatic lipase)。该酶与胃酶不同,能够水解甘油三酯的1位和2位酯键,产生游离脂肪酸和单酰甘油(monoglycerides)。在中性pH下,游离脂肪酸的头部基团带电荷,因此这些分子迁移至油滴表面。胰脂肪酶还表现出一个明显的悖论:它会被同样存在于小肠内容物中的胆汁酸抑制。胆汁酸吸附在油滴表面导致脂肪酶解离。然而,脂肪酶活性通过胰液提供的的重要辅助因子——辅脂酶(colipase)得以维持。辅脂酶是能够同时结合胆汁酸和脂肪酶的桥接分子;即使在胆汁酸存在下,它也能将脂肪酶锚定在油滴表面。
胰液还含有另外两种对脂肪消化重要的酶。其一是磷脂酶\mathrm{A}_{2}(phospholipase \mathrm{A}_{2}),它能水解细胞膜等结构中存在的磷脂。可以预见,该酶在缺乏膳食底物时具有较强毒性,因此它以非活性酶原形式分泌,仅在到达小肠后才被激活。此外,胰液含有相对非特异性的胆固醇酯酶(cholesterol esterase),顾名思义,该酶既能分解胆固醇酯,也能分解脂溶性维生素酯甚至甘油三酯。值得注意的是,该酶的活性需要胆汁酸(与前述脂肪酶形成对比),并与母乳中一种对新生儿脂解起重要作用的酶存在关联。
随着脂解过程的进行,脂解产物从脂滴中被提取出来,首先进入层状相(lamellar phase)或膜相(membrane phase),随后进入由脂解产物和胆汁酸组成的混合微团(mixed micelles)。两亲性(amphipathic,指同时具有疏水面和亲水面)的胆汁酸通过屏蔽脂解产物的疏水区域,使其亲水面暴露于水环境(图30.15)。微团真正处于溶解状态,因此显著提高了脂质在肠内容物中的溶解度。这加快了脂质向吸收上皮表面扩散的速率。然而,考虑到小肠具有极大的表面积以及甘油三酯水解产物具有可观的分子溶解度,微团对甘油三酯的吸收并非必需。因此,胆汁酸分泌不足(例如由胆结石阻塞胆汁排出引起)的患者通常不会出现脂肪吸收不良。另一方面,胆固醇和脂溶性维生素几乎完全不溶于水,因此即使在消化后也需要依赖微团才能被吸收。若管腔中胆汁酸浓度低于临界微团浓度(critical micellar concentration),患者可能出现脂溶性维生素缺乏症。
• 图30.15 胆汁酸(A)和混合微团(B)的示意图。溶液中的胆汁酸具有两亲性。混合微团是胆汁酸与其他膳食脂质形成的圆柱状集合体。
脂质的摄取与后续处理
由于亲脂性特征,脂肪消化产物被认为能够轻易穿过细胞膜。然而,最新证据表明其摄取可能还受到特定膜转运蛋白活性的调节。微绒毛膜脂肪酸结合蛋白(microvillus membrane fatty acid–binding protein, MVMFABP)介导长链脂肪酸通过刷状缘的摄取。同样,Niemann Pick C1 like 1(NPC1L1)被确认为肠细胞摄取胆固醇的途径,可能成为循环胆固醇病理性升高(高胆固醇血症,hypercholesterolemia)患者的治疗靶点。然而,胆固醇的总体吸收效率相对较低,因为该分子与植物固醇一起可通过由两种"ABC"(ATP结合盒,ATP-binding cassette)转运体(称为ABC G5和G8)组成的异源二聚体复合物,被主动排出肠细胞回到胞质溶胶。最后,甘油三酯的甘油骨架可能通过多种不同的水甘油通道蛋白(aquaglyceroporins)转运至肠上皮细胞内。
临床视角
水和电解质的分泌与吸收
对于高胆固醇血症(hypercholesterolemia)的一种较新疗法针对小肠上皮对胆固醇(无论来源于饮食还是胆汁)的吸收过程。依折麦布(Ezetimibe)是一种通过抑制肠上皮细胞顶膜表达的NPC1L1蛋白(NPC1L1)活性来特异性阻断胆固醇细胞摄取的药物。与其他旨在对抗动脉粥样硬化的药物联合使用时,该药物可能成为有效的辅助治疗手段,因为它既能阻断肠肝循环,又能阻止膳食胆固醇的吸收。临床研究表明,对于心血管疾病高危人群,依折麦布能协同增强其他降低循环低密度脂蛋白胆固醇水平的策略(如他汀类药物)的疗效。
脂质在进入肠上皮细胞后的命运也与碳水化合物和蛋白质存在显著差异。单糖和氨基酸以分子形式离开肠上皮细胞进入门脉循环,而脂解产物则会在肠上皮细胞内重新酯化形成甘油三酯(triglycerides)、磷脂(phospholipids)和胆固醇酯(cholesterol esters)。这些代谢过程发生在光滑内质网中。与此同时,肠上皮细胞在粗糙内质网中合成一系列被称为载脂蛋白(apolipoproteins)的蛋白质。随后这些蛋白质与重新合成的脂质结合形成乳糜微粒(chylomicron),其结构特征是由载脂蛋白包裹的脂质核心(主要成分为甘油三酯,含少量胆固醇、磷脂和脂溶性维生素酯)。
乳糜微粒通过胞吐作用从肠上皮细胞排出后,由于体积过大(直径约750-5000 Å),无法通过黏膜毛细血管的细胞间隙。因此它们被固有层(lamina propria)中的淋巴管吸收,从而绕过门脉循环,并至少在首次循环时避开肝脏。最终,淋巴中的乳糜微粒通过胸导管进入血流,成为将脂质运输至全身各器官细胞利用的载体。
这种乳糜微粒介导的运输机制的唯一例外是中链脂肪酸。这类脂肪酸具有相对较强的水溶性,并能显著穿透肠上皮细胞间的紧密连接,这意味着它们绕过了前述的细胞内加工步骤,也不会被包装进入乳糜微粒。因此它们直接进入门脉循环,更易被其他组织利用。对于胆汁酸池不足的患者,富含中链甘油三酯的饮食可能具有特殊益处。
前述关于消化的描述强调了这些过程是在小肠的水性环境中进行的。肠道内容物的流动性,尤其是小肠中的流动性,对于推动食糜沿肠道移动以及允许消化后的营养物质扩散至吸收部位至关重要。这部分液体部分来源于口腔摄入,但在大多数成年人中,每日通过食物和饮品摄入的液体仅约1-2升(图30.16)。额外的液体由胃、小肠自身以及排入胃肠道的器官提供。总体而言,这些分泌液额外贡献约8升,这意味着肠道每天需要处理约9至10升液体。然而,在健康状态下,仅有约2升液体进入结肠进行重吸收,最终仅有100-200毫升以粪便形式排出。因此,肠道总体上吸收水分。
在餐后阶段,小肠主要通过营养吸收的渗透效应促进水分吸收。跨肠上皮形成的渗透梯度可同时驱动水分通过紧密连接移动。图30.17图示了小肠中由营养物质驱动的Na⁺和水吸收的通用机制。此外,在餐间无营养物质时,通过Na⁺-H⁺逆向转运体(钠氢交换体3型,NHE-3)与Cl⁻-HCO₃⁻逆向转运体的协同作用介导的Na⁺和Cl⁻耦联吸收,仍可发生液体吸收(见图30.17)。
• 图30.16 人类胃肠道总体液体平衡。约1-2升水通过摄入进入,另有8升各种分泌液进入胃肠道。其中大部分在小肠被吸收,约2升进入结肠,在健康状态下绝大多数被吸收。(引自Vander AJ, Sherman JH, Luciano DS. Human Physiology. 6th ed. New York: McGraw-Hill; 1994.)
小肠的电解质分泌机制
尽管小肠内水和电解质的净运输以吸收为主,但这并不意味着该组织不参与电解质分泌。分泌活动受到肠腔内容物信号、黏膜形变和肠道扩张的调节。关键的促分泌素(secretagogues)包括乙酰胆碱、VIP、前列腺素和血清素。分泌作用可确保在消化吸收过程中肠内容物保持适当流动性,并对润滑食物颗粒沿肠道的推进具有重要意义。例如,部分临床证据表明,当分泌异常减少时可能导致便秘和肠梗阻(后者常见于囊性纤维化患者)。
肠腔分泌液的主要驱动力是通过氯离子的主动分泌实现的,其机制如图30.18所示。在囊性纤维化中,CFTR Cl⁻通道的缺失可通过辅助性氯通道(如被胞质钙浓度升高激活的TMEM16A通道)部分代偿。某些肠段可能采用额外的分泌机制,例如通过图30.19所示机制分泌碳酸氢根离子。碳酸氢盐分泌可保护上皮细胞(尤其是紧邻幽门下游的十二指肠近端区域)免受胃酸和胃蛋白酶的损伤。
• 图30.17 小肠NaCl吸收机制。DRA(Down-regulated in adenoma,在腺瘤中下调的蛋白);GLUT2(葡萄糖转运蛋白2);KCC1(钾/氯共转运体1);NHE-3(钠/氢交换体3);PAT1(假定的阴离子转运体1);SGLT1(钠/葡萄糖协同转运蛋白1)。
矿物质和水溶性维生素的吸收
小肠也是吸收水溶性维生素(如维生素C和钴胺素)以及钙、镁、铁等矿物质的重要部位。通常这些物质通过特异性转运体的活动从肠腔内容物中被摄取。它们的吸收还受到反馈机制的调控,这些机制可感知循环中相关底物的浓度,并相应调整转运体和辅助分子的表达水平。
• 图30.18 小肠和大肠Cl⁻分泌机制。CFTR(囊性纤维化跨膜传导调节因子);NKCC1(钠/钾/2氯共转运体1)。需注意顶膜可能还存在其他氯通道(未显示),例如受细胞内钙浓度调控的通道,这些通道也参与整体运输过程。
markdown • 图30.19 十二指肠碳酸氢盐分泌机制。C A(碳酸酐酶);CFTR(囊性纤维化跨膜传导调节因子);DRA(腺瘤中下调);NBC1(钠/碳酸氢盐共转运体1);NHE-1(钠/氢交换体-1);P A T1(假定阴离子转运体1)。
小肠的运动模式
小肠平滑肌层产生的运动模式可将食糜与各种消化分泌物混合,并推动内容物沿肠道移动,从而使营养物质(以及水和电解质)被吸收。餐后时期小肠的运动模式主要以混合为导向,主要由延缓食糜移动的分节运动和逆向推进收缩组成,此时消化仍在进行。分节运动(segmentation)(图30.20)是一种节律性收缩的典型模式,反映了肠神经系统程序化活动叠加于基本电节律之上的效应。尽管胆囊收缩素(CCK)参与其中,但这种摄食相关运动模式的激素介导机制尚不明确。如本章开头所述,当食糜进入小肠时,CCK也会延缓胃排空。这种机制的意义在于使营养物质的输送与消化吸收能力相匹配。
当食物被消化吸收后,未消化的残渣将从肠腔清除,为下一餐做准备。这种清除通过蠕动(peristalsis)(图30.21)实现——这是一种协调的收缩序列,发生在肠内容物上方,而下方则松弛,使内容物得以长距离输送。蠕动反映了乙酰胆碱和P物质(substance \mathrm{P})在肠道扩张部位口侧释放引起的环肌收缩效应,以及血管活性肠肽(VIP)和一氧化氮在尾侧的抑制作用。与分节运动类似,当固有神经产生的动作电位叠加于基本电节律决定的细胞去极化位点时,即触发蠕动。此外,空腹时发生的蠕动运动模式被组织成一系列称为迁移性运动复合波(migrating motor complex,MMC)的时相(图30.22)。MMC的I相以相对静止为特征,而II相开始出现少量无组织的收缩。在持续约10分钟的III相期间,由胃动素(motilin)激发的沿肠道长轴传播的大幅收缩将残留的胃和肠内容物排入结肠。此阶段幽门和回盲瓣完全开放,因此即使较大的未消化物也能最终排出体外。随后肠道运动恢复至MMC的I相,成年人的完整周期约90分钟,除非摄食中断此过程。餐后胃动素水平下降,需待其再次升高才能重启MMC。
关键概念
- 食糜离开胃后进入小肠(small intestine),小肠由十二指肠(duodenum)、空肠(jejunum)和回肠(ileum)依次组成。小肠的主要功能是消化(digestion)和吸收(absorption)营养物质。
- 十二指肠内食糜的存在会延缓胃的进一步排空,从而帮助协调营养物质输送速率与小肠消化吸收能力之间的匹配。
- 小肠内的消化和吸收依赖于两种消化液:胰液(pancreatic juice,来自胰腺)和胆汁(bile,来自肝脏)。这些分泌活动由小肠内食糜激活的激素信号和神经信号触发。
- 胰液由胰腺腺泡(acini)分泌,含有多种能够消化食糜或作为重要辅助因子的蛋白质。当胰液流经胰管时,会被稀释并碱化。
- 胆汁由肝脏产生并储存于胆囊(gallbladder),直至餐后需要时释放。胆汁酸(bile acids)作为胆汁的重要成分,是生物表面活性剂,能够溶解脂质消化产物。
- 碳水化合物和蛋白质作为水溶性大分子,其消化吸收机制具有广泛相似性。而第三种宏量营养素——脂质,则需要特殊机制将脂解产物转运至可被吸收的上皮表面。小肠还负责吸收脂溶性维生素、水溶性维生素以及钙、镁、铁等矿物质。
- 小肠每日通过主动转运离子和其他电解质驱动大量液体进出肠腔,以促进营养物质的消化和吸收。
• 图30.20 A,正常个体胃和小肠充满钡造影剂的X线影像。注意小肠的分节运动(segmentation)。B,小肠分节收缩的时序示意图。线1至4代表连续时间点,虚线指示下一步收缩发生部位,箭头显示肠内容物移动方向。(A改自Gardener EM, Gray DJ, O’Rahilly R. Anatomy: A Regional Study of Human Structure, 4th ed. Philadelphia: Saunders; 1975;B重绘自Cannon WB. Am J Physiol 1902;6:251)
• 图30.21 肠道蠕动运动(peristaltic motility)推动肠内容物沿小肠长轴移动。
• 图30.22 通过测压法记录禁食人类受试者十二指肠和空肠的移行性运动复合波(migrating motor complexes)。D\eta、D2、\mathcal{J}\mathcal{T}、J2和J3表示沿十二指肠和空肠长轴的连续记录点。强烈收缩(III期)向远端传播。(重绘自Soffer EE, Thongsawat S, Ellerbroek S. Am J Gastroenterol 1998;93:1318
- 小肠的运动模式因是否摄入食物而异。进食后,运动功能立即转向将食物保留在小肠内,使其与消化液混合,并为营养物质的吸收提供充足时间。在空腹期间,一种强烈的收缩"管家"复合波(迁移性运动复合波,migrating motor complex)会周期性地沿胃和小肠全长推进,以清除未消化的残留物。
