颜色反应
本页面主要总结生化中常见的颜色反应。
糖类相关颜色反应
Bial 试验
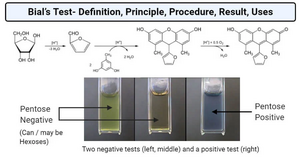

苔黑酚(甲基间苯二酚/地衣酚)、浓盐酸、氯化铁。用于鉴定戊糖。
戊糖会脱水形成糠醛,再产生蓝色或绿色的产物。
己糖可能会产生浑浊棕色、黄色或灰色的溶液,很容易与戊糖的绿色区分开来。
bial实验似乎不能区分DNA和RNA。
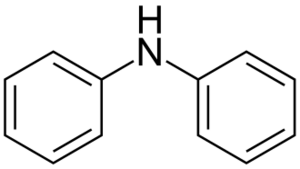
Dische 测试
二苯胺、冰醋酸、硫酸和乙醇。
加热时,DNA会产生蓝色,但RNA不产生反应。
Seliwanoff 检验
间苯二酚和浓盐酸。

醛糖会产生淡红色,而酮糖迅速产生鲜红色。
蔗糖也会产生鲜红色。
Molisch检验
糖与α-萘酚乙醇溶液混合,向其上方加入一层浓硫酸,交界处产生红色环。
用于鉴定是否无糖(不只有糖会反应)的存在。
蒽酮检验
与Molisch检验原理类似,使用蒽酮和浓硫酸,在620nm有最大光吸收,可用于总糖定量。
Fehling试剂&Benedict试剂
斐林试剂:酒石酸钾钠、氢氧化钠、硫酸铜。
本尼迪特试剂:碳酸钠、柠檬酸钠、硫酸铜。
水浴加热,还原糖可以产生砖红色沉淀。
- Barfoed实验:乙酸铜和乙酸,煮沸
Tollens'试剂
即银氨溶液。银氨配合物被醛还原为银单质。
- Tollens’试剂有时指间苯三酚鉴定戊糖,这个检测方法与银氨溶液是同一个人发现的。
氨基酸相关颜色反应
米伦反应
米伦反应(Millon reaction)被用作检测蛋白质,但实质是酪氨酸参与反应。
试剂中含有亚硝酸与硝酸,以及Hg(Ⅱ)和Hg(Ⅲ)离子,主要的显色反应是汞离子的配合过程。
可以看到被硝化后提供了配位反应的基团,因此产生颜色。
产生白色沉淀,加热后变成红色
坂口反应
坂口反应(Sakaguchi reaction),精氨酸的分析与测定,可用NaOH和NaCIO。
胍基与α-萘酚在碱性NaBrO中发生反应,生成红色产物。
Hopkins-Cole反应
这个又叫乙醛酸反应(Glyoxylate reaction),反应过程涉及次溴酸根。
在蛋白溶液中加入乙醛酸,并沿试管壁慢慢注入浓硫酸,在两液层之间就会出现紫色环,凡含有吲哚基的化合物(氨基酸中的Trp)都有此反应
茚三酮反应
茚三酮反应(ninhydrin reaction),首先氨基酸被茚三酮氧化分解为醛、氨、CO2,弱酸下还原性茚三酮与氨和另一分子茚三酮缩合成蓝紫色物质,在570nm有吸收峰。
其中脯氨酸与羟脯氨酸与茚三酮反应生成黄色物质。
黄色反应
芳香族氨基酸(Tyr最为灵敏)溶液中遇到浓硝酸后,先产生白色沉淀,加热则变黄,再加碱颜色还会加深,变为橙黄色。
由于苯环被硝化,产生了硝基苯衍生物
这个反应很灵敏
有个图,可以去文件里看
蛋白质相关颜色反应
考马斯亮蓝法(Bradford反应)
考马斯亮蓝:游离态呈红色(吸收峰为488nm),利用芳香环与与蛋白质疏水区结合后呈亮蓝色(吸收峰为595nm)。

优点:反应灵敏,试剂简单,速率快,且不易被干扰。
缺点:线性关系不是很好。
有两种型号的考马斯亮蓝:R250和G250。
R250:可以被洗脱,可用于电泳条带染色。
G250:较R250多俩甲基,所以疏水性更强一些,结合迅速,常用于定量。
双缩脲法
当底物中含有肽键时(三肽及以上),试液中的铜与多肽(因为和双缩脲长得像)配位,配合物呈紫色,吸收峰为540nm
常用于需要快速但并不需要十分精确的测定。硫酸铵不干扰此呈色反应,使其有利于对蛋白质纯化早期步骤的测定
福林酚法(Lowry法)
蛋白质与铜离子生成复合物后,其分子中的酪氨酸和色氨酸还原Folin-酚试剂中的磷钼酸及磷钨酸,生成蓝色化合物(钨蓝和钼蓝的混合物)。
此反应灵敏度很高,常用来测定蛋白含量,吸收峰为750nm
最早由Folin发明,后来被Lowry改进
优点:应用广泛
缺点:专一性较差,干扰物质多(如Tris缓冲剂,蔗糖,硫酸铵,巯基化物,酚类,柠檬酸等),标准曲线的直线关系不特别严格。
BCA法
基于双缩脲原理,碱性条件下蛋白质将Cu2+还原成Cu+,BCA鳌合Cu+作为显色剂,产生蓝紫色物质,吸收峰在562nm
优点:抗干扰能力强,不易受一般浓度去污剂的干扰
缺点:可受螯合剂,高浓度还原剂的影响。
核酸相关颜色反应
福尔根反应
Schiff试剂:希夫试剂(又称品红亚硫酸试剂),与醛作用而不与酮作用。
样本水解完RNA后,用1mol/L HCl,使DNA碱基与脱氧核糖之间的糖苷键&磷酯键断裂,暴露醛基,与Schiff试剂反应形成紫红色化合物
甲基绿-派格宁染色法(Unna 染色法)
甲基绿:带两个单位正电荷,与dsDNA结合,使之呈绿色
派格宁(又称嗞罗红):带一个单位正电荷,与RNA结合,使之呈红色
其他物质相关反应
木质素染色
试剂:间苯三酚、盐酸溶液
流程:先将材料由盐酸浸透,再加间苯三酚溶液,间苯三酚与木质素反应发生樱红色。
