第十章 木质部:细胞类型和发育
注:“tracheary elements”译为“管状分子”,将“sieve elements”译为“筛分子”,参考术语在线(termonline.cn)内容。
木质部是维管植物中主要的导水组织。它还参与溶质的运输、支持和食物储存。木质部与主要的食物传导组织韧皮部一起形成贯穿整个植物体的连续维管系统。作为维管系统的组成部分,木质部和韧皮部被称为维管组织(vascular tissues)。有时两者整体合称为维管组织(the vascular tissue)。木质部一词由 Nägeli (1858) 提出,源自希腊语 xylon,即木材。
维管植物(vascular plants,又称tracheophytes),形成一个单系群,由两门无籽维管植物(石松门 Lycopodiophyta 和蕨类植物门 Pteridophyta;蕨类植物门包括蕨类植物,含真蕨和木贼)以及裸子植物和被子植物组成,所有这些植物都有现存的代表(Raven 等人,2005 年)。此外,还有几个完全灭绝的维管植物门(Steward 和 Rothwell,1993 年;Taylor 和 Taylor,1993 年)。
术语vascular plants和tracheophytes代指了木质部的特征传导分子,即管状分子(tracheary elements)。由于其持久的刚性细胞壁, 管状分子比韧皮部的筛分子更显眼,在化石中保存得更好,研究起来也更容易。因此,木质部而不是韧皮部,在识别维管植物方面起着重要作用。
从发育上讲,第一个木质部在植物个体发育的早期(在胚胎或幼苗中)分化(Gahan,1988;Busse 和 Evert,1999),随着植物的生长,新的木质部(连同伴随的韧皮部)不断从顶端分生组织的衍生物中发育而来。因此,由顶端分生茎活动形成的初生植物体被连续的维管组织系统所贯穿。在初生植物体内分化的维管组织是初生木质部和初生韧皮部。与这些组织的形成直接相关的分生组织是原形成层,它是这些组织的直接前体。古代维管植物和许多当代维管植物(小型的一年生真双子叶植物和大多数单子叶植物)也完全由初生组织组成。
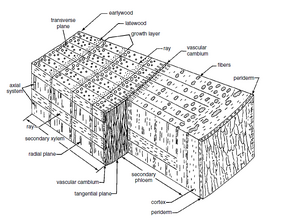
除了初生生长外,许多植物在初生生长(primary growth,伸长生长(extension growth))完成后,还会经历额外的生长,使茎和根变厚。这种生长称为次生生长。它部分是由维管形成层的活动引起的,维管形成层是产生次生维管组织、次生木质部和次生韧皮部的侧分生组织(图 10.1)。
从结构上看,木质部是一种复杂的组织,至少包含管状分子薄壁细胞,通常还包含其他类型的细胞,尤其是支持细胞。次生木质部的主要细胞类型列于表 10.1。初生木质部和次生木质部在组织学上存在差异,但在许多方面,这两种木质部相互交织(Esau,1943;Larson,1974,1976)。因此,为了实用,初生木质部和次生木质部的区分必须考虑周详,将木质部组织的这两个组成部分与整个植物的发育联系起来。
| 细胞类型 | 主要功能 |
|---|---|
| 轴向系统 | |
| 管状分子 | |
| 管胞 | 传导水分;溶质运输 |
| 导管分子 | |
| 纤维 | |
| 纤维管胞 | 支持;有时储存 |
| 韧型纤维 | |
| 薄壁细胞 | 食物储存;多种物质的转移 |
| 径向(射线)系统 | |
| 薄壁细胞 | |
| 管胞(一些针叶树) |
❙ 木质部的细胞类型
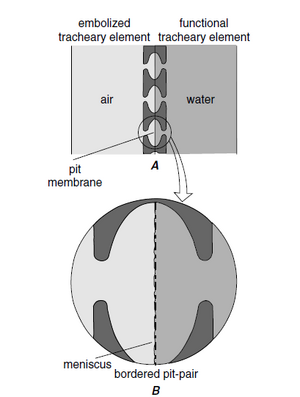
管状分子 —管胞和导管—是木质部的传导细胞
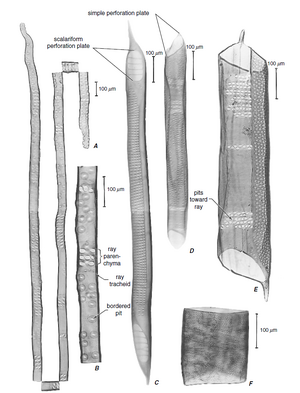
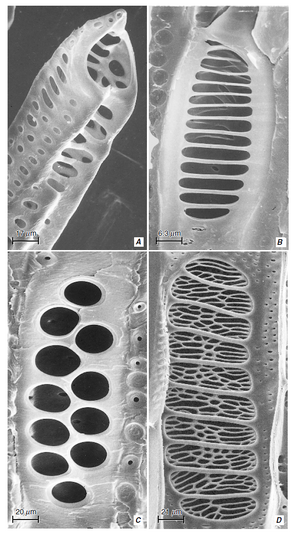
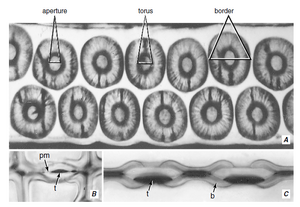
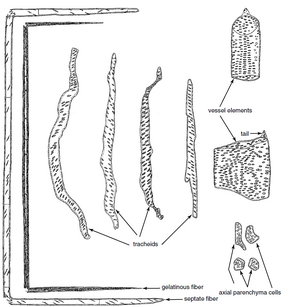
术语管状分子源自“trachea”,该名称最初用于某些类似于昆虫气管的初生木质部分子和次生木质部分子 (Esau, 1961)。木质部中存在两种基本类型的管状分子,即管胞(tracheids)(图 10.2A、B)和导管分子(vessel elements/vessel members)(图 10.2C-F)。两者都是或多或少细长的细胞,具有木质化的次生壁,成熟时为死细胞。它们之间的区别在于,管胞是无孔细胞,在它们的公共壁上只有纹孔对,而导管分子还有穿孔(perforations),这些穿孔是缺乏初生壁和次生壁的区域,导管分子通过这些穿孔相互连接。
导管分子壁上带有穿孔的部分称为穿孔板(perforation plate) 。穿孔板可能有一个穿孔(单穿孔板,simple perforation plate;图 10.2D-F 和 10.3A)或几个穿孔(多穿孔板,multiple perforation plate)。多穿孔板中的穿孔可能细长并排列成平行系列(梯形穿孔板,scalariform perforation plate,来自拉丁语scalaris,梯子;图 10.2C 和 10.3B、D),或呈网状(网状穿孔板,reticulate perforation plate,来自拉丁语rete,网;图 10.3D),或作为一组近似圆形的孔(孔状穿孔板,foraminate perforation plate;图 10.3C;见图 10.16)。
低海拔热带森林的木本植物中很少发现多穿孔板。它们在热带高山植物群和温带和温和中温带气候的木本植物中更常见,这些气候的特点是冬季温度较低,而具有梯状结构的物种往往局限于相对非季节性的中生栖息地,例如热带云雾林、夏季湿润温带森林或土壤永不干燥的北方栖息地(Baas,1986;Alves 和 Angyalossy-Alfonso,2000;Carlquist,2001)。
穿孔通常发生在端壁上,导管分子端对端连接(图 10.4),形成长而连续的柱子或管子,称为导管(vessels)。侧壁上也可能存在穿孔。除最上部和最下部导管分子外,导管的每个导管分子两端均带有穿孔板。最上部导管分子的上端没有穿孔板,最下部导管分子的下端没有穿孔板。水和溶质通过公共壁上的纹孔对从一个导管移动到另一个导管。导管的长度定义为水在不穿过纹孔膜从一个导管穿过另一个导管的情况下可以移动的最大距离(Tyree,1993 年)。

单个导管可以由少至两个导管分子组成(例如,在莎草科的珍珠茅属 Scleria 茎的初生木质部中;Bierhorst 和 Zamora,1965 年),也可以由数百甚至数千个导管分子组成。在后一种情况下,导管长度不能通过传统的显微镜方法测定。茎段中最长导管的近似长度可以通过将空气强行通过一段含有两端切开的导管的茎来确定(Zimmermann,1982)。一个物种的最长导管略长于空气可以强行通过的最长茎段。导管长度分布可以通过将稀释的乳胶漆强行通过一段茎来确定(Zimmermann 和 Jeje,1981;Ewers 和 Fisher,1989)。涂料颗粒通过穿孔从一个导管分子移动到另一个导管分子,但太大而无法穿透纹孔膜的微小孔隙。随着水的横向流失,涂料颗粒在导管中积聚,直到导管被它们塞满。然后将树干切成等长的段,在距注射点不同距离处计数含有涂料的导管(用立体显微镜很容易识别)。假设导管是随机分布的,可以计算出导管长度的分布。在给定的压力梯度下,可以用空气流速测量代替涂料来确定导管长度分布(Zimmermann,1983)。
最长的导管出现在木本真双子叶植物中环孔材物种的早材里。在环孔材物种中,一个生长层中最早形成的木材(早材)的导管(孔)特别宽(图 10.1;第 11 章)。一些大直径的导管被发现延伸到树干的几乎整个长度,尽管大多数要短得多。测量到的美国白梣 (Fraxinus americana) 的最大长度为 18 米 (Greenidge, 1952),红槲栎 (Quercus rubra) 的最大长度为 10.5 至 11.0 米 (Zimmermann 和 Jeje, 1981)。一般来说,导管长度与导管直径相关:宽导管较长,窄导管较短 (Greenidge, 1952; Zimmermann 和 Jeje, 1981)。然而,导管长度分布分析表明,木质部包含的短导管比长导管多得多。
据报道,树木和灌木的导管分子尺寸从叶到根逐渐增加 (Ewers 等人,1997)。在北美红杉 (Sequoia sempervirens) 中,管胞直径和长度从树枝到树干再到根部逐渐增大 (Bailey, 1958)。在红花槭 (Acer rubrum) 中,导管直径和长度从小枝到树枝、从茎到根部逐渐增大 (Zimmermann and Potter, 1982)。同样,在水桦 (Betula occidentalis) 中,小枝中的导管最窄,树干中的导管中等,根中的导管最宽 (Sperry and Saliendra, 1994)。一般来说,根部的导管比茎部的导管宽。藤本植物是个例外,因为它们的茎部导管与根部的导管一样宽,甚至比根部的导管更宽 (Ewers et al., 1997)。导管直径的向基增加伴随着导管密度的降低,即单位横截面积上的导管数量减少。
大多数管状分子的次生壁含有纹孔
在最新形成的初生木质部和次生木质部上,导管分子的次生壁中可发现简单纹孔和具缘纹孔。这些纹孔的数量和排列变化很大,即使在同一个细胞的不同壁面或表面上也是如此,因为它们取决于特定壁面边界的细胞类型。通常连续的管状分子之间出现具缘纹孔对(管间纹孔,intervascular pitting;图 10.5);管状分子和纤维之间可能没有或只有很少的纹孔对;在管状分子和薄壁细胞之间存在具缘纹孔对、半缘纹孔对或单纹孔对。半缘纹孔对中,具缘部分位于管状分子侧(图 10.5K)。
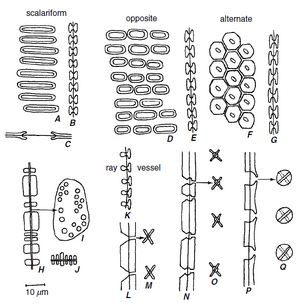
管状分子中的具缘纹孔主要有三种排列类型:梯状(scalariform)、对生(opposite)和互生(alternate)。如果纹孔横向延长并排列成垂直的梯状列,则这种图案称为梯状纹孔(scalariform pitting)(图 10.5A-C)。圆形或椭圆形的具缘纹孔在水平方向上成对或成短行排列,为对生纹孔(opposite pitting)的特征(图 10.5D、E)。如果这些纹孔相互紧邻,其边缘在正面观中将呈现矩形轮廓。当纹孔以对角线排列时,为互生纹孔(alternate pitting)(图 10.5F、G 和 10.8),纹孔相互紧邻,导致边缘在正面观中呈现多边形(有棱角且有四条以上边)。互生纹孔显然是真双子叶植物中最常见的纹孔类型。
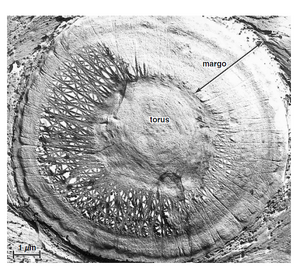
针叶树管胞的具缘纹孔对具有特别复杂的结构(Hacke 等人,2004 年)。在大型、壁相对较薄的早材管胞中,这种纹孔对通常从正面看呈圆形(图 10.6A),其边缘围成一个明显的空腔(图 10.6B)。纹孔膜的中心有一个增厚部分,即纹孔塞(torus,复数:tori),其直径比纹孔孔径略大(图 10.6A、B)。它被纹孔膜的薄部分,即塞缘(margo)所包围,塞缘由成束的纤维素微纤维组成,其中大部分从纹孔塞辐射出来(图 10.6A 和 10.7)。塞缘的开放结构是由于细胞成熟过程中去除了初生壁和中层的非纤维素基质。中间层和初生壁的增厚,称为眉条(crassulae,单数:crassula,来自拉丁语,意为“小增厚”),可能发生在纹孔对之间(图 10.6A 中不明显)。塞缘是柔韧的,在某些压力条件下,它会向边界的一侧或另一侧移动,用纹孔塞关闭孔口(图 10.6C)。当纹孔塞处于此位置时,水通过纹孔对的移动受到限制。这种纹孔对被称为闭塞的(aspirated)。纹孔塞是买麻藤类植物和针叶植物中具缘纹孔的特征,但可能发育不良。在几种真双子叶植物中发现了纹孔塞或类纹孔塞结构(Parameswaran 和 Liese,1981;Wheeler,1983;Dute 等人,1990,1996;Coleman 等人,2004;Jansen 等人,2004)。这些纹孔膜的塞缘与针叶树的不同之处在于,这些微纤维不是从纹孔塞辐射出来,而是形成一个包含许多非常小的孔的密集网状结构。在针叶树管胞和薄壁细胞之间的壁中出现的半缘纹孔对的膜中没有纹孔塞。

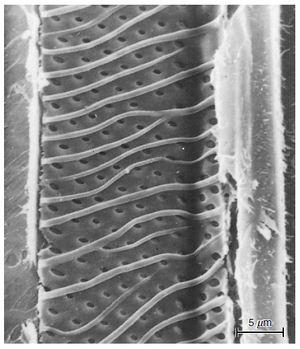
在某些真双子叶植物中,纹孔腔和/或孔全部或部分地排列着次生壁上的微小突起(Jansen 等人,1998 年,2001 年)。这些突起大多是分枝状或形状不规则的,被称为饰纹(vestures),这种纹孔被称为附物纹孔(vestured pits)(图 10.8)。vestures可能出现在次生木质部的所有细胞类型中。它们不仅与纹孔有关,还可以出现在壁的内表面、穿孔板上以及导管壁的螺旋增厚处(见下文)(Bailey,1933 年;Butterfield 和 Meylan,1980 年;Metcalfe 和 Chalk,1983 年;Carlquist,2001 年)。裸子植物的管胞壁上也会出现vestures,在两类单子叶植物中都观察到了这种现象,即某些竹(Parameswaran 和 Liese,1977)和棕榈树(Hong 和 Killmann,1992)。裸子植物的管胞壁和被子植物的导管和纤维壁上也会出现微小的不分枝的突起,通常称为疣(warts)(Castro,1988;Heady 等人,1994;Dute 等人,1996)。一些研究人员认为vestures和warts之间没有区别,并建议将warts和warty layer替换为vestures 和vestured layer(Ohtani 等人,1984)。
显然,大多数vestures主要由木质素组成(Mori 等人,1980 年;Ohtani 等人,1984 年;Harada 和 Côté,1985 年)。据报道,豆科植物的一些vestures缺乏木质素(Ranjani 和 Krishnamurthy,1988 年;Castro,1991 年)。vestures的其他成分是半纤维素和少量果胶;缺乏纤维素(Meylan 和 Butterfield,1974 年;Mori 等人,1983 年;Ranjani 和 Krishnamurthy,1988 年)。
导管穿孔板的类型与附物纹孔之间存在着显著的相关性:几乎所有具有附物纹孔的分类群都有单穿孔板(Jansen 等人,2003 年)。这种相关性以及其他因素,导致人们认为,附物纹孔有助于提高液压安全性。一项研究的结果支持了这一观点。有证据表明,vestures限制了纹孔膜从纹孔腔中心偏转的程度,从而限制了机械应力导致的纹孔膜孔隙度的增加,并降低了空气通过膜进入的概率 (Choat 等,2004)。
称为螺旋增厚(helical thickenings或 helical sculp tures)的脊状结构,可能以大致螺旋状的图案形成在导管分子的内表面上,而不覆盖纹孔 (图 10.9)。在次生木质部中,螺旋增厚在晚材中更常见 (Carlquist 和 Hoekman,1985)。螺旋状增厚在亚热带和温带植物群的木本植物中似乎比在热带植物群的木本植物中更常见 (Van der Graaff 和 Baas, 1974; Baas, 1986; Alves 和 Angyalossy-Alfonso, 2000; Carlquist, 2001)。
正如 Sperry 和 Hacke (2004) 所指出的,管胞和导管壁(木质部管道壁)发挥三种重要作用。它们 (1) 允许水在相邻管道之间流动,(2) 防止空气从充气(栓塞)管道进入相邻的充满水的功能性管道,以及 (3) 防止在蒸腾流的显著负压下内爆(壁坍塌;Cochard 等,2004)。这些功能由木质化的次生壁和纹孔实现,木质化的次生壁提供强度,纹孔使水在导管之间流动。
导管是比管胞更有效的输水管道
导管作为输水管道的效率更高(Wang 等人,1992 年;Becker 等人,1999 年),部分原因是水可以通过端壁上的穿孔在导管分子之间相对畅通无阻地流动。相比之下,从管胞流向管胞的水必须通过重叠壁上的纹孔对的纹孔膜。据估计,加拿大铁杉 (Tsuga canadensis) 管胞中具缘的纹孔占这些管道中水流总阻力的约三分之一 (Lancashire 和 Ennos, 2002)。然而,针叶树管胞的纹孔塞-塞缘比均质导管纹孔膜更具导水性 (Hacke 等人, 2004; Sperry 和 Hacke, 2004)。纹孔塞-塞缘导水性或效率更高的原因是塞缘中的孔比导管纹孔膜中的孔大。
导管越宽越长,其水力传导性就越高 (或对水流的阻力越低)。在这两个参数中,导管宽度对传导率的影响要大得多(Zimmermann,1982,1983)。导管的水力传导率大致与其半径(或直径)的四次方成正比。因此,如果三个导管的相对直径分别为 1、2 和 4,则在类似条件下流过它们的水的相对体积分别为 1、16 和 256。因此,宽导管比窄导管更能有效地传导水。然而,虽然增加导管直径会大大提高水传导效率,但同时也会降低安全性。
菊花 (Dendranthema × grandiflorum) 茎高每增加 0.34 米,水力传导率就会降低 50% (Nijsse 等人,2001)。传导率的降低是由于茎高增加时导管的横截面积和长度都减小。关于后一个因素,茎高越高,每单位茎长,水流必须穿过更多的导管间连接(纹孔对)。导管腔体计算为水力阻力的约 70%,纹孔对至少占剩余 30% 的一部分 (Nijsse 等人,2001)。
木质部管道(导管和/或管胞)中的水柱通常处于张力之下,因此容易发生空化(cavitation),即管道内形成空腔,导致水柱破裂。空化会导致管道被空气栓塞(embolism)或堵塞。从单个导管分子开始,整个导管可能很快就会充满水蒸气和空气(图 10.10)。现在,该导管功能失调,不再能够导水。由于宽导管往往比窄导管长,因此植物拥有的宽导管比窄导管少会更安全(Comstock 和 Sperry,2000 年)。由于木质部导管相对较大,根部比茎或树枝更容易受到水分胁迫引起的空化影响(Mencuccini 和 Comstock,1997 年;Linton 等人,1998 年;Kolb 和 Sperry,1999 年;Martínez Vilalta 等人,2002 年)。
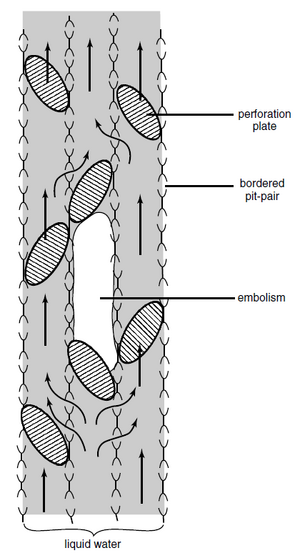
尽管纹孔膜对管道之间的水流造成了显著的阻力,但它们对于水分运输的安全也非常重要。空气-水弯月面的表面张力横跨相邻导管之间具缘纹孔对的纹孔膜中的小孔,通常会阻止气泡挤过孔,从而有助于将它们限制在单个导管中(图 10.11;Sperry 和 Tyree,1988 年)。 在针叶树管胞中,纹孔对的闭塞阻止了空气的通过,导致纹孔被纹孔塞堵塞。 塞缘的孔通常太大而无法容纳栓塞。
两种现象——冰冻和干旱——是造成空化事件的主要原因(Hacke 和 Sperry,2001 年)。在冬季和生长季节,温带木本植物的大多数栓塞都与冻融事件有关(Cochard 等人,1997 年)。木质部汁液含有溶解的空气。当汁液冻结时,溶解的气体会以气泡的形式冻结出来。大量证据表明,大直径的导管比小直径的导管更容易受到冻害引起的栓塞,而针叶树的管胞最不容易受到影响(Sperry 和 Sullivan,1992 年;Sperry 等人,1994 年;Tyree 等人,1994 年)。正如 Sperry 和 Sullivan (1992) 所指出的,这也许可以解释为什么随着纬度和海拔的增加,管道尺寸减小(Baas, 1986)、高纬度地区木质藤本植物(具有宽大导管)变得稀有 (Ewers, 1985; Ewers 等, 1990),以及在寒冷气候下管胞狭窄的针叶树占主导地位 (有关针叶树木质部脆弱性的讨论,请参阅 Maherali 和 DeLucia, 2000 和 Stout 和 Sala, 2003 及其引用的文献)。
干旱引起的水分胁迫增加了木质部汁液,即木质部液体内含物的张力。当这种张力超过横跨纹孔膜孔隙的空气-水弯月面的表面张力时,空气可能会被拉入功能性管道(Sperry and Tyree,1988)。这个过程被称为空气植入(air seeding)(Zimmermann,1983;Sperry and Tyree,1988)。最大的孔隙最容易受到空气渗透。只要植物的导管或管胞之一因物理损伤(例如,被风或食草动物)而充满空气,植物就容易受到这种栓塞模式的影响。在针叶树中,当管胞之间的压力差大到足以将纹孔塞从其位置撕裂时,就可能发生空气植入(Sperry and Tyree,1990)。
关于木质部栓塞后水力传导恢复的可能机制,人们进行了大量讨论(Salleo 等人,1996 年;Holbrook 和 Zwieniecki,1999 年;Tyree 等人,1999 年;Tibbetts 和 Ewers,2000 年;Zwieniecki 等人,2001a 年;Hacke 和 Sperry,2003 年)。两种机制被认为是经历冬季栓塞的欧洲水青冈 (Fagus sylvatica) 树木水力传导恢复的原因(Cochard 等人,2001b 年)。一种机制在早春萌芽前起作用,与树干底部出现正木质部压力有关。正木质部压力驱动主动溶解栓塞。第二种恢复机制在芽萌发后起作用,与形成层活动的恢复相关。此时,栓塞的导管被新的功能性导管所取代。正如 Cochard 等人 (2001b) 所指出的,这两种机制是互补的:第一种机制主要发生在根部和树干中,第二种机制主要发生在年轻的顶枝中。在另一项研究中,桦树 (Betula spp.) 和桤木 (Alnus spp.) 树枝的冬季栓塞通过在春季用正根压重新填充导管而逆转,而甘比耳氏栎 (Quercus gambelii) 树枝则依靠新的功能性导管的产生来恢复水力传导 (Sperry 等人,1994)。与欧洲水青冈一样,桦树和桤木是散孔木;甘比耳氏栎是环孔木。
尽管人们早已知道正根压在栓塞木质部管道的再填充中起着重要作用(Milburn,1979),但有报道称,栓塞的管道可以在没有根压和木质部压力明显为负的情况下再填充(Salleo 等人,1996;Tyree 等人,1999;Hacke 和 Sperry,2003)。据报道,在蒸腾草本植物的枝条(Canny,1997a、b)和根(McCully 等人,1998;Buchard 等人,1999;McCully,1999)中的许多导管中每天都会发生栓塞。虽然人们普遍认为栓塞导管的重新充满水是在蒸腾作用停止后发生的,但据报道,相关草本植物中栓塞导管的重新充满发生在植物仍在蒸腾且木质部汁液仍处于张力之下时。这些研究得出的结论受到了一些工作者的批评,他们认为观察到的栓塞是这些研究中所用的冷冻步骤(冷冻显微镜)造成的假象(Cochard 等人,2001a;Richter,2001;但见 Canny 等人,2001)。
导管壁的雕刻和穿孔板的性质可能会影响栓塞的易发性。例如,有人提出,螺旋状增厚可能通过增加导管的表面积来减少栓塞事件的发生,从而增加水与导管壁的结合(Carlquist,1983)。螺旋状增厚也可能增加狭窄导管的输导能力,这将为它们在狭窄的晚材导管中普遍存在提供因果解释(Roth,1996)。梯状穿孔板被认为是一种在单个导管分子中捕获气泡并因此防止整个导管堵塞的机制(Zimmermann,1983;Sperry,1985;Schulte 等人,1989;Ellerby 和 Ennos,1998)。虽然简单的穿孔板对流动的阻力低于除最简单的梯状穿孔板以外的所有穿孔板,但梯状穿孔板(即使是那些穿孔较窄的穿孔板)对流动的阻碍也很小(Schulte 等人,1989)。无论穿孔板的类型如何,导管分子中的绝大多数流动阻力似乎都是由于导管壁造成的(Ellerby 和 Ennos,1998)。
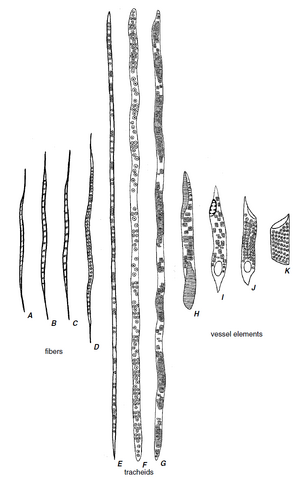
纤维是木质部中特化的支持分子
纤维是长细胞,具有次生壁,通常木质化。壁的厚度各不相同,但通常比同一木材中的管胞壁厚。木质部纤维有两种主要类型,即纤维管胞(fiber-tracheids)和韧型纤维 (libriform fibers)(第 8 章)。如果两者都出现在同一木材中,韧型纤维比纤维管胞更长,并且通常具有比纤维管胞更厚的壁。纤维管胞(图 10.5N,O)具有具缘纹孔,其腔比同一木材中的管胞或导管(图 10.5P,Q)的纹孔腔小。这些纹孔具有纹孔管,其外孔为圆形,内孔为细长或狭缝状(第 4 章)。
韧型纤维中的纹孔具有朝向细胞腔的狭缝状孔和类似非常扁平的漏斗的管,但没有纹孔腔(图 10.5L、M)。换句话说,纹孔没有纹孔缘;它是单纹孔。将韧型纤维的纹孔视作单纹孔,暗示了比实际存在的更明显的划分。纤维状木质部细胞在具有明显纹孔缘的细胞和具有残留纹孔缘或没有纹孔缘的细胞之间显示出一系列渐变的纹孔。为方便起见,具有可识别纹孔缘的过渡形式被归入纤维管胞类别(Panshin 和 de Zeeuw,1980 年)。
两种类型的纤维都可能有隔膜(第 8 章)。隔膜纤维(图 8.6A;见图 10.15)广泛分布于真双子叶植物中,在热带硬木中很常见,它们通常将其原生质体保留在成熟的活性木材中(第 11 章),在那里它们负责储存储备物质(Frison,1948;Fahn 和 Leshem,1963)。因此,活纤维在结构和功能上接近木质部薄壁细胞。当薄壁细胞发育出次生壁和隔膜时,两者之间的区别尤其微弱。原生质体在纤维中的保留是演化优势的标志(Bailey,1953;Bailey 和 Srivastava,1962),而当有活纤维存在时,轴向薄壁组织的数量很少或不存在(Money 等,1950)。
纤维管胞和韧型纤维的另一种变体是所谓的胶状纤维(第 8 章)。胶状纤维(图 8.7;见图 10.15)是真双子叶植物反应木(第 11 章)的常见成分。
(有关纤维的进一步论述,参见 第八章 厚壁组织)
活薄壁细胞存在于初生木质部和次生木质部中
在次生木质部中,薄壁细胞通常以两种形式存在:轴向薄壁细胞(axial parenchyma)和射线薄壁细胞(ray parenchyma)(见图 10.16)。轴向薄壁细胞来自维管形成层的细长纺锤形初始细胞,因此它们的长轴在茎或根中沿垂直方向。如果这种形成层细胞的衍生物分化为没有横向(或斜向)分裂的薄壁细胞,则会产生纺锤形薄壁细胞(fusiform parenchyma cell)。如果发生此类分裂,则会形成薄壁组织束(parenchyma strand)。薄壁组织束比梭形薄壁细胞更常见。两种类型都不会经历侵入性生长。射线薄壁细胞源自维管形成层相对较短的射线原始细胞,其长轴可能相对于茎或根的轴垂直或水平(第 11 章)。
次生木质部的射线薄壁细胞和轴向薄壁细胞通常具有木质化的次生壁。薄壁细胞之间的纹孔对可能是具缘的、半具缘的或简单的(Carlquist,2001),尽管它们几乎总是简单的(图 10.5H-J)。一些薄壁细胞沉积厚的次生壁,这些是石细胞。
木质部的薄壁细胞内具有多种成分。它们以储存淀粉或脂肪形式的食物储备而闻名。在温带的许多落叶乔木中,淀粉在夏末或初秋积累,并在休眠期间减少,因为淀粉在冬季低温下转化为蔗糖(Zimmermann 和 Brown,1971;Kozlowski 和 Pallardy,1997a;Höll,2000)。完全休眠期间淀粉的分解可能主要是对霜冻伤害的保护作用(Essiamah 和 Eschrich,1985)。淀粉在休眠期结束时重新合成并再次积累,即早春。随后,随着早期生长旺盛期储备物质的利用,其含量会逐渐减少。薄壁组织细胞的脂肪和储存蛋白含量也会随季节变化 (Fukazawa 等人,1980 年;Kozlowski 和 Pallardy,1997 年 b;Höll,2000 年)。
单宁和晶体是常见的内含物 (Scurfield 等人,1973 年;Wheeler 等人,1989 年;Carlquist,2001 年)。晶体的类型及其排列可能具有足够的特征,可用于识别木材。棱柱形 (菱形) 晶体是木材中最常见的晶体类型。含有晶体的薄壁细胞通常具有木质化壁,具有次生增厚,并可能被隔膜分成小室,每个小室包含单个晶体。细胞可能在晶体周围分泌一层次生壁物质。通常,这层壁物质相对较薄,但在某些情况下,它可能非常厚,以至于填满晶体和初生壁之间的大部分细胞腔。在草本植物和木本植物的幼枝中,叶绿体通常出现在木质薄壁细胞中,特别是射线薄壁细胞中(Wiebe,1975)。
在某些物种中,薄壁组织细胞会形成突出(侵填体)进入导管
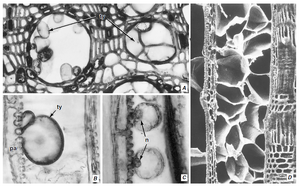
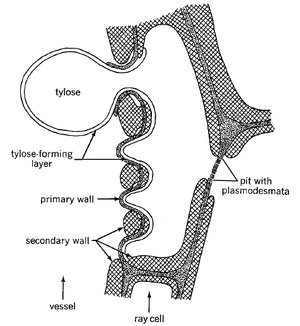
在次生木质部中,位于导管旁边的轴向薄壁组织细胞和射线薄壁组织细胞,都可能在导管失去活性并失去内部压力时,通过纹孔腔形成向外生长的突起,并进入导管腔内(图 10.12)。这些突起被称为侵填体(tyloses,单数:tylose),而产生这些突起的薄壁组织细胞被称为接触细胞(contact cells)(Braun,1967,1983),因为它们实际上直接与导管接触(接触细胞将在第 11 章中进一步讨论)。接触细胞的特点是存在松散的纤维状、缺乏纤维素、富含果胶的壁层,该壁层由原生质体在次生壁形成完成后沉积(Czaninski,1977;Gregory,1978;Mueller 和 Beckman,1984)。它被称为保护层(protective layer),通常沉积在接触细胞壁的所有表面上,但在细胞与导管接壤的一侧最厚,尤其是在纹孔膜处。
在侵填体形成期间,保护层膨胀为侵填体进入导管腔(图 10.13)。薄壁细胞的细胞核和部分细胞质通常迁移到侵填体中。侵填体的生长似乎受激素控制 (VanderMolen 等,1987)。侵填体储存各种物质,并可能形成次生壁。有些甚至分化成石细胞。当导管侧的纹孔直径小于 10 μm 时,很少发现侵填体 (Chattaway,1949),这表明侵填体的形成可能受到最小的接触纹孔直径的物理限制 (van der Schoot,1989)。除次生木质部外,侵填质也出现在初生木质部中 (Czaninski,1973;Catesson 等,1982;Canny,1997c;Keunecke 等,1997)。
侵填质可能非常多,以至于它们完全填满导管分子的腔。在某些木材中,它们是在导管停止发挥作用时形成的(图 10.12A、D)。侵填体通常会受植物病原体诱导而过早形成,并可能通过抑制病原体通过木质部在植物中传播发挥防御机制作用(Beckman 和 Talboys,1981;Mueller 和 Beckman,1984;VanderMolen 等人,1987;Clérivet 等人,2000)。 在受镰孢菌(Fusarium)感染的香蕉中,保护层与植物病原体的形成无关(VanderMolen 等人,1987)。
❙ 管状分子和纤维的系统发育特化
木质部在植物组织中占据着独特的地位,因为其解剖学研究在分类学和系统发育学中发挥着重要作用。木质部各种结构特征的特化过程比任何其他单一组织都更明确。在各个路线中,与管状分子演化有关的路线研究得尤为彻底。
管胞是一种比导管分子更原始的分子。它是唯一一种在化石种子植物(Stewart and Rothwell,1993;Taylor and Taylor,1993)和大多数现存的无籽维管植物和裸子植物(Bailey and Tupper,1918;Gifford and Foster,1989)中发现的管状分子。
管状分子的特化与维管植物演化过程中传导和支持功能的分离相吻合(Bailey,1953)。在特化程度较低的状态下,传导和支持在管胞中结合在一起。随着特化的提高,传导分子(即导管分子)在传导方面的效率高于在支持方面的效率。相反,纤维则主要作为支持分子演化。因此,从原始管胞开始,两条特化路线就分化出来了,一条是朝着导管的方向,另一条是朝着纤维的方向(图 10.14)。
导管分子在某些蕨类植物中独立演化,包括松叶蕨类 [ 松叶蕨(Psilotum nudum)和梅溪蕨(Tmesipteris obliqua) ] (Schneider and Carlquist, 2000c; Carlquist and Schneider, 2001), 木贼属(Equisetum) (Bierhorst, 1958), 卷柏(Selaginella)(Schneider and Carlquist, 2000a, b)、买麻藤类(Carlquist, 1996a)、单子叶植物和“双子叶植物”(木兰藤目、木兰类和真双子叶植物)。真双子叶植物导管分子首先在次生木质部发生并特化,然后在晚期初生木质部(后生木质部),最后在早期初生木质部(原生木质部)。单子叶植物初生木质部导管分子的发生和特化也是首先在后生木质部,然后在原生木质部;此外,在单子叶植物中,导管分子首先出现在根部,然后依次出现在茎、花序轴和叶中(Cheadle,1953;Fahn,1954)。在真双子叶植物中,导管的首次出现与器官类型之间的关系尚未得到充分研究,但一些数据表明,叶片、花附属物和幼苗中有相关的演化迟滞(Bailey,1954)。
在真双子叶植物的次生木质部中,具有导管分子的物种起源于具有梯状边缘纹孔的管胞的物种(Bailey,1944)。从无导管状态到有导管状态的转变,涉及含多个具缘纹孔的细胞壁部分区域纹孔膜的丢失。因此,有纹孔的壁部分变成了梯状穿孔板(图 10.14G、H)。膜的残留出现在许多原始真双子叶植物导管分子的穿孔中,这被认为是真双子叶植物的原始特征(Carlquist 1992、1996b、2001)。管胞-导管的转变并不明显;可以发现各种程度的中间转变(Carlquist 和 Schneider,2002)。
导管分子演化的主要趋势与导管分子长度的减少相关
1. 长度减少。导管分子演化中最明显的趋势是长度减少(图 10.14H-K)。较长的导管分子出现在更原始的群体(具有更多原始花部特征的群体)中,较短的导管分子出现在更特化的群体(具有更多特化花部特征的群体)中。真双子叶植物次生木质部中导管分子类型的演化顺序始于长梯状凹陷管胞,类似于某些原始真双子叶植物中发现的管胞。这些管胞被细长且末端逐渐变细的导管分子所取代。然后,导管分子的长度逐渐减小。导管分子在系统发育过程中的缩短是一个特别一致的特征,并且发生在所有已发育出导管的维管植物中(Bailey,1944)。导管分子演化的其他趋势与导管分子长度的减少相关。
2. 倾向于横向端壁。随着导管分子缩短,其端壁倾斜度减小,最终呈横向。因此,导管分子逐渐获得倾斜度逐渐减小的明确端壁,与管胞的逐渐变细的末端形成对比。
3. 梯状到简单的穿孔板。在更原始的状态下,穿孔板是梯状的,有许多横条,与具有梯状排列的、没有纹孔膜的具缘纹孔的细胞壁类似。特化的增加导致纹孔缘的去除,然后条状物的数量减少,直到最后条状物完全消失。因此,有纹孔的壁部分变成了梯状穿孔板,后来演变成带有单个开口的简单穿孔板(图 10.14G-I)。
4. 梯状具缘纹孔到互生具缘纹孔。在演化过程中,导管壁的纹孔也发生了变化。在导管间纹孔中,梯状排列中的具缘纹孔对被其他类型具缘纹孔对取代,先是对生,后来是互生(图 10.14H-K)。导管和薄壁细胞之间的纹孔对从具缘、半具缘到简单纹孔对。
5. 导管轮廓从有棱角变为圆形(如横截面所示)。在真双子叶植物导管中,轮廓的棱角性被认为是原始状态,而圆形则是一种特殊情况。有趣的是,棱角性和导管狭窄度之间存在相关性。轮廓为圆形的导管往往更宽。
据推测,导管分子的系统发育特化朝着增加传导效率或安全性的方向发展,尽管趋势与其适应价值之间的关系并不总是很明显。例如,对于减少导管分子长度的功能意义几乎没有共识,尽管在较干燥生境的真双子叶植物中发现的导管分子比在较潮湿生境的相关真双子叶植物中发现的导管分子更短(Carlquist,2001)。从梯状纹孔到对生纹孔再到互生纹孔的趋势的适应意义似乎是导管壁机械强度的增加,而不是安全性或导水性(Carlquist,1975)。虽然导管演化趋势不像其他特征那样明确,但导管分子的加宽显然导致更大的传导能力。
导管分子演化趋势存在偏差
前几段讨论的导管分子特化的不同趋势在特定的植物群体中不一定密切相关。其中一些趋势可能被加快了,而另一些趋势则可能被减缓,因此更高度特化和不太高度特化的特征会组合出现。(镶嵌演化,小子!)此外,植物可能由于演化上的丢失而继发性地获得看似原始的特征。例如,导管的特征可能由于潜在导管分子中穿孔的不发育而丢失。在水生植物、寄生虫和多肉植物中,导管可能无法发育,同时维管组织减少。这些无导管植物与原始无导管的被子植物(例如 昆栏树属 Trochodendron、水青树属 Tetracentron、林仙属 Drimys、含笑林仙属 Pseudowintera 等)相比,具有高度特化性(Bailey,1953;Cheadle,1956;Lemesle,1956)。在某些科中,例如仙人掌科和菊科,导管分子的演化退化涉及细胞宽度的减小和穿孔的不发育(Bailey,1957;Carlquist,1961)。由此产生的无穿孔细胞具有与相同木材的导管分子相同类型的凹陷,被称为维管胞(vascular tracheids)。特化的另一个偏离趋势可能是在系统发育上高度发达的科(如菊科)中发展出网状穿孔板(Carlquist,1961)。
尽管存在这些不一致之处,但被子植物导管分子特化的主要趋势是如此可靠地确定,以至于它们在确定木质部其他结构的特化方面发挥着重要作用。虽然木质部演化的主要趋势通常被认为是不可逆的,但生态木材解剖学研究的结果表明,木材结构与宏观气候环境因素(例如温度、季节性和水资源可用性)之间存在很强的相关性,这使人们对演化趋势的完全不可逆性产生了怀疑(参见 Endress 等人,2000 年的讨论和参考文献)。不可逆性的概念也受到了分支分类分析的挑战,这些分析表明无导管是一种衍生状态,而不是原始状态(例如,Young,1981;Donoghue 和 Doyle,1989;Loconte 和 Stevenson,1991)。有人假设,冬科植物的无导管状态是由于导管的丧失而导致的,这种丧失是为了适应易受冻的环境(Feild 等人,2002)。Baas 和 Wheeler(1996)以及 Carlquist(1996b)为支持不可逆性的概念提出了优雅而令人信服的辩护。被子植物是否原始地无导管仍然是一个有争议的问题(Herendeen 等人,1999;Endress 等人,2000)。到目前为止,尽管化石记录很少,但还没有证据表明被子植物最初是无导管的。事实上,中、晚白垩世出现了具有相当先进木材的带导管被子植物(Wheeler and Baas,1991),而最古老的无导管被子植物木材来自晚白垩世(Poole and Francis,2000)。额外的古植物学数据可能有助于解决这个问题。Amborella 中明显缺乏导管——被许多人认为是所有其他被子植物的姐妹——表明祖先被子植物的状态是无导管的(Parkinson 等人,1999;Zanis 等人,2002;被子植物系统发育组,2003)。虽然被子植物中导管分子演化,但管胞被保留了下来,它们也经历了系统发育变化。管胞变短了,但没有导管分子短,其壁上的凹陷变得与导管分子基本相似相关导管分子的宽度。管胞的宽度通常没有增加。管胞可能出于导电安全性的原因而被保留,尽管它们仅存在于现存木材中的比例相对较小。
与导管分子和管胞一样,纤维经历了系统发育缩短
在木质部纤维的特化中(图 10.14D-A),机械支撑功能作为重点在细胞宽度的减小和纹孔膜占据的壁面积的减小中变得明显。同时,纹孔缘减小并最终消失。纹孔的内孔变长,然后呈缝状,与构成壁的纤维素微纤维平行。演化顺序是从管胞,通过纤维管胞,到韧型纤维。两种类型的纤维相互关联,也与管胞关联。由于纤维和管胞之间缺乏明确的区分,这两种类型的分子有时被统归为无孔管状分子(imperforate tracheary elements)(Bailey 和 Tupper,1918;Carlquist,1986)。纤维在具有最特化的导管分子的木材中作为支撑分子最为特化(图 10.15),而具有管胞状导管分子的木材中则缺乏此类纤维(图 10.16)。进一步的演化进步导致原生质体被隔膜纤维保留(Money 等人,1950)。

纤维长度的演化变化问题相当复杂。导管分子的缩短与纺锤状初始细胞(第 12 章)的缩短有关,木质部的轴向细胞就是从纺锤状初始细胞衍生而来的。因此,在导管分子较短的木材中,纤维在个体发育过程中从比更加原始的木材中的较长的原始细胞更短的初始细胞衍生而来。换句话说,随着木质部特化程度的提高,纤维变得更短。然而,由于在个体发育过程中纤维经历侵入性生长,而导管分子仅轻微生长或根本不生长,因此纤维比成熟木材中的导管分子长,并且在两类纤维中,韧形纤维是较长的。然而,经历特化后木材的纤维比它们最终的原始前体——原始管胞——短。
❙ 初生木质部
初生木质部早期和晚期形成的部分之间存在一些发育和结构差异
从发育上讲,初生木质部通常由早期形成的部分原生木质部(protoxylem)(来自希腊语 proto,意为第一)和晚期形成的部分后生木质部(metaxylem)(来自希腊语 meta,意为之后或之后)组成(图 10.17 和 10.18B)。尽管这两个部分具有一些区别性特征,但它们彼此融合得难以察觉,因此只能大致区分两者。
原生木质部在初生植物体尚未完成生长和分化的部分中分化。事实上,在茎和叶中,原生木质部通常在这些器官经历密集伸长之前成熟。因此,原生木质部的成熟无生命管状分子被拉伸并最终被破坏。在根部,原生木质部分子经常在主要伸长区域之外成熟,因此比在枝条中存活的时间更长。
后生木质部通常在仍在生长的初生植物体中开始分化,但在伸长完成后才基本成熟。因此,它受周围组织初生延伸的影响比原生木质部要小。
原生木质部通常包含相对较少的管状分子(管胞或导管分子),这些管状分子嵌入被认为是原生木质部一部分的薄壁组织中。当管状分子被破坏时,它们可能会被周围的薄壁组织细胞清除掉。后者要么保持薄壁,要么木质化,有或没有次生壁的沉积。在许多单子叶植物的茎木质部中,拉伸的无功能分子会部分塌陷但不会消失;相反,它们的位置上会出现开放的管道,即所谓的原生木质部空隙(protoxylem lacunae),周围是薄壁细胞(见图 13.33B)。沿着空隙的边缘可以看到无功能导管分子的次生壁。
后生木质部通常是一种比原生木质部更复杂的组织,其导管分子通常更宽。除了导管分子和薄壁细胞外,次生木质部可能还含有纤维。薄壁细胞可能分散在导管分子中,也可能呈放射状排列。在横切面上,薄壁细胞的排列类似于射线,但纵切面上则显示它们是轴向薄壁组织。这种在后生木质部和原生木质部中经常遇到的径向排列,有时导致研究人员将许多植物的初生木质部解释为次生木质部,因为径向排列是次生维管组织的特征。
后生木质部的管状分子在初生生长完成后保留,但在产生一些次生木质部后失去功能。在缺乏次生生长的植物中,次生木质部在成熟的植物器官中仍然具有功能。
初生管状分子具有各种次生壁增厚
不同形式的壁出现在特定的个体发育系列中,表明初生壁面积被次生壁材料覆盖的范围逐渐增加(图 10.18)。在最早的 管状分子 中,次生壁可能以不相互连接的环(环状增厚)形式出现。接下来分化的分子具有螺旋状(螺旋状)增厚。接下来是具有增厚的细胞,这些增厚可能以螺旋状相互连接(梯状增厚)为特征。这些细胞之后是具有网状或网状增厚的细胞,最后是凹陷分子。并非所有类型的次生增厚都必然出现在给定植物或植物部分的初生木质部中,不同类型的壁结构相互交错。环状增厚可能在这里和那里相互连接,环状和螺旋状或螺旋状和梯状增厚可能组合在同一个细胞中,梯状和网状之间的差异有时非常微弱,以至于增厚最好被称为梯状-网状。凹陷分子也与早期的个体发生类型相互交错。
次生壁梯状网状结构中的开口可能与纹孔类似,特别是当存在轻微的
边界时。次生壁的边界状拱形在初生木质部的各种类型的次生壁中很常见。梯状网状增厚的环、螺旋和
带可以通过狭窄的基部连接到初生壁,因此
次生壁层向细胞腔扩展并拱起暴露的初生壁部分(见图 10.25A)。
初生木质部中次生壁增厚的相互过渡性质使得无法将不同类型的壁增厚分配给原生木质部和次生木质部,并且具有任何程度的一致性。
最常见的是,最先成熟的导管分子,即原生木质部分子,具有最少量的
次生壁物质。环状和螺旋状增厚占主导地位。这些类型的增厚不会在初生植物体伸展生长过程中严重阻碍成熟的原生木质部分子的伸展。这种伸展发生的证据很容易从较老的木质部分子中环间距离的增加、环的倾斜和螺旋的展开中看出(图 10.19)。
后生木质部,就伸展生长后成熟的木质部组织而言,可能具有螺旋状、鳞片状、网状和凹陷分子;可以省略一种或多种类型的增厚。如果存在许多具有螺旋增厚的分子,则后续分子的螺旋会越来越不陡峭,这种情况表明在较早的后生木质部分子发育过程中发生了一些伸展。有令人信服的证据表明,初生木质部的壁增厚类型受到这些细胞分化的内部环境的强烈影响。当木质部在植物部分最大延伸之前开始成熟时,就会形成环状增厚,例如在正常伸长植物的枝条中(图 10.18A,节点 3-5);如果第一个分子在这种生长基本完成之后成熟,则可能会省略它们,这在根部很常见。如果在第一个木质部分子成熟之前抑制植物部分的伸长,则会省略一种或多种早期遗传类型的增厚。相反,如果通过黄化等刺激伸长,则将出现比通常更多的具有环状和螺旋增厚的分子。根据对成熟和发育中的被子植物原生木质部和次生木质部的综合研究(Bierhorst 和 Zamora,1965),次生增厚程度比螺旋结构更为广泛的成分分两个阶段沉积次生壁。
首先,构建螺旋框架(一级次生壁)。然后,额外的次生壁材料以片状或条状或两者的形式沉积在螺旋的回旋之间(二级次生壁)。这个概念可用于解释环境对壁型的影响,即根据情况抑制或诱导二级次生壁沉积。
不同类型的管状成分增厚的相互影响并不局限于初生木质部。初生木质部和次生木质部之间的界限也可能不明确。要识别这两种组织的界限,必须考虑许多特征,其中包括管状分子的长度(最后的初生分子通常比第一个次生分子长)和组织的组织,特别是次生木质部特有的射线和轴向系统组合的出现。有时,次生木质部的一个或多个识别特征的出现会延迟,这种现象被称为幼态发育(Carlquist,1962,2001)。在初生木质部中,原生木质部分子可能最窄,但不一定如此。连续分化的次生木质部分子通常越来越宽,而第一个次生木质部细胞可能相当窄,因此与最新的宽细胞次生木质部细胞不同。但总体而言,很难准确区分连续发育的组织类别。
❙ 管状分子分化
管状分子在个体发育过程中起源于原形成层细胞(就初生分子而言)或形成层衍生物(就次生分子而言)。原始管状分子在形成次生壁之前可能会或可能不会伸长,但它们通常会横向扩展。原始管状分子的伸长主要限于初生分子,并且与它们所在的植物部分的伸长或伸展有关。
分化中的管状分子是高度液泡化的细胞,具有细胞核和全套细胞器(图 10.20 和 10.21)。在许多管状分子分化的早期,细胞核在大小和倍性水平上都会发生显著变化(Lai 和 Srivastava,1976 年)。细胞核内重复在植物体细胞组织中很常见(第 5 章;Gahan,1988 年)。据推测,它为分化中的管状分子提供了额外的基因拷贝,以满足合成细胞壁和细胞质成分的大量需求(O’Brien,1981 年;Gahan,1988 年)。
细胞增大完成后,次生壁层以给定类型管状分子特有的模式沉积(图 10.20B 和 10.21)。
原始管状分子即将开始分化的最早迹象之一是皮层微管分布的变化(Abe 等,1995a、b;Chaffey 等,1997a)。起初,微管随机排列,均匀分布在整个管壁上(Chaffey,2000;Funada 等,2000;Chaffey 等,2002);在分化过程中,它们的方向会发生动态变化。例如,在正在扩张的针叶树管胞中,皮层微管的方向逐渐从纵向变为横向。B A
图 10.19
蓖麻子(Ricinus
communis)首次形成的初生木质部(原生木质部)的管状分子部分。 A、部分伸展的分子中倾斜的环状(左侧的环状形状)和螺旋状壁增厚。B、已伸展的分子中的双螺旋增厚。左侧的分子已大大伸展,螺旋的线圈已被拉得很远。
图示说明具有螺旋状二次增厚的导管分子的发育。A、无二次壁的细胞。B、细胞已达到全宽,细胞核已扩大,二次壁已开始沉积,孔位处的初生壁厚度增加。C、裂解阶段的细胞:二次增厚完成,液泡膜破裂,细胞核变形,孔位处的壁部分崩解。D、无原生质体的成熟细胞,两端均有开放的孔,二次增厚之间的初生壁部分水解。 (摘自 Esau,1977 年)横向,促进径向壁扩张(Funada 等人,2000 年;Funada,2002 年)。微管方向的进一步变化发生在次生壁形成过程中,因为现在螺旋排列的微管方向发生了几次变化,最终形成扁平的 S 螺旋(Funada 等人,2000 年;Funada,2002 年)。微管方向的变化反映在纤维素微纤维方向的变化中。在分化的 管状分子 中,皮质微管集中在次生增厚部位的带状中(图 10.22)。内质网在次生壁增厚沉积过程中比以前更加明显,其轮廓通常出现在增厚之间(图 10.21)。高尔基体和高尔基衍生囊泡在导管分子和管胞的次生壁形成过程中也很明显,因为高尔基体在基质物质(特别是半纤维素)的合成和输送到发育中的壁中起着重要作用(Awano 等,2000 年,2002 年;Samuels 等,2002 年)。高尔基体还将参与纤维素合成的玫瑰花结或纤维素合酶复合物输送到细胞壁。微纤维丝附着在质膜上(Haigler 和 Brown,1986 年)。
Hosoo 等人(2002 年)报道了日本隐孢子虫分化管胞中半纤维素(葡甘露聚糖)沉积的昼夜周期性。
尽管在夜间发育中的次生壁最内表面发现了大量含有葡甘露聚糖的无定形物质,但在白天很少观察到无定形物质,而此时纤维素纤维清晰可见。
次生壁沉积伴随着木质化。在次生壁沉积开始时,原始管状分子的初生壁未木质化。在初生分子中,初生壁通常保持未木质化(O’Brien,1981 年;Wardrop,1981 年)。这与次生木质部的
管状分子的情况形成了鲜明的对比,在分化过程中,除了
管状分子之间的纹孔膜和
导管分子之间的穿孔点外,
所有壁都木质化了 (O’Brien, 1981; Czaninski, 1973; Chaffey et al., 1997b)。
纹孔缘的发育开始于壁的二次增厚之前 (Liese, 1965;
Leitch and Savidge, 1995)。
“初始纹孔缘”可以在纹孔环的外围检测到同心定向的微纤维 (Liese, 1965; Murmanis
and Sachs, 1969; Imamura and Harada, 1973)。期间
早期免疫荧光研究在内缘周围发现了皮质微管的圆形带
冷杉管胞中发育的凹坑边界
和红豆杉(图 10.23;Uehara 和 Hogetsu,1993;Abe
等人,1995a; Funada 等人,1997)和容器分子
七叶树 (Chaffey et al., 1997b)。随后,发现肌动蛋白丝以及肌动蛋白丝和肌球蛋白与微管环共定位在七叶树和杨树导管分子和松树管胞的有界纹孔处(图 10.23;Chaffey 等人,1999、2000、2002;Chaffey,2002;Chaffey 和 Barlow,2002)。
针叶树管胞(Funada 等人,1997、2000)和七叶树导管分子(Chaffey 等人,1997b、1999;Chaffey,2000)中纹孔发育的早期迹象是,在最终形成有界纹孔的位置,微管消失了。在早期,七叶树的导管分子中小孔排列的交替模式已经可以检测到(图 10.24)。每个初始小孔边界随后由微管环、肌动蛋白丝和肌球蛋白界定。随着次生壁在开口和预先存在的小孔膜周围沉积,环和小孔孔径的直径减小,这可能是通过肌动蛋白和肌球蛋白成分的活动实现的,有人认为,这些成分可能构成肌动蛋白-肌球蛋白收缩系统(Chaffey 和 Barlow,2002 年)。在七叶树中,还可以通过随机排列的微管中无微管区域的存在来早期检测出导管接触小孔的位置(Chaffey 等人,1999 年)。与发育中的具缘纹孔相关的微管环不同,与发育中的接触纹孔相关的微管环不同,导管分子和相邻(接触)射线细胞之间的无缘(简单)纹孔在次生壁形成过程中直径不会减小。
导管分子中后来穿孔的初生壁部分未被次生壁物质覆盖(图 10.20B 和 10.25C)。占据未来穿孔位置的壁与次生壁明显不同。它比其他地方的初生壁厚,在未染色的薄切片中,在电子显微镜下看起来比同一细胞的其他壁部分要浅得多(图 10.25C;Esau 和 Charvat,1978 年)。已证明,意大利杨和康乃馨导管分子中穿孔部位的增厚主要是由于果胶和半纤维素的添加所致(Benayoun 等人,1981 年)。微管环也与七叶树和杨树中简单穿孔板的发育有关(Chaffey,2000 年;Chaffey 等人,2002 年)。肌动蛋白丝不伴随这些微管,但杨树导管分子中的穿孔部位被明显的肌动蛋白丝网状结构覆盖(Chaffey 等人,2002 年)。次生壁沉积后,细胞发生自溶,影响原生质体和原代细胞壁的某些部分(图 10.20C)。 管状分子死亡过程是程序性细胞死亡的一个很好的例子(第 5 章;Groover 等人,1997 年;Pennell 和 Lamb,1997 年;Fukuda 等人,1998 年;Mittler,1998 年;Groover 和 Jones,1999 年)。 管状分子的结构程序性细胞死亡涉及大型中央液泡的塌陷和破裂,从而释放水解酶(图 10.20C)。 细胞液泡膜破裂后,细胞质和细胞核开始水解。水解酶也到达细胞壁,攻击未被木质化次生壁层覆盖的初生壁部分,包括导管分子之间的纹孔膜和导管分子之间穿孔处的初生壁。细胞壁水解导致非纤维素成分(果胶和半纤维素)的去除,留下纤维素微纤维的细网络(图 10.20D 和 10.25A)。所有木质化细胞壁似乎都完全耐水解。当导管分子与木质部薄壁细胞接壤时,水解或多或少在中间层区域停止。水解去除导管间纹孔膜上的果胶似乎会阻止“水凝胶”的存在,而水凝胶被认为在控制木质部汁液流动方面发挥着作用(Zwieniecki 等人,2001b)。Phaseolus Vulgaris 和 Glycine Max 原生木质部分子的非木质化初生壁水解后,富含甘氨酸的蛋白质(GRP1.8)会分泌并掺入水解壁中(Ryser 等人,1997)。因此,原生木质部分子的初生壁不仅仅是部分水解和被动伸长的残余。它们富含蛋白质,具有特殊的化学和物理特性。富含甘氨酸的蛋白质也已在分离的百日草叶肉细胞的细胞壁中观察到,这些细胞再生为导管分子(见下文)(Taylor and Haigler,1993 年)。在穿孔处,整个初生壁部分消失(图 10.20D 和 10.25A)。穿孔处微纤维网络被去除的确切过程尚不清楚。在裂解的梯状穿孔板中,可以看到细小的纤维网络延伸到较窄的穿孔和较宽的穿孔的侧端。由于这些网络通常不存在于传导组织中,因此很可能被蒸腾流去除(Meylan and Butterfield,1981 年)。然而,这种机制无法解释培养中分离的
管状分子 的穿孔形成(Nakashima 等人,
2000 年)。
植物激素参与 管状分子 的分化
众所周知,生长素从发育中的芽和幼叶向根部的极性流动会诱导 管状分子 的分化(第 5 章;
Aloni,1987 年、1995 年;Mattsson 等人,1999 年;Sachs,2000 年)。有人提出,生长素浓度的梯度下降是导致 管状分子 直径普遍增加、密度从叶子到根部降低的原因(Aloni 和 Zimmer mann,1983 年)。如六点假说(Aloni 和 Zimmermann,1983 年)所述,幼叶附近的高生长素水平会诱导狭窄的导管,因为它们会迅速分化,而更深处的低生长素浓度会导致分化速度变慢,在开始次生壁沉积之前细胞扩张更多,因此导管变宽。对改变生长素水平的转基因植物的研究证实了生长素水平与 管状分子 分化之间的一般关系(Klee 和 Estelle,1991 年)。生长素过量产生的植物比对照植物含有更多且更小的木质部分子(Klee 等人,1987 年)。相反,生长素水平较低的植物含有较少且通常较大的 管状分子 (Romano 等人,1991 年)。根部的细胞分裂素也可能是维管分化的限制和控制因素。它促进多种植物的导管分子分化,但只有与生长素结合才能起作用(Aloni,1995)。在生长素存在的情况下,细胞分裂素会刺激维管分化的早期阶段。然而,维管分化的晚期阶段可能在没有细胞分裂素的情况下发生。对过量产生细胞分裂素的转基因植物的研究证实,细胞分裂素是维管分化的控制因素(Aloni,1995;Fukuda,1996)。在一项研究中,
细胞分裂素过量产生植物比对照植物含有更多且更小的导管(Li 等人,
松树(Pinus pinea)管胞径向壁上边缘纹孔发育过程中细胞骨架蛋白的免疫荧光定位。A、B,管胞的差分对比图像,显示边缘纹孔发育的早期(A)和晚期(B)。最初直径较宽(A),随着边界的发育,成熟管胞中纹孔的开口减小为狭窄的孔径。C–H,边缘纹孔发育早期(C、E、G)和晚期(D、F、H)阶段微管蛋白(C、D)、肌动蛋白(E、F)和肌球蛋白(G、H)的免疫荧光定位。(全部,同一张图。来自 Chaffey,
2002;经新植物学家信托基金许可转载。)
1992);另一篇,o细胞分裂素的产生促进了维管柱的增厚和更多的 管状分子 的形成,而对照组则没有 (Medford 等,1989)。
总体而言,Kuriyama 和 Fukuda (2001)、Aloni (2001) 和 Dengler (2001) 全面回顾了参与调节 管状分子 和维管发育的因素。
培养中的分离叶肉细胞可直接分化为 管状分子
管状分子 分化为研究植物细胞分化和程序性细胞死亡提供了有用的模型。百日草实验系统尤其有用,其中,在生长素和细胞分裂素存在的情况下,单个叶肉细胞可以转分化(即去分化然后重新分化)为管状分子,而无需中间细胞分裂(Fukuda 1996、1997b;Groover 等人,1997;Groover 和 Jones,1999;Milioni 等人,2001)。然而,Chaffey 及其同事 (Chaffey et al., 1997b) 注意到,在七叶树形成层衍生物的维管分化早期阶段和百日草叶肉细胞的转分化阶段,皮层微管和肌动蛋白丝的行为存在显著差异,因此警告说,体外系统是否能够验证更自然系统的发现值得怀疑。
在百日草系统中,已经鉴定出许多用于 管状分子 分化的细胞学、生物化学和分子标记,这些标记有助于将转分化过程分为三个阶段 (图 10.26) (Fukuda, 1996, 1997b)。第一阶段紧随分化诱导之后,与去分化过程相对应。后者涉及伤口诱发事件和蛋白质合成的激活,这两者都受转分化过程后期激素的调节。第二阶段由与微管分子分化相关的基因 TED2、TED3 和 TED4 的转录本积累定义。它还包括编码蛋白质合成装置成分的其他基因转录的显著增加。
在第一阶段和第二阶段,细胞骨架发生剧烈变化。微管蛋白基因的表达始于第一阶段,并在第二阶段持续,导致第三阶段参与次生壁形成的微管数量增加。
第二阶段肌动蛋白组织的变化导致形成粗肌动蛋白索,这些索在细胞质流动中发挥作用(Kobayashi 等人,1987 年)。第三阶段是成熟阶段,涉及次生壁形成和自溶。在此之前,油菜素类固醇迅速增加,而油菜素类固醇是启动最后阶段管状分子分化所必需的(Yamamoto 等人,2001 年)。此外,钙/钙钙调蛋白 (Ca/CaM) 系统可能参与进入第三阶段(图 10.26)。在第三阶段,与次生壁形成和细胞自溶相关的各种酶被激活(Fukuda,1996 年;Endo 等人,2001 年)。水解酶在液泡中积累,并被隔离在细胞质中。当液泡破裂时,它们从液泡中释放出来。水解酶中包括百日草内切酶 1,它已被证明可直接在核 DNA 退化中发挥作用(Ito 和 Fukuda,2002 年)。在百日草的分化管状分子中,已检测到两种蛋白水解酶,即半胱氨酸蛋白酶和丝氨酸蛋白酶。毫无疑问,这些只是参与自溶过程的一组复杂蛋白酶中的两种。有人提出,在次生细胞壁合成过程中分泌的 40 kDa 丝氨酸可能作为次生细胞壁合成和程序性细胞死亡之间的协调因子(Groover 和 Jones,1999 年)。然而,随后对拟南芥裂隙木质部突变体的研究表明,次生细胞壁形成和细胞死亡的过程在木质部分子的发育过程中受到独立调控 (Turner and Hall, 2000)。在成熟阶段,许多水解酶从 管状分子 释放到细胞外空间。有证据表明,当时释放到质外体的 TED4 蛋白可以抑制这些水解酶,保护邻近细胞免受不良损伤 (Endo et al., 2001)。初生壁穿孔发生在单个分子的一端;在双分子中,它们都来自一个叶肉细胞,在它们之间的共同壁上以及两个分子中的一个的末端发生穿孔,这表明这些体外形成的分子有自己的形成穿孔的程序(Nakashima 等人,2000 年)。在诱导培养基中培养的百日草细胞中,已经确定了导管分子分化的时间过程um (Groover 等人,1997)。在典型的细胞中,次生细胞壁的形成平均需要 6 小时才能完成。细胞质流动在次生壁形成的整个时期内持续进行,但在其完成时突然停止。大型中央液泡的塌陷始于次生壁形成的完成,在典型的细胞中仅需 3 分钟即可完成。液泡膜破裂后,细胞核迅速降解——在 10 到 20 分钟内(Obara 等人,2001)。在液泡膜破裂后的几个小时内,死细胞的内容物被清除。然而,叶绿体的残余物可能会持续长达 24 小时。
