第七章 薄壁组织和厚角组织:修订间差异
自动添加《Esau's Plant Anatomy》章节导航 |
自动添加 Sofia 模板和分类 |
||
| 第160行: | 第160行: | ||
{{:Esau's Plant Anatomy}} | {{:Esau's Plant Anatomy}} | ||
{{学科分类}} | |||
[[Category:植物学]] | |||
2025年8月23日 (六) 17:28的最新版本
❙ 薄壁组织
薄壁组织 (parenchyma) 一词指的是由形态和生理上多样的活细胞组成的组织,这些细胞通常具有薄壁和多面体形状(图7.1),并参与植物的营养活动。这种组织中的单个细胞称为薄壁细胞 (parenchyma cells)。薄壁组织一词源自希腊语 para(旁边)和 en-chein(倾倒),这一组合词表达了古代对薄壁组织的概念,即一种半液态物质“倾倒”在更早形成且更坚实的其他组织旁边。
薄壁组织常被称为基本组织或基础组织 (fundamental / ground tissue)。从形态学和生理学角度来看,它都符合这一定义。在植物整体或其器官中,薄壁组织表现为一种基础物质,其他组织(尤其是维管组织)嵌入其中。从生殖细胞(孢子和配子)本质上属于薄壁细胞的角度来看,薄壁组织是植物的基础。由于植物的假定祖先完全由薄壁细胞组成(Graham, 1993),薄壁组织可以被视为所有其他组织的系统发育前体。
这种组织是光合作用()、同化作用()、呼吸作用()、贮藏()、分泌()和排泄()等基本活动的主要场所——简而言之,这些活动依赖于完整活原生质体的存在。发生在木质部和韧皮部中的薄壁组织细胞()在水分运动和食物物质运输中起着重要作用。
从发育角度来看,薄壁组织细胞相对未分化。与筛管分子(sieve elements)、管胞(tracheids)和纤维等细胞相比,它们在形态和生理上都不特化,因为与这三类细胞不同,薄壁组织细胞可以改变功能或结合几种不同的功能。然而,薄壁组织细胞也可能明显特化,例如在光合作用、特定物质的贮藏或植物体内过量物质的沉积方面。无论是否特化,薄壁组织细胞在生理上都非常复杂,因为它们具有活的原生质体。
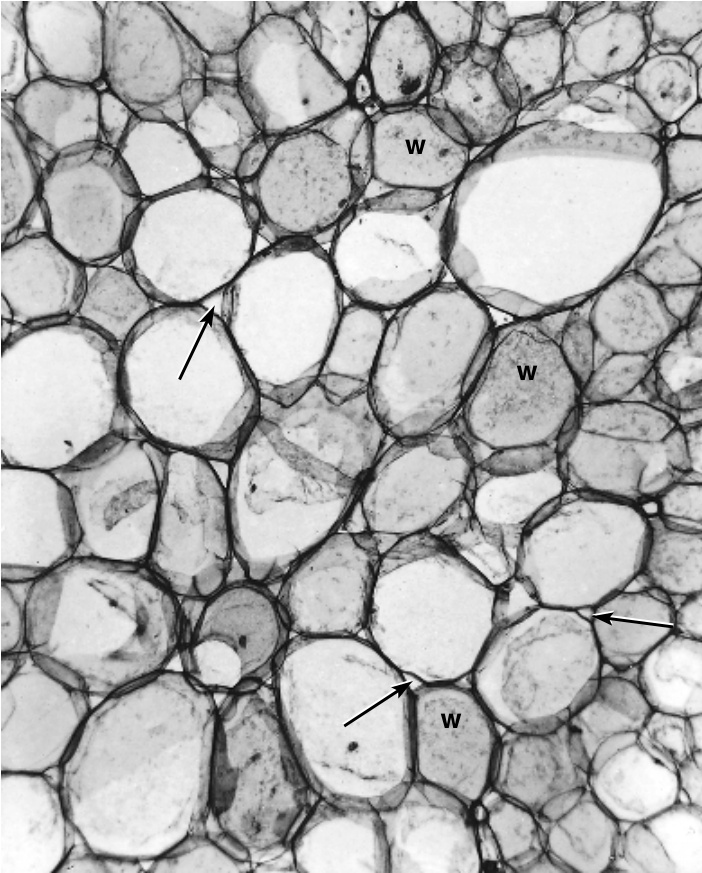
图7.1 番茄(Solanum lycopersicum)茎中的薄壁组织。细节:箭头指向细胞间隙;w,表面观的细胞壁。(×49.)
薄壁组织细胞在成熟时具有生命特征,能够恢复分生组织活性:去分化(dedifferentiate)、分裂(divide)和再分化(redifferentiate)。由于这种能力,仅具有初生壁的薄壁组织细胞在伤口愈合、再生、不定根(adventitious roots)和不定芽(adventitious shoots)的形成以及嫁接结合中起着重要作用。此外,单个薄壁组织细胞具有受精卵中存在的所有基因,能够成为胚胎细胞,然后在适当的生长和发育条件下发育成整株植物。这样的细胞被称为全能性(totipotent)细胞(第5章)。利用组织培养方法或微繁殖(micropropagation)进行植物繁殖的研究人员的目标是诱导单个细胞表达其全能性(Bengochea和Dodds,1986)。
薄壁组织细胞可以作为薄壁组织连续存在,也可以与形态异质组织中的其他细胞类型相关联
主要由或完全由薄壁组织细胞组成的植物部分的例子包括茎和根的髓()和皮层()、叶片的光合组织(叶肉,mesophyll)(见图7.3A)、肉质果实的果肉以及种子的胚乳()。作为异质或复杂组织的组成部分,薄壁组织细胞形成维管射线(vascular rays)和木质部和韧皮部中垂直排列的活细胞。有时,本质上为薄壁组织的组织可能包含在形态或生理上与组织中主要细胞群不同的薄壁或非薄壁细胞或细胞群。例如,石细胞(sclereids)可能存在于叶肉、髓和皮层薄壁组织中(第8章)。乳汁管(laticifers)存在于含有乳胶(latex)的植物的各种薄壁组织区域(第17章)。筛管()穿过某些植物的皮层薄壁组织(第13章)。
初生植物体的薄壁组织(),即皮层()和髓()的薄壁组织、叶肉()的薄壁组织以及花部()的薄壁组织,都是由基本分生组织(ground meristem)分化而来的。与初生和次生维管组织(primary and secondary vascular tissues)相关的薄壁细胞分别由原形成层(procambium)和维管形成层(vascular cambium)形成。薄壁组织也可能以栓内层的形式起源于木栓形成层(phellogen),并且可能通过扩散的次生生长(diffuse secondary growth)而增加数量。
薄壁组织的可变结构(图7.2)以及薄壁细胞在植物体中的分布清楚地说明了组织正确定义和分类所涉及的问题。一方面,薄壁组织可能符合最严格的组织定义,即具有共同起源、基本相同的结构和相同功能的一群细胞。另一方面,薄壁组织的同质性可能因存在数量不等的非薄壁细胞(nonparenchymatous cells)而被打破,或者薄壁细胞可能作为复杂组织中的众多细胞类别之一出现。
因此,薄壁组织作为组织在植物体中的空间界限并不精确。此外,薄壁细胞可能与明显非薄壁的细胞相互过渡。薄壁细胞可能或多或少地伸长并具有厚壁,这种特征组合表明其在支持方面的特化。某一类薄壁细胞作为支持组织()分化得如此明显,以至于它被赋予了特殊的名称——厚角组织(collenchyma),本章稍后将讨论。薄壁细胞可能发育出相对较厚的木质化壁,并具有一些厚壁组织细胞(sclerenchyma cells)的特征(第8章)。单宁可能存在于普通薄壁细胞中,也可能存在于基本为薄壁但具有明显形态(囊泡、囊或管)的细胞中,这些细胞被称为异细胞(idioblasts)。同样,某些分泌细胞()与其他薄壁细胞的主要区别在于其功能;其他细胞则发生了很大的改变,以至于它们通常被视为一类特殊的元素(乳汁管;第17章)。
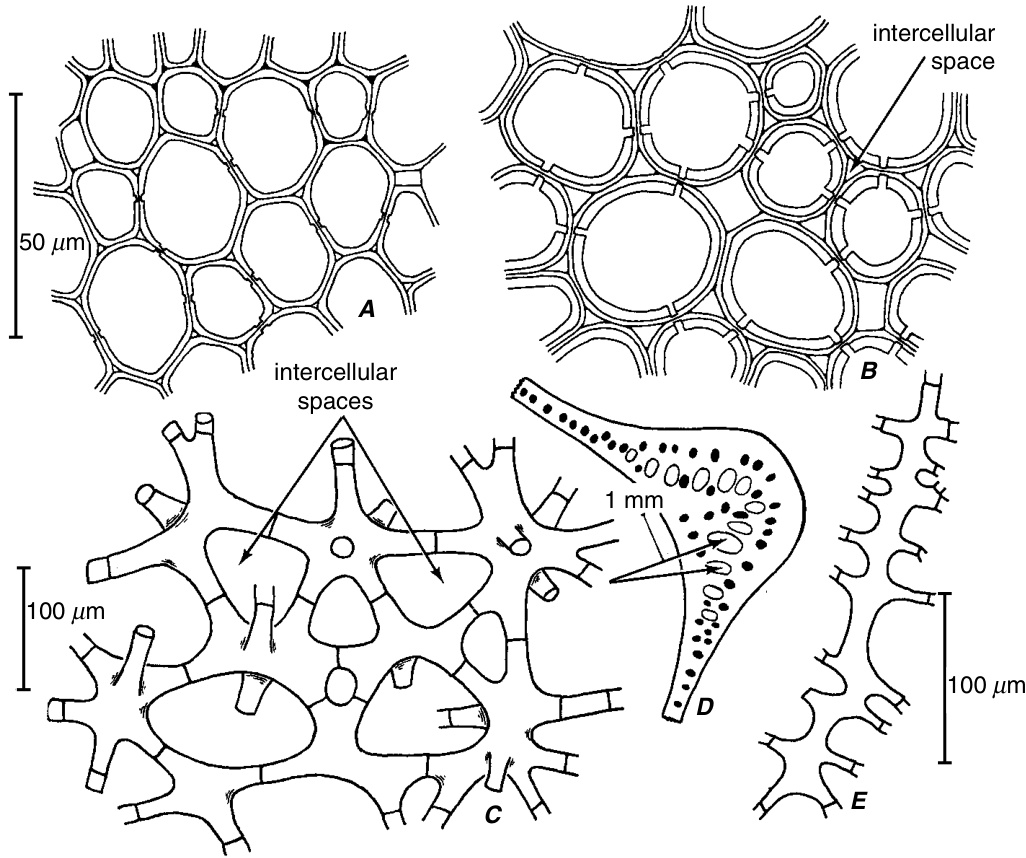
图7.2 薄壁细胞的形状和壁结构。(省略了细胞内容物。)A、B,来自桦树(Betula)茎髓的薄壁组织。在较年轻的茎(A)中,细胞只有初生壁;在较老的茎(B)中,也出现了次生壁。C、D,通气组织(aerenchyma)类型的薄壁组织(C),出现在美人蕉(Canna)叶的叶柄和中脉(D)的腔隙中。细胞有许多"臂"。E,来自天人菊(Gaillardia)的盘花(disc flower)叶肉的长"臂"细胞。(来自Esau, 1977。)
本章仅限于讨论与植物最普通的营养活动有关的薄壁组织,不包括分生组织。木质部和韧皮部的薄壁细胞将在讨论这两种组织的章节中描述,薄壁细胞原生质体(protoplasts)的一般特征将在第2章和第3章中讨论。第2章和第3章中的大部分讨论都与下一个主题相关。
薄壁细胞的内容物反映了细胞的活动
专门用于光合作用的薄壁组织()含有大量的叶绿体,被称为绿色组织( chlorenchyma )。绿色组织的最典型表现是叶片的叶肉()(图7.3A),但叶绿体也可能在茎的皮层()中大量存在(图7.3B)。叶绿体可能出现在更深的茎组织中,包括次生木质部()甚至髓部()。典型的光合细胞通常具有明显的液泡化( vacuolated ),并且组织被广泛的细胞间隙系统所渗透。相比之下,分泌型薄壁细胞具有致密的原生质体(),尤其是富含核糖体(),并且根据形成的分泌产物类型,可能具有大量的高尔基体()或高度发达的内质网()(第16章)。
薄壁细胞可能通过积累特定种类的物质而表现出独特的特征。在储存淀粉的细胞中,如马铃薯块茎(图3.9)、谷物的胚乳()和许多胚胎的子叶(),含有大量淀粉的淀粉体()几乎可以掩盖所有其他细胞质成分。在许多种子中,储存薄壁细胞的特征是富含蛋白质和/或油体()(图3.10)。花和果实的薄壁细胞通常含有有色体()(图2.11)。在植物的不同部位,薄壁细胞可能通过在液泡中积累花青素()或单宁()(图2.21)或沉积一种或另一种形式的晶体(图3.11-3.14)而变得显著。
水在所有活跃的液泡化薄壁细胞中都非常丰富,因此薄壁组织作为水库起着重要作用。在对一种竹子的研究中,发现不同部位的水分含量变化与组织系统中薄壁细胞的比例明显相关(Liese和Grover,1961)。
薄壁组织可能相当专门化作为储水组织。许多多汁植物,如仙人掌科( Cactaceae )、芦荟( Aloe )、龙舌兰( Agave )、虎尾兰( Sansevieria )(Koller和Rost,1988a,b)、日中花( Mesembryanthemum )和豆瓣绿( Peperomia )(图7.4),在其光合作用器官中含有充满水的无叶绿体薄壁细胞。这种水组织由特别大的活细胞组成,通常具有薄壁。这些细胞通常成行排列,且可能像栅栏细胞一样伸长。每个细胞都有一层相对致密的细胞质、一个细胞核和一个含有水状或略带黏液内容物的大液泡。这些黏液似乎增加了细胞吸收和保持水分的能力,可能存在于原生质体和细胞壁中。
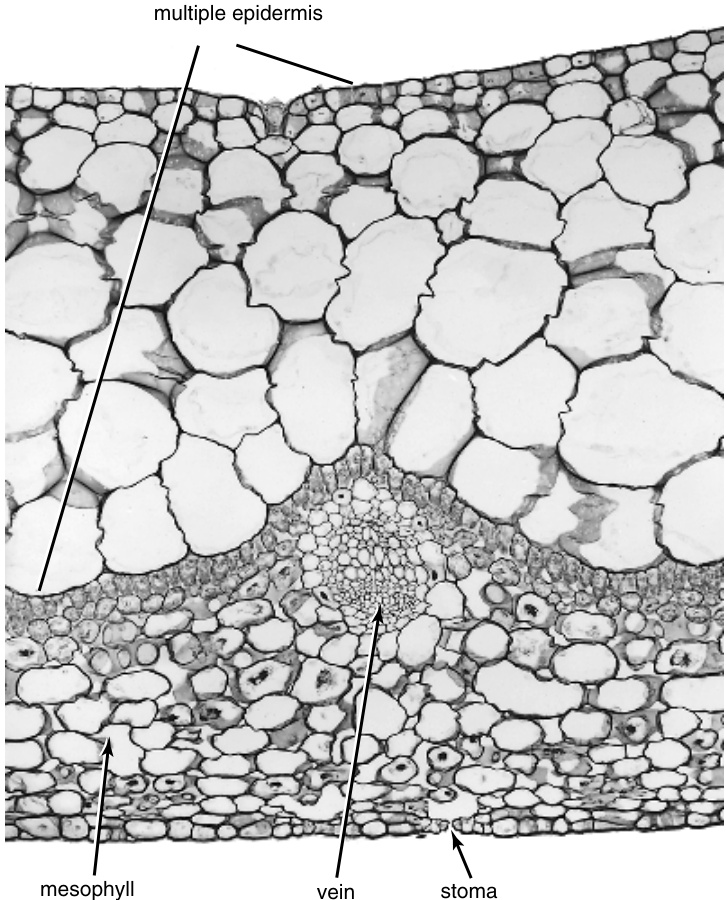
图7.4 豆瓣绿( Peperomia )叶片的横切面。在其上表面可见的非常厚的多重表皮( multiple epidermis )可能具有储水组织的功能。(×110.)
在地下贮藏器官中,通常没有单独的水分贮藏组织,但含有淀粉和其他食物物质的细胞具有高含水量。马铃薯块茎可以在空气中开始芽的生长,并为生长部分提供初始生长所需的水分(Netolitzky, 1935)。高含水量不仅是地下贮藏器官(如块茎和鳞茎)的特征,也是芽和地上茎肉质膨大部分的特征。在这些结构中,水分的贮藏与食物储备的贮藏是结合在一起的。
薄壁组织细胞的细胞壁可能厚或薄
薄壁组织细胞,包括绿色组织和大多数贮藏细胞,通常具有薄的、非木质化的初生壁(图7.1和7.2)。在这样的壁中,胞间连丝很常见,有时聚集在初生纹孔场或加厚的壁部分,有时均匀分布在厚度一致的壁中。一些贮藏薄壁组织发育出非常厚的壁(Bailey, 1938)。如前所述,位于这些壁中的木葡聚糖构成了主要的贮藏碳水化合物(第4章)。例如,在枣椰树(Phoenix dactylifera)、柿子(Diospyros;图4.19)、芦笋(Asparagus)和咖啡(Coffea arabica)的胚乳中,壁较厚。在萌发过程中,它们会变薄。相对较厚且通常木质化的次生壁也出现在木材(次生木质部)和髓的薄壁组织细胞中,这使得区分这些硬化的薄壁组织细胞和典型的厚壁组织细胞变得困难。
典型薄壁组织的机械强度主要来自其细胞的水压特性(Romberger等,1993)。由具有薄的、非木质化初生壁的细胞组成,薄壁组织只有在细胞接近或达到完全膨胀时才具有刚性。正如Niklas(1992)所指出的,薄壁组织用于机械支撑的程度还取决于其细胞紧密排列的程度。在这方面,具有大量细胞间隙的通气组织可能被认为对器官提供的机械支撑很少。然而,有人提出,具有蜂窝状细胞间隙系统的通气组织在结构上是高效的,能够以最少的组织提供必要的强度(Williams和Barber, 1961)。
一些薄壁组织细胞——传递细胞——含有壁内生长物
传递细胞(transfer cells)是一种特化的薄壁组织细胞(),含有细胞壁内突(),这些内突通常大大增加了质膜()的表面积(图7.5)。内突在细胞成熟过程中相对较晚发育,并沉积在原有的初生壁()上;因此,它们可以被视为次生壁()的一种特化形式(Pate and Gunning, 1972)。转运细胞在溶质()的短距离转运中起着重要作用(Gunning, 1977)。它们的存在通常与质膜上强烈的溶质通量()相关——无论是向内还是向外。壁内突在强烈转运开始时形成,并且在最活跃参与溶质转运的细胞表面上发育得最好(Gunning and Pate, 1969)。质膜紧密跟随壁内突的轮廓,无论它们多么曲折,形成所谓的壁膜装置(wall-membrane apparatus),其边缘有许多线粒体()和显著的内质网()。
质膜H+-ATPase和蔗糖转运蛋白的高密度共定位于发育中的Vicia faba种子母体/子代界面的种皮()和子叶()转运细胞的壁内突上(Harrington et al., 1997a, b),表明这些转运细胞是蔗糖进出种子质外体()的膜转运位点。蔗糖跨膜转运涉及质子/蔗糖共转运机制(proton/sucrose cotransport mechanism)(McDonald et al., 1996a, b)。
在形态学上,大多数转运细胞的壁内突可以分为两类:网状(reticulate)和肋状(flange)(图7.6; Talbot et al., 2002)。网状壁内突起源于底层壁上的小而随机分布的乳头状突起(papillae)。这些乳头状突起随后分支并横向融合,形成形态各异的复杂迷宫。肋状内突则起源于与底层壁沿其长度接触的曲线形、肋状突起。这些突起在不同类型的转运细胞中以各种方式变得复杂化。一些转运细胞同时表现出网状和肋状壁内突;另一些则具有不符合任何一类的壁内突。
图7.5 Sonchus deraceus(苦苣菜)叶片小脉韧皮部部分的纵切面(longitudinal section)。这张电子显微照片中心具有致密细胞质(cytoplasm)的细胞是伴胞(companion cell)。韧皮部薄壁细胞(parenchyma cells)位于伴胞的两侧。所有三个细胞都含有壁内突(箭头);所有三个细胞都是转运细胞。
图7.6 A, Vicia faba根瘤(root nodule)中木质部薄壁细胞(xylem parenchyma)转运细胞的网状壁内突。箭头指向沉积在最新形成的壁内突层上的新壁内突。B, Triticum aestivum营养节(vegetative nodes)纵切面中木质部薄壁细胞转运细胞(tc)的肋状壁内突。肋状内突大致平行,呈长条状增厚(箭头),与相邻管状分子(tracheary element, te)的壁增厚相似但更薄。(来自Talbot et al., 2002)
传递细胞广泛存在于植物体的多个部位:在许多草本双子叶植物子叶和叶片的小叶脉或次生脉的木质部和韧皮部中(Pate and Gunning, 1969; van Bel et al., 1993);在双子叶植物和单子叶植物节部叶迹的木质部和韧皮部附近(Gunning et al., 1970);在生殖结构的各种组织中(胎座、胚囊、糊粉细胞、胚乳;Rost and Lersten, 1970; Pate and Gunning, 1972; Wang and Xi, 1992; Diane et al., 2002; Gómez et al., 2002);在根瘤中(Joshi et al., 1993);以及在各种腺体结构中(蜜腺、盐腺、食虫植物的腺体;Pate and Gunning, 1972; Ponzi and Pizzolongo, 1992)。这些位置都是潜在的短距离溶质(short-distance solute)密集转运的场所。转运细胞也可以通过外部刺激诱导形成,例如在通常不发育此类细胞的植物中,通过线虫感染(Sharma and Tiagi, 1989; Dorhout et al., 1993)诱导形成。
推测壁膜装置()的表面积越大,通过它的总通量可能就越大。在一项旨在验证这一假设的研究中(Wimmers and Turgeon, 1991),通过在相对较高的光子通量密度下培养植物,显著增加了Pisum sativum叶片小叶脉韧皮部转运细胞壁内突()的大小和数量。值得注意的是,高光叶片质膜()表面积比低光叶片增加了47%,同时外源蔗糖()进入转运细胞及其相关筛管()的通量也增加了47%。
壁内突并不是溶质跨质膜运输的先决条件。没有这种修饰的细胞可能同样参与细胞间的物质转运。
薄壁组织细胞()的形状和排列差异很大
薄壁组织细胞通常被描述为具有多面体形状,即具有多个侧面或面,但即使在同一种植物中,它们的形状也差异很大(图7.2和7.7)。通常,基本组织()的薄壁细胞由长宽相近的细胞组成,可能接近等径(isodiametric)。相比之下,薄壁细胞可能或多或少伸长,或者具有各种裂片或分支。在相对均质的薄壁组织中,面的数量往往接近14个。几何上完美的14面体是一个具有8个六边形面和6个四边形面的多面体(图7.7A)(正交十四面体,orthic tetrakaidecahedron)。植物细胞很少接近这种理想形式(图7.7B;Matzke, 1940),即使在茎髓(pith)中常见的均质薄壁组织中,细胞的面数也表现出可变性(图7.7C-F)。同一组织中大小细胞的存在、细胞间隙(intercellular spaces)的发育以及细胞从接近等径到其他形状的变化是决定每个细胞面数的因素(Matzke and Duffy, 1956)。小细胞的面数少于14个,大细胞的面数多于14个。细胞间隙的存在,特别是大细胞间隙的存在,减少了接触的数量(Hulbary, 1944)。
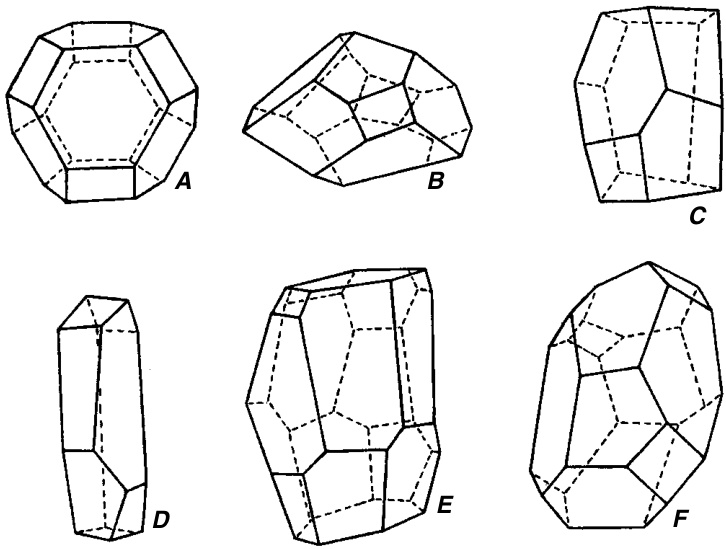
图7.7
薄壁组织细胞的形状
A. 正交十四面体(orthic tetrakaidecahedron)的示意图,一种具有14个面的多面体。
B. Ailanthus 髓部细胞的示意图。该细胞具有1个七边形、4个六边形、5个五边形和4个四边形面,共14个面。这是一个近似正交十四面体的细胞示例。
C–F. Eupatorium 髓部细胞的示意图。面数分别为10(C)、9(D)、16(E)和20(F)。(引自Esau, 1977;A、B,根据Matzke, 1940;C–F,根据Marvin, 1944。)
压力和表面张力长期以来被认为是影响细胞形状和大小的因素。在Canna叶片叶肉和Juncus髓部的“臂状”或“星状”薄壁细胞分化过程中,侧向张力似乎是决定最终形状的因素之一(Maas Geesteranus, 1941)。这些臂显然会沿其整个长度延伸。Korn(1980)提出,细胞的形状和大小是三种细胞过程的结果:(1)细胞壁扩展的速率,(2)细胞周期的持续时间,以及(3)细胞板通常位于最长细胞壁的中心附近,从而避免与相邻细胞之间的现有分隔相交,并实现几乎均等的细胞分裂。影响细胞扩展和细胞间隙形成的亚细胞因素将在第4章讨论。
不同种类的薄壁组织中,细胞的排列方式各不相同。肉质根和茎的贮藏薄壁组织具有丰富的细胞间隙,而种子的胚乳通常是一种紧密的组织,最多只有很小的细胞间隙。叶肉以及一般绿色组织中的细胞间隙的广泛发育显然与光合组织中的气体交换有关。然而,在整个植物体中,基本组织通常被一个不太明显的细胞间隙迷宫所渗透,这对于依赖扩散的气体流动也是必不可少的(Prat et al., 1997)。在草本植物中,细胞间隙的迷宫可能从叶片的气孔下腔延伸到根冠的极短距离内,通过茎和根的皮层薄壁组织(Armstrong, W., 1979)。
上述各种组织中的细胞间隙通常是由裂生(schizogenous)起源形成的(第4章)。如果细胞沿其与其他细胞接触的较大区域分离,这些间隙可以变得非常大。这种分离伴随着整个组织的扩展。在生长组织中,细胞通过差异生长保持彼此之间的有限连接,并呈现出裂片状或“臂状”形态(图7.2C、E;Kaul, 1971)。在某些物种中,细胞不仅在细胞间隙旁边生长,还会分裂。在这些分裂中,新细胞壁的形成与围绕间隙的细胞壁垂直(Hulbary, 1944)。
某些薄壁组织——通气组织(aerenchyma)——含有特别大的细胞间隙
气腔(air spaces)在水生和半水生生境或水涝土壤中生长的被子植物中特别发达(Armstrong, W., 1979; Kozlowski, 1984; Bacanamwo and Purcell, 1999; Drew et al., 2000)。由于细胞间隙的显著存在,这种组织被称为通气组织(aerenchyma),这一术语最初用于指由木栓形成层(phellogen)衍生的、未栓化的木栓(phellem)组织,其中包含大量气室(Schenck, 1889)。在某些物种的根中,通气组织的发育完全通过裂生细胞间隙(schizogenous intercellular spaces)的扩大来实现;而在其他物种中,通气组织的发育涉及不同程度的溶生(lysigeny)(Smirnoff and Crawford, 1983; Justin and Armstrong, 1987; Armstrong and Armstrong, 1994)。有趣的是,无论溶生程度如何,侧根周围的皮层细胞始终保持完整,这表明通气组织的形成是一个受控的过程。乙烯(ethylene)被认为在水涝植物根部的溶生通气组织发育中起重要作用(Kawase, 1981; Kozlowski, 1984; Justin and Armstrong, 1991; Drew, 1992)。如前所述(第5章),这些植物中氧气的缺乏会触发乙烯的产生,进而诱导程序性细胞死亡和通气组织的发育。在某些物种的根部,通气组织的形成是自然发生的(组成性的),即显然不需要任何外部刺激。其中最显著的是水稻(Oryza sativa)的根部(图7.8;Webb and Jackson, 1986)。
水生植物叶片和茎中的通气组织在结构上通常与根部不同(Armstrong, W., 1979)。这种组织表现为大的纵向气腔或腔隙(lacunae),有时包含星状细胞(stellate cells),并经常被薄而横向排列的细胞板(称为隔膜,diaphragms)以规则的间隔分隔,这些隔膜通常具有细胞间隙(图7.9;Kaul, 1971, 1973, 1974; Matsukura et al., 2000)。在某些物种的茎中,所有隔膜都是相似的;而在其他物种中,会产生两种或三种类型的隔膜。例如,在香蒲(Typha latifolia)的叶片中,完全由星状细胞组成的隔膜与具有维管束的隔膜交替出现(Kaul, 1974)。尽管有人认为通气组织通常充满水或液体(Canny, 1995),但有大量证据表明腔隙通常是充满气体的(Constable et al., 1992; Drew, 1997)。从茎到根连续存在的通气组织增强了空气从叶片到根部的扩散,使湿地和水涝植物能够维持足够的氧气水平以支持呼吸作用。超过呼吸细胞消耗的氧气通常会从根部扩散到土壤大气中(Hook et al., 1971)。这通过创造一个局部的在厌氧土壤中形成的好氧根际(aerobic rhizosphere)(Topa和McLeod, 1986)来帮助植物的生存。

图7.8
水稻(Oryza sativa)根部的扫描电子显微镜照片,横截面显示通气组织。\langle×80。由P. Dayanandan提供。)
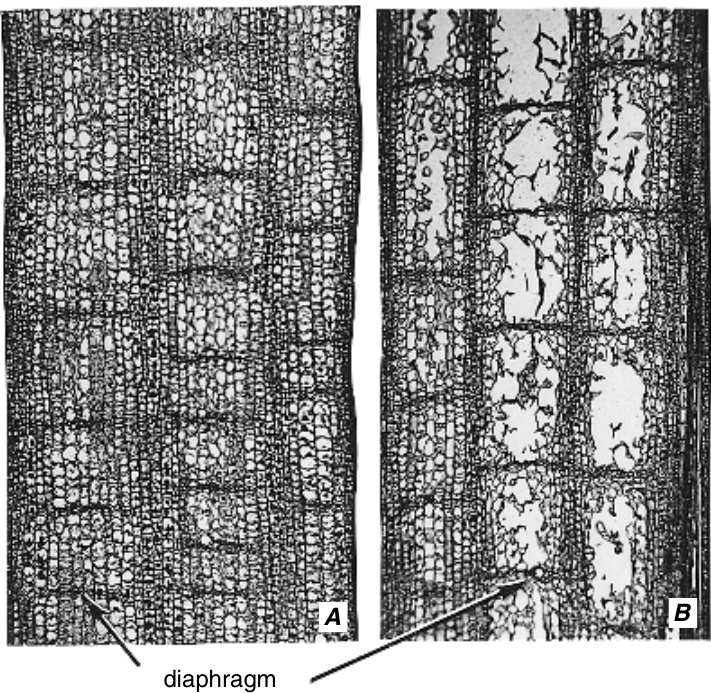
图7.9 A, B,水稻(Oryza sativa)叶鞘中脉通气组织(aerenchyma)形成的两个阶段。气腔(lacunae)之间的隔膜(diaphragms)保持完整。(两者,×190。来自Kaufman, 1959。)
与淹水相关的其他发育现象包括不定根(adventitious roots)的发育(Visser等, 1996; Shiba和Daimon, 2003)以及茎基部和老根上皮孔(lenticels)的形成(Hook, 1984)。在一些木本植物中,随着次生生长导致皮层通气组织(cortical aerenchyma)的破坏,通气木栓(aerenchymatous phellem)可能为根和茎之间的气体交换提供替代途径(Stevens等, 2002)。
❙ 厚角组织(COLLENCHYMA)
厚角组织(collenchyma)是一种活组织,由或多或少伸长的细胞组成,具有加厚的初生壁()(图7.10)。它是一种简单组织(simple tissue),因为它由单一细胞类型——厚角细胞(collenchyma cell)组成。厚角细胞和薄壁细胞()在生理和结构上彼此相似。两者都具有完整的原生质体(),能够恢复分生组织()活性,它们的细胞壁通常是初生的()且未木质化()。
两者的区别主要在于厚角细胞的壁较厚;此外,高度特化的厚角细胞比大多数类型的薄壁细胞更长。当厚角细胞和薄壁细胞相邻时,它们在壁厚和形态上会相互过渡。与厚角细胞相邻的薄壁细胞的壁可能会加厚——“厚角状加厚(collenchymatously thickened)”——就像厚角细胞的壁一样。两种细胞类型都含有叶绿体()(Maksymowych等, 1993)。在形态上接近薄壁细胞的厚角细胞中,叶绿体数量最多。长而窄的厚角细胞只含有少量小叶绿体或根本没有。由于这两种组织之间的相似性以及薄壁组织的结构和功能可变性,厚角组织通常被认为是一种壁较厚的薄壁组织,在结构上特化为支持组织(supporting tissue)。术语薄壁组织(parenchyma)和厚角组织(collenchyma)也相关,但在后者中,词的第一部分源自希腊语colla,意为胶水,指的是厚角组织特有的厚而闪亮的壁。
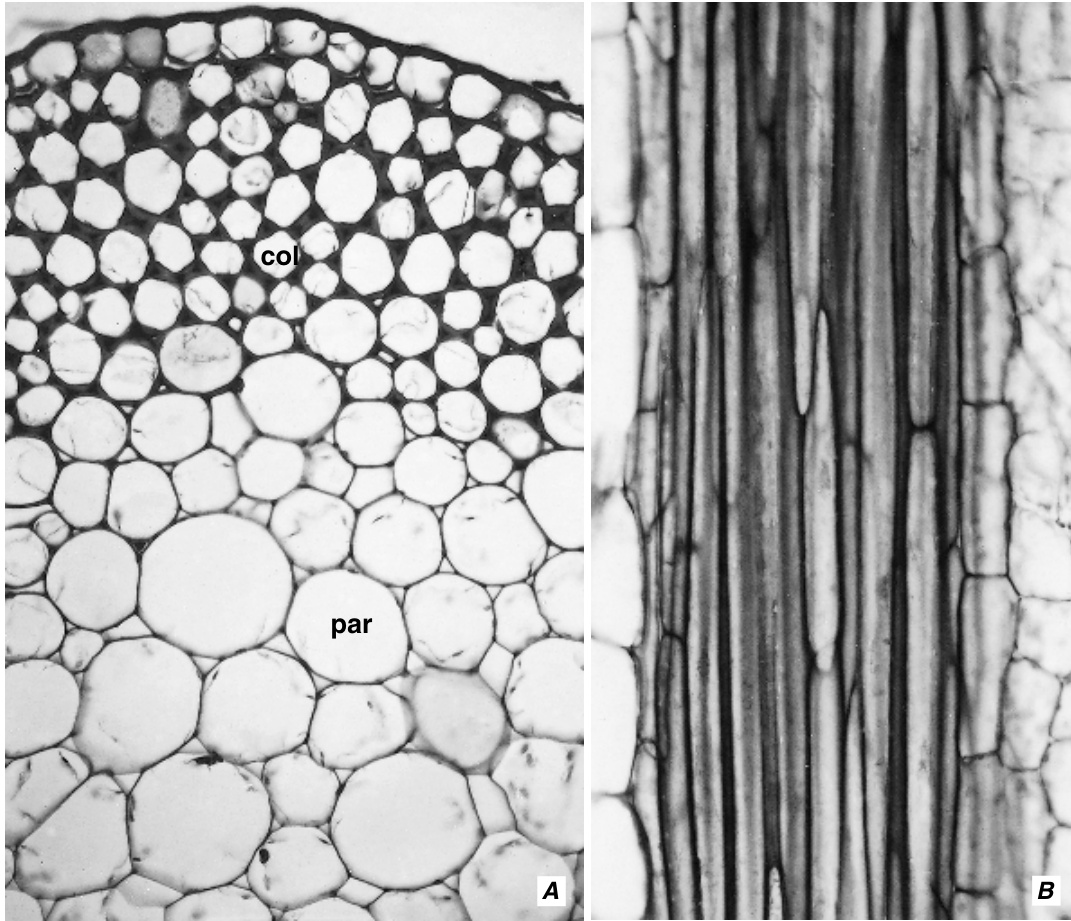
图7.10 甜菜(Beta)叶柄横切面(A)和葡萄藤(Vitis)茎纵切面(B)中的厚角组织(col)。其他细节:par,薄壁组织。(×285.)
厚角组织(collenchyma)与其他代表性的支持组织——厚壁组织(sclerenchyma)(第8章)在细胞壁结构和原生质体状态上有所不同。厚角组织具有相对柔软、柔韧、非木质化的初生壁,而厚壁组织则具有坚硬、或多或少刚性的次生壁,这些壁通常被木质化。厚角组织细胞保留着活跃的原生质体,当细胞被诱导恢复分生组织活性时,如形成木栓形成层(cork cambium)(第15章)或响应伤口时,能够去除壁的增厚。厚壁组织的壁比厚角组织的壁更持久。即使原生质体保留在细胞中,它们也不容易被去除。许多厚壁组织细胞在成熟时缺乏原生质体。在一些厚角组织细胞中,横向分裂的产物仍然在一起,被共同的母细胞壁包围(Majumdar, 1941; Majumdar和Preston, 1941)。这种细胞复合体类似于隔膜纤维(septate fibers)。
厚角组织细胞壁的结构是该组织最显著的特征
厚角组织细胞的壁在新鲜切片中厚而有光泽(图7.11),且增厚通常分布不均匀。除了纤维素外,它们还含有大量的果胶(pectins)和半纤维素(hemicelluloses),但不含木质素(lignin)(Roelofsen, 1959; Jarvis和Apperley, 1990)。

图7.11 大黄(Rheum rhabarbarum)叶柄中厚角组织的横切面。在这种新鲜组织中,不均匀增厚的厚角组织细胞壁具有光泽的外观。(×400.)
在某些物种中,厚角组织壁具有富含纤维素而缺乏果胶的层与富含果胶而缺乏纤维素的层交替排列的结构(Beer和Setterfeld, 1958; Preston, 1974; Dayanandan等, 1976)。由于果胶是亲水性的,厚角组织壁富含水分(Jarvis和Apperley, 1990)。这一特征可以通过用酒精处理厚角组织的新鲜切片来证明。酒精的脱水作用会导致厚角组织壁明显收缩。在超微结构上,各种类型的厚角组织壁被描述为具有交叉的多层结构(Wardrop, 1969; Chafe, 1970; Deshpande, 1976; Lloyd, 1984)或螺旋结构(第4章; Vian等, 1993)。初生纹孔场()通常存在于厚角组织壁中,尤其是在那些厚度相当均匀的壁中(Duchaigne, 1955)。
厚角组织()的细胞壁增厚分布呈现出几种模式(图7.12; Chafe, 1970)。如果细胞壁增厚不均匀,增厚最显著的位置要么在细胞的角隅处,要么在两个相对的壁上,即内切向壁和外切向壁(与植物器官表面平行的壁)。切向壁增厚的厚角组织被称为片状(lamellar)或板状(plate)厚角组织(图7.12A)。片状厚角组织在Sambucus nigra的茎皮层中特别发达。它们也可能存在于Sanguisorba、Rheum和Eupatorium的茎皮层以及Cochlearia armoracia的叶柄中。细胞壁增厚集中在角隅处的厚角组织通常被称为角隅(angular)厚角组织(图7.12B)。角隅厚角组织的例子见于Atropa belladonna和Solanum tuberosum的茎以及Begonia、Beta、Coleus、Cucurbita、Morus、Ricinus和Vitis的叶柄中。
厚角组织可能含有也可能不含有细胞间隙(intercellular spaces)。如果角隅型厚角组织中存在细胞间隙,增厚的细胞壁就位于细胞间隙旁边。具有这种细胞壁增厚分布的厚角组织有时被归类为一种特殊类型,即腔隙(lacunar)或腔隙状(lacunate)厚角组织(图7.12C)。当厚角组织不发育细胞间隙时,多个细胞相遇的角隅处显示出增厚的胞间层(middle lamella)。这种增厚有时会因胞间物质在潜在的细胞间隙中的积累而加剧。这种积累的速度显然有所不同,因为细胞间隙可能在发育的早期阶段出现,但随后被果胶物质(pectic substances)封闭。在细胞间隙较大的地方,果胶物质无法完全填充它们,并形成突起或疣状积累物,伸入细胞间隙中(Duchaigne, 1955; Carlquist, 1956)。细胞间隙的存在并未被普遍接受为区分厚角组织类型的有效标准。在Brunellia和Salvia以及各种菊科(Asteraceae)和锦葵科(Malvaceae)的茎皮层中,可以找到被解释为腔隙厚角组织的结构。
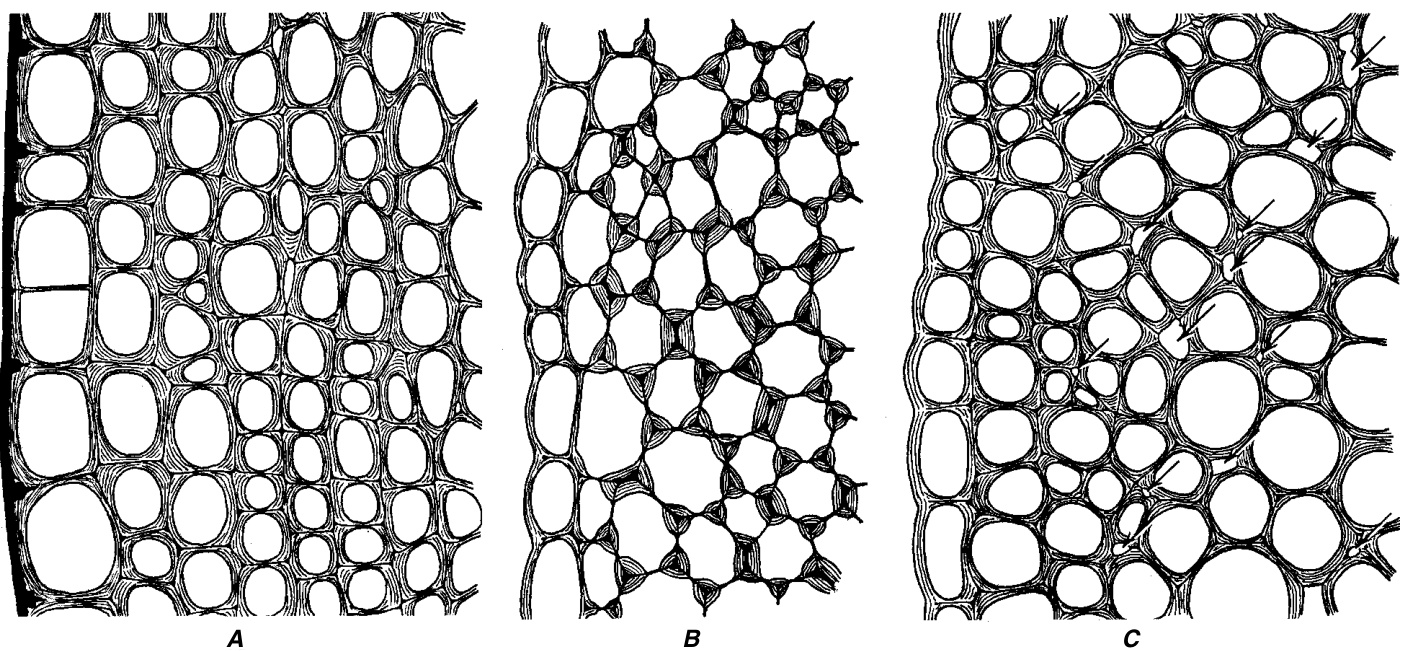
图7.12
茎中的厚角组织(横切面)。在所有图中,表皮层位于左侧。A,Sambucus;增厚主要在切向壁上(片状厚角组织)。B,Cucurbita;增厚在角隅处(角隅厚角组织)。C,Lactuca;大量细胞间隙(用箭头表示)和最显著的增厚位于这些间隙旁边(腔隙厚角组织)。A中显示厚的角质层(黑色)。(全部,×320.)
一些植物解剖学家还识别出第四种类型的厚角组织,即环状(annular)厚角组织(Metcalfe, 1979)。这种厚角组织的特征是细胞壁增厚更均匀,横切面观察时细胞腔(lumina)轮廓更接近圆形。环状厚角组织和角隅厚角组织之间的区别并不明确,因为角隅厚角组织中细胞壁增厚限制在角隅处的程度与其他部位细胞壁增厚的量有关。如果细胞壁整体增厚变得显著,角隅处的增厚就会被掩盖,细胞腔呈现圆形轮廓,而不是角隅状(Duchaigne, 1955; Vian et al., 1993)。
厚角组织(collenchyma)的细胞壁通常被认为是厚初生壁(primary wall)的典型代表,其增厚是在细胞生长过程中沉积的。换句话说,细胞壁的表面积和厚度同时增加。通常无法确定细胞停止生长后是否还有增厚沉积,因此通常无法在这样的细胞中区分初生壁和次生壁层。
在较老的植物部位,厚角组织壁可能会发生改变。在具有次生生长的木本植物中,厚角组织至少在一段时间内通过活跃生长保持原始特征,跟随轴周长的增加。在一些植物(如Tilia、Acer、Aesculus)中,厚角组织细胞会扩大,其壁会变薄(de Bary, 1884)。显然,尚不清楚这种壁厚度的减少是由于壁材料的移除还是由于拉伸和脱水所致。厚角组织可能通过沉积带有单纹孔(simple pits)的木质化次生壁转变为厚壁组织(sclerenchyma)(Duchaigne, 1955; Wardrop, 1969; Calvin and Null, 1977)。
厚角组织通常位于外围位置
厚角组织是典型的支持组织,首先是生长器官的支持组织,其次是那些仅轻微次生生长或完全缺乏次生生长的成熟草本器官的支持组织。它是茎、叶和花部中的第一种支持组织,也是许多成熟双子叶植物叶片和一些绿色茎中的主要支持组织。根部很少具有厚角组织,但厚角组织可能出现在皮层(cortex)中(Guttenberg, 1940),特别是当根部暴露在光线下时(Van Fleet, 1950)。在许多早期发育出厚壁组织的单子叶植物中,茎和叶中缺乏厚角组织(Falkenberg, 1876; Giltay, 1882)。厚角组织通常取代厚壁组织出现在叶片和叶鞘的连接处(叶片关节)以及禾本科植物叶片的叶枕(pulvinus)中(Percival, 1921; Esau, 1965; Dayanandan et al., 1977; Paiva and Machado, 2003)。大量的厚角组织束帽(bundle caps)与叶鞘束分化有关。
厚角组织的外围位置非常典型(图7.13)。它可能直接出现在在表皮下方,或者可能与表皮被一层或多层薄壁组织()隔开。它起源于基本分生组织()。如果厚角组织()位于表皮旁边,表皮的内切向壁可能会像厚角组织的壁一样增厚。有时整个表皮细胞都是厚角组织化的。在茎中,厚角组织经常在轴的周围形成一个连续的层(图7.13C)。有时它以束状出现,通常位于许多草本茎和尚未经历次生生长的木本茎的外部可见的脊(肋)内(图7.13D,E)。厚角组织在叶柄中的分布显示出与茎中遇到的模式相似的模式(图7.13A,F)。在叶片中,厚角组织出现在伴随较大维管束(主脉)的肋中,有时在肋的两侧(图7.13B),有时仅在一侧,通常是下侧。厚角组织也沿着叶片的边缘分化。
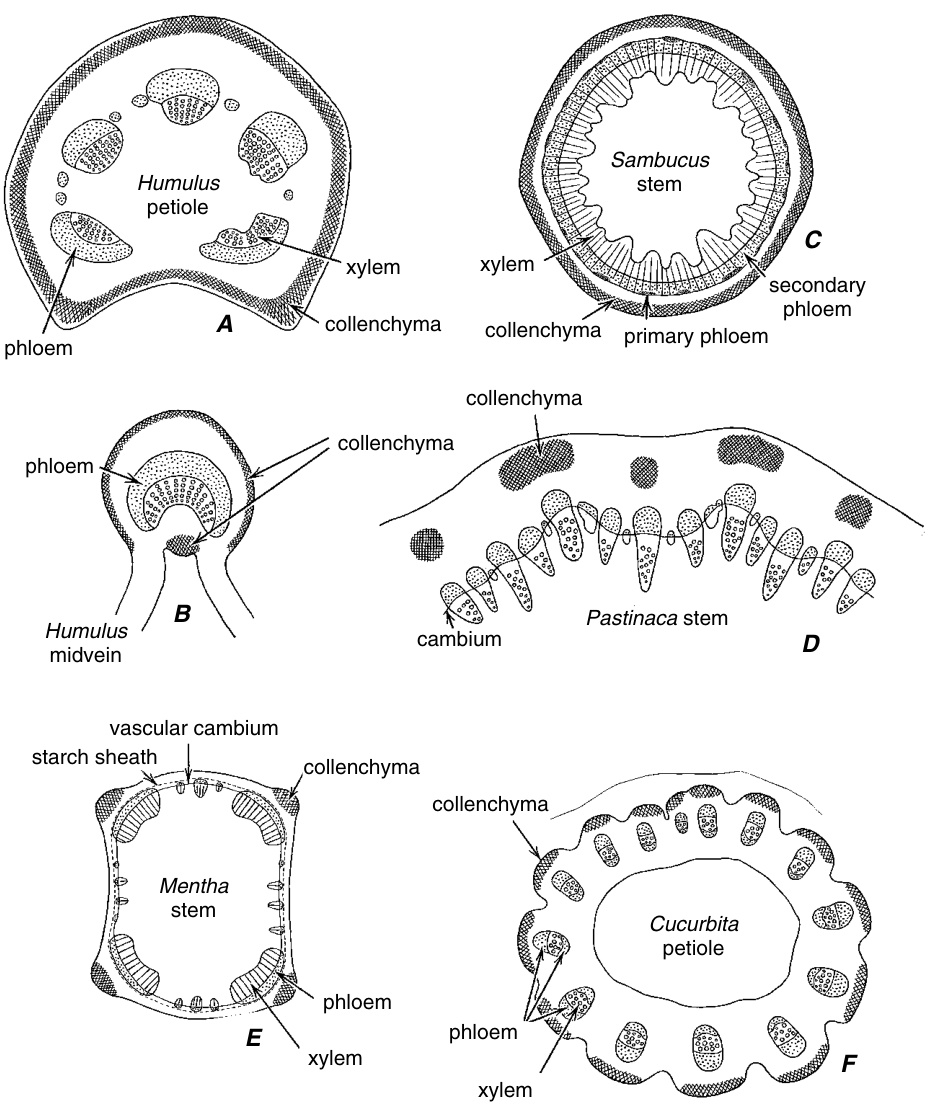
图7.13 厚角组织(交叉阴影)和维管组织在不同植物部位的分布。横切面。(A, B, ×19 ; C–F, ×9.5._{\textrm{\textperthousand}} )
在许多植物中,出现在维管束最外层(韧皮部侧)或最内层(木质部侧)部分或完全包围维管束的薄壁组织由具有厚初生壁的长细胞组成。壁的增厚可能类似于厚角组织,尤其是环状类型(Esau, 1936; Dayanandan et al., 1976)。这种组织通常被称为厚角组织,但由于它与维管组织的关联,其发育历史与起源于基本分生组织的独立厚角组织有些不同。因此,如果必须强调它们与厚角组织细胞的相似性,最好将这种具有厚初生细胞壁的细长、与维管束相关的细胞称为厚角组织化的薄壁组织细胞或厚角组织增厚的薄壁组织。这种命名可以应用于植物中任何位置类似于厚角组织的薄壁组织。
厚角组织似乎特别适合支持生长的叶和茎
在茎的发育早期,厚角组织()的细胞壁就开始增厚。由于这些细胞能够同时增加细胞壁的表面积和厚度,它们在器官仍在伸长时就能发育并维持厚壁。此外,由于壁的增厚具有可塑性()和延展性(),它们不会阻碍茎和叶的伸长。在芹菜叶柄中,厚角组织细胞的长度增加了约30倍,同时细胞壁的厚度和表面积也显著增加(Frey-Wyssling和Mühlethaler, 1965)。在更高级的发育阶段,厚角组织继续作为植物部分(许多叶片、草本茎)的支持组织,这些部分没有发育出很多厚壁组织(sclerenchyma)。关于厚角组织的支持作用,值得注意的是,在受到机械应力(如暴露在风中、在倾斜的茎上附加重量)的发育中的植物部分中,厚角组织的壁增厚比未受到这种应力的植物开始得更早(Venning, 1949; Razdorskii, 1955; Walker, 1960)。此外,受到应力的茎可能表现出显著更高比例的厚角组织(Patterson, 1992)。这些应力不会影响形成的厚角组织类型。除了作为支持组织的作用外,厚角组织还与橡树对槲寄生定植(Hariri et al., 1992)和昆虫茎部取食(Oghiakhe et al., 1993)的抗性有关。
将厚角组织与纤维(fiber)进行比较特别有趣。在一项研究中,厚角组织束在断裂前从2\%伸长到2.5\%,而纤维束在断裂前伸长不到1.5\%(Ambronn, 1881)。厚角组织束能够支撑每\mathbf{mm}^{2} 10到{\bf12k g},而纤维束能够支撑每\mathbf{mm}^{2} 15到20\mathrm{kg}。纤维束即使在受到每\mathbf{mm}^{2} 15到20\mathrm{kg}的张力后也能恢复其原始长度,而厚角组织束在仅支撑每\mathbf{mm}^{2} 1.5到2\mathbf{k}\mathbf{g}后就永久性地保持伸长。换句话说,厚角组织的抗拉强度(tensile strength)与纤维相当,但厚角组织是可塑的(plastic),而厚壁组织是弹性的(elastic)。如果纤维在生长的植物部分中发育,它们会阻碍伸长,因为它们在被拉伸时有恢复原始长度的趋势。另一方面,厚角组织在相同条件下会保持伸长。厚角组织细胞壁可塑性的重要性进一步体现在观察到许多节间伸长发生在厚角组织细胞壁增厚之后。在芹菜叶柄中,壁增厚在生长停止后仍持续一段时间(Vian et al., 1993)。
成熟的厚角组织(collenchyma)是一种强韧且柔韧的组织,由长而重叠的细胞组成(在束的中心,有些细胞长度可达2毫米;Duchaigne, 1955),其细胞壁厚且未木质化。在老化的植物部分中,厚角组织可能会变硬,变得比年轻部分更不具可塑性,或者如前所述,它可能通过木质化次生壁的沉积转变为厚壁组织(sclerenchyma)。成熟的芹菜厚角组织失去延伸生长的能力,归因于其微纤维的净纵向排列以及相对缺乏甲基化的果胶(Fenwick et al., 1997)。果胶和半纤维素的交联也可能使成熟的厚角组织细胞壁变硬(Liu et al., 1999)。如果厚角组织未经历这些变化,由于茎或叶柄深层部分厚壁组织的发展,其作为支持组织的作用可能会变得不那么重要。此外,在具有次生生长的茎中,木质部成为主要的支持组织,因为该组织中具有木质化次生壁的细胞占主导地位,并且长而重叠的细胞数量丰富。
