第十三章 韧皮部:细胞类型和发育:修订间差异
自动添加 Sofia 模板和分类 |
无编辑摘要 |
||
| 第1行: | 第1行: | ||
韧皮部虽然正确地被称为维管植物的主要食物传导组织,但在植物的生命中扮演着比这更重要的角色。韧皮部中运输着多种物质。这些物质包括糖类、氨基酸、微量营养素、脂类(主要以游离脂肪酸的形式;Madey 等,2002)、激素(Baker,2000)、花刺激素(florigen;Hoffmann-Benning 等,2002)以及许多蛋白质和RNA(Schobert 等,1998),其中一些除了激素、花刺激素和蔗糖(Chiou 和 Bush,1998;Lalonde 等,1999)外,还作为信息或信号分子(Ruiz-Medrano 等,2001)。韧皮部被称为“信息高速公路”(Jorgensen 等,1998),在器官间的通讯和植物内生长过程的协调中起着重要作用。植物中的长距离信号传递主要通过韧皮部进行(Crawford 和 Zambryski,1999;Thompson 和 Schulz,1999;Ruiz-Medrano 等,2001;van Bel 和 Gaupels,2004)。韧皮部还运输大量的水,可能是果实、幼叶和储存器官(如块茎)的主要水源(Ziegler,1963;Pate,1975;Lee,1989,1990;Araki 等,2004;Nerd 和 Neumann,2004)。 | 韧皮部虽然正确地被称为维管植物的主要食物传导组织,但在植物的生命中扮演着比这更重要的角色。韧皮部中运输着多种物质。这些物质包括糖类、氨基酸、微量营养素、脂类(主要以游离脂肪酸的形式;Madey 等,2002)、激素(Baker,2000)、花刺激素(florigen;Hoffmann-Benning 等,2002)以及许多蛋白质和RNA(Schobert 等,1998),其中一些除了激素、花刺激素和蔗糖(Chiou 和 Bush,1998;Lalonde 等,1999)外,还作为信息或信号分子(Ruiz-Medrano 等,2001)。韧皮部被称为“信息高速公路”(Jorgensen 等,1998),在器官间的通讯和植物内生长过程的协调中起着重要作用。植物中的长距离信号传递主要通过韧皮部进行(Crawford 和 Zambryski,1999;Thompson 和 Schulz,1999;Ruiz-Medrano 等,2001;van Bel 和 Gaupels,2004)。韧皮部还运输大量的水,可能是果实、幼叶和储存器官(如块茎)的主要水源(Ziegler,1963;Pate,1975;Lee,1989,1990;Araki 等,2004;Nerd 和 Neumann,2004)。 | ||
[[文件:E-13.1.png|居中|缩略图|604x604像素|图13.1 A,''Cucurbita'' 茎的横切面。草本藤本植物,具有离散的维管束,每个维管束的韧皮部位于木质部的两侧。维管区域的外围由厚壁组织-perivascular fibers界定。皮层由薄壁组织和厚角组织组成。有表皮。髓腔被空腔取代。维管区域和皮层的薄壁组织中穿行着少量的束外筛管(extrafascicular sieve tubes)和伴胞。B,Cucurbita 维管束的横切面,显示外部和内部的韧皮部。通常在外部韧皮部和木质部之间会形成维管形成层,但在内部韧皮部和木质部之间不会形成。(A,×8;B,×130。)]] | |||
通常,韧皮部在维管系统中与木质部在空间上相关联(图13.1),并且像木质部一样,可以根据其出现的时间与植物或器官整体发育的关系分为初生韧皮部和次生韧皮部。初生韧皮部在胚胎或幼苗中开始形成(Gahan,1988;Busse 和 Evert,1999),在初生植物体的发育过程中不断添加,当初生植物体完全形成时完成其分化。初生韧皮部来源于原形成层。次生韧皮部(第14章)来源于维管形成层,并反映了这种分生组织的轴向和径向系统的组织结构。韧皮部射线通过形成层与木质部的射线相连,为两种维管组织之间的物质径向运输提供了途径。 | 通常,韧皮部在维管系统中与木质部在空间上相关联(图13.1),并且像木质部一样,可以根据其出现的时间与植物或器官整体发育的关系分为初生韧皮部和次生韧皮部。初生韧皮部在胚胎或幼苗中开始形成(Gahan,1988;Busse 和 Evert,1999),在初生植物体的发育过程中不断添加,当初生植物体完全形成时完成其分化。初生韧皮部来源于原形成层。次生韧皮部(第14章)来源于维管形成层,并反映了这种分生组织的轴向和径向系统的组织结构。韧皮部射线通过形成层与木质部的射线相连,为两种维管组织之间的物质径向运输提供了途径。 | ||
尽管韧皮部通常在茎和根中位于木质部的外部,或在叶和叶状器官中位于下侧(abaxial),但在许多真双子叶植物科(如'''夹竹桃科、萝藦科、旋花科、葫芦科、桃金娘科、茄科、菊科''')中,部分韧皮部也位于相对的一侧(图13.1)。这两种韧皮部分别称为'''外生韧皮部(external phloem)'''和'''内生韧皮部(internal phloem)'''或'''木内韧皮部(intraxylary phloem)'''。内部韧皮部在发育上主要是初生的(在一些多年生物种中,内部韧皮部的增加会延续到轴的次生生长阶段),并且开始分化的时间晚于外部韧皮部,通常也晚于原生木质部(protoxylem)(Esau, 1969)。一个显著的例外是在Cucurbita pepo 叶的小脉中,近轴面(上侧)的韧皮部分化早于远轴面的韧皮部(Turgeon and Webb, 1976)。在某些科('''如苋科(Amaranthaceae)、藜科(Chenopodiaceae)、紫茉莉科(Nyctaginaceae)、刺茉莉科(Salvadoraceae)''')中,形成层除了向外产生韧皮部和向内产生木质部外,还会<u>周期性地向茎的内部形成一些韧皮部束或层,从而使韧皮部束嵌入木质部中</u>。这些韧皮部束被称为'''内含韧皮部(included phloem)'''或'''木间韧皮部(interxylary phloem)'''。 | |||
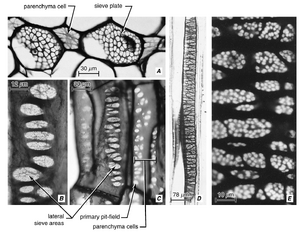
[[文件:E-13.2.png|缩略图|图13.2 在Dahlia pinnata 节间的厚切片中,经过透明处理和苯胺蓝染色后观察到的韧皮部吻合(两个用箭头标记)。照片是用落射荧光显微镜拍摄的。大量的点表示胼胝质(callose)的位置,这些胼胝质出现在筛管的侧筛区(lateral sieve areas)和筛板(sieve plates)上。这里可以看到两个纵向维管束,它们通过韧皮部吻合相互连接。在Dahlia 中,每个节间大约有3000个韧皮部吻合。(由Roni Aloni提供。)]] | |||
在节间和叶柄的纵向维管束的初生韧皮部中,形成'''横向连接的筛管'''在许多种子植物中很常见(图13.1A和13.2;Aloni and Sachs, 1973;Oross and Lucas, 1985;McCauley and Evert, 1988;Aloni and Barnett, 1996)。这被称为'''韧皮部吻合(phloem anastomoses)''',它们也在茎中'''连接内部和外部韧皮部'''(Esau, 1938;Fukuda, 1967;Bonnemain, 1969),并'''在叶中连接近轴面和远轴面的韧皮部'''(Artschwager, 1918;Hayward, 1938;McCauley and Evert, 1988)。在对Dahlia pinnata 茎中韧皮部吻合功能意义的研究中(Aloni and Peterson, 1990),发现韧皮部吻合并不在正常情况下起作用。然而,当纵向束被切断时,吻合开始发挥运输功能。结论是,尽管Dahlia节间的韧皮部吻合能够发挥作用,但它们主要作为一个应急系统,为同化物提供绕过茎的替代路径(Aloni和Peterson,1990)。 | |||
图13. | |||
韧皮部组织的整体发育和结构与木质部相似,但韧皮部的独特功能与其特有的结构特征相关。韧皮部组织的硬化程度较低,且不如木质部组织持久。由于它通常位于茎和根的外围,韧皮部在次生生长过程中随着轴周长的增加而发生显著变化,其中不再参与传导的部分最终可能被周皮切断(第15章)。相比之下,老化的木质部在其基本结构上保持相对不变。 | 韧皮部组织的整体发育和结构与木质部相似,但韧皮部的独特功能与其特有的结构特征相关。韧皮部组织的硬化程度较低,且不如木质部组织持久。由于它通常位于茎和根的外围,韧皮部在次生生长过程中随着轴周长的增加而发生显著变化,其中不再参与传导的部分最终可能被周皮切断(第15章)。相比之下,老化的木质部在其基本结构上保持相对不变。 | ||
< | == ❙ 韧皮部的细胞类型 == | ||
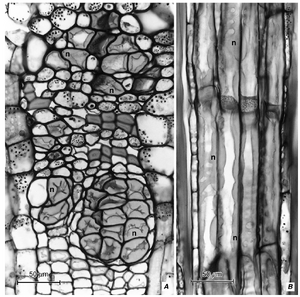
[[文件:E-13.3.png|缩略图|图13.3 真双子叶植物Robinia pseudoacacia次生韧皮部中的细胞类型。A–E,纵切面;F-J,横切面。A, J,纤维。B,筛管分子和伴胞。F,筛板平面上的筛管分子和伴胞。C, G,韧皮部薄壁细胞(C中的薄壁细胞束)。D, H,含晶体的薄壁细胞。E, I,石细胞。K–M,韧皮部切向(K)、径向(L)和横切(M)切面中的射线细胞。(来自Esau, 1977。) ]] | |||
初生和次生韧皮部组织包含相同的细胞类别。然而,<u>初生韧皮部并未组织成轴向和径向两个系统;</u>'''它没有射线'''。韧皮部的基本组成部分是筛管分子(sieve elements)和各种类型的薄壁细胞(parenchyma cells)。纤维(fibers)和石细胞(sclereids)是常见的韧皮部组成部分。乳汁管(laticifers)、树脂道(resin ducts)和各种idioblasts,在形态和生理上特化,也可能存在于韧皮部中。在本章中,仅详细讨论主要的细胞类型。总结图(图13.3)和表13.1中的韧皮部细胞列表基于次生韧皮部的特征组成。 | |||
[[文件:E-13.4.png|缩略图|图13.4 筛管分子结构的变异。A,Pinus pinea的筛胞,与相关的射线一起,如切向切面所示。其他为以下物种韧皮部切向切面中的筛管分子及其伴胞:B,Juglans hindsii;C,Malus domestica;D,Liriodendron tulipifera;E,Acer pseudoplatanus;F,Cryptocarya rubra;G,Fraxinus americana;H,Wisteria sp. 在B-G中,筛板呈侧面观,由于胼胝质的沉积,其筛域比相邻的壁区域更厚。(引自Esau, 1977)]] | |||
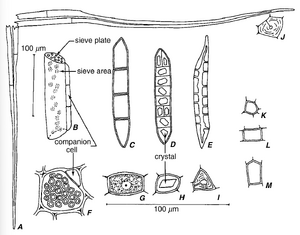
韧皮部的主要传导细胞是筛成分(sieve elements),之所以如此命名是因为它们的壁上有被孔穿透的区域(筛域,sieve | 韧皮部的主要传导细胞是筛成分(sieve elements),之所以如此命名是因为它们的壁上有被孔穿透的区域(筛域,sieve areas)。在种子植物中,筛成分可以分为较不特化的筛胞(sieve cells)(图13.4A)和更特化的筛管分子(sieve-tube elements)或筛管成员(sieve-tube members)(图13.4B-H)。这种分类与管成分(tracheary elements)分为较不特化的管胞(tracheids)和更特化的导管分子(vessel elements)相似。术语“筛管”(sieve tube)指的是一系列纵向排列的筛管分子,就像术语“导管”(vessel)指的是一系列纵向排列的导管分子一样。在这两种分类中,壁结构的特征——管状分子中的纹孔(pits)和穿孔板(perforation plates),筛管分子中的筛域和筛板(sieve plates)(见下文)——可以用来区分这两类细胞。然而,导管分子存在于被子植物、买麻藤植物(Gnetophyta)和一些无种子维管植物中,而筛管分子仅存在于被子植物中。此外,术语“筛胞”(sieve cell)仅限于裸子植物的筛管分子,这些筛管分子在本章后面讨论,其结构和发育非常一致。无种子维管植物或维管隐花植物(vascular cryptogams)的筛管分子在结构和发育上表现出很大的变异,通常简单地用通用术语sieve element来指代(Evert,1990a)。 | ||
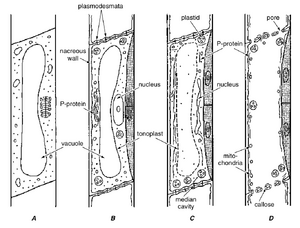
[[文件:E-13.5.png|缩略图|图13.5 图示筛管分子的分化过程。A,分裂中的筛管分子前体。B,分裂后:具有珠光壁和P-蛋白体的筛管分子;分裂中的伴胞前体(点状)。C,细胞核退化,液泡膜部分破裂,P-蛋白分散;未来筛板中的中央腔;两个伴胞(点状)。D,成熟的筛管分子;筛板上的孔开放;它们内衬有胼胝质和一些P-蛋白。除了质体外,还存在线粒体。未显示内质网。(引自Esau, 1977)]] | |||
年轻的筛管分子包含年轻植物细胞的所有细胞成分。随着它们的分化,筛管分子经历了深刻的变化。主要的变化包括细胞核和液泡膜的分解以及壁区域的形成,即筛域,其上的孔增加了垂直或水平相邻筛分子之间的原生质连续性。而管状分子经历程序性细胞死亡——一种完全的自噬——导致原生质内容物的完全丧失,筛分子则经历选择性自噬(图13.5)。成熟时,筛分子的原生质体保留了质膜、内质网、质体和线粒体,所有这些都位于细胞壁附近的位置。 | 年轻的筛管分子包含年轻植物细胞的所有细胞成分。随着它们的分化,筛管分子经历了深刻的变化。主要的变化包括细胞核和液泡膜的分解以及壁区域的形成,即筛域,其上的孔增加了垂直或水平相邻筛分子之间的原生质连续性。而管状分子经历程序性细胞死亡——一种完全的自噬——导致原生质内容物的完全丧失,筛分子则经历选择性自噬(图13.5)。成熟时,筛分子的原生质体保留了质膜、内质网、质体和线粒体,所有这些都位于细胞壁附近的位置。 | ||
== ❙ 被子植物的筛管分子 == | |||
'''被子植物的筛管分子的特征是存在筛板,筛板上的筛域孔比其他壁部分的筛域孔更大'''。除少数例外(例如,Nicotiana tabacum根的原生韧皮部分子,Esau和Gill, 1972;全寄生植物Epifagus virginiana气生茎的次生韧皮部分子,Walsh和Popovich, 1977;许多棕榈植物的筛分子,Parthasarathy, 1974a, b;Lemna minor,Melaragno和Walsh, 1976;以及禾本科的所有成员,Evert等, 1971b;Kuo等, 1972;Eleftheriou, 1990),'''筛管分子的原生质体含有P-蛋白'''(韧皮部蛋白phloem protein,以前称为slime)。除了筛板和P-蛋白外,筛管分子通常与伴胞相关联,伴胞是与筛管分子密切相关的特化薄壁细胞,对于筛管分子而言在个体发育和功能上都具有重要意义。术语“筛管-伴胞复合体”或“筛分子-伴胞复合体”通常用于指代筛管分子及其相关的伴胞。。 | |||
=== 在某些分类群中,筛管分子的壁显著增厚 === | |||
[[文件:E-13.6.png|缩略图|图13.6 大麦(Hordeum vulgare)叶片中一个大维管束部分的电子显微照片。注意靠近木质部的四个最后形成的筛管(实心点)的厚壁,以及较早形成的筛管(空心点)的相对薄壁。其他细节:x,木质部。(来自 Dannenhoffer 等,1990。)]] | |||
筛管分子的壁通常被描述为初生壁,并且通过标准的显微化学测试'''通常仅对纤维素和果胶呈阳性反应'''(Esau, 1969)。在禾本科植物的叶片中,纵向维管束中最后形成的筛管通常具有相对较厚的细胞壁(图13.6)。在'''某些物种中'''——Triticum aestivum(Kuo and O’Brien, 1974)、Aegilops comosa(Eleftheriou, 1981)、Saccharum officinarum(Colbert and Evert, 1982)、Hordeum vulgare(Dannenhoffer et al., 1990)——'''这些壁是木质化'''的。'''尽管厚度不一,筛管分子的壁通常明显比周围的薄壁细胞更厚,这一特征可能有助于识别筛管分子。''' | |||
[[文件:E-13.7.png|缩略图|图13.7 Magnolia kobus次生韧皮部的横切面(A)和径向纵切面(B)。注意筛管的厚内壁层(n,珠光质层)。(来自 Evert,1990b,图16.19 和 16.20。© 1990,Springer-Verlag。)]] | |||
在许多物种中,筛管分子的壁由两个形态上不同的层组成,一层相对较薄的外层和一层或多或少的较厚的内层。在'''新鲜切片中,明显的内层呈现出闪亮或发光的表面''',因此得名'''珠光质'''nacreous(具有珍珠光泽)的壁。珠光质层比外层壁'''含有更少的纤维素,并且缺乏果胶质'''(pectin-poor)(Esau 和 Cheadle,1958;Botha 和 Evert,1981)。有时珠光质层非常厚,几乎堵塞了细胞的腔室。尽管一些研究者将此壁层分类为次生壁,但其行为变化很大。在初生筛管分子中,它通常是暂时性的,随着细胞接近成熟而厚度减少,并在细胞达到成熟时消失。在次生韧皮部筛管分子中,珠光质层可能随年龄减少厚度,也可能不减少(图13.7;Esau 和 Cheadle,1958;Gilliland 等,1984)。'''珠光质层不会延伸到筛域和筛板的区域。''' | |||
通过使用温和的提取程序去除非纤维素壁成分并结合电子显微镜观察,某些真双子叶植物的珠光质增厚显示出多层结构,同心排列的薄层由密集排列的微纤丝(microfibrils)组成(Deshpande,1976;Catesson,1982)。海草筛管分子中的珠光质壁在没有提取的情况下也表现出多层结构(Kuo,1983)。 | 通过使用温和的提取程序去除非纤维素壁成分并结合电子显微镜观察,某些真双子叶植物的珠光质增厚显示出多层结构,同心排列的薄层由密集排列的微纤丝(microfibrils)组成(Deshpande,1976;Catesson,1982)。海草筛管分子中的珠光质壁在没有提取的情况下也表现出多层结构(Kuo,1983)。 | ||
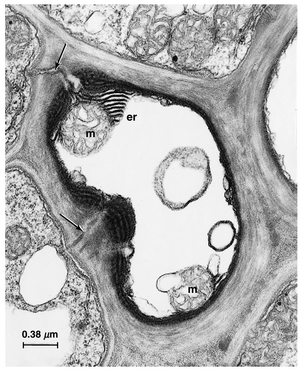
[[文件:E-13.8.png|缩略图|图13.8大麦(Hordeum vulgare)筛管的电子显微照片,显示的是通过叶片纵向束的横切面。壁的内表面明显比壁的其他部分电子密度更高,在与薄壁组织元素连接的孔-胞间连丝(plasmodesmata)处最厚(箭头所示)。其他细节:er,内质网();m,线粒体(mitochondrion)。(来自Evert和Mierzwa, 1989, 图2. \copyright 1989, Springer-Verlag.)]] | |||
在用戊二醛-四氧化锇固定并用醋酸铀和柠檬酸铅染色后,筛管分子壁的内表面通常比壁的其他部分显示出更高的电子密度(图13.8;Evert 和 Mierzwa,1989)。该区域通常显示出网状和/或条纹状图案,显然是一个富含果胶质的非微纤丝材料层,与珠光质增厚不同,它延伸到筛域和筛板(Lucas 和 Franceschi,1982;Evert 和 Mierzwa,1989)。在Hordeum vulgare叶片叶脉的筛管中,这个电子密度高的内壁区域在侧筛域和筛板处最厚,其中充满了由质膜形成的管状迷宫(Evert 和 Mierzwa,1989)。在筛域之间的侧壁处,这个内壁区域充满了许多质膜的微绒毛状突起,大大增加了细胞壁与质膜的界面,使其呈现出刷状缘的外观。 | |||
=== 筛板通常出现在端壁上 === | |||
[[文件:E-13.9.png|缩略图|图13.9 A, simple sieve plates of Cucurbita in surface view. B, C, lateral sieve areas in sieve-tube elements and primary pit f i elds in parenchyma cells of Cucurbita in surface view. D, surface view of compound sieve plate of Cocos, a monocot with sieve areas in reticulate arrangement. E, part of similar sieve plate. Light spots are callose cylinders. (A–C, from Esau et al., 1953; D, E, from Cheadle and Whitford, 1941.)]] | |||
如前所述,在被子植物中,同一细胞壁上的筛域(sieve-area)孔的大小差异很大(图13.9A–C)。筛域中的孔直径从几分之一μm(比胞间连丝稍宽)到15μm不等,在某些真双子叶植物(eudicots)中可能更大(Esau和Cheadle, 1959)。'''具有较大孔的筛域通常出现在端壁上,而具有较小孔的筛域则出现在侧壁或侧壁上。'''因此,'''筛板通常出现在端壁上''',筛管元素(sieve-tube elements)端对端排列,形成筛管(sieve tube)。'''筛板也可能出现在侧壁上'''。一些筛板'''仅承载一个筛域'''(图13.9A;'''简单筛板'''(simple sieve plate)),而其他筛板则'''承载两个或更多筛域'''(图13.9D, E;'''复合筛板'''(compound sieve plate))。 | |||
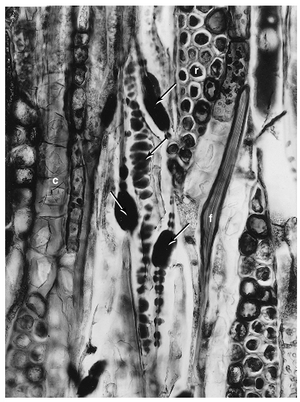
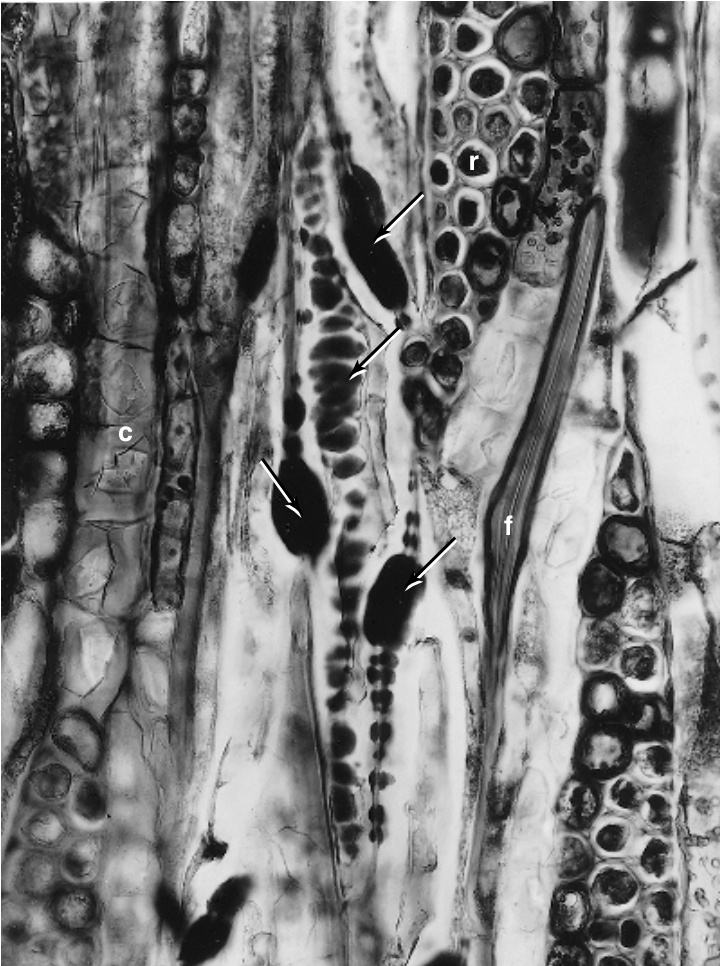
[[文件:E-13.10.png|缩略图|图13.10 Ulmus americana次生韧皮部中非功能性筛管分子的纵向视图(切向切面),筛板和侧筛区域有大量确定的胼胝质沉积(箭头)。其他细节:c,含晶细胞;f,纤维;r,射线。(×400。来自Evert等,1969。)]] | |||
<u>在常规的韧皮部制备中,筛孔(sieve pores)通常由壁成分胼胝质(callose)衬里(第4章)</u>。<u>大多数(如果不是全部)与传导筛管元素相关的胼胝质是由于机械损伤或其他类型的刺激而沉积在那里的</u>(Evert和Derr, 1964; Esau, 1969; Eschrich, 1975)。并非所有与筛孔相关的胼胝质都是这种伤口胼胝质(wound callose)。胼胝质通常在衰老筛元素(senescing sieve elements)的筛板和侧面的筛域上积累(图13.10)。这种确定的胼胝质(definitive callose)在筛元素死亡后一段时间消失。胼胝质通常在功能超过一个生长季节的次生韧皮部筛管元素的筛板和侧筛域上积累(Davis和Evert, 1970)。在温带地区,这种休眠胼胝质(dormancy callose)在秋季沉积,然后在早春休眠越冬筛元素重新激活时被移除。 | |||
图13. | |||
=== 胼胝质似乎在筛孔发育中起作用 === | |||
在幼嫩的筛管分子(sieve-tube elements)中,初生筛板(sieve plate)的筛域(sieve area)被数量不等的胞间连丝(plasmodesmata)穿过,每根胞间连丝在细胞壁两侧都与内质网()的cisterna相连(图13.11A)。孔位(pore sites)最初通过细胞壁两侧每个胞间连丝周围质膜(plasma membrane)下方胼胝质(callose)的出现而与细胞壁的其他部分区分开来。成对的胼胝质沉积物,通常称为platelets,呈领状或锥状,在胞间连丝所在的中部中断(图13.11B, C)。platelets迅速增大,最初其增厚速度可能超过细胞壁的其他部分。细胞壁的纤维素-果胶(cellulosic-pectin)部分的增厚可能超过胼胝质platelets;然后孔位在筛板上表现为凹陷。孔位处胼胝质platelets的存在显然阻止了纤维素在那里进一步沉积,因此夹在platelets之间的纤维素壁部分保持薄的状态。孔位处胼胝质platelets的定位和细胞壁的增厚是筛管分子发育的最早指标之一。 | |||
在幼嫩的筛管分子(sieve-tube elements)中,初生筛板(sieve plate)的筛域(sieve area)被数量不等的胞间连丝(plasmodesmata)穿过,每根胞间连丝在细胞壁两侧都与内质网( | |||
孔位的穿孔大约在细胞核退化时开始。细胞壁物质的移除从围绕胞间连丝的中胶层(middle lamella)区域开始(图13.11D, E)。在某些情况下,最初形成一个median cavity,然后胼胝质platelets和夹在它们之间的细胞壁物质同时被移除,从而形成孔(Deshpande, 1974, 1975)。在其他情况下,中胶层区域的溶解导致相对的胼胝质platelets合并,因此最初幼嫩的孔内衬有胼胝质(Esau和Thorsch, 1984, 1985)。在整个孔发育过程中,内质网囊泡始终紧密贴附在胼胝质platelets边缘的质膜上,直到孔达到其完全大小时才被移除(图13.11F)。侧筛域(sieve-area)孔的发育与筛板孔的发育基本相似(Evert等, 1971a)。 | 孔位的穿孔大约在细胞核退化时开始。细胞壁物质的移除从围绕胞间连丝的中胶层(middle lamella)区域开始(图13.11D, E)。在某些情况下,最初形成一个median cavity,然后胼胝质platelets和夹在它们之间的细胞壁物质同时被移除,从而形成孔(Deshpande, 1974, 1975)。在其他情况下,中胶层区域的溶解导致相对的胼胝质platelets合并,因此最初幼嫩的孔内衬有胼胝质(Esau和Thorsch, 1984, 1985)。在整个孔发育过程中,内质网囊泡始终紧密贴附在胼胝质platelets边缘的质膜上,直到孔达到其完全大小时才被移除(图13.11F)。侧筛域(sieve-area)孔的发育与筛板孔的发育基本相似(Evert等, 1971a)。 | ||
胼胝质是否普遍参与筛孔(sieve-pore) | 胼胝质是否普遍参与筛孔(sieve-pore)的形成尚存疑问。在小型水生单子叶植物Lemna minor的根原韧皮部(protophloem)中,在筛孔发育的任何阶段都没有发现胼胝质(Walsh和Melaragno, 1976)。然而,胼胝质可以在受伤时诱导形成。 | ||
=== 质体(plastids)外观的变化和P蛋白(P-protein)的出现是筛管分子发育的早期指标 === | |||
最初,年轻的筛管分子原生质体(图13.12)与其他原形成层细胞或新近形成的形成层衍生物的原生质体相似。年轻的、有核的筛管分子及其邻近的有核细胞都含有高尔基体、质体和线粒体。液泡的数量不一,由液泡膜(tonoplasts)与细胞质分隔开来。细胞质富含游离核糖体,并含有粗糙内质网(rough )的网络。微管(microtubules)主要与细胞长轴成直角排列,位于质膜旁边,紧贴着薄薄的细胞壁。纵向排列的肌动蛋白丝束相当多。除了微管外,各种细胞组分或多或少随机分布在细胞中。 | |||
质体外观的变化是筛管发育的早期指标,最初它们与邻近细胞的质体相似。随着筛管质体的成熟,其基质(stroma)变得不那么致密,并且可能出现该质体类型特有的内含物(图13.13A-D)。在此之前,通常很难将质体与线粒体区分开来。在成熟的筛管分子中,基质是电子透明的,内部的膜(类囊体)通常稀少。筛管质体有两种基本类型,S型(淀粉)和P型(蛋白质)(Behnke,1991a)。S型有两种形式,一种仅含有淀粉(图13.13A,C);另一种则没有任何内含物。P型有六种形式,含有一或两种蛋白质内含物(晶体,图13.13B,D,和/或丝状体,图13.13E)。其中两种还含有淀粉。所有单子叶植物都具有P型质体,而仅含有楔形蛋白质晶体(图13.13B,D)的类型又占多数(Eleftheriou,1990)。与普通淀粉不同,筛管淀粉用碘(I2KI)染色时呈棕红色而非蓝黑色。Phaseolus vulgaris中的筛管淀粉是一种高度分支的支链淀粉(amylopectin)分子,具有大量的\alpha\mathfraka(1\rightarrow6)键(Palevitz和Newcomb,1970)。筛管分子中的质体差异在分类学上具有重要价值(Behnke,1991a,2003)。 | |||
<nowiki> | <nowiki> | ||
筛管分子(sieve-tube element)发育的另一个早期指标是P蛋白(P-protein)的出现,它最初在光学显微镜下表现为离散的颗粒,每个细胞中有一个或多个(图13.14A, B)。P蛋白颗粒在筛管分子前体分裂产生一个或多个伴胞(companion cell)后出现。大多数物种具有分散的P蛋白颗粒。这些P蛋白颗粒最初很小,随后逐渐增大(图13.14A, B),最终开始分散,在细胞质的壁层形成丝状或网状结构。此时,细胞核已经开始退化。在液泡膜消失后,分散的P蛋白位于细胞腔和筛板孔(sieve-plate pores)的壁层位置(图13.15和13.16D; Evert et al., 1973c; Fellows and Geiger, 1974; Fisher, D. B., 1975; Turgeon et al., 1975; Lawton, D. M., and Newman, 1979; Deshpande, 1984; Deshpande and Rajendrababu, 1985; Russin and Evert, 1985; Knoblauch and van Bel, 1998; Ehlers et al., 2000),前提是在取样过程中尽可能少地干扰韧皮部。否则,当筛管被切断时,随着筛管内容物高压的释放,P蛋白可能会在整个细胞腔中分散,或者在压力释放时在筛板远离压力释放部位的一侧积聚形成黏液塞(slime plugs)。 | |||
筛管分子(sieve-tube element) | |||
在电子显微镜下,P蛋白通常呈管状的丝,亚基呈螺旋排列(图13.16A-C) | 在电子显微镜下,P蛋白通常呈管状的丝,亚基呈螺旋排列(图13.16A-C)。Cucurbita maxima中的P蛋白丝由两种非常丰富的蛋白质组成:韧皮蛋白1(phloem protein 1, PP1),一种96 kDa的蛋白质丝,和韧皮蛋白2(phloem protein 2, PP2),一种25 kDa的二聚体凝集素(lectin),它与PP1共价结合。蛋白质和mRNA的定位模式表明,PP1和PP2是在分化和成熟的筛管分子-伴胞复合体中合成的,并且在分化过程中聚合形式的P蛋白在筛管分子中积累(Bostwick et al., 1992; Clark et al., 1997; Dannenhoffer et al., 1997; Golecki et al., 1999)。显然,在伴胞中合成的PP1和PP2亚基通过它们共同壁中的孔-胞间连丝(pore-plasmodesmata)连接被运输到筛管分子中。到目前为止,丝状P蛋白的作用仍不确定。有人认为,PP1用于封闭受损筛管分子的筛板孔,代表筛管抵御同化物(assimilates)流失的第一道防线,而伤口胼胝质(wound callose)以不同的速率加强防御(Evert, 1990b)。凝集素(PP2)的作用同样不确定。已发现PP2亚基在同化物流中从源移动到库(见下文),并在筛管分子和伴胞之间循环(Golecki et al., 1999; Dinant et al., 2003)。在16个种子植物属中发现了PP2样基因,包括一种裸子植物(Picea taeda)和四个禾本科(Poaceae)属,这些植物都不含PP1。在一种非维管植物——苔藓Physcomitrella patens中也发现了PP2样基因。看来PP2样蛋白质可能具有不仅与PP1或维管特异性功能相关的特性(Dinant等, 2003)。有人提出PP2可能用于在伤口部位固定细菌和真菌,或作为成熟、传导的筛管分子中沿壁持续存在的细胞器的锚点。在Vicia faba和Lycopersicon esculentum的筛管分子中发现了微小的夹状结构,这些结构被认为负责成熟筛管分子中组件的周边定位(Ehlers等, 2000)。这些"夹子"的化学性质尚不清楚。 | ||
<nowiki> | <nowiki> | ||
图13.11 | 图13.11 从棉花(Gossypium hirsutum)节间发育的筛管分子中的筛板,如横切面(A、B、D、F)和表面视图(C、E)所示。A,一个胞间连丝(plasmodesma),标记了未来孔的位置。一些胼胝质(callose,c)已经沉积在内质网(,er)的池下。B、C,胼胝质片(c)包围了孔位点的胞间连丝(pd)。D、E,随着胞间连丝通道的加宽,孔开始发育。F,成熟的筛板,开放的孔(po)内衬有少量胼胝质并充满P蛋白。其他细节:dt,连丝管(desmotubule);ml,中层(middle lamella)。(来自Esau和Thorsch,1985年) | ||
图13.12 | 图13.12 烟草(Nicotiana tabacum)叶片中年轻筛管分子(SE)和伴胞(CC)的纵向视图。箭头标记了筛管分子两端(未来的筛板)以及筛管分子和伴胞之间的共同壁中可辨别的胞间连丝(未来孔-胞间连丝连接的位置)。筛管分子细胞核上方和下方有许多小液泡(v)。(来自Esau和Thorsch,1985年) | ||
图13.13 | 图13.13 筛管质体。豆类(Phaseolus)根尖中的未成熟(A)和成熟(C)S型质体;洋葱(Allium)根尖中的未成熟(B)和成熟(D)P型质体,带有楔形蛋白晶体(密集内含物)。E,菠菜(Spinacia)叶片筛管中的P型质体,带有丝状蛋白内含物(f)。其他细节:er,内质网;s,淀粉;w,壁。 | ||
图13.14 | 图13.14 南瓜(Cucurbita maxima)茎韧皮部中未成熟和成熟的筛管分子,如纵向(A)和横切面(B、C)所示。A,两个未成熟的筛管分子(右侧和中央)含有许多P蛋白体(箭头)。右侧筛管分子中的P蛋白体已经开始在细胞质的壁层中分散。该筛管分子中的细胞核(n)已经开始退化,几乎不可辨认。一束伴胞(cc)伴随着成熟的筛管分子,位于最右侧和左侧。左下角的筛管分子中可以看到一个黏液塞(sp)。B,两个未成熟的筛管。左侧的筛管中可以看到大的P蛋白体(箭头),右侧的筛管中可以看到未成熟(简单)筛板的正面视图。小而密集的细胞是伴胞。C,两个成熟的筛管分子。左侧的筛管分子中可以看到一个黏液塞(sp),右侧的筛管分子中可以看到一个成熟的筛板。小而密集的细胞是伴胞。(A,×300;B、C,×750) | ||
图13.15 | 图13.15 电子显微镜下成熟的Cucurbita maxima筛板部分表面视图。孔道内衬有狭窄的胼胝质圆柱体(c)和质膜(未标记)。内质网(er)和P蛋白(pp)的元素也沿着孔道的边缘分布。(来自Evert等, 1973c, 图2. 1973, Springer-Verlag.) | ||
<nowiki> | <nowiki> | ||
图13.16 | 图13.16 P蛋白。Poinsettia (A)、Nicotiana tabacum (B)、Nelumbo nucifera (C)和Cucurbita pepo (D)的筛管分子。A, P蛋白体的一部分显示管状丝。B, 负染的韧皮部渗出液的高倍放大显示了P蛋白丝的双链结构。C, 积累在筛板孔中的P蛋白显示延伸的丝中的水平条纹;孔道内衬有胼胝质(c)位于质膜(pm)下方。D, 横切面显示成熟筛管分子(上方)的壁(w)部分和细胞质的壁层。此视图中的壁层由质膜(pm)、不连续的内质网(er)轮廓和P蛋白(pp)组成。在筛管分子(孔侧)-伴胞(胞间连丝侧)壁中可以看到孔-胞间连丝连接。其他细节: po, 孔; pd, 胞间连丝。(B, 转载自Cronshaw等, 1973. \copyright 1973, 经Elsevier许可; C, 来自Esau, 1977; D, 来自Evert等, 1973c, 图6. \copyright 1973, Springer-Verlag.) | ||
在一些分类群(主要是木本植物科)中,P-蛋白体(P-protein bodies)仅部分分散或完全不分散(非分散性P-蛋白体,图13.17;另见图13.36A;Behnke, 1991b)。曾经被认为是挤出的核仁的细胞质内含物就是这些的例子(Deshpande and Evert, 1970; Esau, 1978a; Behnke and Kiristis, 1983)。常被引为非分散性P-蛋白体例子的是Fabaceae的有尾或无尾纺锤形结晶P-蛋白体,这些在光学显微镜下曾被称为持久性黏液体(Esau, 1969)。然而,研究表明,这些P-蛋白体能够经历快速且可逆的钙控制转化,从浓缩的“静止状态”转变为分散状态,在此状态下它们会阻塞筛管(Knoblauch et al., 2001)。结晶体的分散是由质膜泄漏和急剧的膨压变化触发的。有人认为,P-蛋白在分散和浓缩之间循环的能力可能提供了一种控制筛管导电性的有效机制(Knoblauch et al., 2001)。在双子叶植物的筛管元素中,可以识别出四种主要的非分散性P-蛋白体形式:纺锤形、复合球形、棒状和玫瑰状(Behnke, 1991b)。绝大多数非分散性蛋白体来源于细胞质。在双子叶植物的两个科——Boraginaceae和Myristicaceae(Behnke, 1991b)以及单子叶植物的Zingiberaceae(Behnke, 1994)中发现了核来源的非分散性蛋白体。 | 在一些分类群(主要是木本植物科)中,P-蛋白体(P-protein bodies)仅部分分散或完全不分散(非分散性P-蛋白体,图13.17;另见图13.36A;Behnke, 1991b)。曾经被认为是挤出的核仁的细胞质内含物就是这些的例子(Deshpande and Evert, 1970; Esau, 1978a; Behnke and Kiristis, 1983)。常被引为非分散性P-蛋白体例子的是Fabaceae的有尾或无尾纺锤形结晶P-蛋白体,这些在光学显微镜下曾被称为持久性黏液体(Esau, 1969)。然而,研究表明,这些P-蛋白体能够经历快速且可逆的钙控制转化,从浓缩的“静止状态”转变为分散状态,在此状态下它们会阻塞筛管(Knoblauch et al., 2001)。结晶体的分散是由质膜泄漏和急剧的膨压变化触发的。有人认为,P-蛋白在分散和浓缩之间循环的能力可能提供了一种控制筛管导电性的有效机制(Knoblauch et al., 2001)。在双子叶植物的筛管元素中,可以识别出四种主要的非分散性P-蛋白体形式:纺锤形、复合球形、棒状和玫瑰状(Behnke, 1991b)。绝大多数非分散性蛋白体来源于细胞质。在双子叶植物的两个科——Boraginaceae和Myristicaceae(Behnke, 1991b)以及单子叶植物的Zingiberaceae(Behnke, 1994)中发现了核来源的非分散性蛋白体。 | ||
核退化可能是染色质溶解性或核固缩性的 | |||
筛管元素个体发育的最后阶段的主要事件之一是核的退化。在大多数被子植物中——无论是双子叶植物(Evert, 1990b)还是单子叶植物(Eleftheriou, 1990)——核退化是通过染色质溶解(chromatolysis)进行的,这一过程涉及可染色内容物(染色质和核仁)的丢失以及核膜的最终破裂(图13.18B)。核固缩性退化(pycnotic degeneration),在此过程中染色质在核膜破裂前形成一个非常致密的团块,据报道主要发生在分化的原生韧皮部筛管元素中。 | 筛管元素个体发育的最后阶段的主要事件之一是核的退化。在大多数被子植物中——无论是双子叶植物(Evert, 1990b)还是单子叶植物(Eleftheriou, 1990)——核退化是通过染色质溶解(chromatolysis)进行的,这一过程涉及可染色内容物(染色质和核仁)的丢失以及核膜的最终破裂(图13.18B)。核固缩性退化(pycnotic degeneration),在此过程中染色质在核膜破裂前形成一个非常致密的团块,据报道主要发生在分化的原生韧皮部筛管元素中。 | ||
| 第127行: | 第80行: | ||
两个界膜,质膜和液泡膜,表现出不同的行为。质膜作为选择性通透膜持续存在,而液泡膜分解,液泡和壁旁细胞质之间的界限消失。随着叠加的筛管分子腔的清除和它们之间未闭塞的筛板孔(sieve-plate pore)的发育,筛管成为同化物流溶液流动的理想导管(图13.15和13.20)。 | 两个界膜,质膜和液泡膜,表现出不同的行为。质膜作为选择性通透膜持续存在,而液泡膜分解,液泡和壁旁细胞质之间的界限消失。随着叠加的筛管分子腔的清除和它们之间未闭塞的筛板孔(sieve-plate pore)的发育,筛管成为同化物流溶液流动的理想导管(图13.15和13.20)。 | ||
== ❙ 伴胞(Companion Cells) == | |||
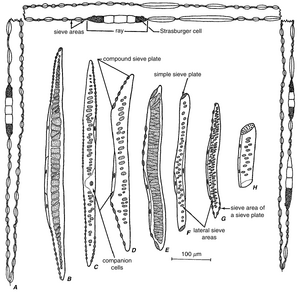
筛管分子通常与称为伴胞(companion cell)的特化薄壁组织细胞相关联。通常,伴胞与它们相关的筛管分子来自同一个母细胞,因此这两种细胞在个体发育上密切相关(图13.5)。在伴胞的形成过程中,筛管分子的分生组织前体纵向分裂一次或多次。其中一个产生的细胞,通常以较大为特征,分化为筛管分子。一个或多个伴胞可能与单个筛管分子相关联,并且伴胞可能出现在筛管分子壁的一侧或多侧。在一些分类群中,伴胞以垂直系列出现(伴胞链companion cell strands;图13.21B, C),这是它们直接前体分裂的结果。伴胞大小也有所不同。一些——无论是单个细胞还是细胞链——都与它们相关的筛管分子(sieve-tube element)一样长(图13.21A);另一些则比筛管分子短(图13.21D–I;Esau, 1969)。伴胞(companion cells)与筛管分子的个体发育关系通常被认为是这些细胞的一个特定特征,尽管一些通常被认为是伴胞的薄壁组织细胞可能并非与它们相关的筛管分子来自同一个母细胞(例如,在玉米叶片的纵向脉中;Evert等,1978)。然而,这种关系在被子植物(angiosperms)中是典型的,并且伴胞的存在被包含在筛管分子的定义中,与筛细胞(sieve cell)形成对比。 | |||
筛管分子通常与称为伴胞(companion cell)的特化薄壁组织细胞相关联。通常,伴胞与它们相关的筛管分子来自同一个母细胞,因此这两种细胞在个体发育上密切相关(图13.5) | |||
<nowiki> | <nowiki> | ||
图13.17 非分散性P-蛋白体。A, | 图13.17 非分散性P-蛋白体。A, Quercus alba。成熟筛管分子中靠近筛板的复合球形体。B, Quercus alba。球形体的细节。C, Rhus glabra。成熟筛管分子中的复合球形体。被Deshpande和Evert(1970)描述为“星状”。D, Robinia pseudoacacia。未成熟筛管分子中纺锤形体的横切面。E, R. pseudoacacia。成熟筛管分子中纺锤形体的纵切面。F, Tilia americana。复合球形体的一部分。外围区域(上方)由杆状成分组成;更密集的中央区域(下方)几乎没有或没有亚结构。Quercus和Tilia的球形体曾被认为是挤出的核仁。(A–C和F,转载自Deshpande和Evert,1970。\copyright 1970,经Elsevier许可;D, E,来自Evert,1990b,图6.16和6.17。\copyright 1990,Springer-Verlag。) | ||
<nowiki> | <nowiki> | ||
图13.18 A, | 图13.18 A, 烟草(Nicotiana tabacum)根中的未成熟原生韧皮部筛管分子。内质网(er)的堆叠已经开始,大多数质体(pl)和线粒体(m)已经分布在细胞壁附近。细胞核(n)开始失去可染色的内容物,发育中的筛板孔位点由成对的胼胝质小板标记。单个胞间连丝(pd)穿过小板,壁的两侧各有一个小板。其他细节:gb,高尔基体;w,薄壁细胞之间的壁。B, 未成熟筛管分子中部分塌陷的细胞核(n),阶段比A更晚。细胞器现在位于壁(w)附近。(转载自Esau和Gill,1972。\copyright 1972,经Elsevier许可。) | ||
<nowiki> | <nowiki> | ||
图13.19 | 图13.19 烟草(Nicotiana tabacum)根中未成熟(A, B)和成熟(C)原生韧皮部筛管分子的横切面。A, 堆叠的内质网(er)和细胞器(线粒体,m,和质体,pl)已经位于外围位置。高尔基体(gb)和丰富的核糖体仍然存在。B, 堆叠内质网的细节。C, 成熟筛管分子具有清晰的形态。其他细节:w,壁。(A, B,转载自Esau和Gill,1972。\copyright 1972,经Elsevier许可。) | ||
<nowiki> | <nowiki> | ||
图13.20 成熟筛管分子部分的纵切面,显示细胞质成分的壁分布和未堵塞孔的筛板。A, | 图13.20 成熟筛管分子部分的纵切面,显示细胞质成分的壁分布和未堵塞孔的筛板。A, Cucurbita maxima。未标记的箭头指向P-蛋白。其他细节:CC,伴胞;PC,薄壁细胞。B, Zea mays。典型的单子叶植物筛管分子,玉米的筛管分子含有P型质体(pl),带有楔形蛋白晶体。玉米是禾本科(Poaceae)的一员,缺乏P-蛋白。(A,来自Evert等,1973c,图11。\copyright 1973,Springer-Verlag;B,由Michael A. Walsh提供。) | ||
在筛管分子的原生质体(protoplast)经历选择性自噬(selective autophagy)并在其个体发育过程中呈现出透明外观的同时,伴胞的原生质体通常在接近成熟时密度增加。这种密度的增加部分是由于核糖体(多核糖体)(ribosome (polysome))数量的增加,部分是由于细胞质(cytosol)本身的密度增加(Behnke, 1975;Esau, 1978b)。成熟的伴胞还含有大量的线粒体(mitochondria)、粗面内质网(rough | 在筛管分子的原生质体(protoplast)经历选择性自噬(selective autophagy)并在其个体发育过程中呈现出透明外观的同时,伴胞的原生质体通常在接近成熟时密度增加。这种密度的增加部分是由于核糖体(多核糖体)(ribosome (polysome))数量的增加,部分是由于细胞质(cytosol)本身的密度增加(Behnke, 1975;Esau, 1978b)。成熟的伴胞还含有大量的线粒体(mitochondria)、粗面内质网(rough )、质体(plastids)和一个显著的细胞核(nucleus)。伴胞的质体通常不含淀粉,尽管存在一些例外(例如,在Cucurbita中,Esau和Cronshaw, 1968;Amaranthus中,Fisher, D. G.和Evert, 1982;Solanum中,McCauley和Evert, 1989)。这些细胞在不同程度上具有液泡(vacuolated)。 | ||
<nowiki> | <nowiki> | ||
图13.21 | 图13.21 伴胞(纵向视图)。A,Tilia americana的筛管分子,伴胞(点状)从筛板延伸到筛板。B,Eucalyptus的筛管分子,伴胞长链。靠近筛板的致密体是曾经被认为是挤出的核仁的非分散性P-蛋白体。C,Daucus(胡萝卜)的筛管分子,伴胞三链。靠近筛板的小体是含有淀粉的质体(plastids);大的是P-蛋白。D–F,Vitis的筛管分子部分;伴胞用阴影表示。G,Calycanthus occidentalis的筛管分子与伴胞;H, I,Pyrus communis的筛管分子部分,伴胞。 | ||
伴胞(companion cells)通过大量的细胞质连接与其相关的筛管分子(sieve-tube elements)紧密相连,这些连接由筛管分子侧壁上的孔和伴胞侧高度分支的胞间连丝(plasmodesmata)组成(图13.22)。在这些连接发育过程中,胼胝质(callose)出现在筛管分子侧壁未来孔的位置(图13.22A)。孔的形成始于中层(middle lamella)区域中腔的发育,而分支胞间连丝的形成与伴胞侧细胞壁的增厚有关(Deshpande, 1975; Esau and Thorsch, 1985)。因此,这些分支的胞间连丝不是次生胞间连丝(secondary plasmodesmata),而是修饰的原生胞间连丝(primary plasmodesmata)(第4章)。通常认为成熟筛管分子的壁旁内质网( | 伴胞(companion cells)通过大量的细胞质连接与其相关的筛管分子(sieve-tube elements)紧密相连,这些连接由筛管分子侧壁上的孔和伴胞侧高度分支的胞间连丝(plasmodesmata)组成(图13.22)。在这些连接发育过程中,胼胝质(callose)出现在筛管分子侧壁未来孔的位置(图13.22A)。孔的形成始于中层(middle lamella)区域中腔的发育,而分支胞间连丝的形成与伴胞侧细胞壁的增厚有关(Deshpande, 1975; Esau and Thorsch, 1985)。因此,这些分支的胞间连丝不是次生胞间连丝(secondary plasmodesmata),而是修饰的原生胞间连丝(primary plasmodesmata)(第4章)。通常认为成熟筛管分子的壁旁内质网()通过伴胞壁中的连丝小管(desmotubules)与伴胞的内质网相连。 | ||
通常情况下,伴胞的壁既不硬化(sclerified)也不木质化(lignified),并且当相关的筛管分子死亡时,伴胞通常会塌陷。在Carpodetus serratus (Brook, 1951)和Tilia americana (Evert, 1963)的非传导韧皮部(nonconducting phloem)中报道了伴胞的硬化。在许多草本双子叶植物(herbaceous eudicots)成熟叶的小叶脉(minor veins)中,伴胞具有不规则的壁物质内生长,这是传递细胞(transfer cells)的典型特征(见下文; Pate and Gunning, 1969)。 | 通常情况下,伴胞的壁既不硬化(sclerified)也不木质化(lignified),并且当相关的筛管分子死亡时,伴胞通常会塌陷。在Carpodetus serratus (Brook, 1951)和Tilia americana (Evert, 1963)的非传导韧皮部(nonconducting phloem)中报道了伴胞的硬化。在许多草本双子叶植物(herbaceous eudicots)成熟叶的小叶脉(minor veins)中,伴胞具有不规则的壁物质内生长,这是传递细胞(transfer cells)的典型特征(见下文; Pate and Gunning, 1969)。 | ||
| 第165行: | 第117行: | ||
用荧光标记探针显微注射伴胞或筛管的研究表明,成熟筛管-伴胞复合体中胞间连丝(plasmodesmata)的大小排阻限相对较大,在10到40 kDa之间,并且伴胞和筛管分子之间的物质运动是双向的(Kempers and van Bel, 1997)。大量证据表明,在伴胞中合成的蛋白质在伴胞和筛管分子之间循环(Thompson, 1999),表达绿色荧光蛋白(GFP)的转基因植物(推测GFP在伴胞中合成)已经证明GFP通过同化物流(assimilate stream)在整个植物中运动(Imlau et al., 1999)。在韧皮部渗出液或筛管汁液中存在的约200种内源性可溶性蛋白质中,只有少数被鉴定出来。其中包括泛素(ubiquitin)和分子伴侣(chaperones),它们与成熟筛管分子中的蛋白质周转有关(Schobert et al., 1995)。虽然一些韧皮部蛋白质可能作为长距离信号分子,但许多可能参与维持筛管分子的功能。 | 用荧光标记探针显微注射伴胞或筛管的研究表明,成熟筛管-伴胞复合体中胞间连丝(plasmodesmata)的大小排阻限相对较大,在10到40 kDa之间,并且伴胞和筛管分子之间的物质运动是双向的(Kempers and van Bel, 1997)。大量证据表明,在伴胞中合成的蛋白质在伴胞和筛管分子之间循环(Thompson, 1999),表达绿色荧光蛋白(GFP)的转基因植物(推测GFP在伴胞中合成)已经证明GFP通过同化物流(assimilate stream)在整个植物中运动(Imlau et al., 1999)。在韧皮部渗出液或筛管汁液中存在的约200种内源性可溶性蛋白质中,只有少数被鉴定出来。其中包括泛素(ubiquitin)和分子伴侣(chaperones),它们与成熟筛管分子中的蛋白质周转有关(Schobert et al., 1995)。虽然一些韧皮部蛋白质可能作为长距离信号分子,但许多可能参与维持筛管分子的功能。 | ||
❙ 被子植物韧皮部运输的机制 | |||
最初由Ernst Münch(1930)提出并由其他人修改(见下文;Crafts and Crisp, 1971; Eschrich et al., 1972; Young et al., 1973; van Bel, 1993),渗透产生的压力流机制(pressure-flow mechanism)被广泛接受用于解释同化物通过被子植物筛管在源(source)和库(sink)之间的流动。同化物遵循源-库模式。同化物的主要来源(净输出者)是进行光合作用的叶片,尽管贮藏组织也可能是重要的来源。所有无法满足自身营养需求的植物部分都可能充当库(同化物的净输入者),包括分生组织、地下部分(如根、块茎、根状茎)、果实、种子以及皮层、髓、木质部和韧皮部的大多数薄壁细胞。 | 最初由Ernst Münch(1930)提出并由其他人修改(见下文;Crafts and Crisp, 1971; Eschrich et al., 1972; Young et al., 1973; van Bel, 1993),渗透产生的压力流机制(pressure-flow mechanism)被广泛接受用于解释同化物通过被子植物筛管在源(source)和库(sink)之间的流动。同化物遵循源-库模式。同化物的主要来源(净输出者)是进行光合作用的叶片,尽管贮藏组织也可能是重要的来源。所有无法满足自身营养需求的植物部分都可能充当库(同化物的净输入者),包括分生组织、地下部分(如根、块茎、根状茎)、果实、种子以及皮层、髓、木质部和韧皮部的大多数薄壁细胞。 | ||
| 第183行: | 第135行: | ||
在终端库(terminal sinks)的释放韧皮部(release phloem)中,伴胞的大小大大减小或完全消失(Offler and Patrick, 1984; Warmbrodt, 1985a, b; Hayes et al., 1985)。在大多数库组织(sink tissues)(如发育中的根和叶)中,卸载( unloading)是通过共质体(symplastically)进行的。实际的卸载过程可能是被动的,不需要伴胞消耗能量。然而,进入库组织的运输,称为韧皮部后运输(postphloem transport)或筛管后运输(post-sieve-tube transport)(Fisher, D. B., and Oparka, 1996; Patrick, 1997),依赖于代谢能量。在共质体卸载者(symplastic unloaders)中,需要能量来维持筛管-伴胞复合体与库细胞之间的浓度梯度。在质外体卸载者(apoplastic unloaders)中,需要能量将糖积累到库细胞中的高浓度,如甜菜根和甘蔗茎中的库细胞,尽管成熟甘蔗节间中的质外体卸载受到质疑(Jacobsen et al., 1992)。在马铃薯中,发现蔗糖的质外体卸载在经历广泛生长的匍匐茎中占主导地位;然而,在块茎化的第一个可见迹象期间,发生了从质外体到共质体卸载的转变(Viola et al., 2001; 另见Kühn et al., 2003)。 | 在终端库(terminal sinks)的释放韧皮部(release phloem)中,伴胞的大小大大减小或完全消失(Offler and Patrick, 1984; Warmbrodt, 1985a, b; Hayes et al., 1985)。在大多数库组织(sink tissues)(如发育中的根和叶)中,卸载( unloading)是通过共质体(symplastically)进行的。实际的卸载过程可能是被动的,不需要伴胞消耗能量。然而,进入库组织的运输,称为韧皮部后运输(postphloem transport)或筛管后运输(post-sieve-tube transport)(Fisher, D. B., and Oparka, 1996; Patrick, 1997),依赖于代谢能量。在共质体卸载者(symplastic unloaders)中,需要能量来维持筛管-伴胞复合体与库细胞之间的浓度梯度。在质外体卸载者(apoplastic unloaders)中,需要能量将糖积累到库细胞中的高浓度,如甜菜根和甘蔗茎中的库细胞,尽管成熟甘蔗节间中的质外体卸载受到质疑(Jacobsen et al., 1992)。在马铃薯中,发现蔗糖的质外体卸载在经历广泛生长的匍匐茎中占主导地位;然而,在块茎化的第一个可见迹象期间,发生了从质外体到共质体卸载的转变(Viola et al., 2001; 另见Kühn et al., 2003)。 | ||
在运输韧皮部(transport phloem)中,筛管的横截面积大于收集和释放韧皮部中的筛管,而伴胞在收集和释放韧皮部之间的大小介于中间或完全缺失(图13.1B和13.14B,C)。运输韧皮部具有双重任务。一是将光合产物输送到终端库。这需要保留足够的光合产物以维持压力流。如前所述,光合产物从筛管中泄漏是运输韧皮部或源库之间路径上的常见现象。据信,伴胞参与了泄漏光合产物的回收。运输韧皮部中光合产物的保留通过筛管-伴胞复合体的近乎共质体隔离得到增强(van Bel和van Rijen,1994;van Bel,1996)。运输韧皮部的第二个任务是为沿路径的异养组织提供营养,包括轴向库如形成层组织。 | |||
<nowiki> | <nowiki> | ||
| 第189行: | 第141行: | ||
图13.24 | 图13.24 | ||
Cucumis melo叶小叶脉的横切面。在这个切面中,远轴(下部)韧皮部包含两个小的筛管(s),由四个中间细胞(ic)和一个薄壁细胞(pc)包围。近轴韧皮部由一个筛管(s)和一个伴胞(cc)组成。注意中间细胞和束鞘细胞(bs)之间共同壁中的众多胞间连丝(箭头)。这是一个1型小叶脉,一个共质体装载者。其他细节:t,管状分子;vp,维管薄壁细胞。(来自Schmitz et al., 1987, 图1. \copyright 1987, Springer-Verlag.) | |||
<nowiki> | <nowiki> | ||
| 第195行: | 第147行: | ||
图13.25 | 图13.25 | ||
甜菜(Beta vulgaris)叶片小脉部分的横切面。在这个切面中,脉包含四个筛管(s)和七个“普通”伴胞(cc),即没有壁内生长的伴胞。这是一个2a型小脉,属于质外体韧皮部装载类型。其他细节:bs,束鞘细胞;php,韧皮部薄壁细胞;t,管状分子;vp,维管薄壁细胞。(来自Evert和Mierzwa,1986年。) | |||
❙ 源叶和小脉韧皮部 | |||
如前所述,成熟的光合叶片是植物的主要源。在除单子叶植物外的大多数被子植物中,叶片的维管束或脉以分支模式排列,较小的脉从较大的脉中分支出来。 | 如前所述,成熟的光合叶片是植物的主要源。在除单子叶植物外的大多数被子植物中,叶片的维管束或脉以分支模式排列,较小的脉从较大的脉中分支出来。 | ||
| 第205行: | 第157行: | ||
图13.26 | 图13.26 | ||
万寿菊(Tagetes patula)叶片小脉部分的横切面。在这个切面中,脉包含两个筛管(s)和三个具有壁内生长的伴胞(cc),即伴胞是传递细胞或A型细胞(Pate和Gunning,1969)。这是一个2b型小脉,属于质外体韧皮部装载类型。其他细节:bs,束鞘细胞;php,韧皮部薄壁细胞;t,管状分子;vp,维管薄壁细胞。 | |||
这种脉排列类型被称为网状脉序。通常,最大的脉沿着叶片的长轴延伸为中脉。中脉及其空间相关的基本组织组成了所谓的中肋。从中脉分支出来的其他较小的脉通常也与肋组织相关。所有与肋相关的脉(最常见于叶片下侧的突起)被称为主脉。叶片中或多或少嵌入叶肉组织且不与肋相关的小脉被称为小脉。小脉完全由紧密排列的细胞组成的束鞘包围。在双子叶植物叶片中,束鞘细胞通常是薄壁细胞,可能含有或不含有叶绿体。木质部通常位于脉的上侧,韧皮部位于下侧(图13.25和13.26)。 | 这种脉排列类型被称为网状脉序。通常,最大的脉沿着叶片的长轴延伸为中脉。中脉及其空间相关的基本组织组成了所谓的中肋。从中脉分支出来的其他较小的脉通常也与肋组织相关。所有与肋相关的脉(最常见于叶片下侧的突起)被称为主脉。叶片中或多或少嵌入叶肉组织且不与肋相关的小脉被称为小脉。小脉完全由紧密排列的细胞组成的束鞘包围。在双子叶植物叶片中,束鞘细胞通常是薄壁细胞,可能含有或不含有叶绿体。木质部通常位于脉的上侧,韧皮部位于下侧(图13.25和13.26)。 | ||
| 第211行: | 第163行: | ||
小叶脉在光合产物(photoassimilate)的收集过程中起主要作用。在光合产物被小叶脉的筛管-伴胞复合体(sieve tube–companion cell complexes)吸收之前,由叶肉细胞(mesophyll cells)光合作用产生并准备从叶片输出的光合产物必须首先穿过包围叶脉的束鞘(bundle sheaths)。从小叶脉的筛管中,溶解在筛管液(sieve-tube sap)中的光合产物流入逐渐变大的叶脉,最终进入主要叶脉——运输叶脉(transport veins)——以便从叶片输出。因此,叶片的同化物流(assimilate stream)类似于分水岭(watershed),小溪流汇入逐渐变大的河流。 | 小叶脉在光合产物(photoassimilate)的收集过程中起主要作用。在光合产物被小叶脉的筛管-伴胞复合体(sieve tube–companion cell complexes)吸收之前,由叶肉细胞(mesophyll cells)光合作用产生并准备从叶片输出的光合产物必须首先穿过包围叶脉的束鞘(bundle sheaths)。从小叶脉的筛管中,溶解在筛管液(sieve-tube sap)中的光合产物流入逐渐变大的叶脉,最终进入主要叶脉——运输叶脉(transport veins)——以便从叶片输出。因此,叶片的同化物流(assimilate stream)类似于分水岭(watershed),小溪流汇入逐渐变大的河流。 | ||
双子叶植物叶片中存在几种类型的小叶脉 | |||
"双子叶植物"(dicotyledonous)(包括木兰类植物(magnoliids)和真双子叶植物(eudicots))叶片的小叶脉在其结构以及筛管-伴胞复合体与叶片其他细胞类型之间的共质体连续性(symplastic continuity)程度上存在差异。在一些植物中,束鞘细胞(bundle-sheath cells)和伴胞(companion cells)之间的胞间连丝(plasmodesmata)数量丰富或适中,而在其他植物中,该界面的胞间连丝很少(Gamalei, 1989, 1991)。在此基础上,已经识别出两种主要类型的小叶脉(Gamalei, 1991)。那些在束鞘-伴胞界面具有丰富胞间连丝的叶脉(每 | "双子叶植物"(dicotyledonous)(包括木兰类植物(magnoliids)和真双子叶植物(eudicots))叶片的小叶脉在其结构以及筛管-伴胞复合体与叶片其他细胞类型之间的共质体连续性(symplastic continuity)程度上存在差异。在一些植物中,束鞘细胞(bundle-sheath cells)和伴胞(companion cells)之间的胞间连丝(plasmodesmata)数量丰富或适中,而在其他植物中,该界面的胞间连丝很少(Gamalei, 1989, 1991)。在此基础上,已经识别出两种主要类型的小叶脉(Gamalei, 1991)。那些在束鞘-伴胞界面具有丰富胞间连丝的叶脉(每\upmum^2界面\bf\left(>10\right)个胞间连丝)被称为1型,而在该界面具有少量胞间连丝的叶脉被称为2型。1型小叶脉也被称为开放型(open),2型被称为闭合型(closed)。束鞘细胞和伴胞之间具有适中胞间连丝接触的叶脉(每\upmum^2界面_<10个胞间连丝)介于1型和2型之间,被称为1-2a型。(拟南芥(Arabidopsis thaliana)是一种1-2a型物种; Haritatos et al., 2000。)2型又分为两个亚类:2a型,具有零星胞间连丝接触(每\upmum^2界面<1个胞间连丝),和2b型,几乎没有胞间连丝接触(每\upmum^2界面\bf(<0.1个胞间连丝)。因此,1型和2b型之间在束鞘-伴胞界面的胞间连丝频率跨度约为三个数量级。 | ||
由于不同物种小叶脉束鞘-伴胞界面的胞间连丝频率存在很大差异,因此产生了两种韧皮部装载(phloem loading)机制的概念,即共质体(symplastic)和质外体(apoplastic)装载(van Bel, 1993)。1型物种,其小叶脉伴胞与束鞘之间具有丰富的胞间连丝,被认为是共质体装载者(symplastic loaders),而2型物种,由于缺乏这种连接,被认为是质外体装载者(apoplastic loaders)(Gamalei, 1989, 1991, 2000; van Bel, 1993; Grusak et al., 1996; Turgeon, 1996)。 | 由于不同物种小叶脉束鞘-伴胞界面的胞间连丝频率存在很大差异,因此产生了两种韧皮部装载(phloem loading)机制的概念,即共质体(symplastic)和质外体(apoplastic)装载(van Bel, 1993)。1型物种,其小叶脉伴胞与束鞘之间具有丰富的胞间连丝,被认为是共质体装载者(symplastic loaders),而2型物种,由于缺乏这种连接,被认为是质外体装载者(apoplastic loaders)(Gamalei, 1989, 1991, 2000; van Bel, 1993; Grusak et al., 1996; Turgeon, 1996)。 | ||
| 第219行: | 第171行: | ||
尽管质外体装载的机制早已被理解(见下文),但对于涉及通过胞间连丝主动运输(active transport)的共质体装载的解释仍然缺乏。正如Turgeon和Medville(2004)所指出的,"通过胞间连丝主动运输小分子是未知的,而逆浓度梯度(diffusion against a concentration gradient)扩散是不可能的。" | 尽管质外体装载的机制早已被理解(见下文),但对于涉及通过胞间连丝主动运输(active transport)的共质体装载的解释仍然缺乏。正如Turgeon和Medville(2004)所指出的,"通过胞间连丝主动运输小分子是未知的,而逆浓度梯度(diffusion against a concentration gradient)扩散是不可能的。" | ||
具有特殊伴胞(称为中介细胞(intermediary cells))的1型物种是共质体装载者 | |||
一些类型1物种的细脉特征在于存在称为中间细胞(intermediary cells)的特化伴胞(图13.24)。通常这些细胞特别大,具有密集的细胞质,含有广泛的内质网(ER)迷宫、众多小液泡、原始质体(plastids),以及从束鞘细胞(bundle-sheath cells)延伸而来的高度分支的胞间连丝(plasmodesmata)区域(Turgeon等,1993)。迄今为止,仅鉴定出八个具有“真正”中间细胞的科:爵床科(Acanthaceae)、卫矛科(Celastraceae)、葫芦科(Cucurbitaceae)、绣球科(Hydrangaceae)、唇形科(Lamiaceae)、木犀科(Oleaceae)、玄参科(Scrophulariaceae)和马鞭草科(Verbenaceae)(参见Turgeon和Medville,1998,以及Turgeon等,2001的参考文献)。 | 一些类型1物种的细脉特征在于存在称为中间细胞(intermediary cells)的特化伴胞(图13.24)。通常这些细胞特别大,具有密集的细胞质,含有广泛的内质网(ER)迷宫、众多小液泡、原始质体(plastids),以及从束鞘细胞(bundle-sheath cells)延伸而来的高度分支的胞间连丝(plasmodesmata)区域(Turgeon等,1993)。迄今为止,仅鉴定出八个具有“真正”中间细胞的科:爵床科(Acanthaceae)、卫矛科(Celastraceae)、葫芦科(Cucurbitaceae)、绣球科(Hydrangaceae)、唇形科(Lamiaceae)、木犀科(Oleaceae)、玄参科(Scrophulariaceae)和马鞭草科(Verbenaceae)(参见Turgeon和Medville,1998,以及Turgeon等,2001的参考文献)。 | ||
| 第227行: | 第179行: | ||
关于缺乏中间细胞的类型1物种的数据有限。已研究的少数此类物种是质外体装载者(apoplastic loaders)。这些包括鹅掌楸(Liriodendron tulipifera)(木兰科(Magnoliaceae))(Goggin等,2001)、日本山柳(Cletbra barbinervis)和枫香树(Liquidambar struraciflua)(均为金缕梅科(Altingiaceae))(Turgeon和Medville,2004)。这三种物种几乎只运输蔗糖。显然,仅凭胞间连丝频率不能用作韧皮部装载策略的指标。这些研究的结果使Turgeon和Medville(2004)提出,共质体装载可能仅限于运输聚合物(如大量棉子糖家族寡糖)的物种,而其他物种,无论其细脉胞间连丝数量如何,可能通过质外体装载。 | 关于缺乏中间细胞的类型1物种的数据有限。已研究的少数此类物种是质外体装载者(apoplastic loaders)。这些包括鹅掌楸(Liriodendron tulipifera)(木兰科(Magnoliaceae))(Goggin等,2001)、日本山柳(Cletbra barbinervis)和枫香树(Liquidambar struraciflua)(均为金缕梅科(Altingiaceae))(Turgeon和Medville,2004)。这三种物种几乎只运输蔗糖。显然,仅凭胞间连丝频率不能用作韧皮部装载策略的指标。这些研究的结果使Turgeon和Medville(2004)提出,共质体装载可能仅限于运输聚合物(如大量棉子糖家族寡糖)的物种,而其他物种,无论其细脉胞间连丝数量如何,可能通过质外体装载。 | ||
具有类型2细脉的物种是质外体装载者 | |||
如前所述,质外体装载(apoplastic loading)的机制已经得到充分证实。蔗糖是质外体装载者的主要运输糖类。蔗糖分子的质外体装载涉及蔗糖-质子共转运(sucrose-proton cotransport),这一过程由质膜ATPase提供能量,并由位于质膜上的蔗糖转运蛋白(sucrose transporter)介导(Lalonde et al., 2003)。在马铃薯、番茄和烟草中,叶片蔗糖转运蛋白(SUT1)定位于筛管分子(sieve element)的质膜,而不是伴胞(companion cell)的质膜(Kühn et al., 1999),而在拟南芥(Arabidopsis)(Stadler and Sauer, 1996; Gottwald et al., 2000)和车前草(Plantago major)(Stadler et al., 1995)中,蔗糖转运蛋白(SUC2) | 如前所述,质外体装载(apoplastic loading)的机制已经得到充分证实。蔗糖是质外体装载者的主要运输糖类。蔗糖分子的质外体装载涉及蔗糖-质子共转运(sucrose-proton cotransport),这一过程由质膜ATPase提供能量,并由位于质膜上的蔗糖转运蛋白(sucrose transporter)介导(Lalonde et al., 2003)。在马铃薯、番茄和烟草中,叶片蔗糖转运蛋白(SUT1)定位于筛管分子(sieve element)的质膜,而不是伴胞(companion cell)的质膜(Kühn et al., 1999),而在拟南芥(Arabidopsis)(Stadler and Sauer, 1996; Gottwald et al., 2000)和车前草(Plantago major)(Stadler et al., 1995)中,蔗糖转运蛋白(SUC2)特异性地在伴胞中表达。拟南芥伴胞中也定位有质膜H^+-ATPase(DeWitt and Sussman, 1995)。蔗糖转运蛋白定位的差异可能表明,在某些质外体装载者中,蔗糖的摄取是通过筛管分子质膜进行的,而在另一些中则是通过伴胞的质膜进行的。因此,与那些通过能量在中间细胞(intermediary cells)中合成棉子糖(raffinose)和水苏糖(stachyose)来浓缩糖类的1型物种不同,2型物种利用能量通过质膜上的蔗糖-质子共转运来浓缩糖类。 | ||
2a型小叶脉的伴胞具有光滑的壁,通常被称为普通伴胞(ordinary companion cells)(图13.25)。2b型小叶脉的伴胞具有壁内生长(wall ingrowths),因此它们是传递细胞(transfer cells)(图13.26)。 | 2a型小叶脉的伴胞具有光滑的壁,通常被称为普通伴胞(ordinary companion cells)(图13.25)。2b型小叶脉的伴胞具有壁内生长(wall ingrowths),因此它们是传递细胞(transfer cells)(图13.26)。 | ||
| 第237行: | 第189行: | ||
拟南芥(Arabidopsis thaliana)是一种1-2a型物种,其小叶脉具有B型细胞和普通伴胞(Haritatos et al., 2000)。Haritatos等人(2000)注意到B型细胞与束鞘细胞(bundle-sheath cells)和伴胞都有大量接触,他们认为拟南芥小叶脉中蔗糖运输的最可能途径是从束鞘通过胞间连丝(plasmodesmata)进入韧皮部薄壁细胞(B型细胞),然后通过质膜跨壁内生长区域外排到质外体,并通过载体介导的摄取进入筛管分子-伴胞复合体。 | 拟南芥(Arabidopsis thaliana)是一种1-2a型物种,其小叶脉具有B型细胞和普通伴胞(Haritatos et al., 2000)。Haritatos等人(2000)注意到B型细胞与束鞘细胞(bundle-sheath cells)和伴胞都有大量接触,他们认为拟南芥小叶脉中蔗糖运输的最可能途径是从束鞘通过胞间连丝(plasmodesmata)进入韧皮部薄壁细胞(B型细胞),然后通过质膜跨壁内生长区域外排到质外体,并通过载体介导的摄取进入筛管分子-伴胞复合体。 | ||
某些叶片中小叶脉对光合产物的收集可能不涉及主动步骤 | |||
在某些植物中,蔗糖进入小叶脉筛管-伴胞复合体的机制似乎不涉及主动步骤,也就是说,不涉及韧皮部装载(phloem loading)本身。这些植物具有开放的小叶脉,运输大量的蔗糖,而只运输少量的棉子糖(raffinose)和水苏糖(stachyose)。柳树( | 在某些植物中,蔗糖进入小叶脉筛管-伴胞复合体的机制似乎不涉及主动步骤,也就是说,不涉及韧皮部装载(phloem loading)本身。这些植物具有开放的小叶脉,运输大量的蔗糖,而只运输少量的棉子糖(raffinose)和水苏糖(stachyose)。柳树(Salix babylonica; Turgeon and Medville, 1998)和三角杨(Populus deltoides; Russin and Evert, 1985)是这类植物的代表。根据Gamalei (1989)的分类,两者都属于1型植物。在柳树和三角杨中,没有发现蔗糖在小叶脉韧皮部中逆浓度梯度积累的证据。显然,蔗糖是沿着浓度梯度从叶肉细胞通过共质体(symplastically)扩散到小叶脉的筛管-伴胞复合体中的(Turgeon and Medville, 1998)。缺乏装载步骤与Münch (1930)的韧皮部运输模型相符。Münch认为叶肉细胞的叶绿体是浓度梯度的“源”,并推测一旦糖进入小叶脉的筛管,它就会被溶液的集体流动带走,这大概是因为茎部筛管中的静水压力低于叶片筛管中的静水压力。 | ||
一些小叶脉含有不止一种伴胞 | |||
到目前为止,我们关于小叶脉的讨论将它们归入了明确的类别,每个类别都以特定类型的伴胞为特征。然而,在某些物种中,小叶脉含有不止一种类型的伴胞。例如,在葫芦科(Cucurbitaceae)的小叶脉中发现了中间细胞(intermediary cells)和普通伴胞(ordinary companion cells)(图13.24; | 到目前为止,我们关于小叶脉的讨论将它们归入了明确的类别,每个类别都以特定类型的伴胞为特征。然而,在某些物种中,小叶脉含有不止一种类型的伴胞。例如,在葫芦科(Cucurbitaceae)的小叶脉中发现了中间细胞(intermediary cells)和普通伴胞(ordinary companion cells)(图13.24; Cucurbita pepo, Turgeon et al., 1975; Cucumis melo, Schmitz et al., 1987),Coleus blumei (Fisher, D. G., 1986)和Euonymus fortunei (Turgeon et al., 2001)中也是如此。这种伴胞类型的组合也在几种玄参科(Scrophulariaceae)植物中发现(Alonsoc meridonalis, Knop et al., 2001; 以及Alonsoc warscewiczii, Mimulus cardinalis, Verbascum chaixi, Turgeon et al., 1993)。一些玄参科植物的小叶脉含有中间细胞和传递细胞(transfer cells)(Nemesia strumosa, Rhodochiton atrosanguineum, Turgeon et al., 1993),而另一些则含有修饰的中间细胞和传递细胞(Ascarina spp., Turgeon et al., 1993; Knop et al., 2001)。在Ascarina scandens中,一些修饰的中间细胞甚至有一些壁内生长(wall ingrowths)(Turgeon et al., 1993)。小叶脉中存在不止一种类型的伴胞表明,在某些植物的单个叶脉中可能运行着不止一种韧皮部装载机制(Knop et al., 2004)。 | ||
禾本科(Poaceae)植物叶片中的小叶脉含有两种类型的后生韧皮部筛管 | |||
禾草叶片的维管系统(vascular system)与“双子叶植物(dicotyledonous)”叶片的网状排列不同,由纵向束和横向束相互连接组成。这种脉序被称为条纹状(striate)或平行(parallel)脉序。在叶片的任何横切面中,根据大小、木质部和韧皮部的组成以及相邻组织的性质,可以识别出三种类型的纵向维管束——大、中、小(Colbert和Evert,1982;Russell和Evert,1985;Dannenhoffer等,1990)。尽管所有纵向束都能够将光合产物(photoassimilate)沿叶片向下运输一定距离,但主要是大束参与纵向运输和从叶片输出光合产物。另一方面,小束主要参与韧皮部装载(phloem loading)和光合产物的收集。收集在小束中的光合产物(这些束不延伸到叶鞘中)通过横向脉横向转移到较大的束中,以便从叶片输出(Fritz等,1983,1989)。在叶片中,中束也参与光合产物的收集;因此,中束和小束都可以被视为小脉(minor veins)。 | 禾草叶片的维管系统(vascular system)与“双子叶植物(dicotyledonous)”叶片的网状排列不同,由纵向束和横向束相互连接组成。这种脉序被称为条纹状(striate)或平行(parallel)脉序。在叶片的任何横切面中,根据大小、木质部和韧皮部的组成以及相邻组织的性质,可以识别出三种类型的纵向维管束——大、中、小(Colbert和Evert,1982;Russell和Evert,1985;Dannenhoffer等,1990)。尽管所有纵向束都能够将光合产物(photoassimilate)沿叶片向下运输一定距离,但主要是大束参与纵向运输和从叶片输出光合产物。另一方面,小束主要参与韧皮部装载(phloem loading)和光合产物的收集。收集在小束中的光合产物(这些束不延伸到叶鞘中)通过横向脉横向转移到较大的束中,以便从叶片输出(Fritz等,1983,1989)。在叶片中,中束也参与光合产物的收集;因此,中束和小束都可以被视为小脉(minor veins)。 | ||
| 第257行: | 第209行: | ||
图13.27 | 图13.27 | ||
玉米( | 玉米(Zea mays)叶片中小维管束的横切面。这个小束包含一个薄壁筛管(空心点)及其相关的伴胞(cc)和两个厚壁筛管(实心点),它们通过维管薄壁细胞(vp)与导管(v)分离。束被束鞘(bs)包围。(来自Evert等,1996a。© 1996 by The University of Chicago。版权所有。) | ||
❙ 裸子植物的筛胞 | |||
筛胞(sieve cells) | 筛胞(sieve cells)通常是显著伸长的细胞(在针叶树的次生韧皮部中,长度为1.5至5mm),其末端壁逐渐变细,不易与侧壁区分(图13.4A)。筛域(sieve areas)在筛胞重叠的末端较多,但其分化程度与侧壁的筛域基本相同。换句话说,与筛管分子(sieve-tube elements)不同,筛胞缺乏筛板(sieve plates)。此外,与筛管分子的开放筛孔不同,筛胞的筛孔被许多管状内质网的结构穿过。此外,筛管分子通常含有P蛋白(P-protein),而筛胞在其发育的所有阶段都缺乏P蛋白。筛胞也缺乏伴胞(companion cells),但在功能上与Strasburger细胞或albuminous细胞(图13.28)相关联,这些细胞类似于伴胞。Strasburger细胞很少在个体发育上与其相关的筛胞有联系。 | ||
关于筛胞的大部分信息来自对针叶树次生韧皮部的研究。然而,在大多数方面,其他裸子植物筛胞的发育和结构与针叶树筛胞相似(Behnke, 1990; Schulz, 1990)。 | 关于筛胞的大部分信息来自对针叶树次生韧皮部的研究。然而,在大多数方面,其他裸子植物筛胞的发育和结构与针叶树筛胞相似(Behnke, 1990; Schulz, 1990)。 | ||
筛胞的壁被定性为初生壁 | |||
筛胞壁的厚度存在相当大的变化。除了松科(Pinaceae)外,裸子植物筛胞的壁被定性为初生壁(primary walls)。在松科次生韧皮部的筛胞中,壁较厚,并被认为具有次生加厚(secondary thickening)(Abbe and Crafts, 1939)。这种加厚具有层状外观(图13.29),但不覆盖筛域,而是在其周围形成边界。在其他裸子植物分类群的筛胞中尚未记录到明显的次生壁。 | 筛胞壁的厚度存在相当大的变化。除了松科(Pinaceae)外,裸子植物筛胞的壁被定性为初生壁(primary walls)。在松科次生韧皮部的筛胞中,壁较厚,并被认为具有次生加厚(secondary thickening)(Abbe and Crafts, 1939)。这种加厚具有层状外观(图13.29),但不覆盖筛域,而是在其周围形成边界。在其他裸子植物分类群的筛胞中尚未记录到明显的次生壁。 | ||
胼胝质在裸子植物筛孔发育中不起作用 | |||
裸子植物的筛域由被许多胞间连丝(plasmodesmata)穿过的壁部分发育而成。与被子植物筛孔发育不同,裸子植物的筛孔发育既不涉及小的内质网池( | 裸子植物的筛域由被许多胞间连丝(plasmodesmata)穿过的壁部分发育而成。与被子植物筛孔发育不同,裸子植物的筛孔发育既不涉及小的内质网池( cisternae),也不涉及胼胝质片(callose platelets)(Evert et al., 1973b; Neuberger and Evert, 1975, 1976; Cresson and Evert, 1994)。 | ||
在孔形成之前,壁材料的选择性沉积,与发生在初生壁上的积累相似,导致筛域壁的加厚。在筛管细胞分化的早期,中胶层区域出现与胞间连丝相关的中央腔。随着筛域分化的进行,中央腔逐渐增大并合并形成单个大(复合)中央腔。同时,胞间连丝在其全长范围内或多或少均匀地加宽,并且在发育中的孔对面出现平滑管状内质网的聚集物。这些膜聚集物在筛管细胞的整个生命周期中持续存在于筛域(Neuberger 和 Evert, 1975, 1976; Schulz, 1992)。大量管状内质网穿过由质膜排列的孔和中央腔,将壁两侧的聚集物统一起来(图 13. | 在孔形成之前,壁材料的选择性沉积,与发生在初生壁上的积累相似,导致筛域壁的加厚。在筛管细胞分化的早期,中胶层区域出现与胞间连丝相关的中央腔。随着筛域分化的进行,中央腔逐渐增大并合并形成单个大(复合)中央腔。同时,胞间连丝在其全长范围内或多或少均匀地加宽,并且在发育中的孔对面出现平滑管状内质网的聚集物。这些膜聚集物在筛管细胞的整个生命周期中持续存在于筛域(Neuberger 和 Evert, 1975, 1976; Schulz, 1992)。大量管状内质网穿过由质膜排列的孔和中央腔,将壁两侧的聚集物统一起来(图 13.30)。注意,与被子植物的筛孔不同,被子植物的筛孔在共同壁上是连续的,而裸子植物的筛孔仅延伸到中央腔的一半。传导筛管的孔可能被胼胝质覆盖,也可能不被覆盖,如果存在,则可能是创伤胼胝质。典型的最终胼胝质通常在衰老筛管细胞的筛域积累。它在筛管细胞死亡后最终消失。 | ||
<nowiki> | <nowiki> | ||
| 第285行: | 第237行: | ||
图13.29 | 图13.29 | ||
Pinus resinosa 下胚轴成熟筛管细胞的横切面。A 显示了被大量内质网 (, er) 包围的坏死细胞核 (n)。B 展示了成熟筛管细胞的典型细胞组分分布,包括内质网 (, er)、线粒体 (m) 和质体 (plastids, pl)。注意壁 (w) 的层状外观。(引自 Neuberger 和 Evert, 1974。) | |||
裸子植物筛管细胞分化中的变异很小 | 裸子植物筛管细胞分化中的变异很小 | ||
| 第295行: | 第247行: | ||
<nowiki> | <nowiki> | ||
Pinus resinosa 下胚轴成熟筛管细胞之间壁 (w) 中筛域的斜切面。大量管状内质网 (er) 聚集在筛域的两侧。可以看到内质网 (er) 穿过孔 (po) 并进入中央腔 (mc),中央腔中含有大量内质网。(引自 Neuberger 和 Evert, 1975。) | |||
有核植物细胞。类似地,筛管细胞在成熟过程中经历选择性自噬,导致大多数细胞组分的解体和/或消失,包括细胞核、核糖体、高尔基体、肌动蛋白丝、微管和液泡膜。 | 有核植物细胞。类似地,筛管细胞在成熟过程中经历选择性自噬,导致大多数细胞组分的解体和/或消失,包括细胞核、核糖体、高尔基体、肌动蛋白丝、微管和液泡膜。 | ||
| 第303行: | 第255行: | ||
筛管细胞中的核退化是固缩的,退化的核通常以电子致密团块的形式存在(图 13.29A),有时核膜的部分仍然完整(Behnke 和 Paliwal)。 | 筛管细胞中的核退化是固缩的,退化的核通常以电子致密团块的形式存在(图 13.29A),有时核膜的部分仍然完整(Behnke 和 Paliwal)。 | ||
1973; Evert 等, 1973a; Neuberger 和 Evert, 1974, 1976)。除了核固缩和质体的改变外,筛胞分化过程中细胞质组分最显著的变化涉及内质网( | 1973; Evert 等, 1973a; Neuberger 和 Evert, 1974, 1976)。除了核固缩和质体的改变外,筛胞分化过程中细胞质组分最显著的变化涉及内质网()。幼嫩筛胞的原始粗糙内质网(rough )失去其核糖体,并被整合到一个广泛的新形成的平滑管状内质网(smooth tubular )系统中。如前所述,管状内质网的聚集体在发育中的筛域(sieve areas)对面早期出现,并在成熟细胞的整个生命周期中持续存在。在Pinus (Neuberger 和 Evert, 1975) 和 Ephedra (Cresson 和 Evert, 1994) 中,与筛域相关的聚集体通过壁内质网(parietal )网络纵向相互连接。因此,成熟筛胞的内质网构成了一个广泛的系统,该系统还通过筛域孔(sieve-area pores)和中间腔(median cavities)与邻近筛胞的内质网连续。 | ||
❙ STRASBURGER CELLS | |||
裸子植物韧皮部中伴胞(companion cell)的对应物是Strasburger细胞,以Eduard Strasburger命名,他将其称为“Eiweisszellen”或蛋白细胞(albuminous cell)。Strasburger细胞与韧皮部其他薄壁组织成分的主要区别在于其与筛胞的共质体连接(symplastic connections)。这些连接让人联想到筛管分子(sieve-tube elements)和伴胞之间的连接:筛胞一侧的孔和Strasburger细胞一侧的分枝胞间连丝(branched plasmodesmata)(图13.28和13.31)。筛胞-Strasburger细胞连接具有较大的中间腔,其中包含大量平滑管状内质网的组分,这些组分通过孔边缘的管状内质网大聚集体与筛胞一侧的壁内质网网络连续。在Strasburger细胞一侧,内质网的小管与Strasburger细胞壁中胞间连丝的连丝小管(desmotubules)连续。 | 裸子植物韧皮部中伴胞(companion cell)的对应物是Strasburger细胞,以Eduard Strasburger命名,他将其称为“Eiweisszellen”或蛋白细胞(albuminous cell)。Strasburger细胞与韧皮部其他薄壁组织成分的主要区别在于其与筛胞的共质体连接(symplastic connections)。这些连接让人联想到筛管分子(sieve-tube elements)和伴胞之间的连接:筛胞一侧的孔和Strasburger细胞一侧的分枝胞间连丝(branched plasmodesmata)(图13.28和13.31)。筛胞-Strasburger细胞连接具有较大的中间腔,其中包含大量平滑管状内质网的组分,这些组分通过孔边缘的管状内质网大聚集体与筛胞一侧的壁内质网网络连续。在Strasburger细胞一侧,内质网的小管与Strasburger细胞壁中胞间连丝的连丝小管(desmotubules)连续。 | ||
| 第313行: | 第265行: | ||
图13.31 | 图13.31 | ||
Ephedra viridis 幼茎中筛胞(左)和Strasburger细胞(右)之间的孔-胞间连丝连接。箭头指向Strasburger细胞壁中的分枝胞间连丝。胼胝质(callose, c)收缩了孔,掩盖了其内容物,但未延伸到中间腔(mc)。内质网(er)的聚集体与孔相关。(来自Cresson和Evert, 1994。) | |||
与伴胞一样,Strasburger细胞含有大量的线粒体和大量的核糖体(多核糖体, polysome),以及其他具有核的植物细胞特征的细胞组分。如前所述,与伴胞不同,Strasburger细胞很少在个体发育上与其相关的筛胞有关。 | 与伴胞一样,Strasburger细胞含有大量的线粒体和大量的核糖体(多核糖体, polysome),以及其他具有核的植物细胞特征的细胞组分。如前所述,与伴胞不同,Strasburger细胞很少在个体发育上与其相关的筛胞有关。 | ||
| 第319行: | 第271行: | ||
Strasburger细胞的作用可能与伴胞(companion cells)类似:维持其相关的筛管(sieve element)的功能。组织化学数据强烈暗示Strasburger细胞在筛管(sieve cells)中物质的长距离运输中发挥作用(Sauter and Braun, 1968, 1972; Sauter, 1974)。当相关的筛管(sieve cells)成熟时,Strasburger细胞中的呼吸作用(Sauter and Braun, 1972; Sauter, 1974)和酸性磷酸酶(Sauter and Braun, 1968, 1972; Sauter, 1974)活性显著增加。在与未成熟筛管(sieve cells)相邻的Strasburger细胞或与筛管(sieve cells)无连接的其他韧皮部薄壁组织(parenchymatous elements)中,未检测到活性增加。当相关的筛管(sieve cells)死亡时,Strasburger细胞也会死亡。 | Strasburger细胞的作用可能与伴胞(companion cells)类似:维持其相关的筛管(sieve element)的功能。组织化学数据强烈暗示Strasburger细胞在筛管(sieve cells)中物质的长距离运输中发挥作用(Sauter and Braun, 1968, 1972; Sauter, 1974)。当相关的筛管(sieve cells)成熟时,Strasburger细胞中的呼吸作用(Sauter and Braun, 1972; Sauter, 1974)和酸性磷酸酶(Sauter and Braun, 1968, 1972; Sauter, 1974)活性显著增加。在与未成熟筛管(sieve cells)相邻的Strasburger细胞或与筛管(sieve cells)无连接的其他韧皮部薄壁组织(parenchymatous elements)中,未检测到活性增加。当相关的筛管(sieve cells)死亡时,Strasburger细胞也会死亡。 | ||
❙ 裸子植物韧皮部运输的机制 | |||
裸子植物韧皮部运输的机制仍有待阐明。由于筛区(sieve areas)被内质网( | 裸子植物韧皮部运输的机制仍有待阐明。由于筛区(sieve areas)被内质网()的聚集体覆盖,且大部分孔空间被内质网()的管状结构占据,由此产生的对体积流动的阻力似乎与压力流动机制不相容。然而,针叶树Metasequoia glyptostroboides韧皮部中同化物的运输速度为每小时48至60厘米(Willenbrink and Kollmann, 1966),基本上落在被子植物常见的运输速度范围内,即每小时50至100厘米(Crafts and Crisp, 1971; Kursanov, 1984)。当筛管(sieve-cell)内质网()的作用被了解时,这个谜题的答案无疑将被解开。作为筛管(sieve-cell)原生质体(protoplast)中如此突出的组成部分,内质网()形成了一个从一个筛管(sieve cell)延伸到下一个筛管(sieve cell)的连续系统,很难想象它在长距离运输中不发挥重要作用。 | ||
内质网( | 内质网()的积极作用得到了筛区(sieve areas)边缘内质网()聚集体中酶核苷三磷酸酶(nucleoside triphosphatase)和甘油磷酸酶(glycerophosphatase)定位的支持(Sauter, 1976, 1977)。内质网()的这种作用还得到了其与阳离子染料DiOC染色(Schulz, 1992)的进一步支持。DiOC可能标记了具有显著膜电位且内部带负电荷的膜(Matzke and Matzke, 1986)。有人提出,筛管(sieve cells)的内质网()能够通过在每个库(sink)中重新建立梯度来调节同化物的长距离梯度(Schulz, 1992)。Schulz (1992)指出,(1)内质网()复合体或聚集体中核苷三磷酸酶(nucleoside triphosphatases)的活性,(2)这些膜上质子梯度的存在,以及(3)高膜表面表明,裸子植物的韧皮部运输不仅依赖于源叶(source leaves)中的装载和库(sinks)中的卸载,还需要在运输路径中消耗能量的步骤。 | ||
❙ 薄壁组织细胞 | |||
韧皮部中含有数量不等的薄壁组织细胞(parenchyma cells),除了伴胞(companion cells)和Strasburger细胞外。含有各种物质(如淀粉、单宁和晶体)的薄壁组织细胞(parenchyma cells)是韧皮部的常规组成部分。形成晶体的薄壁组织细胞(parenchyma cells)可能被细分为小细胞,每个细胞含有一个晶体(图13.3D)。这种分室的含晶细胞通常与纤维或石细胞(sclereids)相关,并具有木质化的壁和次生加厚(Nanko et al., 1976)。 | 韧皮部中含有数量不等的薄壁组织细胞(parenchyma cells),除了伴胞(companion cells)和Strasburger细胞外。含有各种物质(如淀粉、单宁和晶体)的薄壁组织细胞(parenchyma cells)是韧皮部的常规组成部分。形成晶体的薄壁组织细胞(parenchyma cells)可能被细分为小细胞,每个细胞含有一个晶体(图13.3D)。这种分室的含晶细胞通常与纤维或石细胞(sclereids)相关,并具有木质化的壁和次生加厚(Nanko et al., 1976)。 | ||
| 第335行: | 第287行: | ||
在输导韧皮部(conducting phloem)中,韧皮部薄壁组织和射线薄壁组织细胞显然具有初生非木质化壁(primary unlignified walls)。在某些情况下,当薄壁组织细胞与纤维接触时,它们可能会发育出木质化的次生壁(lignified secondary walls)。在组织停止输导后,薄壁组织细胞可能保持相对不变,或者可能发生硬化(sclerified)。在许多植物中,木栓形成层(phellogen)最终会在韧皮部中产生(第15章)。它由韧皮部薄壁组织和射线薄壁组织形成。 | 在输导韧皮部(conducting phloem)中,韧皮部薄壁组织和射线薄壁组织细胞显然具有初生非木质化壁(primary unlignified walls)。在某些情况下,当薄壁组织细胞与纤维接触时,它们可能会发育出木质化的次生壁(lignified secondary walls)。在组织停止输导后,薄壁组织细胞可能保持相对不变,或者可能发生硬化(sclerified)。在许多植物中,木栓形成层(phellogen)最终会在韧皮部中产生(第15章)。它由韧皮部薄壁组织和射线薄壁组织形成。 | ||
❙ 厚壁组织细胞(SCLERENCHYMA CELLS) | |||
纤维和石细胞(sclereids)的基本结构、起源和发育已在第8章中讨论。纤维是初生韧皮部和次生韧皮部的常见组成部分。在初生韧皮部中,纤维存在于组织的最外层;在次生韧皮部中,纤维以各种分布模式存在于轴向系统的其他韧皮部细胞中。在某些植物中,纤维通常是木质化的;而在其他植物中则不然。它们壁上的纹孔(pits)通常是单纹孔(simple),但也可能略有具缘纹孔(bordered)。纤维可能是分隔的(septate)或非分隔的(nonseptate),在成熟时可能是活的或死的。活纤维像在木质部中一样充当储存细胞(storage cells)。胶质纤维(gelatinous fibers)也存在于韧皮部中。在许多物种中,初生纤维和次生纤维都很长,被用作商业纤维来源( | 纤维和石细胞(sclereids)的基本结构、起源和发育已在第8章中讨论。纤维是初生韧皮部和次生韧皮部的常见组成部分。在初生韧皮部中,纤维存在于组织的最外层;在次生韧皮部中,纤维以各种分布模式存在于轴向系统的其他韧皮部细胞中。在某些植物中,纤维通常是木质化的;而在其他植物中则不然。它们壁上的纹孔(pits)通常是单纹孔(simple),但也可能略有具缘纹孔(bordered)。纤维可能是分隔的(septate)或非分隔的(nonseptate),在成熟时可能是活的或死的。活纤维像在木质部中一样充当储存细胞(storage cells)。胶质纤维(gelatinous fibers)也存在于韧皮部中。在许多物种中,初生纤维和次生纤维都很长,被用作商业纤维来源(Linum, Cannabis, Hibiscus)。 | ||
石细胞(sclereids)也经常在韧皮部中发现。它们可能与纤维结合或单独存在,并且可能出现在次生韧皮部的轴向和径向系统中。石细胞通常在韧皮部的较老部分分化,这是由于薄壁细胞(parenchyma cells)的硬化(sclerification)所致。这种硬化可能伴随着细胞的侵入性生长(intrusive growth),也可能不伴随。在这种生长过程中,石细胞通常会分枝或伸长。纤维和石细胞之间的区别并不总是很明显,特别是当石细胞又长又细时。中间类型的细胞被称为纤维石细胞(fiber-sclereids)。 | 石细胞(sclereids)也经常在韧皮部中发现。它们可能与纤维结合或单独存在,并且可能出现在次生韧皮部的轴向和径向系统中。石细胞通常在韧皮部的较老部分分化,这是由于薄壁细胞(parenchyma cells)的硬化(sclerification)所致。这种硬化可能伴随着细胞的侵入性生长(intrusive growth),也可能不伴随。在这种生长过程中,石细胞通常会分枝或伸长。纤维和石细胞之间的区别并不总是很明显,特别是当石细胞又长又细时。中间类型的细胞被称为纤维石细胞(fiber-sclereids)。 | ||
❙ 筛管分子(sieve elements)的寿命 | |||
长期以来,人们已经认识到韧皮部从传导状态过渡到非传导状态时筛管分子和邻近细胞的行为(Esau, 1969)。通常,筛管分子功能停止的最早迹象是筛域(sieve areas)上出现明确的胼胝质(callose)。胼胝质可能会大量积累,通常在筛管分子的原生质内容物退化后的一段时间内完全消失。如前所述,筛管分子的死亡伴随着它们的伴胞(companion cells)或Strasburger细胞的死亡,有时还包括其他薄壁细胞的死亡。随着退化的筛管分子失去膨压(turgor pressure)以及组织内的生长调整,筛管分子和紧密相关的薄壁细胞可能会塌陷并消失。然而,筛管分子可能保持开放并被空气填充。侵填体(tylosoids)(来自邻近薄壁细胞的类似侵填体(tylose)的突起)可能会侵入死亡的筛管分子的腔(lumina),或者简单地将筛管分子壁推到一边,导致筛管分子塌陷( | 长期以来,人们已经认识到韧皮部从传导状态过渡到非传导状态时筛管分子和邻近细胞的行为(Esau, 1969)。通常,筛管分子功能停止的最早迹象是筛域(sieve areas)上出现明确的胼胝质(callose)。胼胝质可能会大量积累,通常在筛管分子的原生质内容物退化后的一段时间内完全消失。如前所述,筛管分子的死亡伴随着它们的伴胞(companion cells)或Strasburger细胞的死亡,有时还包括其他薄壁细胞的死亡。随着退化的筛管分子失去膨压(turgor pressure)以及组织内的生长调整,筛管分子和紧密相关的薄壁细胞可能会塌陷并消失。然而,筛管分子可能保持开放并被空气填充。侵填体(tylosoids)(来自邻近薄壁细胞的类似侵填体(tylose)的突起)可能会侵入死亡的筛管分子的腔(lumina),或者简单地将筛管分子壁推到一边,导致筛管分子塌陷(例如,在Vitis中,Esau, 1948;在棕榈的次生韧皮部中,Parthasarathy和Tomlinson, 1967)。在Smilax rotundifolia中,形成侵填体的是伴胞,然后这些侵填体可能会硬化(Ervin和Evert, 1967)。在对来自尼日利亚的六种森林树木的次生韧皮部的研究中,所有通常形成侵填体的树木的次生韧皮部中都发现了侵填体(Lawton和Lawton, 1971)。 | ||
寿命最短的筛管分子是原生韧皮部(protophloem)的筛管分子,它们很快被次生韧皮部(metaphloem) | 寿命最短的筛管分子是原生韧皮部(protophloem)的筛管分子,它们很快被次生韧皮部(metaphloem)的筛管分子取代。在几乎没有或没有次生生长的植物部分中,大多数次生韧皮部筛管分子在其所在部分的整个生命周期内保持功能,这通常是几个月的时间。在Polygonatum canaliculatum和Typha latifolia的根茎以及Smilax hispida和Smilax latifolia的地上茎中(这四种都是多年生单子叶植物),许多次生韧皮部筛管分子保持功能两年或更长时间(Ervin和Evert, 1967, 1970)。在Smilax hispida中,一些成熟的5年筛管分子仍然存活(Ervin和Evert, 1970)。这与一些棕榈树的数十年存活的次生韧皮部筛管分子相比显得微不足道(Parthasarathy, 1974b)。 | ||
在许多温带木本被子植物(woody angiosperms)中,次生韧皮部(secondary phloem)的筛管分子(sieve-tube elements) | 在许多温带木本被子植物(woody angiosperms)中,次生韧皮部(secondary phloem)的筛管分子(sieve-tube elements)仅在它们形成的季节发挥作用,在秋季变得无功能,因此韧皮部在冬季缺乏成熟的活筛管(第14章)。类似的生长模式在一些亚热带和热带物种中也有报道。另一方面,在一些木本被子植物中,大量的次生筛管分子可能发挥功能两个或更多个季节(例如,在Tilia americana中为五年,Evert, 1962;在Tilia cordata中为10年,Holdheide, 1951),在晚秋进入休眠状态,在春季重新激活。在Pinus longaeva针叶的次生韧皮部中,单个筛细胞(sieve cells)存活3.8至6.5年(Ewers, 1982)。 | ||
❙ 筛管分子特化的趋势 | |||
筛管分子的进化变化已在单子叶植物(monocotyledons)的后生韧皮部(metaphloem)中得到了全面研究(Cheadle和Whitford, 1941;Cheadle, 1948;Cheadle和Uhl, 1948)。在33科158属219种单子叶植物中,仅发现了筛管分子。这些筛管分子显示出以下进化特化趋势:(1) 端壁(end walls)的取向从非常倾斜或倾斜逐渐变为横向,(2) 高度特化的筛域(sieve areas)(具有较大孔的区域)逐渐集中在端壁上,(3) 从复合筛板(compound sieve plates)逐步变为简单筛板(simple sieve plates),以及(4) 侧壁(side walls)上筛域的显著程度逐渐降低。特化从叶片向根部发展;也就是说,最高度特化的筛管分子出现在叶片、花序轴、球茎和根茎中,而较低度进化的筛管分子出现在根部。在对棕榈植物后生韧皮部的广泛研究中获得了基本相似的结果(Parthasarathy, 1966)。因此,单子叶植物中筛管分子的特化方向与管状分子(tracheary elements)的进化方向相反(第10章)。 | 筛管分子的进化变化已在单子叶植物(monocotyledons)的后生韧皮部(metaphloem)中得到了全面研究(Cheadle和Whitford, 1941;Cheadle, 1948;Cheadle和Uhl, 1948)。在33科158属219种单子叶植物中,仅发现了筛管分子。这些筛管分子显示出以下进化特化趋势:(1) 端壁(end walls)的取向从非常倾斜或倾斜逐渐变为横向,(2) 高度特化的筛域(sieve areas)(具有较大孔的区域)逐渐集中在端壁上,(3) 从复合筛板(compound sieve plates)逐步变为简单筛板(simple sieve plates),以及(4) 侧壁(side walls)上筛域的显著程度逐渐降低。特化从叶片向根部发展;也就是说,最高度特化的筛管分子出现在叶片、花序轴、球茎和根茎中,而较低度进化的筛管分子出现在根部。在对棕榈植物后生韧皮部的广泛研究中获得了基本相似的结果(Parthasarathy, 1966)。因此,单子叶植物中筛管分子的特化方向与管状分子(tracheary elements)的进化方向相反(第10章)。 | ||
关于木质被子植物(主要是真双子叶植物)中筛管分子(sieve-tube elements)特化的系统发育趋势的讨论主要涉及次生韧皮部(secondary phloem)中的筛管分子(Zahur, 1959; Roth, 1981; den Outer, 1983, | 关于木质被子植物(主要是真双子叶植物)中筛管分子(sieve-tube elements)特化的系统发育趋势的讨论主要涉及次生韧皮部(secondary phloem)中的筛管分子(Zahur, 1959; Roth, 1981; den Outer, 1983, 1986)。这些分子特化的趋势包括长度的减少,这是木质被子植物次生木质部中导管分子(vessel elements)特化程度最可靠和一致的衡量标准(第10章;Bailey, 1944;Cheadle, 1956)。导管分子长度的系统发育减少与导致层状形成层(storied cambia)的纺锤状原始细胞(fusiform initials)的缩短相关。事实上,对49种木质真双子叶植物次生韧皮部中层状结构相关特征的分析揭示了高度特化的筛管分子。这些分子通常较短,具有简单筛板(simple sieve plates),位于略微倾斜至横向的端壁上,并且侧壁上的筛区(sieve areas)发育不良且数量较少(den Outer, 1986)。然而,与导管分子相比,筛管分子在系统发育中长度的减少趋势不那么直接和一致。这是因为在许多木质被子植物中,韧皮部母细胞(phloem mother cells)通过横向分裂(次生分隔,secondary partitions)在个体发育中长度的减少模糊了筛管分子与纺锤状原始细胞之间的长度关系(Esau和Cheadle, 1955;Zahur, 1959)。 | ||
人们可能会认为特化程度较低的筛管分子类似于裸子植物的筛细胞(sieve cells)。就原始筛管分子相对较长且端壁和侧壁上的筛区区分不明显而言,这是正确的。然而,没有任何被子植物的筛分子具有类似于裸子植物筛细胞中含有内质网的筛区。裸子植物中筛细胞的结构非常一致,与含有P蛋白(P-protein)的筛管分子形成鲜明对比,后者通常与个体发育相关的伴胞(companion cells) | 人们可能会认为特化程度较低的筛管分子类似于裸子植物的筛细胞(sieve cells)。就原始筛管分子相对较长且端壁和侧壁上的筛区区分不明显而言,这是正确的。然而,没有任何被子植物的筛分子具有类似于裸子植物筛细胞中含有内质网的筛区。裸子植物中筛细胞的结构非常一致,与含有P蛋白(P-protein)的筛管分子形成鲜明对比,后者通常与个体发育相关的伴胞(companion cells)相关联。在被子植物中,只有Austrobaileya scandens的次生韧皮部筛分子被报道为缺乏筛板(Srivastava, 1970)。这些细胞在高度倾斜的端壁上的筛孔(sieve pores)与侧壁上的筛孔大小相似(见图14.7B)。然而,Behnke(1986)注意到,Austrobaileya筛分子中的筛区孔在中胶层(middle lamella)区域没有像裸子植物筛细胞那样通过一个共同的中间腔相互连接(见下文),因此选择将具有多个筛区的端壁称为复合筛板(compound sieve plates)。无论如何,这些筛分子含有P蛋白并具有伴胞。由于至少具备筛管分子共有的三个特征中的两个——另一个是筛板——Austrobaileya的筛分子可以被视为原始筛管分子。 | ||
裸子植物的筛管分子在所有发育阶段都缺乏P蛋白,并且缺乏类似于伴胞的薄壁细胞(parenchyma cells)。 | 裸子植物的筛管分子在所有发育阶段都缺乏P蛋白,并且缺乏类似于伴胞的薄壁细胞(parenchyma cells)。 | ||
维管隐花植物(vascular cryptogams)的筛管分子(sieve elements)经历选择性自噬(selective autophagy),导致细胞核退化以及某些细胞质成分的丧失,这与裸子植物(gymnosperms)和被子植物(angiosperms)的筛管分子类似。除了石松类(lycopods)外,所有其他无种子维管植物(seedless vascular plants)的筛管分子最显著的特征是存在折射球体(refractive spherules),这是一种单层膜包裹的电子致密蛋白质体(proteinaceous bodies)(图13.32A, B, D),在未染色的切片中用光学显微镜观察时显得高度折射。内质网( | 维管隐花植物(vascular cryptogams)的筛管分子(sieve elements)经历选择性自噬(selective autophagy),导致细胞核退化以及某些细胞质成分的丧失,这与裸子植物(gymnosperms)和被子植物(angiosperms)的筛管分子类似。除了石松类(lycopods)外,所有其他无种子维管植物(seedless vascular plants)的筛管分子最显著的特征是存在折射球体(refractive spherules),这是一种单层膜包裹的电子致密蛋白质体(proteinaceous bodies)(图13.32A, B, D),在未染色的切片中用光学显微镜观察时显得高度折射。内质网()和高尔基体(Golgi apparatus)都与折射球体的形成有关。(详见Evert, 1990a及其引用的文献,其中详细讨论了维管隐花植物的筛管分子。) | ||
❙ 无种子维管植物的筛管分子 | |||
在电子显微镜用于研究韧皮部组织之前,筛管(sieve-tube)分子和筛细胞(sieve cells)的区别主要基于筛孔(sieve pores)的大小和分布的差异,即是否存在筛板(sieve plates)(筛管分子有筛板,筛细胞没有筛板)。除了少数例外,无种子维管植物(seedless vascular plants)或维管隐花植物(vascular cryptogams)的筛管分子明显缺乏筛板,因此被归类为筛细胞。通过电子显微镜观察发现,维管隐花植物筛管分子筛孔的分布、大小、内容物和发育存在相当大的差异,并且这一多样化植物群中没有任何筛区(sieve areas)与裸子植物筛细胞的筛区相似,后者具有中腔(median cavities)和仅延伸一半的筛孔。尽管某些维管隐花植物(蕨类植物,包括松叶蕨类(whisk ferns)和木贼类(horsetails))的筛管分子壁中的筛孔被许多内质网膜穿过(图13.32A, B, D),但这些膜在形态上与裸子植物筛细胞筛区相关的管状结构群不同。在某些维管隐花植物(石松类)中,筛孔几乎没有任何内质网膜(图13.32C)。此外,维管隐花植物缺乏类似于Strasburger细胞的薄壁细胞(parenchyma cells)。综上所述,维管隐花植物的筛管分子与裸子植物的筛管分子不同,因此将术语“筛细胞”仅限于裸子植物的筛管分子。维管隐花植物的筛管分子也与被子植物的筛管分子不同。 | 在电子显微镜用于研究韧皮部组织之前,筛管(sieve-tube)分子和筛细胞(sieve cells)的区别主要基于筛孔(sieve pores)的大小和分布的差异,即是否存在筛板(sieve plates)(筛管分子有筛板,筛细胞没有筛板)。除了少数例外,无种子维管植物(seedless vascular plants)或维管隐花植物(vascular cryptogams)的筛管分子明显缺乏筛板,因此被归类为筛细胞。通过电子显微镜观察发现,维管隐花植物筛管分子筛孔的分布、大小、内容物和发育存在相当大的差异,并且这一多样化植物群中没有任何筛区(sieve areas)与裸子植物筛细胞的筛区相似,后者具有中腔(median cavities)和仅延伸一半的筛孔。尽管某些维管隐花植物(蕨类植物,包括松叶蕨类(whisk ferns)和木贼类(horsetails))的筛管分子壁中的筛孔被许多内质网膜穿过(图13.32A, B, D),但这些膜在形态上与裸子植物筛细胞筛区相关的管状结构群不同。在某些维管隐花植物(石松类)中,筛孔几乎没有任何内质网膜(图13.32C)。此外,维管隐花植物缺乏类似于Strasburger细胞的薄壁细胞(parenchyma cells)。综上所述,维管隐花植物的筛管分子与裸子植物的筛管分子不同,因此将术语“筛细胞”仅限于裸子植物的筛管分子。维管隐花植物的筛管分子也与被子植物的筛管分子不同。 | ||
❙ 初生韧皮部 | |||
初生韧皮部(primary phloem)分为原生韧皮部(protophloem)和后生韧皮部(metaphloem),其分类依据与初生木质部(primary xylem)分为原生木质部(protoxylem)和后生木质部(metaxylem)相同。原生韧皮部在仍处于伸长生长的植物部位成熟,其筛管分子被拉伸并很快失去功能。最终它们完全消失(图13.33和13.34)。后生韧皮部分化较晚,在没有次生生长的植物中,构成成年植物部位唯一的传导韧皮部。 | 初生韧皮部(primary phloem)分为原生韧皮部(protophloem)和后生韧皮部(metaphloem),其分类依据与初生木质部(primary xylem)分为原生木质部(protoxylem)和后生木质部(metaxylem)相同。原生韧皮部在仍处于伸长生长的植物部位成熟,其筛管分子被拉伸并很快失去功能。最终它们完全消失(图13.33和13.34)。后生韧皮部分化较晚,在没有次生生长的植物中,构成成年植物部位唯一的传导韧皮部。 | ||
| 第377行: | 第329行: | ||
图13.32 | 图13.32 | ||
一些无种子维管植物(seedless vascular plants)筛域孔(sieve-area pores)的电子显微照片。A,在厚囊蕨类(eusporangiate fern)Botrychium virginianum中,孔中充满了许多膜,显然是管状内质网(tubular | 一些无种子维管植物(seedless vascular plants)筛域孔(sieve-area pores)的电子显微照片。A,在厚囊蕨类(eusporangiate fern)Botrychium virginianum中,孔中充满了许多膜,显然是管状内质网(tubular )。B,木贼(Equisetum hyemale)地上茎中成熟筛管分子之间壁中的内质网填充孔。C,水韭(Isoetes muricata)球茎中成熟筛管分子之间壁中的未堵塞孔(po)。D,松叶蕨(Psilotum nudum)地上枝条中成熟筛管分子之间壁中的内质网填充孔。A、B和D中的电子致密体是折射球体(refractive spherules)。(A,来自Evert, 1976。经出版商许可转载;B,来自Dute and Evert, 1978。经牛津大学出版社许可;C,来自Kruatrachue and Evert, 1977;D,来自Perry and Evert, 1975。) | ||
<nowiki> | <nowiki> | ||
| 第383行: | 第335行: | ||
图13.33 | 图13.33 | ||
燕麦(Avena sativa)维管束在两个分化阶段的横切面。A,原生韧皮部和原生木质部(protoxylem)的第一个分子已经成熟。B,后生韧皮部(metaphloem)和后生木质部(metaxylem)成熟;原生韧皮部被压碎;原生木质部被空隙(lacuna)取代。(A,来自Esau, 1957a;B,来自Esau, 1957b。Hilgardia 27 (1), 15–69。 | 燕麦(Avena sativa)维管束在两个分化阶段的横切面。A,原生韧皮部和原生木质部(protoxylem)的第一个分子已经成熟。B,后生韧皮部(metaphloem)和后生木质部(metaxylem)成熟;原生韧皮部被压碎;原生木质部被空隙(lacuna)取代。(A,来自Esau, 1957a;B,来自Esau, 1957b。Hilgardia 27 (1), 15–69。\copyright 1957加州大学董事会。) | ||
在许多物种中,这些伸长的细胞是纤维原基(fiber primordia)。当筛管元素停止功能并被消除时,纤维原基增加长度,发育出次生壁,并成熟为称为初生韧皮部纤维(primary phloem fibers)或原韧皮部纤维(protophloem fibers)的纤维(图13.36)。这种纤维存在于许多双子叶植物茎的韧皮部区域的外围,并经常被错误地称为周缘纤维(pericyclic fibers)(第8章)。在双子叶植物的叶片和叶柄中,筛管破坏后剩余的原韧皮部细胞通常分化为具有厚角组织增厚的非木质化壁的长细胞。这些细胞的束在横切面上看起来像束帽,界定维管束的远轴侧。这种类型的原韧皮部在叶片中的转化广泛分布,也发生在那些茎中具有初生韧皮部纤维的物种中(Esau, 1939)。初生韧皮部纤维也存在于根中。随着其转化,原韧皮部失去了与韧皮部组织的所有相似性。 | 在许多物种中,这些伸长的细胞是纤维原基(fiber primordia)。当筛管元素停止功能并被消除时,纤维原基增加长度,发育出次生壁,并成熟为称为初生韧皮部纤维(primary phloem fibers)或原韧皮部纤维(protophloem fibers)的纤维(图13.36)。这种纤维存在于许多双子叶植物茎的韧皮部区域的外围,并经常被错误地称为周缘纤维(pericyclic fibers)(第8章)。在双子叶植物的叶片和叶柄中,筛管破坏后剩余的原韧皮部细胞通常分化为具有厚角组织增厚的非木质化壁的长细胞。这些细胞的束在横切面上看起来像束帽,界定维管束的远轴侧。这种类型的原韧皮部在叶片中的转化广泛分布,也发生在那些茎中具有初生韧皮部纤维的物种中(Esau, 1939)。初生韧皮部纤维也存在于根中。随着其转化,原韧皮部失去了与韧皮部组织的所有相似性。 | ||
| 第395行: | 第347行: | ||
图13.34 | 图13.34 | ||
初生韧皮部的分化,见于Vitis vinifera茎的横切面。A,两个原形成层束,一个有一个筛管,另一个有几个。B,具有许多原韧皮部筛管的维管束。其中一些被消除。原生木质部存在于A、B中。C,原韧皮部筛管被消除,后韧皮部分化(图的下半部分)。原韧皮部由纤维原基表示。后韧皮部由筛管、伴胞、韧皮部薄壁细胞和大量扩大的含单宁的薄壁细胞组成。(全部,×600。来自Esau, 1948. Hilgardia 18 (5), 217–296. \copyright 1948 Regents, University of California.) | |||
<nowiki> | <nowiki> | ||
| 第401行: | 第353行: | ||
图13.35 | 图13.35 | ||
大麦(Hordeum vulgare)分化根中维管柱的横切面。维管柱有八个成熟的原生韧皮部筛管,每个筛管伴随两个伴胞。后生韧皮部筛管尚未成熟。在木质部中,所有细胞均未成熟,后生木质部细胞比原生木质部细胞具有更高的液泡化程度。(摘自Esau, 1957b. Hilgardia 27 (1), 15–69. \copyright 1957 Regents, University of California.) | |||
后生韧皮部的筛管通常比原生韧皮部的筛管更长更宽,其筛域也更明显。伴胞和韧皮部薄壁组织通常存在于真双子叶植物(eudicots)的后生韧皮部中(图13.36A)。在单子叶植物(monocots)中,筛管和伴胞通常形成不含韧皮部薄壁组织的束,尽管这些细胞可能存在于束的外围(Cheadle和Uhl, 1948)。在这种韧皮部中,筛管和伴胞形成规则的排列模式,这一特征被认为是系统发育上较为高级的特征(Carlquist, 1961)。在草本真双子叶植物(如毛茛科Ranunculaceae)中,可能会发现一种单子叶植物类型的后生韧皮部,其筛管之间没有韧皮部薄壁细胞。 | 后生韧皮部的筛管通常比原生韧皮部的筛管更长更宽,其筛域也更明显。伴胞和韧皮部薄壁组织通常存在于真双子叶植物(eudicots)的后生韧皮部中(图13.36A)。在单子叶植物(monocots)中,筛管和伴胞通常形成不含韧皮部薄壁组织的束,尽管这些细胞可能存在于束的外围(Cheadle和Uhl, 1948)。在这种韧皮部中,筛管和伴胞形成规则的排列模式,这一特征被认为是系统发育上较为高级的特征(Carlquist, 1961)。在草本真双子叶植物(如毛茛科Ranunculaceae)中,可能会发现一种单子叶植物类型的后生韧皮部,其筛管之间没有韧皮部薄壁细胞。 | ||
| 第409行: | 第361行: | ||
原生韧皮部和后生韧皮部之间的界限有时相当清晰,例如在单子叶植物的气生根中,原生韧皮部仅含有筛管,而后生韧皮部中则有明显的伴胞与筛管相连。在真双子叶植物中,这两种组织通常逐渐融合,它们的界限必须基于发育研究来确定。 | 原生韧皮部和后生韧皮部之间的界限有时相当清晰,例如在单子叶植物的气生根中,原生韧皮部仅含有筛管,而后生韧皮部中则有明显的伴胞与筛管相连。在真双子叶植物中,这两种组织通常逐渐融合,它们的界限必须基于发育研究来确定。 | ||
在具有次生韧皮部的植物中,次生韧皮部与后生韧皮部之间的区别可能相当不确定。如果这两种组织中存在细胞的径向排列,则它们的界限尤其难以确定。在Prunus属和Citrus limonia中发现了例外情况,在这些植物中,由原形成层在韧皮部侧启动的最后一批细胞成熟为大型薄壁细胞,从而清晰地将初生韧皮部与次生韧皮部分开(Schneider, 1945, 1955)。 | |||
<nowiki> | <nowiki> | ||
| 第415行: | 第367行: | ||
图13.36 | 图13.36 | ||
菜豆(Phaseolus vulgaris)叶片的韧皮部。A,纵切面显示部分筛管,包含两个完整和两个不完整的筛管分子(s)。伴胞位于cc。三个筛管分子中的纺锤形非分散性P-蛋白体。B,横切面显示不再具有传导功能的原生韧皮部纤维、后生韧皮部以及部分次生韧皮部。筛管分子位于s,伴胞位于cc。(摘自Esau, 1977.) | |||
{{:Esau's Plant Anatomy}} | {{:Esau's Plant Anatomy}} | ||
2025年8月25日 (一) 18:07的最新版本
韧皮部虽然正确地被称为维管植物的主要食物传导组织,但在植物的生命中扮演着比这更重要的角色。韧皮部中运输着多种物质。这些物质包括糖类、氨基酸、微量营养素、脂类(主要以游离脂肪酸的形式;Madey 等,2002)、激素(Baker,2000)、花刺激素(florigen;Hoffmann-Benning 等,2002)以及许多蛋白质和RNA(Schobert 等,1998),其中一些除了激素、花刺激素和蔗糖(Chiou 和 Bush,1998;Lalonde 等,1999)外,还作为信息或信号分子(Ruiz-Medrano 等,2001)。韧皮部被称为“信息高速公路”(Jorgensen 等,1998),在器官间的通讯和植物内生长过程的协调中起着重要作用。植物中的长距离信号传递主要通过韧皮部进行(Crawford 和 Zambryski,1999;Thompson 和 Schulz,1999;Ruiz-Medrano 等,2001;van Bel 和 Gaupels,2004)。韧皮部还运输大量的水,可能是果实、幼叶和储存器官(如块茎)的主要水源(Ziegler,1963;Pate,1975;Lee,1989,1990;Araki 等,2004;Nerd 和 Neumann,2004)。
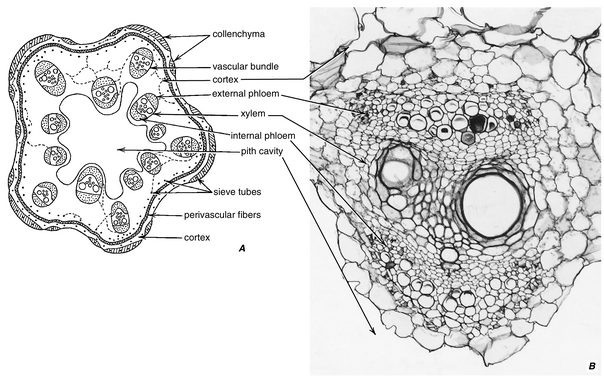
通常,韧皮部在维管系统中与木质部在空间上相关联(图13.1),并且像木质部一样,可以根据其出现的时间与植物或器官整体发育的关系分为初生韧皮部和次生韧皮部。初生韧皮部在胚胎或幼苗中开始形成(Gahan,1988;Busse 和 Evert,1999),在初生植物体的发育过程中不断添加,当初生植物体完全形成时完成其分化。初生韧皮部来源于原形成层。次生韧皮部(第14章)来源于维管形成层,并反映了这种分生组织的轴向和径向系统的组织结构。韧皮部射线通过形成层与木质部的射线相连,为两种维管组织之间的物质径向运输提供了途径。
尽管韧皮部通常在茎和根中位于木质部的外部,或在叶和叶状器官中位于下侧(abaxial),但在许多真双子叶植物科(如夹竹桃科、萝藦科、旋花科、葫芦科、桃金娘科、茄科、菊科)中,部分韧皮部也位于相对的一侧(图13.1)。这两种韧皮部分别称为外生韧皮部(external phloem)和内生韧皮部(internal phloem)或木内韧皮部(intraxylary phloem)。内部韧皮部在发育上主要是初生的(在一些多年生物种中,内部韧皮部的增加会延续到轴的次生生长阶段),并且开始分化的时间晚于外部韧皮部,通常也晚于原生木质部(protoxylem)(Esau, 1969)。一个显著的例外是在Cucurbita pepo 叶的小脉中,近轴面(上侧)的韧皮部分化早于远轴面的韧皮部(Turgeon and Webb, 1976)。在某些科(如苋科(Amaranthaceae)、藜科(Chenopodiaceae)、紫茉莉科(Nyctaginaceae)、刺茉莉科(Salvadoraceae))中,形成层除了向外产生韧皮部和向内产生木质部外,还会周期性地向茎的内部形成一些韧皮部束或层,从而使韧皮部束嵌入木质部中。这些韧皮部束被称为内含韧皮部(included phloem)或木间韧皮部(interxylary phloem)。
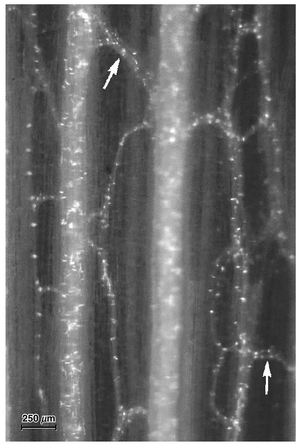
在节间和叶柄的纵向维管束的初生韧皮部中,形成横向连接的筛管在许多种子植物中很常见(图13.1A和13.2;Aloni and Sachs, 1973;Oross and Lucas, 1985;McCauley and Evert, 1988;Aloni and Barnett, 1996)。这被称为韧皮部吻合(phloem anastomoses),它们也在茎中连接内部和外部韧皮部(Esau, 1938;Fukuda, 1967;Bonnemain, 1969),并在叶中连接近轴面和远轴面的韧皮部(Artschwager, 1918;Hayward, 1938;McCauley and Evert, 1988)。在对Dahlia pinnata 茎中韧皮部吻合功能意义的研究中(Aloni and Peterson, 1990),发现韧皮部吻合并不在正常情况下起作用。然而,当纵向束被切断时,吻合开始发挥运输功能。结论是,尽管Dahlia节间的韧皮部吻合能够发挥作用,但它们主要作为一个应急系统,为同化物提供绕过茎的替代路径(Aloni和Peterson,1990)。
韧皮部组织的整体发育和结构与木质部相似,但韧皮部的独特功能与其特有的结构特征相关。韧皮部组织的硬化程度较低,且不如木质部组织持久。由于它通常位于茎和根的外围,韧皮部在次生生长过程中随着轴周长的增加而发生显著变化,其中不再参与传导的部分最终可能被周皮切断(第15章)。相比之下,老化的木质部在其基本结构上保持相对不变。
❙ 韧皮部的细胞类型
初生和次生韧皮部组织包含相同的细胞类别。然而,初生韧皮部并未组织成轴向和径向两个系统;它没有射线。韧皮部的基本组成部分是筛管分子(sieve elements)和各种类型的薄壁细胞(parenchyma cells)。纤维(fibers)和石细胞(sclereids)是常见的韧皮部组成部分。乳汁管(laticifers)、树脂道(resin ducts)和各种idioblasts,在形态和生理上特化,也可能存在于韧皮部中。在本章中,仅详细讨论主要的细胞类型。总结图(图13.3)和表13.1中的韧皮部细胞列表基于次生韧皮部的特征组成。
韧皮部的主要传导细胞是筛成分(sieve elements),之所以如此命名是因为它们的壁上有被孔穿透的区域(筛域,sieve areas)。在种子植物中,筛成分可以分为较不特化的筛胞(sieve cells)(图13.4A)和更特化的筛管分子(sieve-tube elements)或筛管成员(sieve-tube members)(图13.4B-H)。这种分类与管成分(tracheary elements)分为较不特化的管胞(tracheids)和更特化的导管分子(vessel elements)相似。术语“筛管”(sieve tube)指的是一系列纵向排列的筛管分子,就像术语“导管”(vessel)指的是一系列纵向排列的导管分子一样。在这两种分类中,壁结构的特征——管状分子中的纹孔(pits)和穿孔板(perforation plates),筛管分子中的筛域和筛板(sieve plates)(见下文)——可以用来区分这两类细胞。然而,导管分子存在于被子植物、买麻藤植物(Gnetophyta)和一些无种子维管植物中,而筛管分子仅存在于被子植物中。此外,术语“筛胞”(sieve cell)仅限于裸子植物的筛管分子,这些筛管分子在本章后面讨论,其结构和发育非常一致。无种子维管植物或维管隐花植物(vascular cryptogams)的筛管分子在结构和发育上表现出很大的变异,通常简单地用通用术语sieve element来指代(Evert,1990a)。
年轻的筛管分子包含年轻植物细胞的所有细胞成分。随着它们的分化,筛管分子经历了深刻的变化。主要的变化包括细胞核和液泡膜的分解以及壁区域的形成,即筛域,其上的孔增加了垂直或水平相邻筛分子之间的原生质连续性。而管状分子经历程序性细胞死亡——一种完全的自噬——导致原生质内容物的完全丧失,筛分子则经历选择性自噬(图13.5)。成熟时,筛分子的原生质体保留了质膜、内质网、质体和线粒体,所有这些都位于细胞壁附近的位置。
❙ 被子植物的筛管分子
被子植物的筛管分子的特征是存在筛板,筛板上的筛域孔比其他壁部分的筛域孔更大。除少数例外(例如,Nicotiana tabacum根的原生韧皮部分子,Esau和Gill, 1972;全寄生植物Epifagus virginiana气生茎的次生韧皮部分子,Walsh和Popovich, 1977;许多棕榈植物的筛分子,Parthasarathy, 1974a, b;Lemna minor,Melaragno和Walsh, 1976;以及禾本科的所有成员,Evert等, 1971b;Kuo等, 1972;Eleftheriou, 1990),筛管分子的原生质体含有P-蛋白(韧皮部蛋白phloem protein,以前称为slime)。除了筛板和P-蛋白外,筛管分子通常与伴胞相关联,伴胞是与筛管分子密切相关的特化薄壁细胞,对于筛管分子而言在个体发育和功能上都具有重要意义。术语“筛管-伴胞复合体”或“筛分子-伴胞复合体”通常用于指代筛管分子及其相关的伴胞。。
在某些分类群中,筛管分子的壁显著增厚
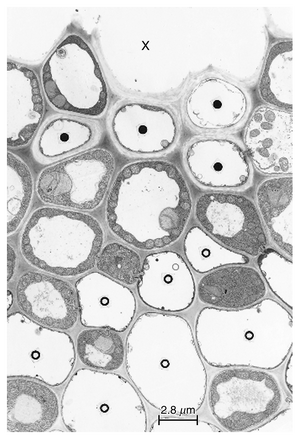
筛管分子的壁通常被描述为初生壁,并且通过标准的显微化学测试通常仅对纤维素和果胶呈阳性反应(Esau, 1969)。在禾本科植物的叶片中,纵向维管束中最后形成的筛管通常具有相对较厚的细胞壁(图13.6)。在某些物种中——Triticum aestivum(Kuo and O’Brien, 1974)、Aegilops comosa(Eleftheriou, 1981)、Saccharum officinarum(Colbert and Evert, 1982)、Hordeum vulgare(Dannenhoffer et al., 1990)——这些壁是木质化的。尽管厚度不一,筛管分子的壁通常明显比周围的薄壁细胞更厚,这一特征可能有助于识别筛管分子。
在许多物种中,筛管分子的壁由两个形态上不同的层组成,一层相对较薄的外层和一层或多或少的较厚的内层。在新鲜切片中,明显的内层呈现出闪亮或发光的表面,因此得名珠光质nacreous(具有珍珠光泽)的壁。珠光质层比外层壁含有更少的纤维素,并且缺乏果胶质(pectin-poor)(Esau 和 Cheadle,1958;Botha 和 Evert,1981)。有时珠光质层非常厚,几乎堵塞了细胞的腔室。尽管一些研究者将此壁层分类为次生壁,但其行为变化很大。在初生筛管分子中,它通常是暂时性的,随着细胞接近成熟而厚度减少,并在细胞达到成熟时消失。在次生韧皮部筛管分子中,珠光质层可能随年龄减少厚度,也可能不减少(图13.7;Esau 和 Cheadle,1958;Gilliland 等,1984)。珠光质层不会延伸到筛域和筛板的区域。
通过使用温和的提取程序去除非纤维素壁成分并结合电子显微镜观察,某些真双子叶植物的珠光质增厚显示出多层结构,同心排列的薄层由密集排列的微纤丝(microfibrils)组成(Deshpande,1976;Catesson,1982)。海草筛管分子中的珠光质壁在没有提取的情况下也表现出多层结构(Kuo,1983)。
在用戊二醛-四氧化锇固定并用醋酸铀和柠檬酸铅染色后,筛管分子壁的内表面通常比壁的其他部分显示出更高的电子密度(图13.8;Evert 和 Mierzwa,1989)。该区域通常显示出网状和/或条纹状图案,显然是一个富含果胶质的非微纤丝材料层,与珠光质增厚不同,它延伸到筛域和筛板(Lucas 和 Franceschi,1982;Evert 和 Mierzwa,1989)。在Hordeum vulgare叶片叶脉的筛管中,这个电子密度高的内壁区域在侧筛域和筛板处最厚,其中充满了由质膜形成的管状迷宫(Evert 和 Mierzwa,1989)。在筛域之间的侧壁处,这个内壁区域充满了许多质膜的微绒毛状突起,大大增加了细胞壁与质膜的界面,使其呈现出刷状缘的外观。
筛板通常出现在端壁上
如前所述,在被子植物中,同一细胞壁上的筛域(sieve-area)孔的大小差异很大(图13.9A–C)。筛域中的孔直径从几分之一μm(比胞间连丝稍宽)到15μm不等,在某些真双子叶植物(eudicots)中可能更大(Esau和Cheadle, 1959)。具有较大孔的筛域通常出现在端壁上,而具有较小孔的筛域则出现在侧壁或侧壁上。因此,筛板通常出现在端壁上,筛管元素(sieve-tube elements)端对端排列,形成筛管(sieve tube)。筛板也可能出现在侧壁上。一些筛板仅承载一个筛域(图13.9A;简单筛板(simple sieve plate)),而其他筛板则承载两个或更多筛域(图13.9D, E;复合筛板(compound sieve plate))。
在常规的韧皮部制备中,筛孔(sieve pores)通常由壁成分胼胝质(callose)衬里(第4章)。大多数(如果不是全部)与传导筛管元素相关的胼胝质是由于机械损伤或其他类型的刺激而沉积在那里的(Evert和Derr, 1964; Esau, 1969; Eschrich, 1975)。并非所有与筛孔相关的胼胝质都是这种伤口胼胝质(wound callose)。胼胝质通常在衰老筛元素(senescing sieve elements)的筛板和侧面的筛域上积累(图13.10)。这种确定的胼胝质(definitive callose)在筛元素死亡后一段时间消失。胼胝质通常在功能超过一个生长季节的次生韧皮部筛管元素的筛板和侧筛域上积累(Davis和Evert, 1970)。在温带地区,这种休眠胼胝质(dormancy callose)在秋季沉积,然后在早春休眠越冬筛元素重新激活时被移除。
胼胝质似乎在筛孔发育中起作用
在幼嫩的筛管分子(sieve-tube elements)中,初生筛板(sieve plate)的筛域(sieve area)被数量不等的胞间连丝(plasmodesmata)穿过,每根胞间连丝在细胞壁两侧都与内质网()的cisterna相连(图13.11A)。孔位(pore sites)最初通过细胞壁两侧每个胞间连丝周围质膜(plasma membrane)下方胼胝质(callose)的出现而与细胞壁的其他部分区分开来。成对的胼胝质沉积物,通常称为platelets,呈领状或锥状,在胞间连丝所在的中部中断(图13.11B, C)。platelets迅速增大,最初其增厚速度可能超过细胞壁的其他部分。细胞壁的纤维素-果胶(cellulosic-pectin)部分的增厚可能超过胼胝质platelets;然后孔位在筛板上表现为凹陷。孔位处胼胝质platelets的存在显然阻止了纤维素在那里进一步沉积,因此夹在platelets之间的纤维素壁部分保持薄的状态。孔位处胼胝质platelets的定位和细胞壁的增厚是筛管分子发育的最早指标之一。
孔位的穿孔大约在细胞核退化时开始。细胞壁物质的移除从围绕胞间连丝的中胶层(middle lamella)区域开始(图13.11D, E)。在某些情况下,最初形成一个median cavity,然后胼胝质platelets和夹在它们之间的细胞壁物质同时被移除,从而形成孔(Deshpande, 1974, 1975)。在其他情况下,中胶层区域的溶解导致相对的胼胝质platelets合并,因此最初幼嫩的孔内衬有胼胝质(Esau和Thorsch, 1984, 1985)。在整个孔发育过程中,内质网囊泡始终紧密贴附在胼胝质platelets边缘的质膜上,直到孔达到其完全大小时才被移除(图13.11F)。侧筛域(sieve-area)孔的发育与筛板孔的发育基本相似(Evert等, 1971a)。
胼胝质是否普遍参与筛孔(sieve-pore)的形成尚存疑问。在小型水生单子叶植物Lemna minor的根原韧皮部(protophloem)中,在筛孔发育的任何阶段都没有发现胼胝质(Walsh和Melaragno, 1976)。然而,胼胝质可以在受伤时诱导形成。
质体(plastids)外观的变化和P蛋白(P-protein)的出现是筛管分子发育的早期指标
最初,年轻的筛管分子原生质体(图13.12)与其他原形成层细胞或新近形成的形成层衍生物的原生质体相似。年轻的、有核的筛管分子及其邻近的有核细胞都含有高尔基体、质体和线粒体。液泡的数量不一,由液泡膜(tonoplasts)与细胞质分隔开来。细胞质富含游离核糖体,并含有粗糙内质网(rough )的网络。微管(microtubules)主要与细胞长轴成直角排列,位于质膜旁边,紧贴着薄薄的细胞壁。纵向排列的肌动蛋白丝束相当多。除了微管外,各种细胞组分或多或少随机分布在细胞中。
质体外观的变化是筛管发育的早期指标,最初它们与邻近细胞的质体相似。随着筛管质体的成熟,其基质(stroma)变得不那么致密,并且可能出现该质体类型特有的内含物(图13.13A-D)。在此之前,通常很难将质体与线粒体区分开来。在成熟的筛管分子中,基质是电子透明的,内部的膜(类囊体)通常稀少。筛管质体有两种基本类型,S型(淀粉)和P型(蛋白质)(Behnke,1991a)。S型有两种形式,一种仅含有淀粉(图13.13A,C);另一种则没有任何内含物。P型有六种形式,含有一或两种蛋白质内含物(晶体,图13.13B,D,和/或丝状体,图13.13E)。其中两种还含有淀粉。所有单子叶植物都具有P型质体,而仅含有楔形蛋白质晶体(图13.13B,D)的类型又占多数(Eleftheriou,1990)。与普通淀粉不同,筛管淀粉用碘(I2KI)染色时呈棕红色而非蓝黑色。Phaseolus vulgaris中的筛管淀粉是一种高度分支的支链淀粉(amylopectin)分子,具有大量的\alpha\mathfraka(1\rightarrow6)键(Palevitz和Newcomb,1970)。筛管分子中的质体差异在分类学上具有重要价值(Behnke,1991a,2003)。
筛管分子(sieve-tube element)发育的另一个早期指标是P蛋白(P-protein)的出现,它最初在光学显微镜下表现为离散的颗粒,每个细胞中有一个或多个(图13.14A, B)。P蛋白颗粒在筛管分子前体分裂产生一个或多个伴胞(companion cell)后出现。大多数物种具有分散的P蛋白颗粒。这些P蛋白颗粒最初很小,随后逐渐增大(图13.14A, B),最终开始分散,在细胞质的壁层形成丝状或网状结构。此时,细胞核已经开始退化。在液泡膜消失后,分散的P蛋白位于细胞腔和筛板孔(sieve-plate pores)的壁层位置(图13.15和13.16D; Evert et al., 1973c; Fellows and Geiger, 1974; Fisher, D. B., 1975; Turgeon et al., 1975; Lawton, D. M., and Newman, 1979; Deshpande, 1984; Deshpande and Rajendrababu, 1985; Russin and Evert, 1985; Knoblauch and van Bel, 1998; Ehlers et al., 2000),前提是在取样过程中尽可能少地干扰韧皮部。否则,当筛管被切断时,随着筛管内容物高压的释放,P蛋白可能会在整个细胞腔中分散,或者在压力释放时在筛板远离压力释放部位的一侧积聚形成黏液塞(slime plugs)。
在电子显微镜下,P蛋白通常呈管状的丝,亚基呈螺旋排列(图13.16A-C)。Cucurbita maxima中的P蛋白丝由两种非常丰富的蛋白质组成:韧皮蛋白1(phloem protein 1, PP1),一种96 kDa的蛋白质丝,和韧皮蛋白2(phloem protein 2, PP2),一种25 kDa的二聚体凝集素(lectin),它与PP1共价结合。蛋白质和mRNA的定位模式表明,PP1和PP2是在分化和成熟的筛管分子-伴胞复合体中合成的,并且在分化过程中聚合形式的P蛋白在筛管分子中积累(Bostwick et al., 1992; Clark et al., 1997; Dannenhoffer et al., 1997; Golecki et al., 1999)。显然,在伴胞中合成的PP1和PP2亚基通过它们共同壁中的孔-胞间连丝(pore-plasmodesmata)连接被运输到筛管分子中。到目前为止,丝状P蛋白的作用仍不确定。有人认为,PP1用于封闭受损筛管分子的筛板孔,代表筛管抵御同化物(assimilates)流失的第一道防线,而伤口胼胝质(wound callose)以不同的速率加强防御(Evert, 1990b)。凝集素(PP2)的作用同样不确定。已发现PP2亚基在同化物流中从源移动到库(见下文),并在筛管分子和伴胞之间循环(Golecki et al., 1999; Dinant et al., 2003)。在16个种子植物属中发现了PP2样基因,包括一种裸子植物(Picea taeda)和四个禾本科(Poaceae)属,这些植物都不含PP1。在一种非维管植物——苔藓Physcomitrella patens中也发现了PP2样基因。看来PP2样蛋白质可能具有不仅与PP1或维管特异性功能相关的特性(Dinant等, 2003)。有人提出PP2可能用于在伤口部位固定细菌和真菌,或作为成熟、传导的筛管分子中沿壁持续存在的细胞器的锚点。在Vicia faba和Lycopersicon esculentum的筛管分子中发现了微小的夹状结构,这些结构被认为负责成熟筛管分子中组件的周边定位(Ehlers等, 2000)。这些"夹子"的化学性质尚不清楚。
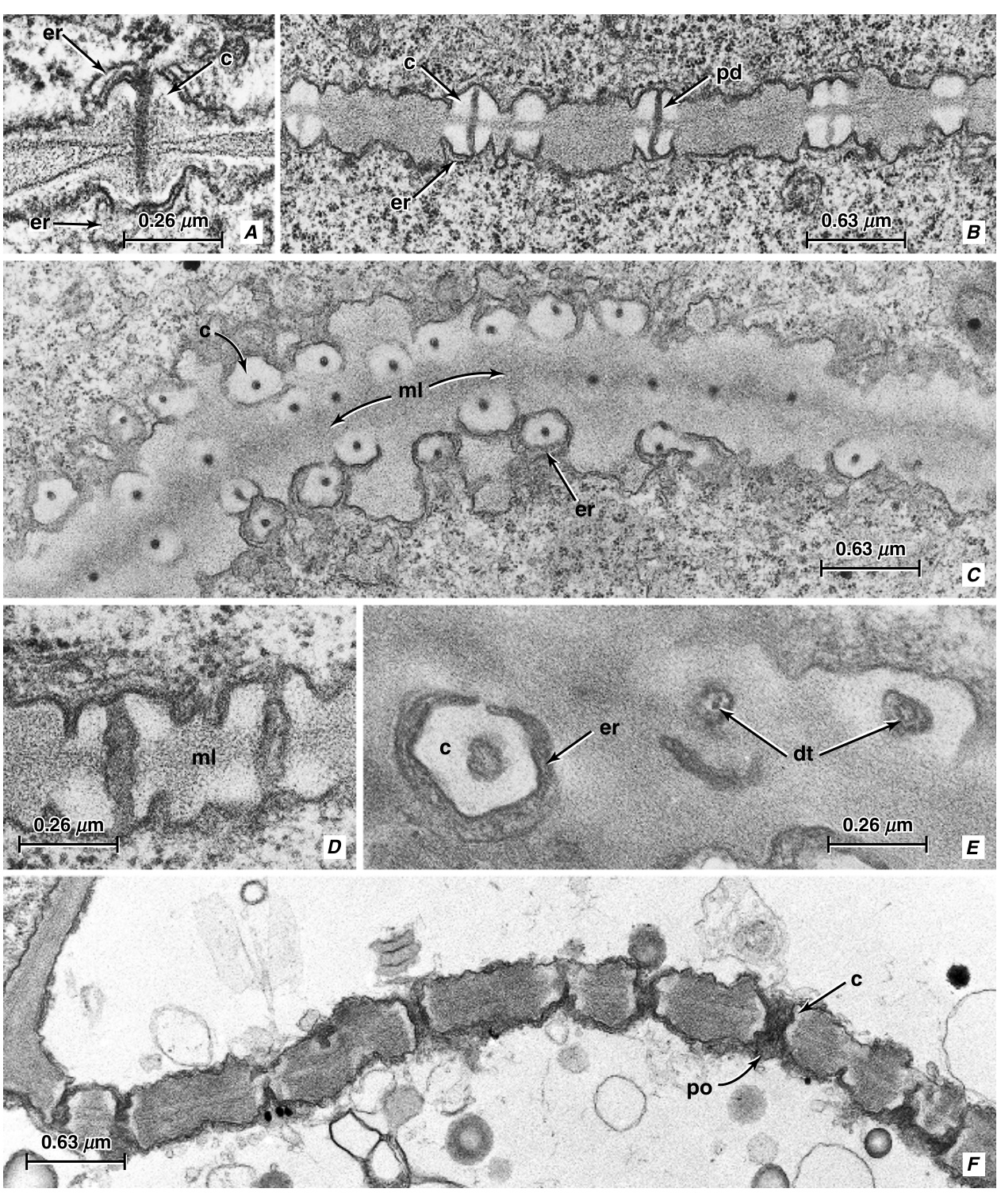
图13.11 从棉花(Gossypium hirsutum)节间发育的筛管分子中的筛板,如横切面(A、B、D、F)和表面视图(C、E)所示。A,一个胞间连丝(plasmodesma),标记了未来孔的位置。一些胼胝质(callose,c)已经沉积在内质网(,er)的池下。B、C,胼胝质片(c)包围了孔位点的胞间连丝(pd)。D、E,随着胞间连丝通道的加宽,孔开始发育。F,成熟的筛板,开放的孔(po)内衬有少量胼胝质并充满P蛋白。其他细节:dt,连丝管(desmotubule);ml,中层(middle lamella)。(来自Esau和Thorsch,1985年)
图13.12 烟草(Nicotiana tabacum)叶片中年轻筛管分子(SE)和伴胞(CC)的纵向视图。箭头标记了筛管分子两端(未来的筛板)以及筛管分子和伴胞之间的共同壁中可辨别的胞间连丝(未来孔-胞间连丝连接的位置)。筛管分子细胞核上方和下方有许多小液泡(v)。(来自Esau和Thorsch,1985年)
图13.13 筛管质体。豆类(Phaseolus)根尖中的未成熟(A)和成熟(C)S型质体;洋葱(Allium)根尖中的未成熟(B)和成熟(D)P型质体,带有楔形蛋白晶体(密集内含物)。E,菠菜(Spinacia)叶片筛管中的P型质体,带有丝状蛋白内含物(f)。其他细节:er,内质网;s,淀粉;w,壁。
图13.14 南瓜(Cucurbita maxima)茎韧皮部中未成熟和成熟的筛管分子,如纵向(A)和横切面(B、C)所示。A,两个未成熟的筛管分子(右侧和中央)含有许多P蛋白体(箭头)。右侧筛管分子中的P蛋白体已经开始在细胞质的壁层中分散。该筛管分子中的细胞核(n)已经开始退化,几乎不可辨认。一束伴胞(cc)伴随着成熟的筛管分子,位于最右侧和左侧。左下角的筛管分子中可以看到一个黏液塞(sp)。B,两个未成熟的筛管。左侧的筛管中可以看到大的P蛋白体(箭头),右侧的筛管中可以看到未成熟(简单)筛板的正面视图。小而密集的细胞是伴胞。C,两个成熟的筛管分子。左侧的筛管分子中可以看到一个黏液塞(sp),右侧的筛管分子中可以看到一个成熟的筛板。小而密集的细胞是伴胞。(A,×300;B、C,×750)
图13.15 电子显微镜下成熟的Cucurbita maxima筛板部分表面视图。孔道内衬有狭窄的胼胝质圆柱体(c)和质膜(未标记)。内质网(er)和P蛋白(pp)的元素也沿着孔道的边缘分布。(来自Evert等, 1973c, 图2. 1973, Springer-Verlag.)
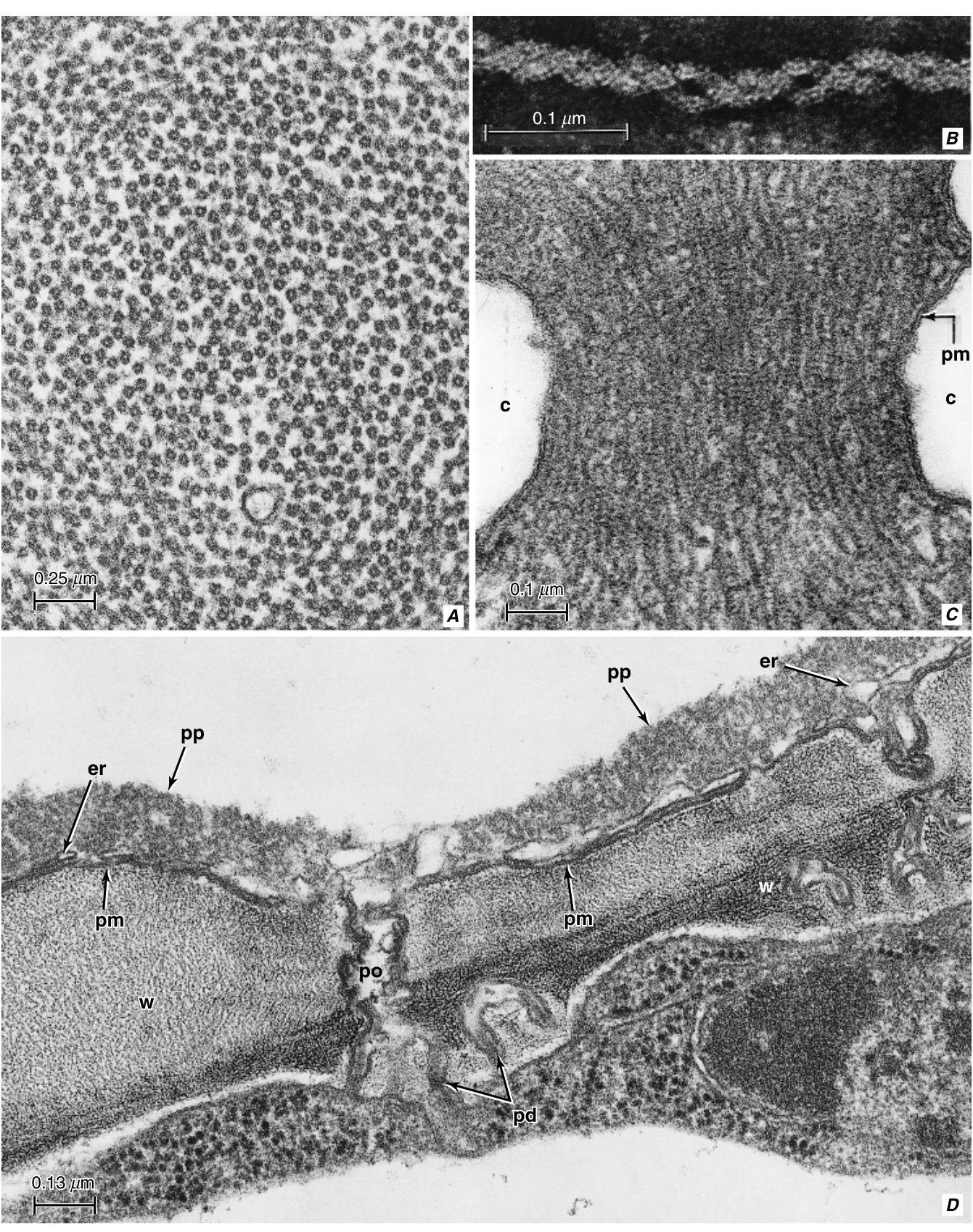
图13.16 P蛋白。Poinsettia (A)、Nicotiana tabacum (B)、Nelumbo nucifera (C)和Cucurbita pepo (D)的筛管分子。A, P蛋白体的一部分显示管状丝。B, 负染的韧皮部渗出液的高倍放大显示了P蛋白丝的双链结构。C, 积累在筛板孔中的P蛋白显示延伸的丝中的水平条纹;孔道内衬有胼胝质(c)位于质膜(pm)下方。D, 横切面显示成熟筛管分子(上方)的壁(w)部分和细胞质的壁层。此视图中的壁层由质膜(pm)、不连续的内质网(er)轮廓和P蛋白(pp)组成。在筛管分子(孔侧)-伴胞(胞间连丝侧)壁中可以看到孔-胞间连丝连接。其他细节: po, 孔; pd, 胞间连丝。(B, 转载自Cronshaw等, 1973. \copyright 1973, 经Elsevier许可; C, 来自Esau, 1977; D, 来自Evert等, 1973c, 图6. \copyright 1973, Springer-Verlag.)
在一些分类群(主要是木本植物科)中,P-蛋白体(P-protein bodies)仅部分分散或完全不分散(非分散性P-蛋白体,图13.17;另见图13.36A;Behnke, 1991b)。曾经被认为是挤出的核仁的细胞质内含物就是这些的例子(Deshpande and Evert, 1970; Esau, 1978a; Behnke and Kiristis, 1983)。常被引为非分散性P-蛋白体例子的是Fabaceae的有尾或无尾纺锤形结晶P-蛋白体,这些在光学显微镜下曾被称为持久性黏液体(Esau, 1969)。然而,研究表明,这些P-蛋白体能够经历快速且可逆的钙控制转化,从浓缩的“静止状态”转变为分散状态,在此状态下它们会阻塞筛管(Knoblauch et al., 2001)。结晶体的分散是由质膜泄漏和急剧的膨压变化触发的。有人认为,P-蛋白在分散和浓缩之间循环的能力可能提供了一种控制筛管导电性的有效机制(Knoblauch et al., 2001)。在双子叶植物的筛管元素中,可以识别出四种主要的非分散性P-蛋白体形式:纺锤形、复合球形、棒状和玫瑰状(Behnke, 1991b)。绝大多数非分散性蛋白体来源于细胞质。在双子叶植物的两个科——Boraginaceae和Myristicaceae(Behnke, 1991b)以及单子叶植物的Zingiberaceae(Behnke, 1994)中发现了核来源的非分散性蛋白体。
核退化可能是染色质溶解性或核固缩性的
筛管元素个体发育的最后阶段的主要事件之一是核的退化。在大多数被子植物中——无论是双子叶植物(Evert, 1990b)还是单子叶植物(Eleftheriou, 1990)——核退化是通过染色质溶解(chromatolysis)进行的,这一过程涉及可染色内容物(染色质和核仁)的丢失以及核膜的最终破裂(图13.18B)。核固缩性退化(pycnotic degeneration),在此过程中染色质在核膜破裂前形成一个非常致密的团块,据报道主要发生在分化的原生韧皮部筛管元素中。
大约在细胞核开始退化的时候,内质网的池(cisternae)开始形成堆叠(图13.18A和13.19A)。在堆叠过程中,内质网开始向细胞壁迁移,并且堆叠中相互面对的表面的核糖体消失,尽管在池之间可能积累有电子致密物质,可能是酶(图13.19A, B)。膜堆叠外表面的核糖体与细胞质中的游离核糖体同时消失。随着筛管分子(sieve-tube element)的逐渐成熟,现在完全光滑的内质网可能会进一步转变为卷曲、网状和管状的形式。在大多数完全成熟的筛管分子中,内质网主要由一个复杂的网络表示——一个靠近质膜的壁旁(parieatal)吻合系统——与存活的细胞器和P-蛋白一起存在。只保留了两种细胞器,质体和线粒体(图13.19C)。尽管在成熟的筛管分子的电子显微照片中既没有发现微管也没有发现肌动蛋白丝(actin filament),但在筛管渗出物中发现了高水平的肌动蛋白和profilin,后者被认为参与调节肌动蛋白丝的聚合(Staiger et al., 1997)(Guo et al., 1998; Schobert et al., 1998)。
两个界膜,质膜和液泡膜,表现出不同的行为。质膜作为选择性通透膜持续存在,而液泡膜分解,液泡和壁旁细胞质之间的界限消失。随着叠加的筛管分子腔的清除和它们之间未闭塞的筛板孔(sieve-plate pore)的发育,筛管成为同化物流溶液流动的理想导管(图13.15和13.20)。
❙ 伴胞(Companion Cells)
筛管分子通常与称为伴胞(companion cell)的特化薄壁组织细胞相关联。通常,伴胞与它们相关的筛管分子来自同一个母细胞,因此这两种细胞在个体发育上密切相关(图13.5)。在伴胞的形成过程中,筛管分子的分生组织前体纵向分裂一次或多次。其中一个产生的细胞,通常以较大为特征,分化为筛管分子。一个或多个伴胞可能与单个筛管分子相关联,并且伴胞可能出现在筛管分子壁的一侧或多侧。在一些分类群中,伴胞以垂直系列出现(伴胞链companion cell strands;图13.21B, C),这是它们直接前体分裂的结果。伴胞大小也有所不同。一些——无论是单个细胞还是细胞链——都与它们相关的筛管分子(sieve-tube element)一样长(图13.21A);另一些则比筛管分子短(图13.21D–I;Esau, 1969)。伴胞(companion cells)与筛管分子的个体发育关系通常被认为是这些细胞的一个特定特征,尽管一些通常被认为是伴胞的薄壁组织细胞可能并非与它们相关的筛管分子来自同一个母细胞(例如,在玉米叶片的纵向脉中;Evert等,1978)。然而,这种关系在被子植物(angiosperms)中是典型的,并且伴胞的存在被包含在筛管分子的定义中,与筛细胞(sieve cell)形成对比。
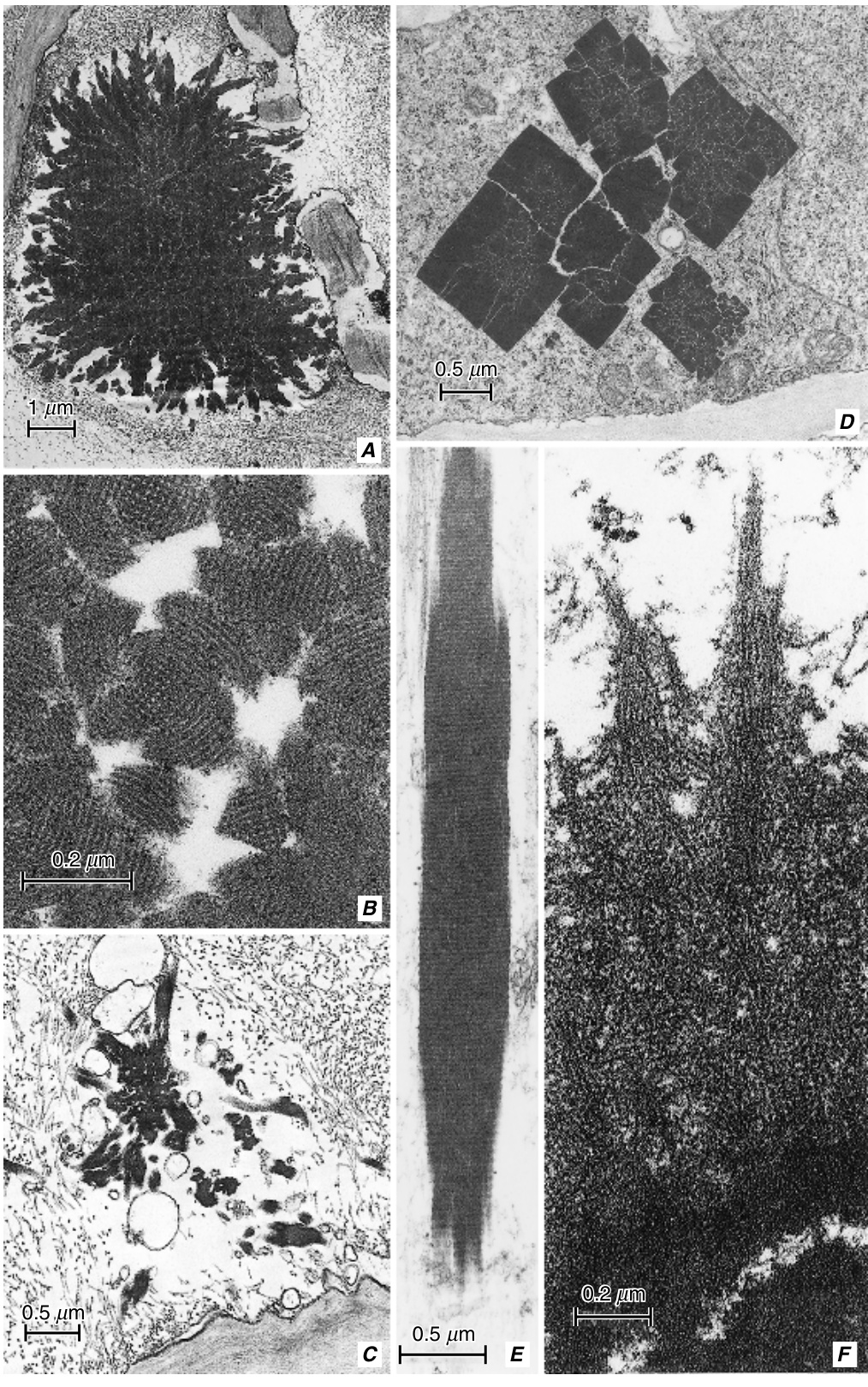
图13.17 非分散性P-蛋白体。A, Quercus alba。成熟筛管分子中靠近筛板的复合球形体。B, Quercus alba。球形体的细节。C, Rhus glabra。成熟筛管分子中的复合球形体。被Deshpande和Evert(1970)描述为“星状”。D, Robinia pseudoacacia。未成熟筛管分子中纺锤形体的横切面。E, R. pseudoacacia。成熟筛管分子中纺锤形体的纵切面。F, Tilia americana。复合球形体的一部分。外围区域(上方)由杆状成分组成;更密集的中央区域(下方)几乎没有或没有亚结构。Quercus和Tilia的球形体曾被认为是挤出的核仁。(A–C和F,转载自Deshpande和Evert,1970。\copyright 1970,经Elsevier许可;D, E,来自Evert,1990b,图6.16和6.17。\copyright 1990,Springer-Verlag。)
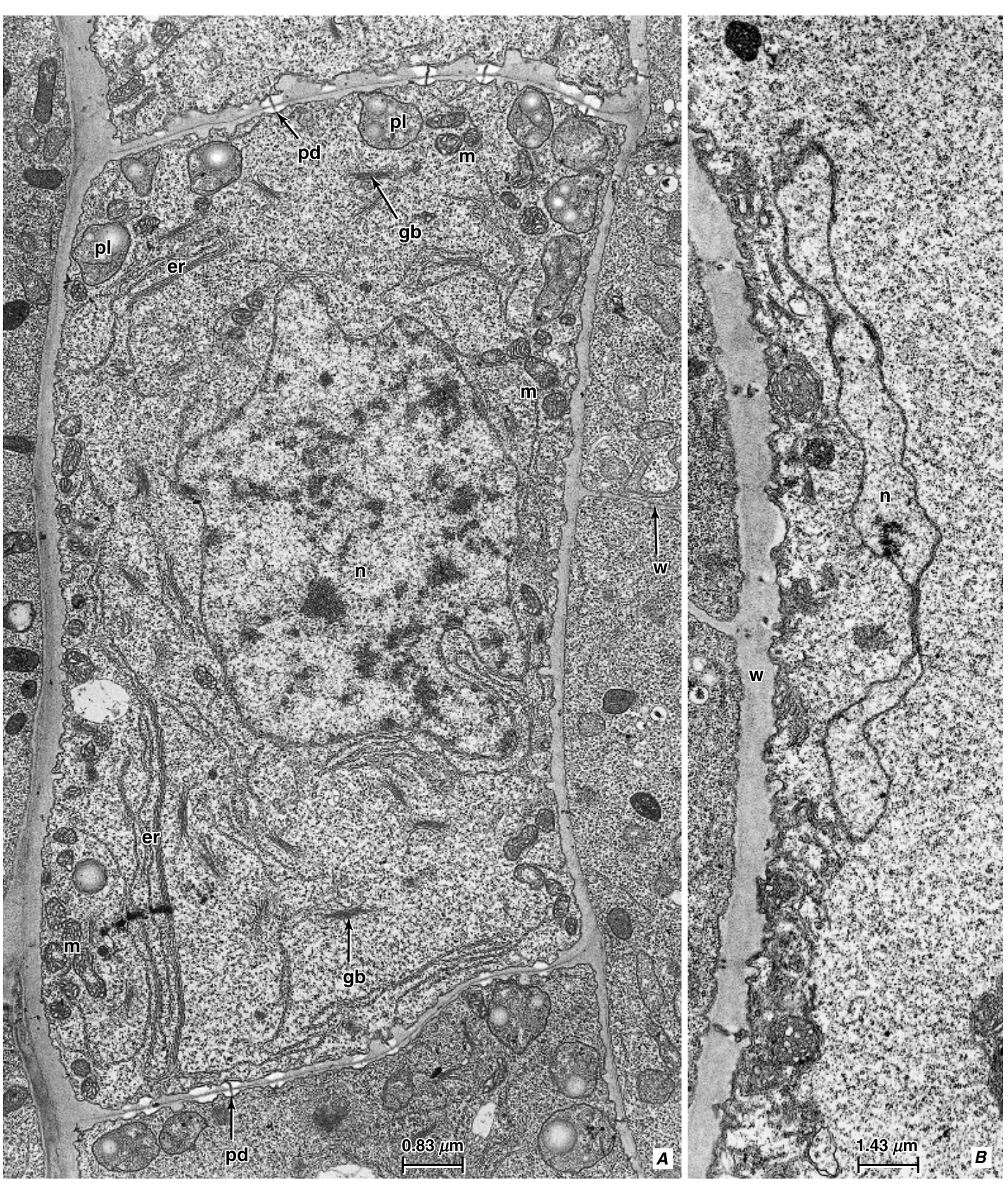
图13.18 A, 烟草(Nicotiana tabacum)根中的未成熟原生韧皮部筛管分子。内质网(er)的堆叠已经开始,大多数质体(pl)和线粒体(m)已经分布在细胞壁附近。细胞核(n)开始失去可染色的内容物,发育中的筛板孔位点由成对的胼胝质小板标记。单个胞间连丝(pd)穿过小板,壁的两侧各有一个小板。其他细节:gb,高尔基体;w,薄壁细胞之间的壁。B, 未成熟筛管分子中部分塌陷的细胞核(n),阶段比A更晚。细胞器现在位于壁(w)附近。(转载自Esau和Gill,1972。\copyright 1972,经Elsevier许可。)
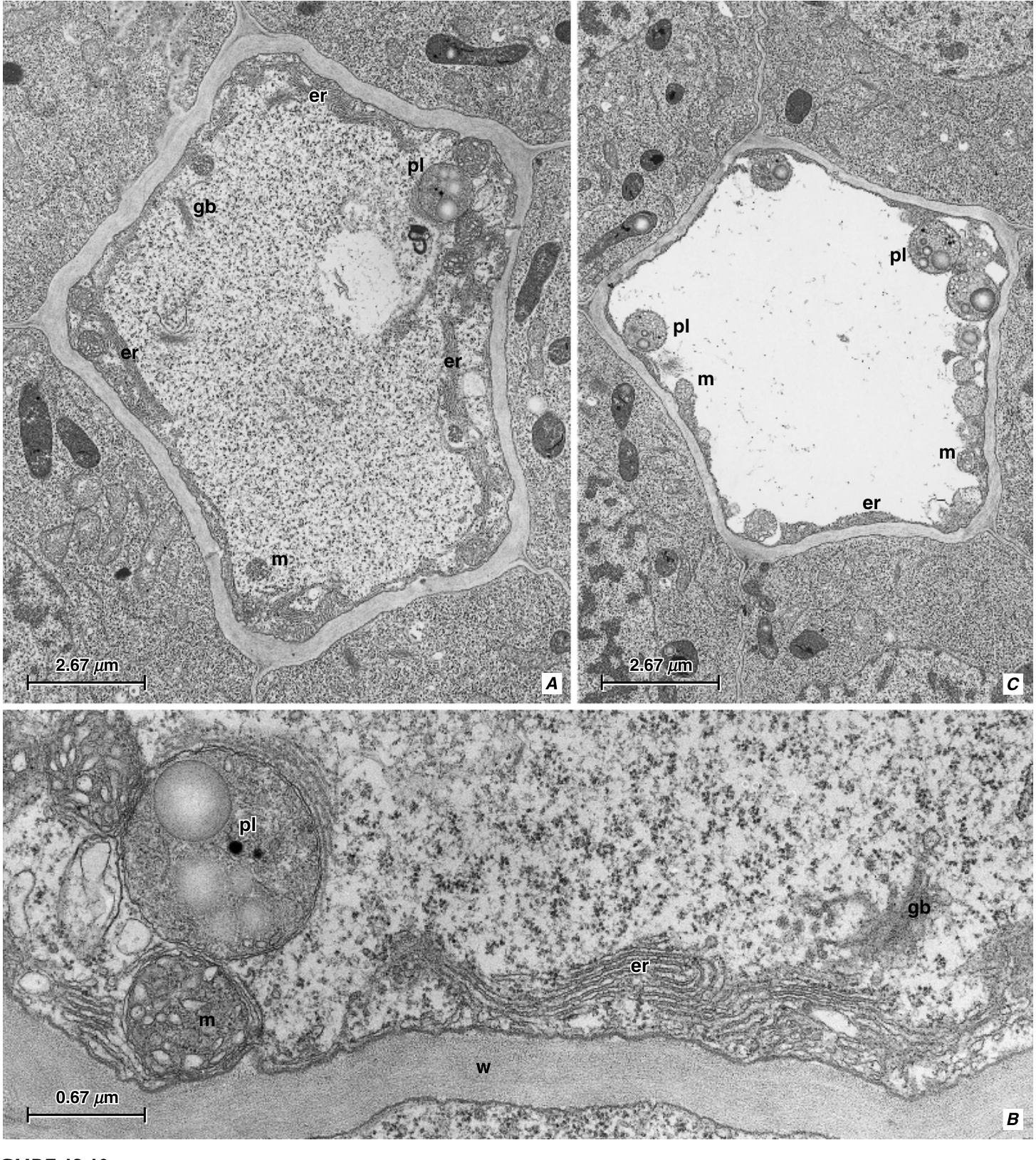
图13.19 烟草(Nicotiana tabacum)根中未成熟(A, B)和成熟(C)原生韧皮部筛管分子的横切面。A, 堆叠的内质网(er)和细胞器(线粒体,m,和质体,pl)已经位于外围位置。高尔基体(gb)和丰富的核糖体仍然存在。B, 堆叠内质网的细节。C, 成熟筛管分子具有清晰的形态。其他细节:w,壁。(A, B,转载自Esau和Gill,1972。\copyright 1972,经Elsevier许可。)
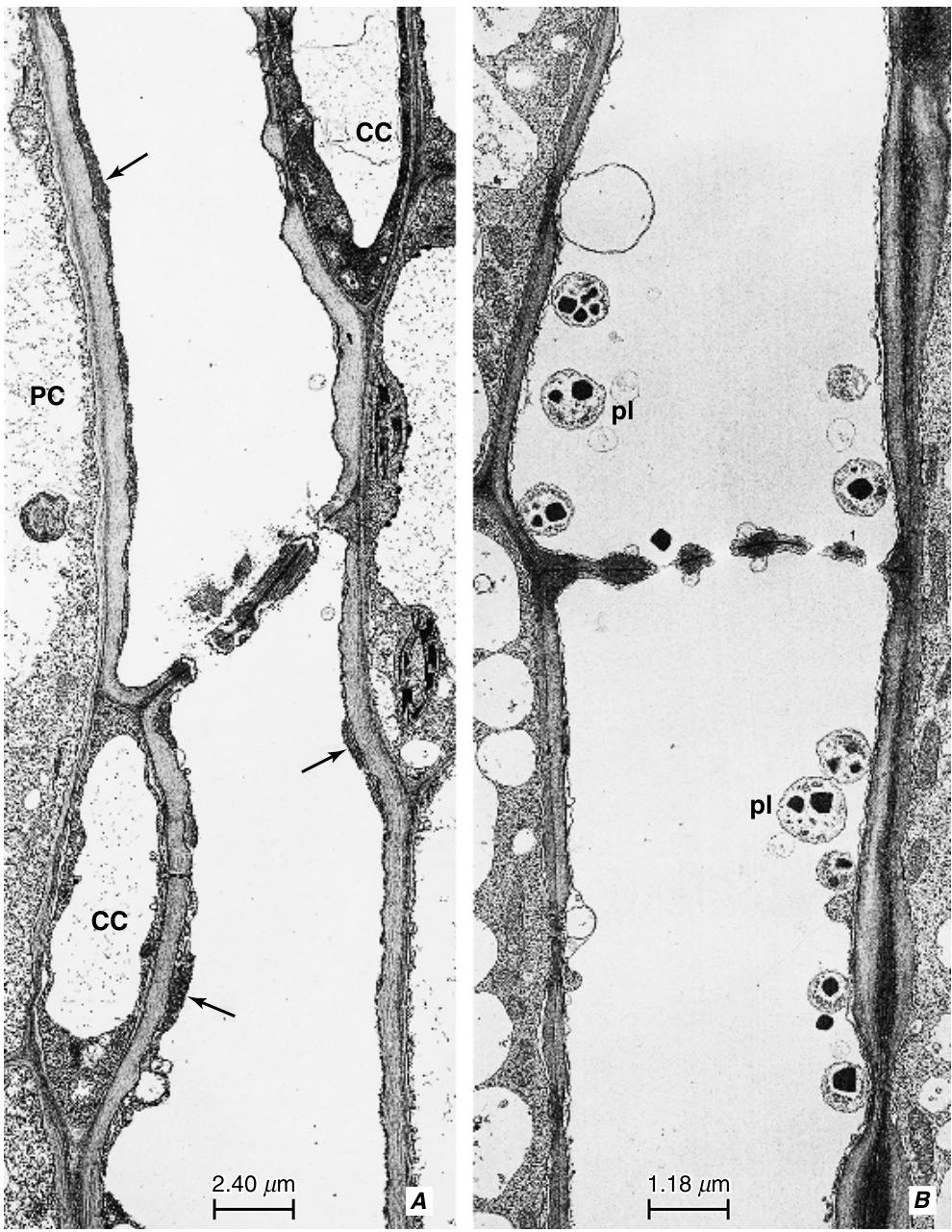
图13.20 成熟筛管分子部分的纵切面,显示细胞质成分的壁分布和未堵塞孔的筛板。A, Cucurbita maxima。未标记的箭头指向P-蛋白。其他细节:CC,伴胞;PC,薄壁细胞。B, Zea mays。典型的单子叶植物筛管分子,玉米的筛管分子含有P型质体(pl),带有楔形蛋白晶体。玉米是禾本科(Poaceae)的一员,缺乏P-蛋白。(A,来自Evert等,1973c,图11。\copyright 1973,Springer-Verlag;B,由Michael A. Walsh提供。)
在筛管分子的原生质体(protoplast)经历选择性自噬(selective autophagy)并在其个体发育过程中呈现出透明外观的同时,伴胞的原生质体通常在接近成熟时密度增加。这种密度的增加部分是由于核糖体(多核糖体)(ribosome (polysome))数量的增加,部分是由于细胞质(cytosol)本身的密度增加(Behnke, 1975;Esau, 1978b)。成熟的伴胞还含有大量的线粒体(mitochondria)、粗面内质网(rough )、质体(plastids)和一个显著的细胞核(nucleus)。伴胞的质体通常不含淀粉,尽管存在一些例外(例如,在Cucurbita中,Esau和Cronshaw, 1968;Amaranthus中,Fisher, D. G.和Evert, 1982;Solanum中,McCauley和Evert, 1989)。这些细胞在不同程度上具有液泡(vacuolated)。
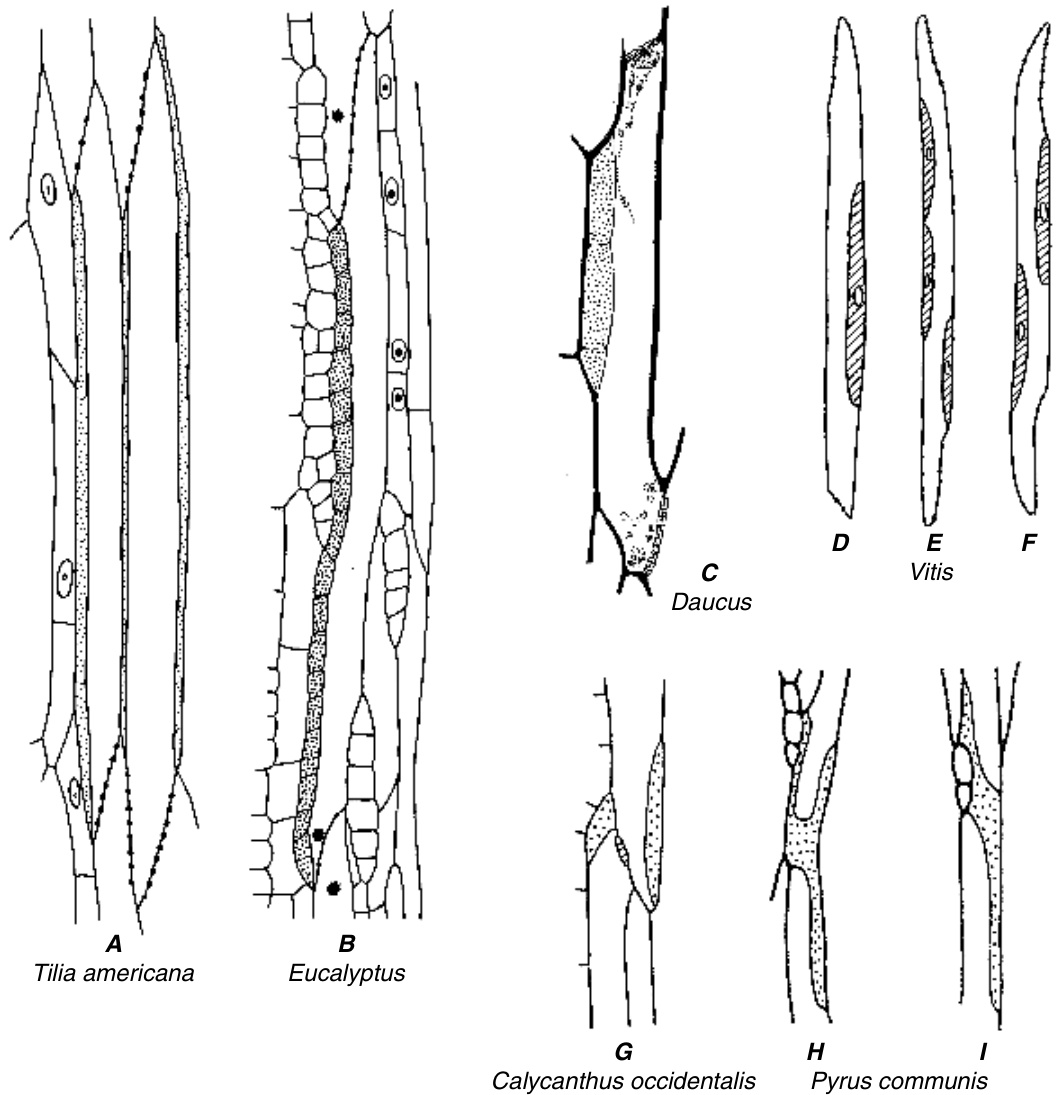
图13.21 伴胞(纵向视图)。A,Tilia americana的筛管分子,伴胞(点状)从筛板延伸到筛板。B,Eucalyptus的筛管分子,伴胞长链。靠近筛板的致密体是曾经被认为是挤出的核仁的非分散性P-蛋白体。C,Daucus(胡萝卜)的筛管分子,伴胞三链。靠近筛板的小体是含有淀粉的质体(plastids);大的是P-蛋白。D–F,Vitis的筛管分子部分;伴胞用阴影表示。G,Calycanthus occidentalis的筛管分子与伴胞;H, I,Pyrus communis的筛管分子部分,伴胞。
伴胞(companion cells)通过大量的细胞质连接与其相关的筛管分子(sieve-tube elements)紧密相连,这些连接由筛管分子侧壁上的孔和伴胞侧高度分支的胞间连丝(plasmodesmata)组成(图13.22)。在这些连接发育过程中,胼胝质(callose)出现在筛管分子侧壁未来孔的位置(图13.22A)。孔的形成始于中层(middle lamella)区域中腔的发育,而分支胞间连丝的形成与伴胞侧细胞壁的增厚有关(Deshpande, 1975; Esau and Thorsch, 1985)。因此,这些分支的胞间连丝不是次生胞间连丝(secondary plasmodesmata),而是修饰的原生胞间连丝(primary plasmodesmata)(第4章)。通常认为成熟筛管分子的壁旁内质网()通过伴胞壁中的连丝小管(desmotubules)与伴胞的内质网相连。
通常情况下,伴胞的壁既不硬化(sclerified)也不木质化(lignified),并且当相关的筛管分子死亡时,伴胞通常会塌陷。在Carpodetus serratus (Brook, 1951)和Tilia americana (Evert, 1963)的非传导韧皮部(nonconducting phloem)中报道了伴胞的硬化。在许多草本双子叶植物(herbaceous eudicots)成熟叶的小叶脉(minor veins)中,伴胞具有不规则的壁物质内生长,这是传递细胞(transfer cells)的典型特征(见下文; Pate and Gunning, 1969)。
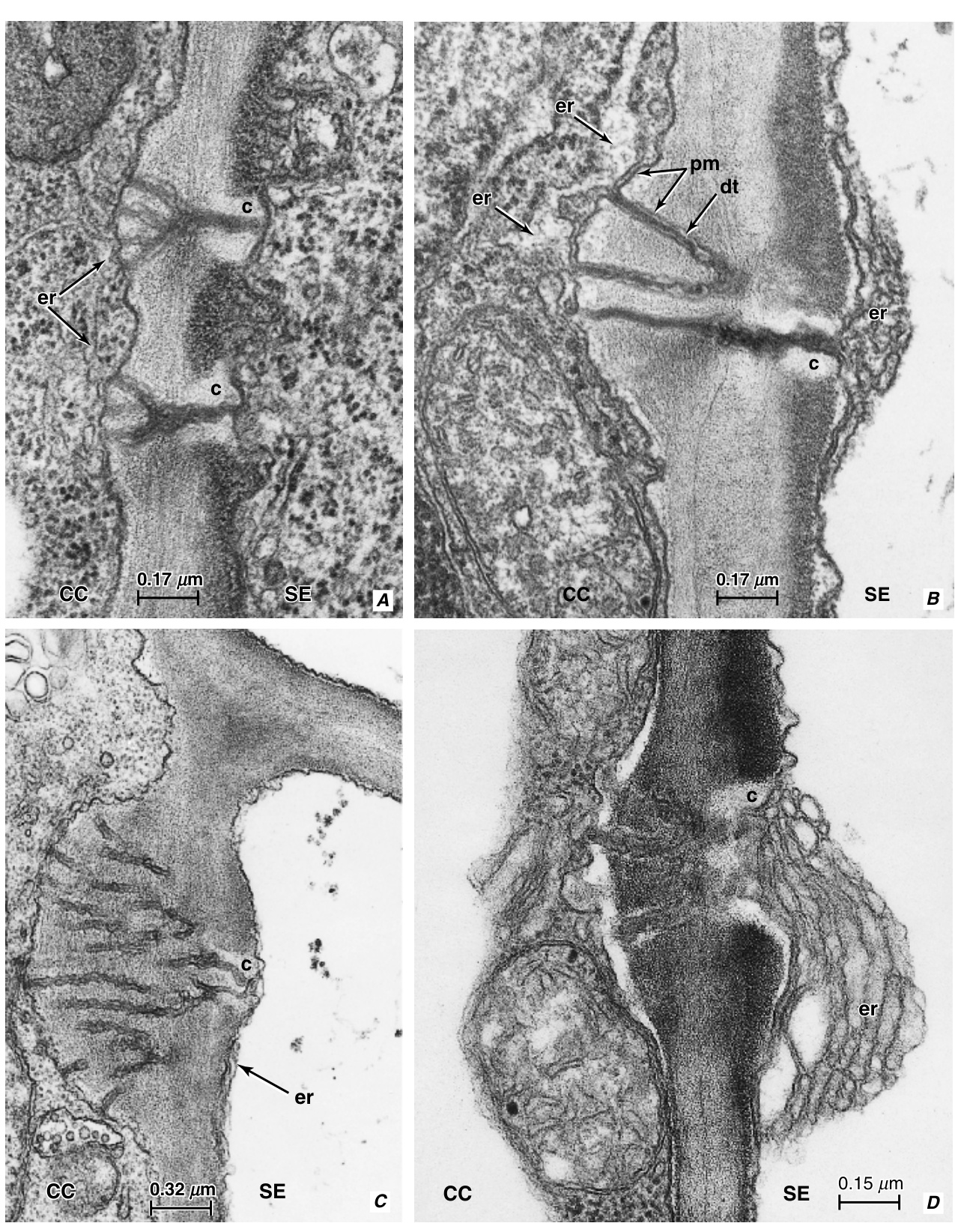
图13.22 孔-胞间连丝连接的纵切面。A,未成熟和B,成熟的连接在棉花(Gossypium hirsutum)节间筛管分子-伴胞壁中。注意伴胞侧壁上的分支胞间连丝。A,在发育过程中,胼胝质沉积仅限于筛管分子侧壁上的胞间连丝(未来孔)。B,在这个成熟的筛管分子中,孔被(推测为)创伤胼胝质部分收缩。C,棉白杨(Populus deltoides)叶小叶脉中筛管分子-伴胞壁增厚部分的孔-胞间连丝连接。胞间连丝在伴胞壁中高度分支。D,大麦(Hordeum vulgare)叶脉中筛管分子和伴胞之间共同壁中的孔-胞间连丝连接。内质网的聚集体与筛管分子侧的孔相关。细节:c,胼胝质;CC,伴胞;dt,连丝小管;er,内质网;pm,质膜;SE,筛管分子。
由于成熟的筛管分子(sieve-tube element)在成熟时缺乏细胞核和核糖体,长期以来人们一直认为这些筛管分子依赖伴胞(companion cell)来维持其生命活动,维持其生存所需的信息分子、蛋白质和ATP通过筛管-伴胞壁上的孔-胞间连丝连接(一些研究者称之为"孔-胞间连丝单位(pore-plasmodesma units)"; van Bel et al., 2002)输送到筛管分子中。这两种细胞同时停止功能并死亡的事实进一步支持了它们之间的相互依赖性。显然,伴胞是筛管分子的生命支持系统。
用荧光标记探针显微注射伴胞或筛管的研究表明,成熟筛管-伴胞复合体中胞间连丝(plasmodesmata)的大小排阻限相对较大,在10到40 kDa之间,并且伴胞和筛管分子之间的物质运动是双向的(Kempers and van Bel, 1997)。大量证据表明,在伴胞中合成的蛋白质在伴胞和筛管分子之间循环(Thompson, 1999),表达绿色荧光蛋白(GFP)的转基因植物(推测GFP在伴胞中合成)已经证明GFP通过同化物流(assimilate stream)在整个植物中运动(Imlau et al., 1999)。在韧皮部渗出液或筛管汁液中存在的约200种内源性可溶性蛋白质中,只有少数被鉴定出来。其中包括泛素(ubiquitin)和分子伴侣(chaperones),它们与成熟筛管分子中的蛋白质周转有关(Schobert et al., 1995)。虽然一些韧皮部蛋白质可能作为长距离信号分子,但许多可能参与维持筛管分子的功能。
❙ 被子植物韧皮部运输的机制
最初由Ernst Münch(1930)提出并由其他人修改(见下文;Crafts and Crisp, 1971; Eschrich et al., 1972; Young et al., 1973; van Bel, 1993),渗透产生的压力流机制(pressure-flow mechanism)被广泛接受用于解释同化物通过被子植物筛管在源(source)和库(sink)之间的流动。同化物遵循源-库模式。同化物的主要来源(净输出者)是进行光合作用的叶片,尽管贮藏组织也可能是重要的来源。所有无法满足自身营养需求的植物部分都可能充当库(同化物的净输入者),包括分生组织、地下部分(如根、块茎、根状茎)、果实、种子以及皮层、髓、木质部和韧皮部的大多数薄壁细胞。
简单来说,渗透压驱动的压力流动机制(pressure-flow mechanism)如下运作(图13.23)。在源端(source)进入筛管(sieve tube)的糖分导致该处溶质浓度增加。随着溶质浓度的增加,水势(water potential)降低,水分通过渗透作用从木质部进入筛管。在库端(sink)移除糖分则产生相反的效果。那里的溶质浓度下降,水势增加,水分离开筛管。随着水分在源端进入筛管并在库端流出,糖分子被水被动地沿着浓度梯度通过体积或质量流动在源端和库端之间运输(Eschrich et al., 1972)。
在最初的Minch压力流动模型中,筛管被视为不可渗透的导管。实际上,源端和库端之间的筛管被选择性渗透膜(selectively permeable membrane)——质膜(plasma membrane)所包围,不仅在源端和库端,而且在整个运输路径上都是如此(Eschrich et al., 1972; Phillips and Dungan, 1993)。选择性渗透膜的存在对于渗透作用(osmosis)——这一机制的驱动力——至关重要;因此需要一个活的导管。就渗透压驱动的压力流动机制而言,质膜是细胞中最重要的组成部分。水分通过渗透作用沿着整个筛管长度进入和离开筛管。几乎没有最初在源端进入筛管的水分子能够到达库端,因为它们与从韧皮部质外体(phloem apoplast)进入筛管的其他水分子在运输路径上进行了交换(Eschrich et al., 1972)。
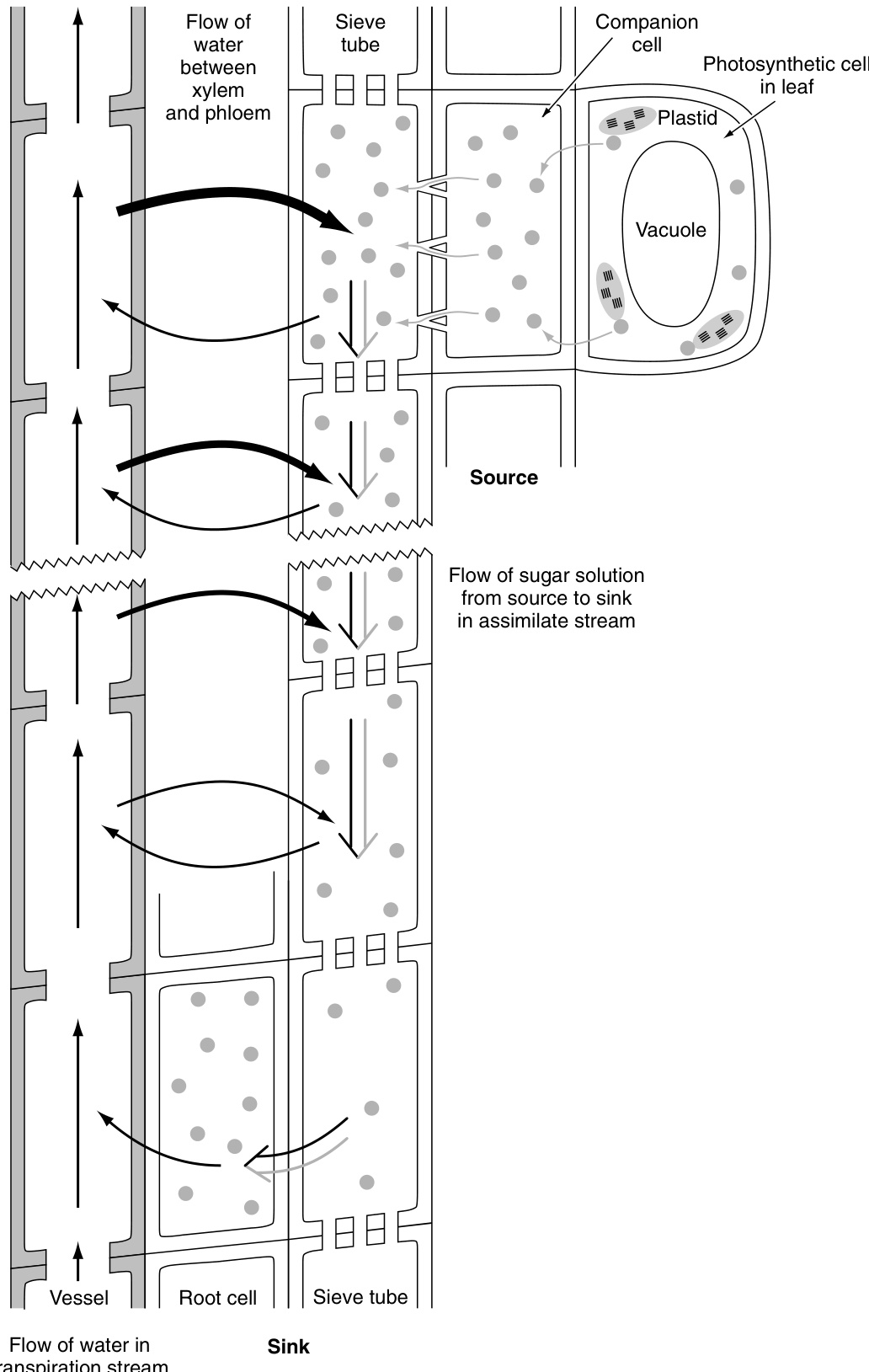
图13.23 渗透压驱动的压力流动机制示意图。点代表源自叶片光合作用细胞(源端)的糖分子。糖通过伴胞(companion cells)在源端被装载到筛管中。随着糖浓度的增加,水势降低,水分通过渗透作用进入筛管。糖在库端被移除(卸载),糖浓度下降;结果水势增加,水分离开筛管。随着水分在源端进入筛管并在库端流出,糖分子被水被动地沿着源端和库端之间的浓度梯度运输。水分在从源端到库端的整个路径上进入和离开筛管。证据表明,几乎没有最初在源端进入筛管的水分子能够到达库端,因为它们与从韧皮部质外体进入筛管的其他水分子在运输路径上进行了交换。(根据Raven et al., 2005)
Phillips and Dungan, 1993)。在库端离开筛管的水分在木质部中循环(Köckenberger et al., 1997)。在整个运输路径上,源自叶片的光合产物(photoassimilates)被移除以维持成熟组织并供应生长组织(如维管形成层及其直接衍生物)的需求。此外,大量的光合产物通常会在运输路径上从筛管中逸出或泄漏(Hayes et al., 1987; Minchin and Thorpe, 1987)。
韧皮部在植物体内分配光合产物(photoassimilates)的功能依赖于筛管分子(sieve-tube elements)与其伴胞(companion cells)之间的协作(van Bel, 1996; Schulz, 1998; Oparka and Turgeon, 1999)。这种协作的性质部分体现在筛管和伴胞沿运输路径的相对大小上。在源叶(source leaves)小叶脉(minor veins)的收集韧皮部(collection phloem)中(小叶脉嵌入叶肉组织(mesophyll tissue)或光合作用基本组织(photosynthetic ground tissue)中),伴胞通常比其筛管分子大(图13.24-13.26; Evert, 1977, 1990b)。这种大小差异被认为是伴胞在收集或吸收(逆浓度梯度)光合产物中发挥积极作用的反映,然后这些光合产物通过筛管-伴胞壁中的孔-胞间连丝(pore-plasmodesmata)连接转移到筛管分子中。这个主动过程称为韧皮部装载(phloem loading)(见下文)。
在终端库(terminal sinks)的释放韧皮部(release phloem)中,伴胞的大小大大减小或完全消失(Offler and Patrick, 1984; Warmbrodt, 1985a, b; Hayes et al., 1985)。在大多数库组织(sink tissues)(如发育中的根和叶)中,卸载( unloading)是通过共质体(symplastically)进行的。实际的卸载过程可能是被动的,不需要伴胞消耗能量。然而,进入库组织的运输,称为韧皮部后运输(postphloem transport)或筛管后运输(post-sieve-tube transport)(Fisher, D. B., and Oparka, 1996; Patrick, 1997),依赖于代谢能量。在共质体卸载者(symplastic unloaders)中,需要能量来维持筛管-伴胞复合体与库细胞之间的浓度梯度。在质外体卸载者(apoplastic unloaders)中,需要能量将糖积累到库细胞中的高浓度,如甜菜根和甘蔗茎中的库细胞,尽管成熟甘蔗节间中的质外体卸载受到质疑(Jacobsen et al., 1992)。在马铃薯中,发现蔗糖的质外体卸载在经历广泛生长的匍匐茎中占主导地位;然而,在块茎化的第一个可见迹象期间,发生了从质外体到共质体卸载的转变(Viola et al., 2001; 另见Kühn et al., 2003)。
在运输韧皮部(transport phloem)中,筛管的横截面积大于收集和释放韧皮部中的筛管,而伴胞在收集和释放韧皮部之间的大小介于中间或完全缺失(图13.1B和13.14B,C)。运输韧皮部具有双重任务。一是将光合产物输送到终端库。这需要保留足够的光合产物以维持压力流。如前所述,光合产物从筛管中泄漏是运输韧皮部或源库之间路径上的常见现象。据信,伴胞参与了泄漏光合产物的回收。运输韧皮部中光合产物的保留通过筛管-伴胞复合体的近乎共质体隔离得到增强(van Bel和van Rijen,1994;van Bel,1996)。运输韧皮部的第二个任务是为沿路径的异养组织提供营养,包括轴向库如形成层组织。
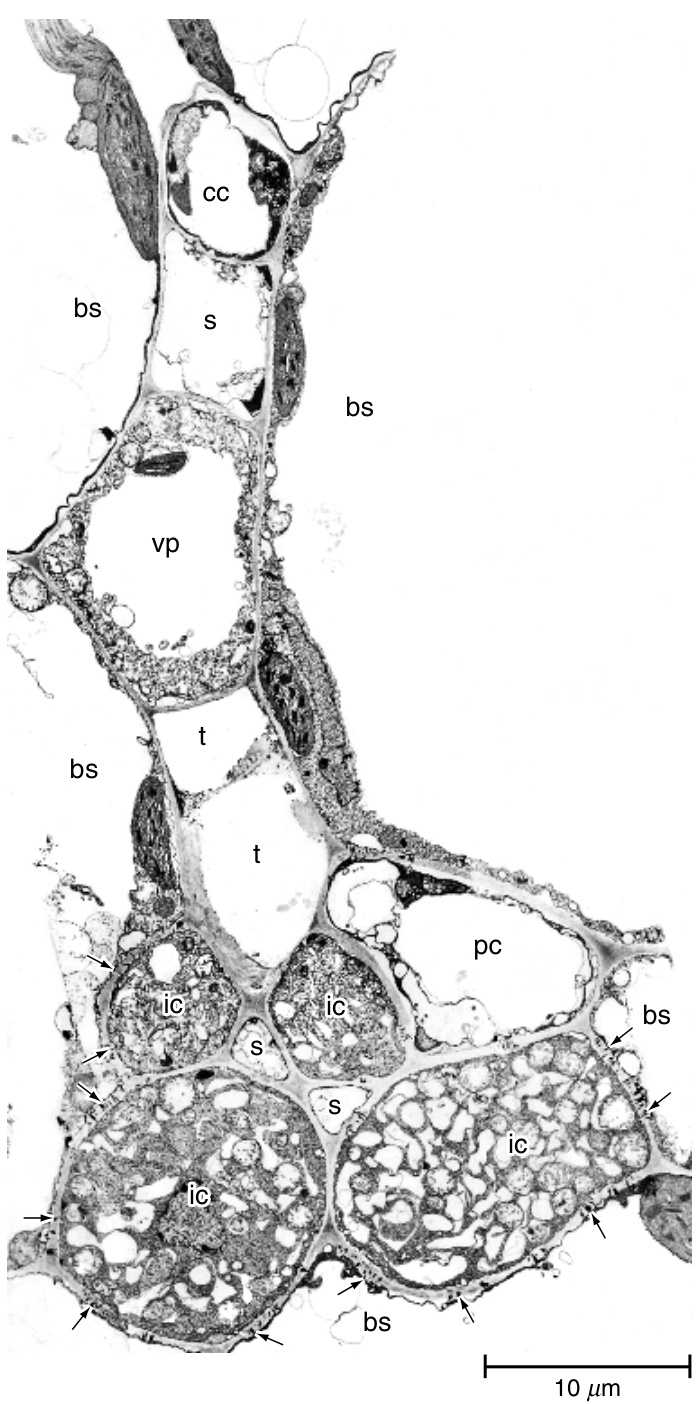
图13.24
Cucumis melo叶小叶脉的横切面。在这个切面中,远轴(下部)韧皮部包含两个小的筛管(s),由四个中间细胞(ic)和一个薄壁细胞(pc)包围。近轴韧皮部由一个筛管(s)和一个伴胞(cc)组成。注意中间细胞和束鞘细胞(bs)之间共同壁中的众多胞间连丝(箭头)。这是一个1型小叶脉,一个共质体装载者。其他细节:t,管状分子;vp,维管薄壁细胞。(来自Schmitz et al., 1987, 图1. \copyright 1987, Springer-Verlag.)
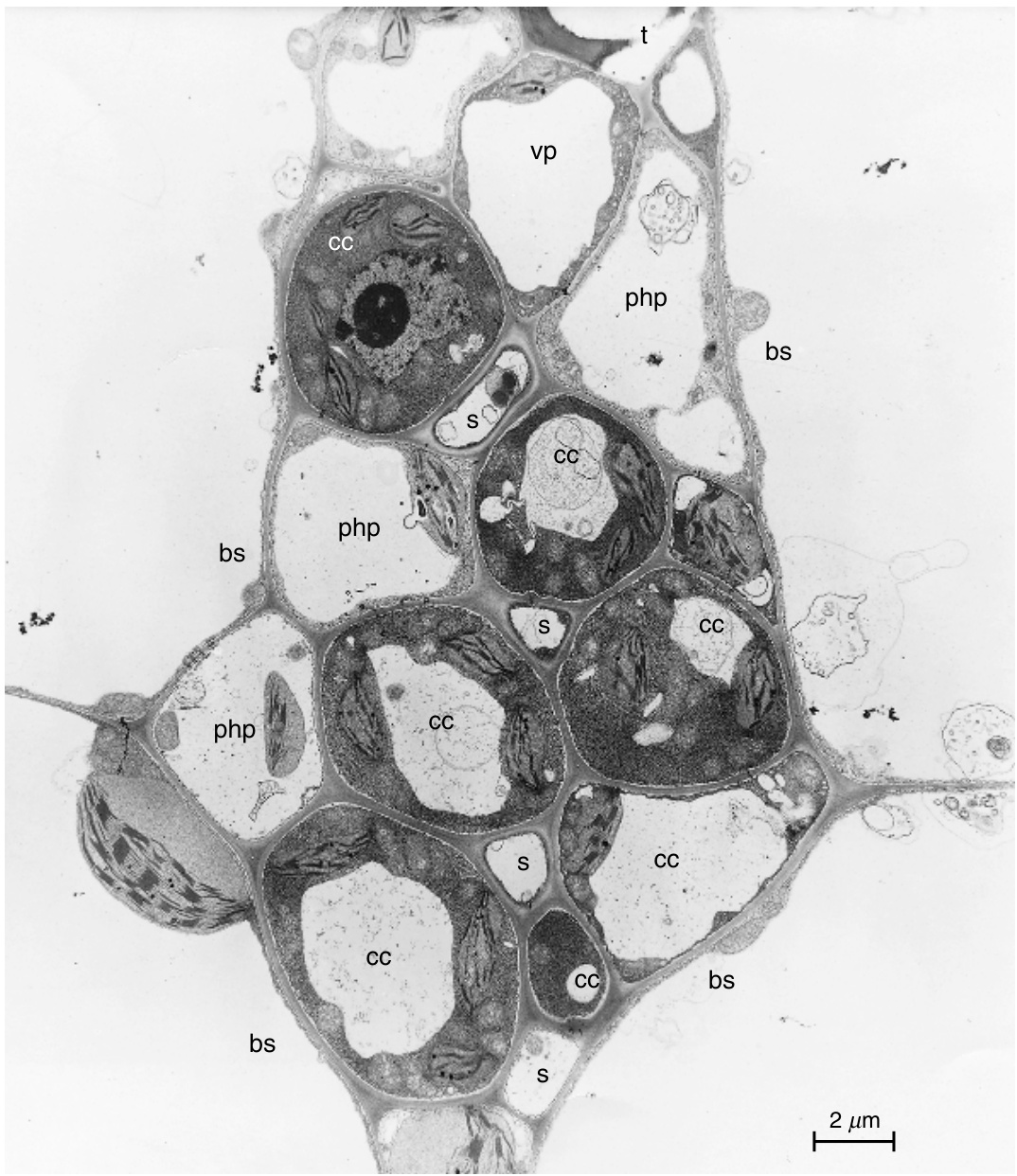
图13.25
甜菜(Beta vulgaris)叶片小脉部分的横切面。在这个切面中,脉包含四个筛管(s)和七个“普通”伴胞(cc),即没有壁内生长的伴胞。这是一个2a型小脉,属于质外体韧皮部装载类型。其他细节:bs,束鞘细胞;php,韧皮部薄壁细胞;t,管状分子;vp,维管薄壁细胞。(来自Evert和Mierzwa,1986年。)
❙ 源叶和小脉韧皮部
如前所述,成熟的光合叶片是植物的主要源。在除单子叶植物外的大多数被子植物中,叶片的维管束或脉以分支模式排列,较小的脉从较大的脉中分支出来。
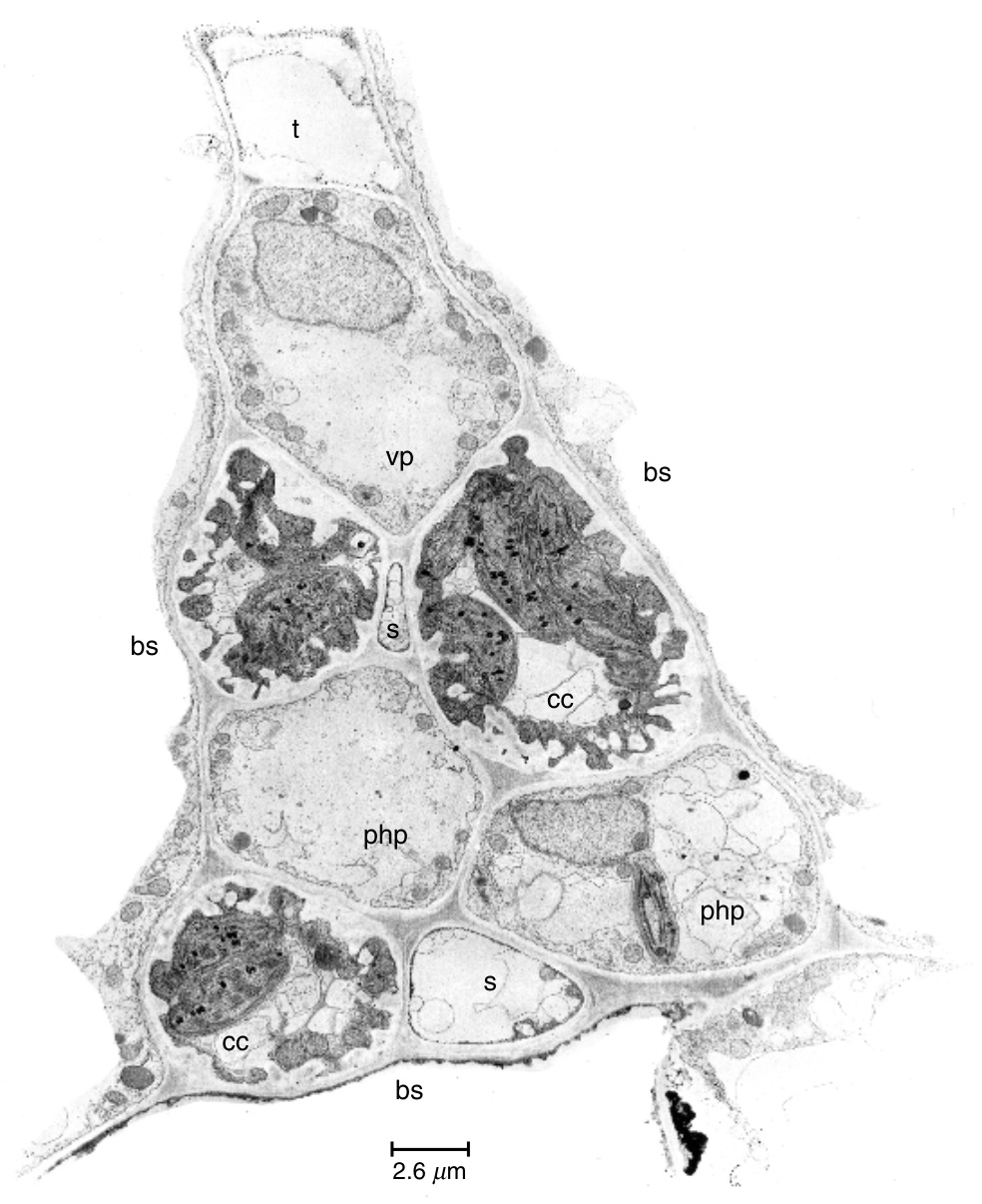
图13.26
万寿菊(Tagetes patula)叶片小脉部分的横切面。在这个切面中,脉包含两个筛管(s)和三个具有壁内生长的伴胞(cc),即伴胞是传递细胞或A型细胞(Pate和Gunning,1969)。这是一个2b型小脉,属于质外体韧皮部装载类型。其他细节:bs,束鞘细胞;php,韧皮部薄壁细胞;t,管状分子;vp,维管薄壁细胞。
这种脉排列类型被称为网状脉序。通常,最大的脉沿着叶片的长轴延伸为中脉。中脉及其空间相关的基本组织组成了所谓的中肋。从中脉分支出来的其他较小的脉通常也与肋组织相关。所有与肋相关的脉(最常见于叶片下侧的突起)被称为主脉。叶片中或多或少嵌入叶肉组织且不与肋相关的小脉被称为小脉。小脉完全由紧密排列的细胞组成的束鞘包围。在双子叶植物叶片中,束鞘细胞通常是薄壁细胞,可能含有或不含有叶绿体。木质部通常位于脉的上侧,韧皮部位于下侧(图13.25和13.26)。
小叶脉在光合产物(photoassimilate)的收集过程中起主要作用。在光合产物被小叶脉的筛管-伴胞复合体(sieve tube–companion cell complexes)吸收之前,由叶肉细胞(mesophyll cells)光合作用产生并准备从叶片输出的光合产物必须首先穿过包围叶脉的束鞘(bundle sheaths)。从小叶脉的筛管中,溶解在筛管液(sieve-tube sap)中的光合产物流入逐渐变大的叶脉,最终进入主要叶脉——运输叶脉(transport veins)——以便从叶片输出。因此,叶片的同化物流(assimilate stream)类似于分水岭(watershed),小溪流汇入逐渐变大的河流。
双子叶植物叶片中存在几种类型的小叶脉
"双子叶植物"(dicotyledonous)(包括木兰类植物(magnoliids)和真双子叶植物(eudicots))叶片的小叶脉在其结构以及筛管-伴胞复合体与叶片其他细胞类型之间的共质体连续性(symplastic continuity)程度上存在差异。在一些植物中,束鞘细胞(bundle-sheath cells)和伴胞(companion cells)之间的胞间连丝(plasmodesmata)数量丰富或适中,而在其他植物中,该界面的胞间连丝很少(Gamalei, 1989, 1991)。在此基础上,已经识别出两种主要类型的小叶脉(Gamalei, 1991)。那些在束鞘-伴胞界面具有丰富胞间连丝的叶脉(每\upmum^2界面\bf\left(>10\right)个胞间连丝)被称为1型,而在该界面具有少量胞间连丝的叶脉被称为2型。1型小叶脉也被称为开放型(open),2型被称为闭合型(closed)。束鞘细胞和伴胞之间具有适中胞间连丝接触的叶脉(每\upmum^2界面_<10个胞间连丝)介于1型和2型之间,被称为1-2a型。(拟南芥(Arabidopsis thaliana)是一种1-2a型物种; Haritatos et al., 2000。)2型又分为两个亚类:2a型,具有零星胞间连丝接触(每\upmum^2界面<1个胞间连丝),和2b型,几乎没有胞间连丝接触(每\upmum^2界面\bf(<0.1个胞间连丝)。因此,1型和2b型之间在束鞘-伴胞界面的胞间连丝频率跨度约为三个数量级。
由于不同物种小叶脉束鞘-伴胞界面的胞间连丝频率存在很大差异,因此产生了两种韧皮部装载(phloem loading)机制的概念,即共质体(symplastic)和质外体(apoplastic)装载(van Bel, 1993)。1型物种,其小叶脉伴胞与束鞘之间具有丰富的胞间连丝,被认为是共质体装载者(symplastic loaders),而2型物种,由于缺乏这种连接,被认为是质外体装载者(apoplastic loaders)(Gamalei, 1989, 1991, 2000; van Bel, 1993; Grusak et al., 1996; Turgeon, 1996)。
尽管质外体装载的机制早已被理解(见下文),但对于涉及通过胞间连丝主动运输(active transport)的共质体装载的解释仍然缺乏。正如Turgeon和Medville(2004)所指出的,"通过胞间连丝主动运输小分子是未知的,而逆浓度梯度(diffusion against a concentration gradient)扩散是不可能的。"
具有特殊伴胞(称为中介细胞(intermediary cells))的1型物种是共质体装载者
一些类型1物种的细脉特征在于存在称为中间细胞(intermediary cells)的特化伴胞(图13.24)。通常这些细胞特别大,具有密集的细胞质,含有广泛的内质网(ER)迷宫、众多小液泡、原始质体(plastids),以及从束鞘细胞(bundle-sheath cells)延伸而来的高度分支的胞间连丝(plasmodesmata)区域(Turgeon等,1993)。迄今为止,仅鉴定出八个具有“真正”中间细胞的科:爵床科(Acanthaceae)、卫矛科(Celastraceae)、葫芦科(Cucurbitaceae)、绣球科(Hydrangaceae)、唇形科(Lamiaceae)、木犀科(Oleaceae)、玄参科(Scrophulariaceae)和马鞭草科(Verbenaceae)(参见Turgeon和Medville,1998,以及Turgeon等,2001的参考文献)。
中间细胞的存在总是与大量棉子糖(raffinose)和水苏糖(stachyose)的运输相关,此外还包括一些蔗糖(sucrose)(Turgeon等,1993)。具有中间细胞的物种被认为是共质体装载者(symplastic loaders)(Turgeon,1996;Beebe和Russin,1999),并且已经提出了一种聚合物陷阱机制(polymer trap mechanism)来解释涉及中间细胞的韧皮部装载(phloem loading)(Turgeon,1991;Haritatos等,1996)。简而言之,叶肉细胞中合成的蔗糖通过胞间连丝从叶肉细胞扩散到束鞘细胞,并进入中间细胞。在中间细胞中,棉子糖和水苏糖由蔗糖合成,从而维持叶肉细胞和中间细胞之间的扩散梯度。棉子糖和水苏糖分子太大,无法通过胞间连丝扩散回束鞘细胞,因此它们在中间细胞中积累到高浓度。从中间细胞中,棉子糖和水苏糖通过它们共同壁上的孔-胞间连丝连接扩散到筛管中,并通过质量流动在同化物流中被带走。
关于缺乏中间细胞的类型1物种的数据有限。已研究的少数此类物种是质外体装载者(apoplastic loaders)。这些包括鹅掌楸(Liriodendron tulipifera)(木兰科(Magnoliaceae))(Goggin等,2001)、日本山柳(Cletbra barbinervis)和枫香树(Liquidambar struraciflua)(均为金缕梅科(Altingiaceae))(Turgeon和Medville,2004)。这三种物种几乎只运输蔗糖。显然,仅凭胞间连丝频率不能用作韧皮部装载策略的指标。这些研究的结果使Turgeon和Medville(2004)提出,共质体装载可能仅限于运输聚合物(如大量棉子糖家族寡糖)的物种,而其他物种,无论其细脉胞间连丝数量如何,可能通过质外体装载。
具有类型2细脉的物种是质外体装载者
如前所述,质外体装载(apoplastic loading)的机制已经得到充分证实。蔗糖是质外体装载者的主要运输糖类。蔗糖分子的质外体装载涉及蔗糖-质子共转运(sucrose-proton cotransport),这一过程由质膜ATPase提供能量,并由位于质膜上的蔗糖转运蛋白(sucrose transporter)介导(Lalonde et al., 2003)。在马铃薯、番茄和烟草中,叶片蔗糖转运蛋白(SUT1)定位于筛管分子(sieve element)的质膜,而不是伴胞(companion cell)的质膜(Kühn et al., 1999),而在拟南芥(Arabidopsis)(Stadler and Sauer, 1996; Gottwald et al., 2000)和车前草(Plantago major)(Stadler et al., 1995)中,蔗糖转运蛋白(SUC2)特异性地在伴胞中表达。拟南芥伴胞中也定位有质膜H^+-ATPase(DeWitt and Sussman, 1995)。蔗糖转运蛋白定位的差异可能表明,在某些质外体装载者中,蔗糖的摄取是通过筛管分子质膜进行的,而在另一些中则是通过伴胞的质膜进行的。因此,与那些通过能量在中间细胞(intermediary cells)中合成棉子糖(raffinose)和水苏糖(stachyose)来浓缩糖类的1型物种不同,2型物种利用能量通过质膜上的蔗糖-质子共转运来浓缩糖类。
2a型小叶脉的伴胞具有光滑的壁,通常被称为普通伴胞(ordinary companion cells)(图13.25)。2b型小叶脉的伴胞具有壁内生长(wall ingrowths),因此它们是传递细胞(transfer cells)(图13.26)。
在某些物种中,小叶脉韧皮部中存在两种类型的传递细胞。被命名为A型和B型(Pate and Gunning, 1969),前者是伴胞,后者是韧皮部薄壁细胞(phloem parenchyma cells)。在小叶脉中可能存在A细胞、B细胞或两者(图7.5),这取决于物种。
拟南芥(Arabidopsis thaliana)是一种1-2a型物种,其小叶脉具有B型细胞和普通伴胞(Haritatos et al., 2000)。Haritatos等人(2000)注意到B型细胞与束鞘细胞(bundle-sheath cells)和伴胞都有大量接触,他们认为拟南芥小叶脉中蔗糖运输的最可能途径是从束鞘通过胞间连丝(plasmodesmata)进入韧皮部薄壁细胞(B型细胞),然后通过质膜跨壁内生长区域外排到质外体,并通过载体介导的摄取进入筛管分子-伴胞复合体。
某些叶片中小叶脉对光合产物的收集可能不涉及主动步骤
在某些植物中,蔗糖进入小叶脉筛管-伴胞复合体的机制似乎不涉及主动步骤,也就是说,不涉及韧皮部装载(phloem loading)本身。这些植物具有开放的小叶脉,运输大量的蔗糖,而只运输少量的棉子糖(raffinose)和水苏糖(stachyose)。柳树(Salix babylonica; Turgeon and Medville, 1998)和三角杨(Populus deltoides; Russin and Evert, 1985)是这类植物的代表。根据Gamalei (1989)的分类,两者都属于1型植物。在柳树和三角杨中,没有发现蔗糖在小叶脉韧皮部中逆浓度梯度积累的证据。显然,蔗糖是沿着浓度梯度从叶肉细胞通过共质体(symplastically)扩散到小叶脉的筛管-伴胞复合体中的(Turgeon and Medville, 1998)。缺乏装载步骤与Münch (1930)的韧皮部运输模型相符。Münch认为叶肉细胞的叶绿体是浓度梯度的“源”,并推测一旦糖进入小叶脉的筛管,它就会被溶液的集体流动带走,这大概是因为茎部筛管中的静水压力低于叶片筛管中的静水压力。
一些小叶脉含有不止一种伴胞
到目前为止,我们关于小叶脉的讨论将它们归入了明确的类别,每个类别都以特定类型的伴胞为特征。然而,在某些物种中,小叶脉含有不止一种类型的伴胞。例如,在葫芦科(Cucurbitaceae)的小叶脉中发现了中间细胞(intermediary cells)和普通伴胞(ordinary companion cells)(图13.24; Cucurbita pepo, Turgeon et al., 1975; Cucumis melo, Schmitz et al., 1987),Coleus blumei (Fisher, D. G., 1986)和Euonymus fortunei (Turgeon et al., 2001)中也是如此。这种伴胞类型的组合也在几种玄参科(Scrophulariaceae)植物中发现(Alonsoc meridonalis, Knop et al., 2001; 以及Alonsoc warscewiczii, Mimulus cardinalis, Verbascum chaixi, Turgeon et al., 1993)。一些玄参科植物的小叶脉含有中间细胞和传递细胞(transfer cells)(Nemesia strumosa, Rhodochiton atrosanguineum, Turgeon et al., 1993),而另一些则含有修饰的中间细胞和传递细胞(Ascarina spp., Turgeon et al., 1993; Knop et al., 2001)。在Ascarina scandens中,一些修饰的中间细胞甚至有一些壁内生长(wall ingrowths)(Turgeon et al., 1993)。小叶脉中存在不止一种类型的伴胞表明,在某些植物的单个叶脉中可能运行着不止一种韧皮部装载机制(Knop et al., 2004)。
禾本科(Poaceae)植物叶片中的小叶脉含有两种类型的后生韧皮部筛管
禾草叶片的维管系统(vascular system)与“双子叶植物(dicotyledonous)”叶片的网状排列不同,由纵向束和横向束相互连接组成。这种脉序被称为条纹状(striate)或平行(parallel)脉序。在叶片的任何横切面中,根据大小、木质部和韧皮部的组成以及相邻组织的性质,可以识别出三种类型的纵向维管束——大、中、小(Colbert和Evert,1982;Russell和Evert,1985;Dannenhoffer等,1990)。尽管所有纵向束都能够将光合产物(photoassimilate)沿叶片向下运输一定距离,但主要是大束参与纵向运输和从叶片输出光合产物。另一方面,小束主要参与韧皮部装载(phloem loading)和光合产物的收集。收集在小束中的光合产物(这些束不延伸到叶鞘中)通过横向脉横向转移到较大的束中,以便从叶片输出(Fritz等,1983,1989)。在叶片中,中束也参与光合产物的收集;因此,中束和小束都可以被视为小脉(minor veins)。
小脉的后生韧皮部(metaphloem)包含两种筛管(sieve tube),薄壁和厚壁(图13.27;Kuo和O'Brien,1974;Miyake和Maeda,1976;Evert等,1978;Colbert和Evert,1982;Eleftheriou,1990;Botha,1992;Evert等,1996b)。比它们壁的相对厚度更重要的是,薄壁筛管是最先形成的,与伴胞(companion cell)相关联。厚壁筛管是最后成熟的维管元素,缺乏伴胞。
在成熟的玉米(Evert等,1978)和甘蔗(Robinson-Beers和Evert,1991)叶片中,薄壁筛管及其伴胞——筛管-伴胞复合体(sieve tube–companion cell complexes)——几乎与叶片的其余部分在共质体(symplast)上隔离。厚壁筛管缺乏伴胞,但与木质部导管元素相邻的维管薄壁细胞(vascular parenchyma cells)在共质体上连接。对玉米叶片的显微放射自显影研究(microautoradiographic studies)表明,薄壁筛管本身能够从质外体(apoplast)积累光合产物,而厚壁筛管则参与由导管周围的维管薄壁细胞转移给它们的蔗糖的回收(Fritz等,1983)。
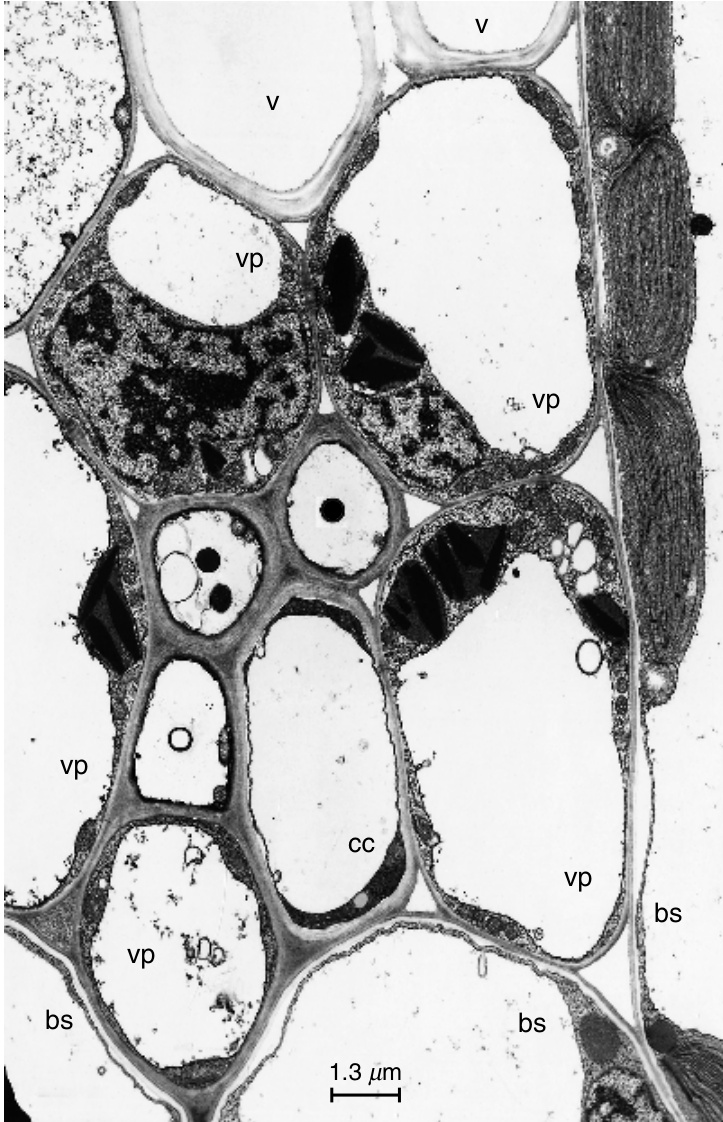
图13.27
玉米(Zea mays)叶片中小维管束的横切面。这个小束包含一个薄壁筛管(空心点)及其相关的伴胞(cc)和两个厚壁筛管(实心点),它们通过维管薄壁细胞(vp)与导管(v)分离。束被束鞘(bs)包围。(来自Evert等,1996a。© 1996 by The University of Chicago。版权所有。)
❙ 裸子植物的筛胞
筛胞(sieve cells)通常是显著伸长的细胞(在针叶树的次生韧皮部中,长度为1.5至5mm),其末端壁逐渐变细,不易与侧壁区分(图13.4A)。筛域(sieve areas)在筛胞重叠的末端较多,但其分化程度与侧壁的筛域基本相同。换句话说,与筛管分子(sieve-tube elements)不同,筛胞缺乏筛板(sieve plates)。此外,与筛管分子的开放筛孔不同,筛胞的筛孔被许多管状内质网的结构穿过。此外,筛管分子通常含有P蛋白(P-protein),而筛胞在其发育的所有阶段都缺乏P蛋白。筛胞也缺乏伴胞(companion cells),但在功能上与Strasburger细胞或albuminous细胞(图13.28)相关联,这些细胞类似于伴胞。Strasburger细胞很少在个体发育上与其相关的筛胞有联系。
关于筛胞的大部分信息来自对针叶树次生韧皮部的研究。然而,在大多数方面,其他裸子植物筛胞的发育和结构与针叶树筛胞相似(Behnke, 1990; Schulz, 1990)。
筛胞的壁被定性为初生壁
筛胞壁的厚度存在相当大的变化。除了松科(Pinaceae)外,裸子植物筛胞的壁被定性为初生壁(primary walls)。在松科次生韧皮部的筛胞中,壁较厚,并被认为具有次生加厚(secondary thickening)(Abbe and Crafts, 1939)。这种加厚具有层状外观(图13.29),但不覆盖筛域,而是在其周围形成边界。在其他裸子植物分类群的筛胞中尚未记录到明显的次生壁。
胼胝质在裸子植物筛孔发育中不起作用
裸子植物的筛域由被许多胞间连丝(plasmodesmata)穿过的壁部分发育而成。与被子植物筛孔发育不同,裸子植物的筛孔发育既不涉及小的内质网池( cisternae),也不涉及胼胝质片(callose platelets)(Evert et al., 1973b; Neuberger and Evert, 1975, 1976; Cresson and Evert, 1994)。
在孔形成之前,壁材料的选择性沉积,与发生在初生壁上的积累相似,导致筛域壁的加厚。在筛管细胞分化的早期,中胶层区域出现与胞间连丝相关的中央腔。随着筛域分化的进行,中央腔逐渐增大并合并形成单个大(复合)中央腔。同时,胞间连丝在其全长范围内或多或少均匀地加宽,并且在发育中的孔对面出现平滑管状内质网的聚集物。这些膜聚集物在筛管细胞的整个生命周期中持续存在于筛域(Neuberger 和 Evert, 1975, 1976; Schulz, 1992)。大量管状内质网穿过由质膜排列的孔和中央腔,将壁两侧的聚集物统一起来(图 13.30)。注意,与被子植物的筛孔不同,被子植物的筛孔在共同壁上是连续的,而裸子植物的筛孔仅延伸到中央腔的一半。传导筛管的孔可能被胼胝质覆盖,也可能不被覆盖,如果存在,则可能是创伤胼胝质。典型的最终胼胝质通常在衰老筛管细胞的筛域积累。它在筛管细胞死亡后最终消失。
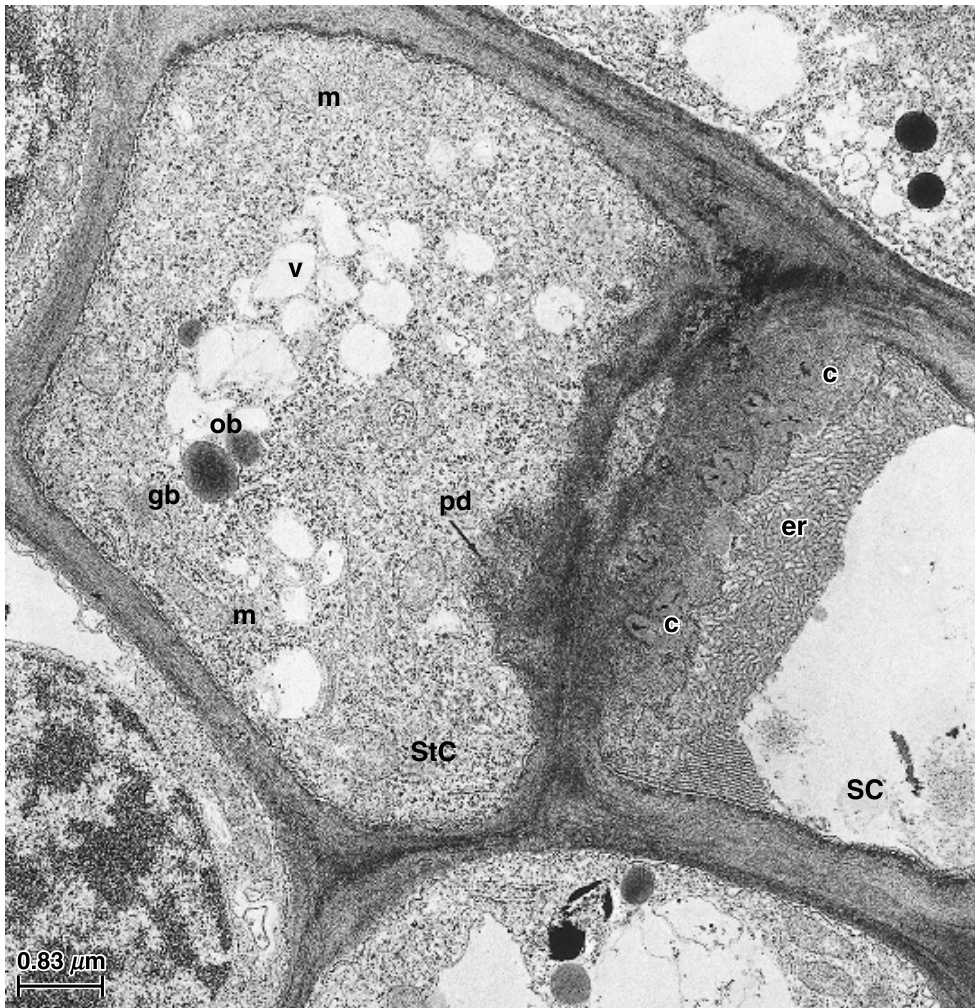
图13.28
横切面显示Pinus resinosa下胚轴中Strasburger细胞(StC)与成熟筛胞(SC)之间的连接。胞间连丝(pd)出现在Strasburger细胞侧的壁上,而孔出现在筛胞侧。孔被胼胝质(c)堵塞,并被大量内质网(er)的聚集体包围。其他细节:gb,高尔基体;m,线粒体;ob,油体。(来自Neuberger and Evert, 1975。)
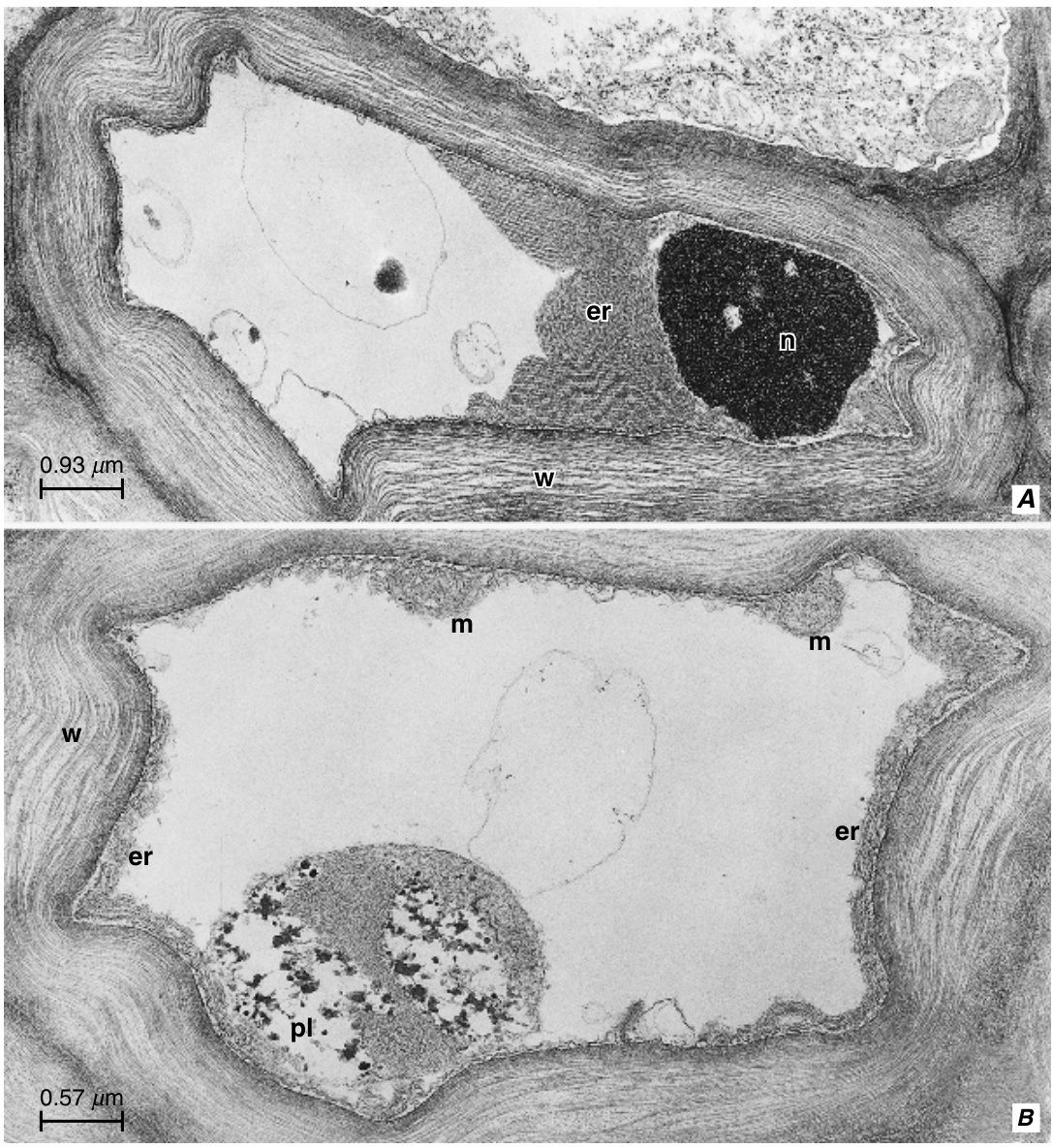
图13.29
Pinus resinosa 下胚轴成熟筛管细胞的横切面。A 显示了被大量内质网 (, er) 包围的坏死细胞核 (n)。B 展示了成熟筛管细胞的典型细胞组分分布,包括内质网 (, er)、线粒体 (m) 和质体 (plastids, pl)。注意壁 (w) 的层状外观。(引自 Neuberger 和 Evert, 1974。)
裸子植物筛管细胞分化中的变异很小
与幼嫩的筛管分子一样,幼嫩的筛管细胞包含所有幼嫩细胞的特征组分。
图 13.30
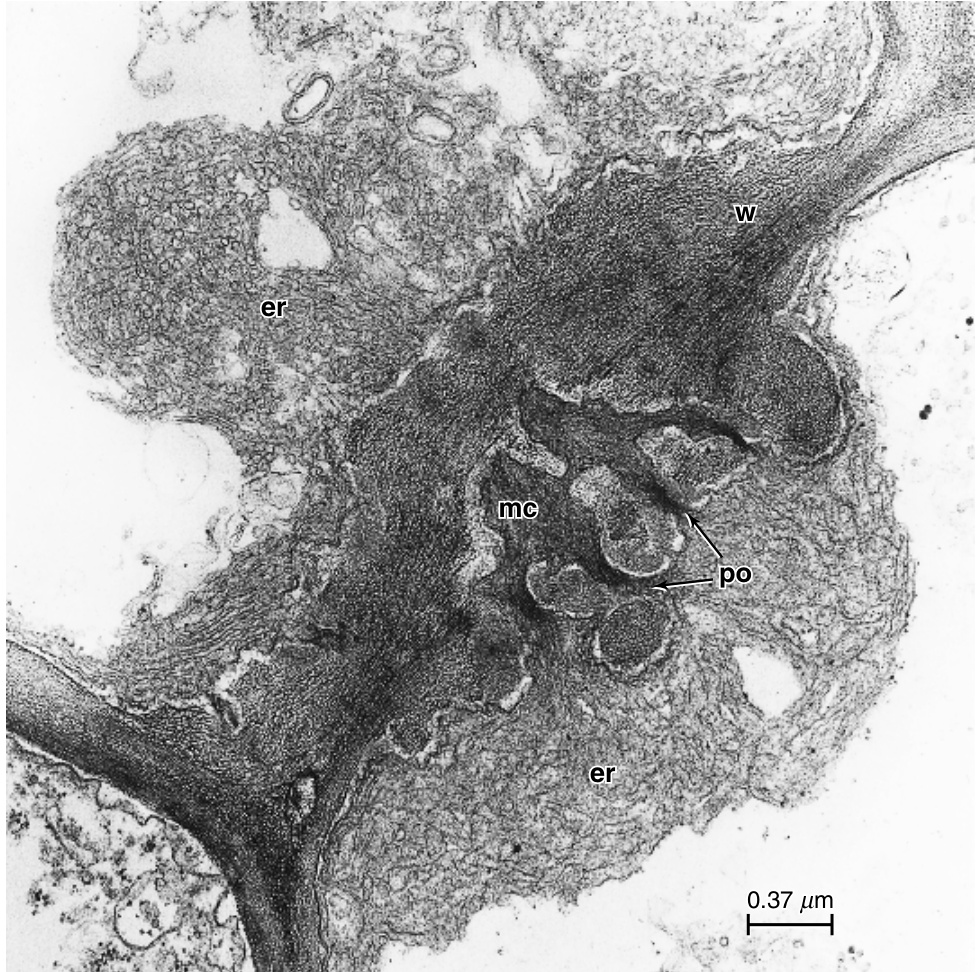
Pinus resinosa 下胚轴成熟筛管细胞之间壁 (w) 中筛域的斜切面。大量管状内质网 (er) 聚集在筛域的两侧。可以看到内质网 (er) 穿过孔 (po) 并进入中央腔 (mc),中央腔中含有大量内质网。(引自 Neuberger 和 Evert, 1975。)
有核植物细胞。类似地,筛管细胞在成熟过程中经历选择性自噬,导致大多数细胞组分的解体和/或消失,包括细胞核、核糖体、高尔基体、肌动蛋白丝、微管和液泡膜。
筛管细胞分化的第一个可见迹象是壁的增厚(Evert 等, 1973a; Neuberger 和 Evert, 1976; Cresson 和 Evert, 1994)。在原生质组分中,质体最早显示出最显著的变化。这两个特征使人们能够区分非常年轻的筛管细胞及其邻近的薄壁组织细胞。筛管细胞中存在 S 型和 P 型质体。S 型质体存在于除松科以外的所有分类群中,松科仅含有 P 型质体(图 13.29B; Behnke, 1974, 1990; Schulz, 1990)。
筛管细胞中的核退化是固缩的,退化的核通常以电子致密团块的形式存在(图 13.29A),有时核膜的部分仍然完整(Behnke 和 Paliwal)。
1973; Evert 等, 1973a; Neuberger 和 Evert, 1974, 1976)。除了核固缩和质体的改变外,筛胞分化过程中细胞质组分最显著的变化涉及内质网()。幼嫩筛胞的原始粗糙内质网(rough )失去其核糖体,并被整合到一个广泛的新形成的平滑管状内质网(smooth tubular )系统中。如前所述,管状内质网的聚集体在发育中的筛域(sieve areas)对面早期出现,并在成熟细胞的整个生命周期中持续存在。在Pinus (Neuberger 和 Evert, 1975) 和 Ephedra (Cresson 和 Evert, 1994) 中,与筛域相关的聚集体通过壁内质网(parietal )网络纵向相互连接。因此,成熟筛胞的内质网构成了一个广泛的系统,该系统还通过筛域孔(sieve-area pores)和中间腔(median cavities)与邻近筛胞的内质网连续。
❙ STRASBURGER CELLS
裸子植物韧皮部中伴胞(companion cell)的对应物是Strasburger细胞,以Eduard Strasburger命名,他将其称为“Eiweisszellen”或蛋白细胞(albuminous cell)。Strasburger细胞与韧皮部其他薄壁组织成分的主要区别在于其与筛胞的共质体连接(symplastic connections)。这些连接让人联想到筛管分子(sieve-tube elements)和伴胞之间的连接:筛胞一侧的孔和Strasburger细胞一侧的分枝胞间连丝(branched plasmodesmata)(图13.28和13.31)。筛胞-Strasburger细胞连接具有较大的中间腔,其中包含大量平滑管状内质网的组分,这些组分通过孔边缘的管状内质网大聚集体与筛胞一侧的壁内质网网络连续。在Strasburger细胞一侧,内质网的小管与Strasburger细胞壁中胞间连丝的连丝小管(desmotubules)连续。
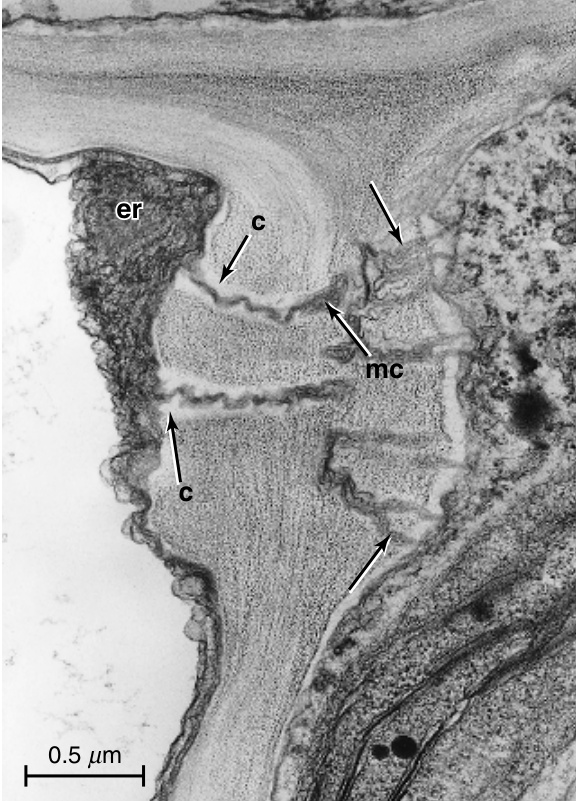
图13.31
Ephedra viridis 幼茎中筛胞(左)和Strasburger细胞(右)之间的孔-胞间连丝连接。箭头指向Strasburger细胞壁中的分枝胞间连丝。胼胝质(callose, c)收缩了孔,掩盖了其内容物,但未延伸到中间腔(mc)。内质网(er)的聚集体与孔相关。(来自Cresson和Evert, 1994。)
与伴胞一样,Strasburger细胞含有大量的线粒体和大量的核糖体(多核糖体, polysome),以及其他具有核的植物细胞特征的细胞组分。如前所述,与伴胞不同,Strasburger细胞很少在个体发育上与其相关的筛胞有关。
Strasburger细胞的作用可能与伴胞(companion cells)类似:维持其相关的筛管(sieve element)的功能。组织化学数据强烈暗示Strasburger细胞在筛管(sieve cells)中物质的长距离运输中发挥作用(Sauter and Braun, 1968, 1972; Sauter, 1974)。当相关的筛管(sieve cells)成熟时,Strasburger细胞中的呼吸作用(Sauter and Braun, 1972; Sauter, 1974)和酸性磷酸酶(Sauter and Braun, 1968, 1972; Sauter, 1974)活性显著增加。在与未成熟筛管(sieve cells)相邻的Strasburger细胞或与筛管(sieve cells)无连接的其他韧皮部薄壁组织(parenchymatous elements)中,未检测到活性增加。当相关的筛管(sieve cells)死亡时,Strasburger细胞也会死亡。
❙ 裸子植物韧皮部运输的机制
裸子植物韧皮部运输的机制仍有待阐明。由于筛区(sieve areas)被内质网()的聚集体覆盖,且大部分孔空间被内质网()的管状结构占据,由此产生的对体积流动的阻力似乎与压力流动机制不相容。然而,针叶树Metasequoia glyptostroboides韧皮部中同化物的运输速度为每小时48至60厘米(Willenbrink and Kollmann, 1966),基本上落在被子植物常见的运输速度范围内,即每小时50至100厘米(Crafts and Crisp, 1971; Kursanov, 1984)。当筛管(sieve-cell)内质网()的作用被了解时,这个谜题的答案无疑将被解开。作为筛管(sieve-cell)原生质体(protoplast)中如此突出的组成部分,内质网()形成了一个从一个筛管(sieve cell)延伸到下一个筛管(sieve cell)的连续系统,很难想象它在长距离运输中不发挥重要作用。
内质网()的积极作用得到了筛区(sieve areas)边缘内质网()聚集体中酶核苷三磷酸酶(nucleoside triphosphatase)和甘油磷酸酶(glycerophosphatase)定位的支持(Sauter, 1976, 1977)。内质网()的这种作用还得到了其与阳离子染料DiOC染色(Schulz, 1992)的进一步支持。DiOC可能标记了具有显著膜电位且内部带负电荷的膜(Matzke and Matzke, 1986)。有人提出,筛管(sieve cells)的内质网()能够通过在每个库(sink)中重新建立梯度来调节同化物的长距离梯度(Schulz, 1992)。Schulz (1992)指出,(1)内质网()复合体或聚集体中核苷三磷酸酶(nucleoside triphosphatases)的活性,(2)这些膜上质子梯度的存在,以及(3)高膜表面表明,裸子植物的韧皮部运输不仅依赖于源叶(source leaves)中的装载和库(sinks)中的卸载,还需要在运输路径中消耗能量的步骤。
❙ 薄壁组织细胞
韧皮部中含有数量不等的薄壁组织细胞(parenchyma cells),除了伴胞(companion cells)和Strasburger细胞外。含有各种物质(如淀粉、单宁和晶体)的薄壁组织细胞(parenchyma cells)是韧皮部的常规组成部分。形成晶体的薄壁组织细胞(parenchyma cells)可能被细分为小细胞,每个细胞含有一个晶体(图13.3D)。这种分室的含晶细胞通常与纤维或石细胞(sclereids)相关,并具有木质化的壁和次生加厚(Nanko et al., 1976)。
初生韧皮部(primary phloem)的薄壁组织细胞(parenchyma cells)呈长条形,与筛管分子(sieve elements)一样,其长轴与维管组织的纵向延伸方向平行。在次生韧皮部(secondary phloem)(第14章)中,薄壁组织细胞存在于轴向系统(axial system)和径向系统(radial system)两个系统中,分别称为轴向薄壁组织细胞(axial parenchyma cells)或韧皮部薄壁组织细胞(phloem parenchyma cells)和射线薄壁组织细胞(ray parenchyma cells)。轴向薄壁组织细胞可能以薄壁组织束(parenchyma strands)或单个纺锤形薄壁组织细胞(fusiform parenchyma cells)的形式存在。薄壁组织束是由前体细胞(precursor cell)分裂成两个或更多细胞而形成的。射线薄壁组织细胞构成了韧皮部射线(phloem rays)。
在许多真双子叶植物(eudicots)中,一些薄壁组织细胞可能与筛管分子(sieve-tube elements)来自相同的母细胞(mother cells)(但在伴胞(companion cells)形成之前)。薄壁组织细胞,特别是那些在个体发育(ontogenetically)上与筛管分子相关的细胞,可能在相关筛管分子功能期结束时死亡。因此,薄壁组织细胞在与筛管分子的关系上可能与伴胞相互过渡,即使在电子显微镜下,两者也不总是能够明确区分(Esau, 1969)。在个体发育上与筛管分子关系越密切的薄壁组织细胞,在外观和与筛管分子的细胞质连接(cytoplasmic connections)频率上就越像伴胞。然而,薄壁组织细胞与筛管分子的共质体连接(symplastic connection)主要是通过伴胞实现的。
在输导韧皮部(conducting phloem)中,韧皮部薄壁组织和射线薄壁组织细胞显然具有初生非木质化壁(primary unlignified walls)。在某些情况下,当薄壁组织细胞与纤维接触时,它们可能会发育出木质化的次生壁(lignified secondary walls)。在组织停止输导后,薄壁组织细胞可能保持相对不变,或者可能发生硬化(sclerified)。在许多植物中,木栓形成层(phellogen)最终会在韧皮部中产生(第15章)。它由韧皮部薄壁组织和射线薄壁组织形成。
❙ 厚壁组织细胞(SCLERENCHYMA CELLS)
纤维和石细胞(sclereids)的基本结构、起源和发育已在第8章中讨论。纤维是初生韧皮部和次生韧皮部的常见组成部分。在初生韧皮部中,纤维存在于组织的最外层;在次生韧皮部中,纤维以各种分布模式存在于轴向系统的其他韧皮部细胞中。在某些植物中,纤维通常是木质化的;而在其他植物中则不然。它们壁上的纹孔(pits)通常是单纹孔(simple),但也可能略有具缘纹孔(bordered)。纤维可能是分隔的(septate)或非分隔的(nonseptate),在成熟时可能是活的或死的。活纤维像在木质部中一样充当储存细胞(storage cells)。胶质纤维(gelatinous fibers)也存在于韧皮部中。在许多物种中,初生纤维和次生纤维都很长,被用作商业纤维来源(Linum, Cannabis, Hibiscus)。
石细胞(sclereids)也经常在韧皮部中发现。它们可能与纤维结合或单独存在,并且可能出现在次生韧皮部的轴向和径向系统中。石细胞通常在韧皮部的较老部分分化,这是由于薄壁细胞(parenchyma cells)的硬化(sclerification)所致。这种硬化可能伴随着细胞的侵入性生长(intrusive growth),也可能不伴随。在这种生长过程中,石细胞通常会分枝或伸长。纤维和石细胞之间的区别并不总是很明显,特别是当石细胞又长又细时。中间类型的细胞被称为纤维石细胞(fiber-sclereids)。
❙ 筛管分子(sieve elements)的寿命
长期以来,人们已经认识到韧皮部从传导状态过渡到非传导状态时筛管分子和邻近细胞的行为(Esau, 1969)。通常,筛管分子功能停止的最早迹象是筛域(sieve areas)上出现明确的胼胝质(callose)。胼胝质可能会大量积累,通常在筛管分子的原生质内容物退化后的一段时间内完全消失。如前所述,筛管分子的死亡伴随着它们的伴胞(companion cells)或Strasburger细胞的死亡,有时还包括其他薄壁细胞的死亡。随着退化的筛管分子失去膨压(turgor pressure)以及组织内的生长调整,筛管分子和紧密相关的薄壁细胞可能会塌陷并消失。然而,筛管分子可能保持开放并被空气填充。侵填体(tylosoids)(来自邻近薄壁细胞的类似侵填体(tylose)的突起)可能会侵入死亡的筛管分子的腔(lumina),或者简单地将筛管分子壁推到一边,导致筛管分子塌陷(例如,在Vitis中,Esau, 1948;在棕榈的次生韧皮部中,Parthasarathy和Tomlinson, 1967)。在Smilax rotundifolia中,形成侵填体的是伴胞,然后这些侵填体可能会硬化(Ervin和Evert, 1967)。在对来自尼日利亚的六种森林树木的次生韧皮部的研究中,所有通常形成侵填体的树木的次生韧皮部中都发现了侵填体(Lawton和Lawton, 1971)。
寿命最短的筛管分子是原生韧皮部(protophloem)的筛管分子,它们很快被次生韧皮部(metaphloem)的筛管分子取代。在几乎没有或没有次生生长的植物部分中,大多数次生韧皮部筛管分子在其所在部分的整个生命周期内保持功能,这通常是几个月的时间。在Polygonatum canaliculatum和Typha latifolia的根茎以及Smilax hispida和Smilax latifolia的地上茎中(这四种都是多年生单子叶植物),许多次生韧皮部筛管分子保持功能两年或更长时间(Ervin和Evert, 1967, 1970)。在Smilax hispida中,一些成熟的5年筛管分子仍然存活(Ervin和Evert, 1970)。这与一些棕榈树的数十年存活的次生韧皮部筛管分子相比显得微不足道(Parthasarathy, 1974b)。
在许多温带木本被子植物(woody angiosperms)中,次生韧皮部(secondary phloem)的筛管分子(sieve-tube elements)仅在它们形成的季节发挥作用,在秋季变得无功能,因此韧皮部在冬季缺乏成熟的活筛管(第14章)。类似的生长模式在一些亚热带和热带物种中也有报道。另一方面,在一些木本被子植物中,大量的次生筛管分子可能发挥功能两个或更多个季节(例如,在Tilia americana中为五年,Evert, 1962;在Tilia cordata中为10年,Holdheide, 1951),在晚秋进入休眠状态,在春季重新激活。在Pinus longaeva针叶的次生韧皮部中,单个筛细胞(sieve cells)存活3.8至6.5年(Ewers, 1982)。
❙ 筛管分子特化的趋势
筛管分子的进化变化已在单子叶植物(monocotyledons)的后生韧皮部(metaphloem)中得到了全面研究(Cheadle和Whitford, 1941;Cheadle, 1948;Cheadle和Uhl, 1948)。在33科158属219种单子叶植物中,仅发现了筛管分子。这些筛管分子显示出以下进化特化趋势:(1) 端壁(end walls)的取向从非常倾斜或倾斜逐渐变为横向,(2) 高度特化的筛域(sieve areas)(具有较大孔的区域)逐渐集中在端壁上,(3) 从复合筛板(compound sieve plates)逐步变为简单筛板(simple sieve plates),以及(4) 侧壁(side walls)上筛域的显著程度逐渐降低。特化从叶片向根部发展;也就是说,最高度特化的筛管分子出现在叶片、花序轴、球茎和根茎中,而较低度进化的筛管分子出现在根部。在对棕榈植物后生韧皮部的广泛研究中获得了基本相似的结果(Parthasarathy, 1966)。因此,单子叶植物中筛管分子的特化方向与管状分子(tracheary elements)的进化方向相反(第10章)。
关于木质被子植物(主要是真双子叶植物)中筛管分子(sieve-tube elements)特化的系统发育趋势的讨论主要涉及次生韧皮部(secondary phloem)中的筛管分子(Zahur, 1959; Roth, 1981; den Outer, 1983, 1986)。这些分子特化的趋势包括长度的减少,这是木质被子植物次生木质部中导管分子(vessel elements)特化程度最可靠和一致的衡量标准(第10章;Bailey, 1944;Cheadle, 1956)。导管分子长度的系统发育减少与导致层状形成层(storied cambia)的纺锤状原始细胞(fusiform initials)的缩短相关。事实上,对49种木质真双子叶植物次生韧皮部中层状结构相关特征的分析揭示了高度特化的筛管分子。这些分子通常较短,具有简单筛板(simple sieve plates),位于略微倾斜至横向的端壁上,并且侧壁上的筛区(sieve areas)发育不良且数量较少(den Outer, 1986)。然而,与导管分子相比,筛管分子在系统发育中长度的减少趋势不那么直接和一致。这是因为在许多木质被子植物中,韧皮部母细胞(phloem mother cells)通过横向分裂(次生分隔,secondary partitions)在个体发育中长度的减少模糊了筛管分子与纺锤状原始细胞之间的长度关系(Esau和Cheadle, 1955;Zahur, 1959)。
人们可能会认为特化程度较低的筛管分子类似于裸子植物的筛细胞(sieve cells)。就原始筛管分子相对较长且端壁和侧壁上的筛区区分不明显而言,这是正确的。然而,没有任何被子植物的筛分子具有类似于裸子植物筛细胞中含有内质网的筛区。裸子植物中筛细胞的结构非常一致,与含有P蛋白(P-protein)的筛管分子形成鲜明对比,后者通常与个体发育相关的伴胞(companion cells)相关联。在被子植物中,只有Austrobaileya scandens的次生韧皮部筛分子被报道为缺乏筛板(Srivastava, 1970)。这些细胞在高度倾斜的端壁上的筛孔(sieve pores)与侧壁上的筛孔大小相似(见图14.7B)。然而,Behnke(1986)注意到,Austrobaileya筛分子中的筛区孔在中胶层(middle lamella)区域没有像裸子植物筛细胞那样通过一个共同的中间腔相互连接(见下文),因此选择将具有多个筛区的端壁称为复合筛板(compound sieve plates)。无论如何,这些筛分子含有P蛋白并具有伴胞。由于至少具备筛管分子共有的三个特征中的两个——另一个是筛板——Austrobaileya的筛分子可以被视为原始筛管分子。
裸子植物的筛管分子在所有发育阶段都缺乏P蛋白,并且缺乏类似于伴胞的薄壁细胞(parenchyma cells)。
维管隐花植物(vascular cryptogams)的筛管分子(sieve elements)经历选择性自噬(selective autophagy),导致细胞核退化以及某些细胞质成分的丧失,这与裸子植物(gymnosperms)和被子植物(angiosperms)的筛管分子类似。除了石松类(lycopods)外,所有其他无种子维管植物(seedless vascular plants)的筛管分子最显著的特征是存在折射球体(refractive spherules),这是一种单层膜包裹的电子致密蛋白质体(proteinaceous bodies)(图13.32A, B, D),在未染色的切片中用光学显微镜观察时显得高度折射。内质网()和高尔基体(Golgi apparatus)都与折射球体的形成有关。(详见Evert, 1990a及其引用的文献,其中详细讨论了维管隐花植物的筛管分子。)
❙ 无种子维管植物的筛管分子
在电子显微镜用于研究韧皮部组织之前,筛管(sieve-tube)分子和筛细胞(sieve cells)的区别主要基于筛孔(sieve pores)的大小和分布的差异,即是否存在筛板(sieve plates)(筛管分子有筛板,筛细胞没有筛板)。除了少数例外,无种子维管植物(seedless vascular plants)或维管隐花植物(vascular cryptogams)的筛管分子明显缺乏筛板,因此被归类为筛细胞。通过电子显微镜观察发现,维管隐花植物筛管分子筛孔的分布、大小、内容物和发育存在相当大的差异,并且这一多样化植物群中没有任何筛区(sieve areas)与裸子植物筛细胞的筛区相似,后者具有中腔(median cavities)和仅延伸一半的筛孔。尽管某些维管隐花植物(蕨类植物,包括松叶蕨类(whisk ferns)和木贼类(horsetails))的筛管分子壁中的筛孔被许多内质网膜穿过(图13.32A, B, D),但这些膜在形态上与裸子植物筛细胞筛区相关的管状结构群不同。在某些维管隐花植物(石松类)中,筛孔几乎没有任何内质网膜(图13.32C)。此外,维管隐花植物缺乏类似于Strasburger细胞的薄壁细胞(parenchyma cells)。综上所述,维管隐花植物的筛管分子与裸子植物的筛管分子不同,因此将术语“筛细胞”仅限于裸子植物的筛管分子。维管隐花植物的筛管分子也与被子植物的筛管分子不同。
❙ 初生韧皮部
初生韧皮部(primary phloem)分为原生韧皮部(protophloem)和后生韧皮部(metaphloem),其分类依据与初生木质部(primary xylem)分为原生木质部(protoxylem)和后生木质部(metaxylem)相同。原生韧皮部在仍处于伸长生长的植物部位成熟,其筛管分子被拉伸并很快失去功能。最终它们完全消失(图13.33和13.34)。后生韧皮部分化较晚,在没有次生生长的植物中,构成成年植物部位唯一的传导韧皮部。
被子植物(angiosperms)的原生韧皮部(protophloem)筛管分子(sieve elements)通常较窄且不明显,但它们是无核的(enucleate)并具有胼胝质(callose)的筛域(sieve areas)。在根和茎的原生韧皮部中可能缺少伴胞(companion cells)。通常与第一个筛管分子相关的有核细胞(nucleate cells)不够明显,无法识别为伴胞,尽管它们可能与筛管分子来自同一个前体细胞(precursor)(Esau, 1969)。许多禾本科植物(grass)的根发育出由原生韧皮部筛管分子和两个明显的伴胞组成的原生韧皮部极(protophloem poles),这两个伴胞在内部(即与中柱鞘(pericycle)相对的一侧)位于筛管分子两侧(图13.35; Eleftheriou, 1990)。在给定的原生韧皮部束中伴胞的缺失并不一定是一致的。一些原生韧皮部筛管分子可能有伴胞,而另一些则没有,如Lepidium sativum、Sinapsis alba和Cucurbita pepo根的原生韧皮部(Resch, 1961)以及玉米(maize)(Evert and Russin, 1993)和大麦(barley)(Evert et al., 1996b)叶片中大维管束的原生韧皮部。
在许多真双子叶植物(eudicots)中,原生韧皮部筛管分子位于明显伸长的活细胞中。在
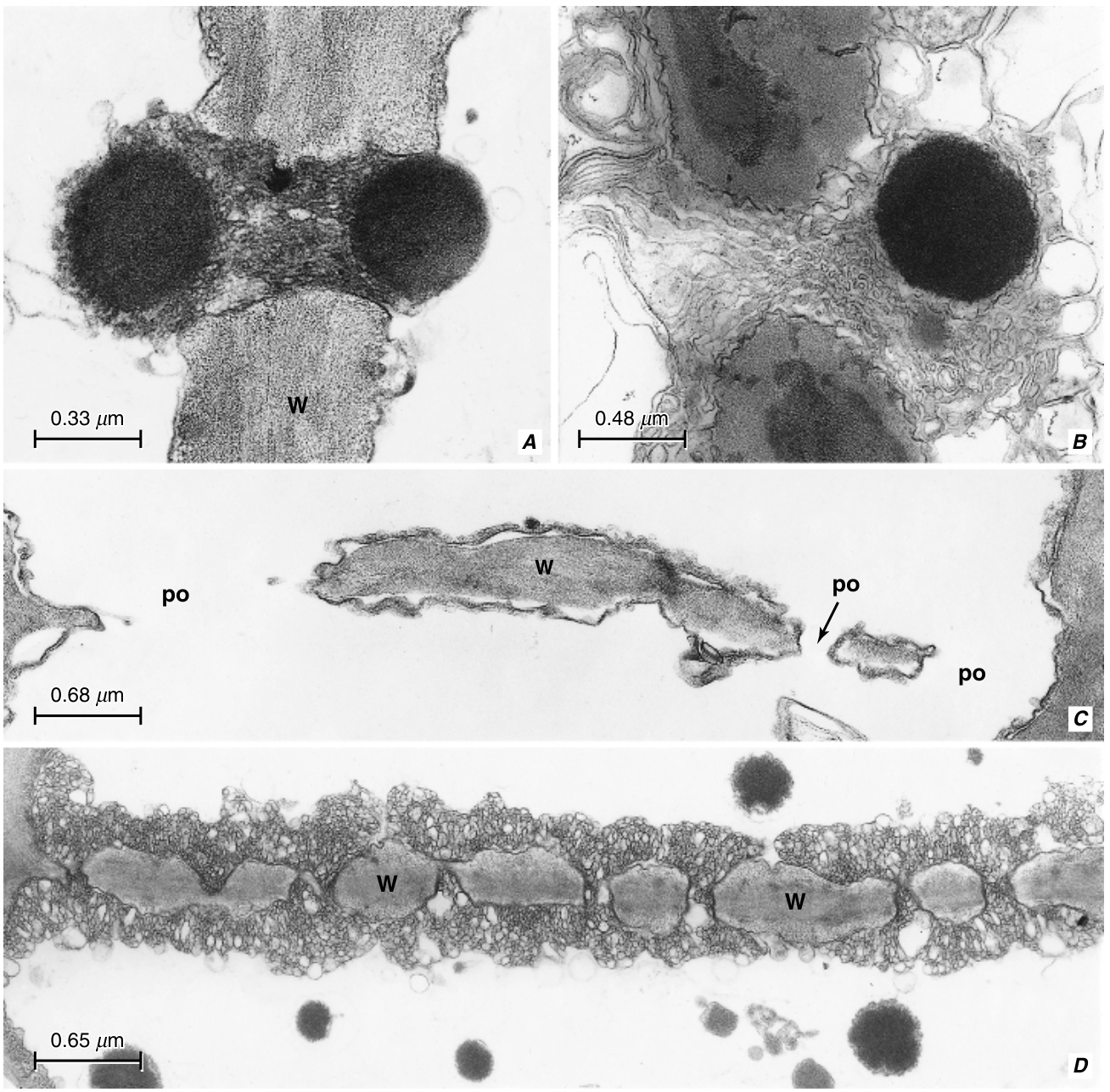
图13.32
一些无种子维管植物(seedless vascular plants)筛域孔(sieve-area pores)的电子显微照片。A,在厚囊蕨类(eusporangiate fern)Botrychium virginianum中,孔中充满了许多膜,显然是管状内质网(tubular )。B,木贼(Equisetum hyemale)地上茎中成熟筛管分子之间壁中的内质网填充孔。C,水韭(Isoetes muricata)球茎中成熟筛管分子之间壁中的未堵塞孔(po)。D,松叶蕨(Psilotum nudum)地上枝条中成熟筛管分子之间壁中的内质网填充孔。A、B和D中的电子致密体是折射球体(refractive spherules)。(A,来自Evert, 1976。经出版商许可转载;B,来自Dute and Evert, 1978。经牛津大学出版社许可;C,来自Kruatrachue and Evert, 1977;D,来自Perry and Evert, 1975。)
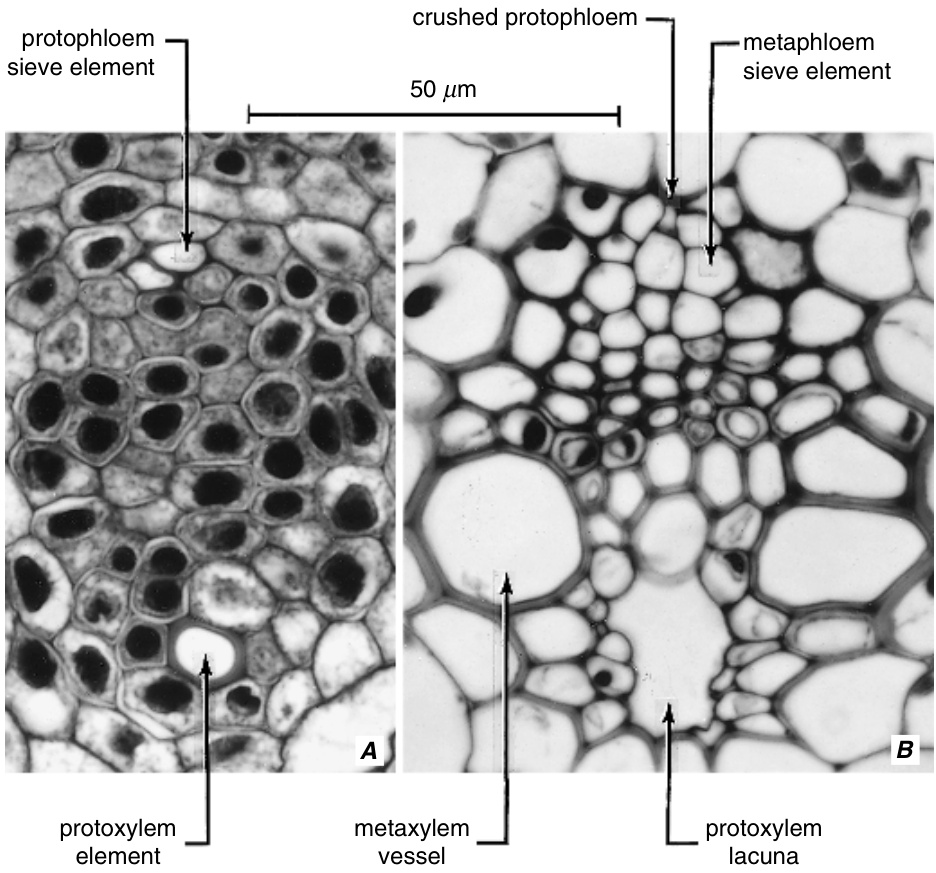
图13.33
燕麦(Avena sativa)维管束在两个分化阶段的横切面。A,原生韧皮部和原生木质部(protoxylem)的第一个分子已经成熟。B,后生韧皮部(metaphloem)和后生木质部(metaxylem)成熟;原生韧皮部被压碎;原生木质部被空隙(lacuna)取代。(A,来自Esau, 1957a;B,来自Esau, 1957b。Hilgardia 27 (1), 15–69。\copyright 1957加州大学董事会。)
在许多物种中,这些伸长的细胞是纤维原基(fiber primordia)。当筛管元素停止功能并被消除时,纤维原基增加长度,发育出次生壁,并成熟为称为初生韧皮部纤维(primary phloem fibers)或原韧皮部纤维(protophloem fibers)的纤维(图13.36)。这种纤维存在于许多双子叶植物茎的韧皮部区域的外围,并经常被错误地称为周缘纤维(pericyclic fibers)(第8章)。在双子叶植物的叶片和叶柄中,筛管破坏后剩余的原韧皮部细胞通常分化为具有厚角组织增厚的非木质化壁的长细胞。这些细胞的束在横切面上看起来像束帽,界定维管束的远轴侧。这种类型的原韧皮部在叶片中的转化广泛分布,也发生在那些茎中具有初生韧皮部纤维的物种中(Esau, 1939)。初生韧皮部纤维也存在于根中。随着其转化,原韧皮部失去了与韧皮部组织的所有相似性。
在裸子植物中,最早形成的韧皮部元素在识别为筛管元素时引起了困难。这些细胞被称为前驱韧皮部细胞(precursory phloem cells)(liber précurseur, Chauveaud, 1902a, b),它们与薄壁细胞和筛管元素相互过渡。Chauveaud(1910)仅在根、下胚轴和子叶中识别出前驱韧皮部。随后发现,裸子植物的茎中最早形成的韧皮部元素可能也没有易于区分的筛区,它们与Chauveaud的前驱韧皮部细胞进行了比较(Esau, 1969)。
由于后韧皮部(metaphloem)在周围组织长度增长完成后成熟,它作为传导组织保留的时间比原韧皮部更长。一些草本双子叶植物和大多数单子叶植物不产生次生组织,完全依赖后韧皮部在身体完全发育后进行同化物的运输。在具有形成层次生生长的木本和草本物种中,后韧皮部筛管元素在次生传导元素分化后变得不活跃。在这些植物中,后韧皮部筛管元素可能部分被压碎或完全消除。
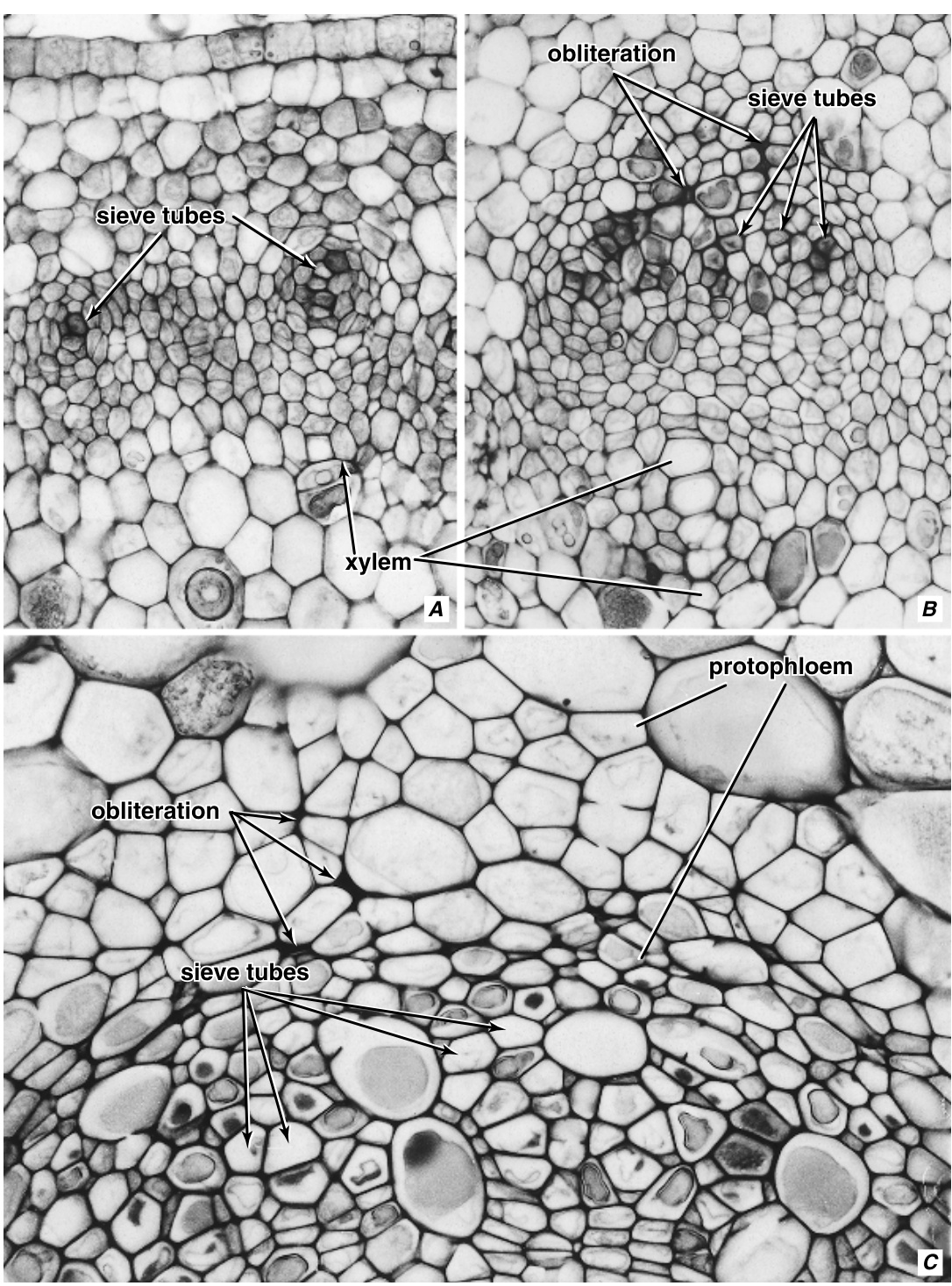
图13.34
初生韧皮部的分化,见于Vitis vinifera茎的横切面。A,两个原形成层束,一个有一个筛管,另一个有几个。B,具有许多原韧皮部筛管的维管束。其中一些被消除。原生木质部存在于A、B中。C,原韧皮部筛管被消除,后韧皮部分化(图的下半部分)。原韧皮部由纤维原基表示。后韧皮部由筛管、伴胞、韧皮部薄壁细胞和大量扩大的含单宁的薄壁细胞组成。(全部,×600。来自Esau, 1948. Hilgardia 18 (5), 217–296. \copyright 1948 Regents, University of California.)
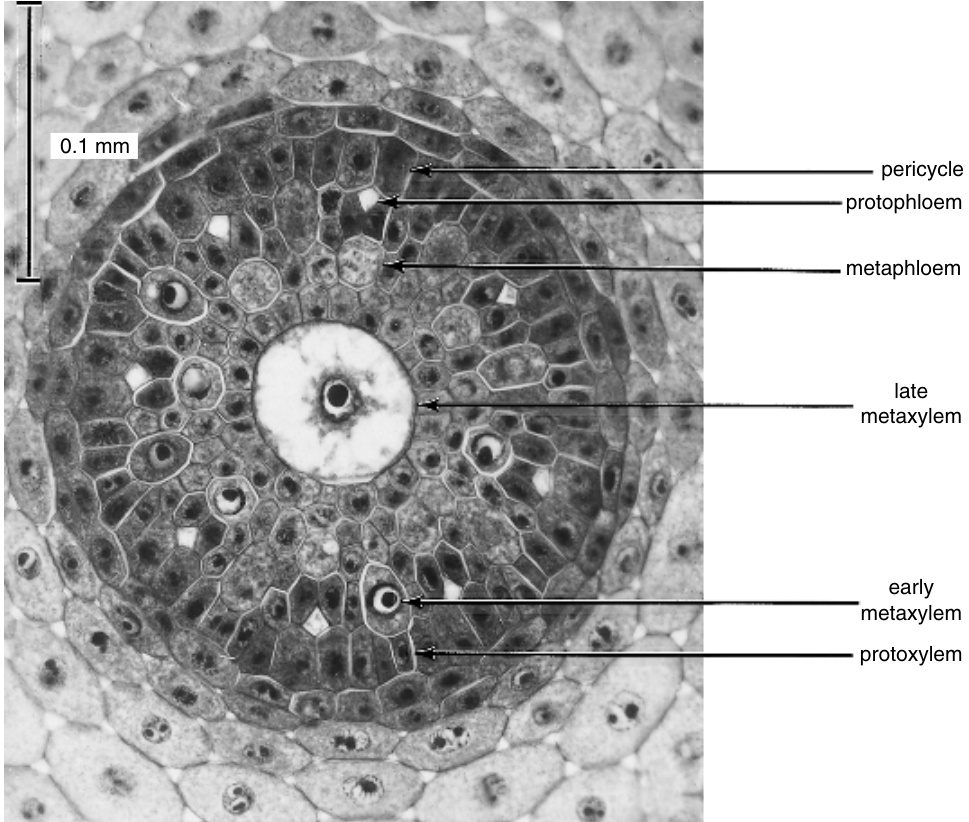
图13.35
大麦(Hordeum vulgare)分化根中维管柱的横切面。维管柱有八个成熟的原生韧皮部筛管,每个筛管伴随两个伴胞。后生韧皮部筛管尚未成熟。在木质部中,所有细胞均未成熟,后生木质部细胞比原生木质部细胞具有更高的液泡化程度。(摘自Esau, 1957b. Hilgardia 27 (1), 15–69. \copyright 1957 Regents, University of California.)
后生韧皮部的筛管通常比原生韧皮部的筛管更长更宽,其筛域也更明显。伴胞和韧皮部薄壁组织通常存在于真双子叶植物(eudicots)的后生韧皮部中(图13.36A)。在单子叶植物(monocots)中,筛管和伴胞通常形成不含韧皮部薄壁组织的束,尽管这些细胞可能存在于束的外围(Cheadle和Uhl, 1948)。在这种韧皮部中,筛管和伴胞形成规则的排列模式,这一特征被认为是系统发育上较为高级的特征(Carlquist, 1961)。在草本真双子叶植物(如毛茛科Ranunculaceae)中,可能会发现一种单子叶植物类型的后生韧皮部,其筛管之间没有韧皮部薄壁细胞。
真双子叶植物的后生韧皮部通常缺乏纤维(Esau, 1950)。如果真双子叶植物中存在初生韧皮部纤维,它们通常出现在原生韧皮部中(图13.34C和13.36B),而不出现在后生韧皮部中,即使这些细胞后来在次生韧皮部中形成。在草本植物中,老化的后生韧皮部可能会强烈硬化。这些经历硬化的细胞是否应归类为纤维或硬化的韧皮部薄壁组织仍存在争议。在单子叶植物中,厚壁组织(sclerenchyma)包围维管束形成束鞘,也可能存在于后生韧皮部中(Cheadle和Uhl, 1948)。
原生韧皮部和后生韧皮部之间的界限有时相当清晰,例如在单子叶植物的气生根中,原生韧皮部仅含有筛管,而后生韧皮部中则有明显的伴胞与筛管相连。在真双子叶植物中,这两种组织通常逐渐融合,它们的界限必须基于发育研究来确定。
在具有次生韧皮部的植物中,次生韧皮部与后生韧皮部之间的区别可能相当不确定。如果这两种组织中存在细胞的径向排列,则它们的界限尤其难以确定。在Prunus属和Citrus limonia中发现了例外情况,在这些植物中,由原形成层在韧皮部侧启动的最后一批细胞成熟为大型薄壁细胞,从而清晰地将初生韧皮部与次生韧皮部分开(Schneider, 1945, 1955)。
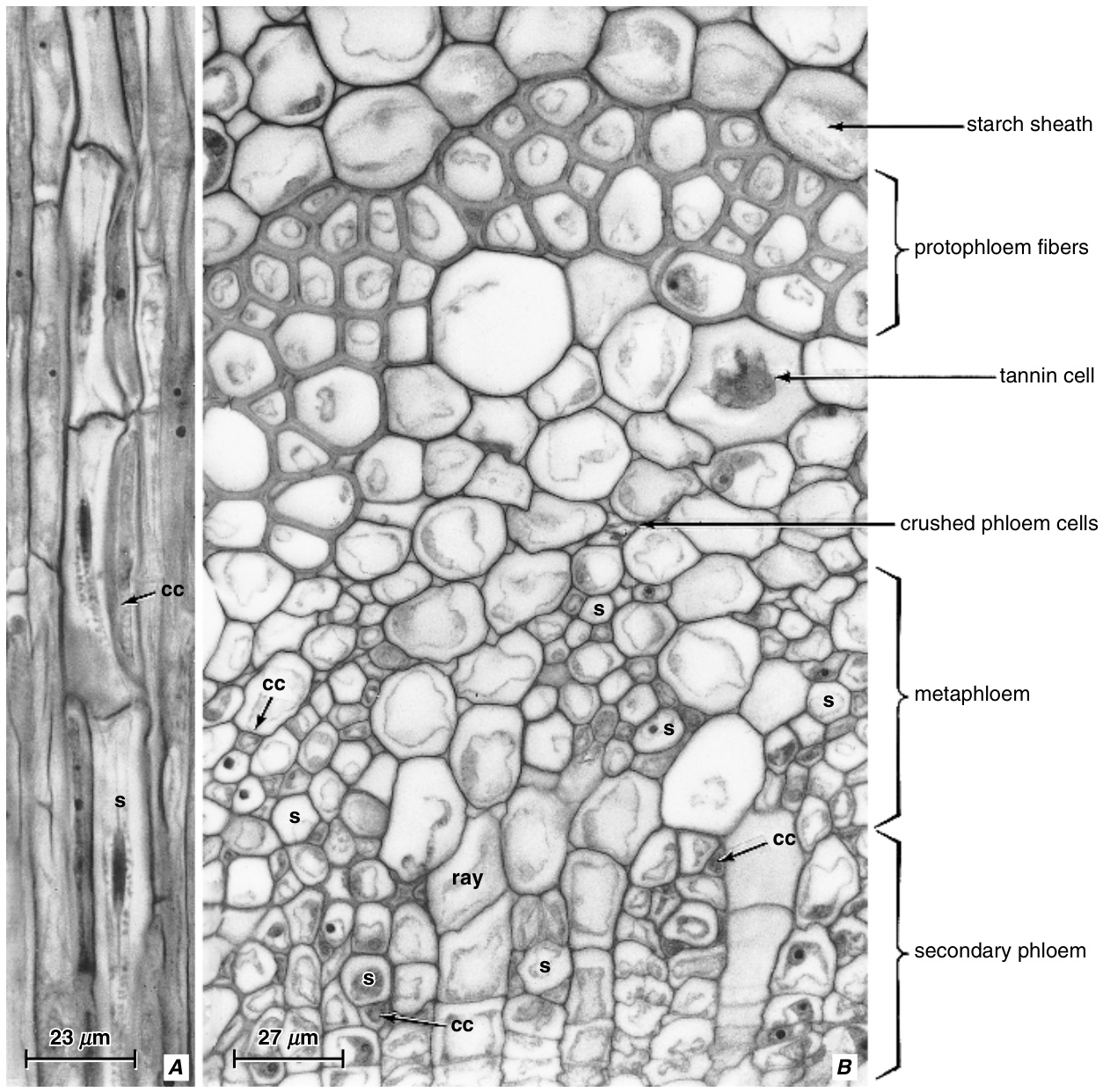
图13.36
菜豆(Phaseolus vulgaris)叶片的韧皮部。A,纵切面显示部分筛管,包含两个完整和两个不完整的筛管分子(s)。伴胞位于cc。三个筛管分子中的纺锤形非分散性P-蛋白体。B,横切面显示不再具有传导功能的原生韧皮部纤维、后生韧皮部以及部分次生韧皮部。筛管分子位于s,伴胞位于cc。(摘自Esau, 1977.)
