第四章 细胞壁
细胞壁的存在,尤其是与其他特征相比,将植物细胞与动物细胞区分开来。它的存在是植物作为有机体的许多特征的基础。细胞壁是刚性的,因此限制了原生质体的大小,防止原生质体在吸水后扩大时质膜破裂。细胞壁在很大程度上决定了细胞的大小和形状、组织的质地以及植物器官的最终形态。细胞类型通常通过其壁的结构来识别,反映了细胞壁结构与细胞功能之间的密切关系。
曾经被认为仅仅是原生质体外层、无活性的产物,细胞壁现在被认识到是一个代谢活跃的区室(),具有特定和重要的功能(Bolwell, 1993; Fry, 1995; Carpita and McCann, 2000)。因此,初生细胞壁(primary cell wall)——主要在细胞增大时形成的壁层——被不同地描述为“重要的”或“不可或缺的细胞器”(Fry, 1988; Hoson, 1991; McCann et al., 1990),“质膜外的特殊亚细胞区室”(SatiatJeunemaitre, 1992),以及“细胞质的延伸”(Carpita and Gibeaut, 1993)。细胞壁含有多种酶,在植物的吸收、运输和分泌物质中起重要作用。实验证据表明,从细胞壁释放的分子参与细胞间信号传递,影响细胞分化(Fry et al., 1993; Mohnen and Hahn, 1993; Pennell, 1998; Braam, 1999; Lišková et al., 1999)。
此外,细胞壁可能通过接收和处理来自病原体表面的信息,并将这些信息传递到宿主细胞的质膜,在防御细菌和真菌病原体中发挥作用。通过基因激活的过程,宿主细胞可能通过产生植物抗毒素(phytoalexins)——对病原体有毒的抗生素(Darvill and Albersheim, 1984; Bradley et al., 1992; Hammerschmidt, 1999)——或通过沉积木质素()、木栓质()或胼胝质()等物质,这些物质可能作为被动屏障阻止入侵(Vance et al., 1980; Perry and Evert, 1983; Pearce, 1989; Thomson et al., 1995)。
从概念上讲,植物学家长期以来一直认为细胞壁是植物细胞的一个组成部分。然而,许多植物细胞生物学家采用了动物细胞生物学家的术语,将细胞壁称为“细胞外基质(m)”,表明细胞壁位于植物细胞外部(Staehelin, 1991; Roberts, 1994)。有许多令人信服的理由不采用细胞外基质这一术语来描述植物细胞壁(Robinson, 1991; Reuzeau and Pont-Lezica, 1995; Connolly and Berlyn, 1996)。例如,动物细胞的细胞外基质与植物细胞壁完全不同,前者依赖蛋白质作为基质,后者主要依赖多糖;动物细胞不是由它与组织中相邻细胞共享的细胞外基质定义的,而植物细胞是由其原生质体制造的壁定义的;动物细胞在空间上不固定,可以移动到预先存在的细胞外环境中,而植物细胞不能在共同的“细胞外基质”内改变其位置;细胞壁的存在是植物细胞分裂的前提;植物细胞要生长和分裂,壁也必须生长和分裂(Suzuki et al., 1998)。此外,正如Connolly和Berlyn(1996)所指出的,细胞外基质这一术语会导致混淆,而使用已确立的细胞壁术语可以避免这种混淆(本章讨论)。本书将继续使用细胞壁这一术语来指代植物细胞这一独特的纤维素成分。
❙ 细胞壁的大分子成分
纤维素是植物细胞壁的主要成分
植物细胞壁的主要成分是纤维素(cellulose),这是一种经验式为(C6H10O5)n的多糖。其分子是由β1,4 - 连接的-D-葡聚糖(glucan)(即首尾相连的葡萄糖()重复单体)组成的线性链(图4.1)。这些长而细的纤维素分子倾向于通过氢键结合在一起,形成微纤丝(microfibrils)。关于微纤丝的直径,文献中存在相当大的差异。大多数值在4到10纳米之间,尽管也有记录到小至1和2纳米(Preston, 1974; Ha et al., 1998; Thimm et al., 2002)和大至25纳米的值(Thimm et al., 2000)。纤维素微纤丝的直径显然高度依赖于所检查的细胞壁部分的水分含量。水合壁的微纤丝似乎比脱水壁的微纤丝更小(Thimm et al., 2000)。水主要存在于基质()中(见下文),在生长组织中约占细胞壁质量的三分之二。
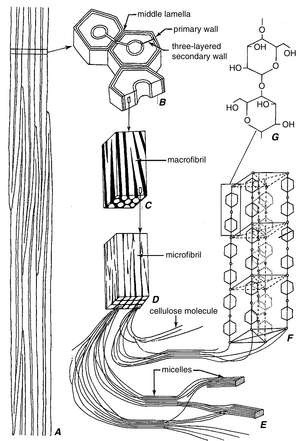
纤维素微纤丝缠绕在一起形成细线,这些细线像电缆中的股线一样相互缠绕。每根“电缆”或大纤丝(macrofibril),在光学显微镜下可见,宽度约为0.5微米,长度可达4到7微米(图4.1)。以这种方式缠绕的纤维素分子具有接近钢的拉伸强度(断裂强度)(Frey-Wyssling, 1976)。纤维素微纤丝构成典型初生壁(primary wall)干重的20%到30%,以及木材细胞次生壁(secondary wall)干重的40%到60%。
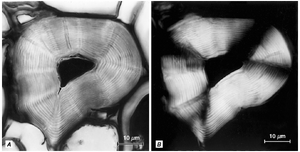
纤维素具有结晶性质,这是由于纤维素分子在微纤丝中的有序排列(Smith, B. G., et al., 1998)。这种排列仅限于微纤丝中被称为微晶(micelles)的部分。在微晶之间和周围存在排列较不规则的葡萄糖链,构成微纤丝的副结晶(paracrystalline)区域。纤维素的结晶结构使细胞壁具有各向异性(anisotropic),因此在偏振光下观察时具有双折射(birefringent)特性(图4.2)。
纤维素微纤丝嵌入非纤维素分子的基质中
细胞壁的纤维素微纤丝嵌入在一个由非纤维素分子组成的交联基质中。这些分子包括被称为半纤维素(hemicellulose)和果胶(pectin)的多糖,以及被称为糖蛋白(glycoprotein)的结构蛋白。
主要半纤维素 半纤维素是一个通用术语,指代细胞壁中紧密结合的一组非结晶性多糖(glycan)。不同细胞类型和分类群中的半纤维素差异很大。通常,在大多数细胞类型中,一种半纤维素占主导地位,其他半纤维素含量较少。
木葡聚糖(xyloglucan)是真双子叶植物和约一半单子叶植物初生细胞壁的主要半纤维素(Carpita和McCann, 2000),占其干重的约20%至25%(Kato和Matsuda, 1985)。木葡聚糖由(1→4)β-D-葡聚糖的线性链组成,与纤维素类似,但带有含有木糖(xylose)、半乳糖(galactose)和通常末端为岩藻糖(fucose)的短侧链(McNeil等, 1984; Fry, 1989; Carpita和McCann, 2000)。大多数木葡聚糖显然与纤维素微纤丝紧密结合(Moore和Staehelin, 1988; Hoson, 1991)。由于与纤维素微纤丝紧密结合,木葡聚糖可能通过束缚相邻的微纤丝来限制细胞壁的延展性,因此可能在调节细胞扩大中起重要作用(Levy和Staehelin, 1992; Cosgrove, 1997, 1999)。
木葡聚糖的降解副产物(木葡聚糖衍生寡糖)对细胞生长具有类似激素的抗生长素(antiauxin)作用(Fry, 1989; McDougall和Fry, 1990)。此外,在一些真双子叶植物的种子中,例如旱金莲(Tropaeolum)、凤仙花(Impatiens)和番荔枝(Annona),位于厚细胞壁中的木葡聚糖构成主要的储存碳水化合物(Reid, 1985)。木葡聚糖显然在木质部成分的次生细胞壁(初生壁内沉积的壁层)中缺失(Fry, 1989)。
主要半纤维素为木葡聚糖的初生细胞壁被指定为I型壁(Carpita和Gibeaut, 1993; Darley等, 2001)。单子叶植物鸭跖草类群(commelinoid line)(包括禾本目(Poales)、姜目(Zingiberales)、鸭跖草目(Commelinales)和棕榈目(Arecales))初生细胞壁中的主要半纤维素是葡糖醛酸阿拉伯木聚糖(glucuronoarabinoxylan),其特征是具有(1→4)β-D-木糖主链。与木葡聚糖类似,葡糖醛酸阿拉伯木聚糖可以与纤维素和彼此形成氢键。禾本目植物的初生壁与其他鸭跖草类单子叶植物的区别在于存在混合连接的(1→3)、(1→4)β-D-葡聚糖(Carpita, 1996; Buckeridge等, 1999; Smith, B. G., 和Harris, 1999; Trethewey和Harris, 2002)。鸭跖草类细胞壁被指定为II型壁(Carpita和Gibeaut, 1993; Darley等, 2001)。
木聚糖(Xylans)是所有被子植物次生壁中主要的非纤维素多糖(noncellulosic polysaccharides)(Bacic et al., 1988; Awano et al., 2000; Awano et al., 2002)。葡甘露聚糖(Glucomannans)是裸子植物次生细胞壁中主要的半纤维素(hemicelluloses)(Brett and Waldron, 1990)。
果胶(Pectins)可能是化学多样性最丰富的非纤维素多糖(Bacic et al., 1988; Levy and Staehelin, 1992; Willats et al., 2001)。它们是真双子叶植物初生壁的特征成分,在单子叶植物中含量较少。果胶可能占真双子叶植物初生壁干重的30%到50%,而在单子叶植物中仅占2%到3%(Goldberg et al., 1989; Hayashi, 1991)。禾本科植物通常只含有痕量的果胶(Fry, 1988)。次生壁可能完全不含果胶。
果胶的两个基本成分是多聚半乳糖醛酸(polygalacturonic acid)和鼠李半乳糖醛酸聚糖(rhamnogalacturonan)。它们与其他果胶成分形成凝胶,纤维素-半纤维素网络嵌入其中(Roberts, 1990; Carpita and Gibeaut, 1993)。
果胶具有高度亲水性,以其形成凝胶的能力而闻名。果胶引入细胞壁的水分赋予细胞壁可塑性(plastic properties),并调节细胞壁的拉伸能力(Goldberg et al., 1989)。分生组织(meristems)的细胞壁中Ca++含量特别低,但随着分生组织衍生物(meristem derivatives)的伸长和分化,其细胞壁中的Ca++含量显著增加。细胞伸长完成后,果胶会发生广泛的Ca++交联(crosslinking),从而阻止进一步拉伸。也有证据表明果胶会发生硼交联(boron cross-linking)(Blevins and Lukaszewski, 1998; Matoh and Kobayashi, 1998; Ishii et al., 1999)。
细胞壁的孔隙度(porosity)似乎主要由果胶的组织结构决定,而不是由纤维素或半纤维素决定(Baron-Epel et al., 1988)。孔隙直径约为4.0到6.8纳米(Carpita et al., 1979; Carpita, 1982; Baron-Epel et al., 1988),允许盐类、糖类、氨基酸和植物激素(phytohormones)等物质通过。直径大于孔隙的分子在穿透此类细胞壁时会受到阻碍。细胞壁对大多数潜在病原体(pathogenic organisms)来说是一道有效的物理屏障。其孔隙太小,甚至病毒也无法穿透到达原生质体(protoplast)(Brett and Waldron, 1990)。果胶降解片段可能作为信号分子(signaling molecules)发挥作用(Aldington and Fry, 1993; Fry et al., 1993)。
除了上述多糖外,细胞壁基质还可能含有结构蛋白(structural proteins)(糖蛋白(glycoproteins))。结构蛋白约占许多初生壁干重的10%。主要的结构蛋白类别包括富含羟脯氨酸的蛋白质(hydroxyproline-rich proteins, HRGPs)、富含脯氨酸的蛋白质(proline-rich proteins, PRPs)和富含甘氨酸的蛋白质(glycine-rich proteins, GRPs)。结构蛋白对某些细胞类型和组织具有高度特异性(Ye and Varner, 1991; Keller, 1993; Cassab, 1998)。关于它们的生物学功能知之甚少。
研究得最清楚的结构蛋白是伸展蛋白(extensin),它是HRGPs家族的一员,之所以这样命名是因为最初认为它们与细胞壁的伸展性(extensibility)有关,但这个观点现在已经被摒弃。现在看来,伸展蛋白可能在发育过程中起结构作用。例如,在大豆种皮的外两层细胞——栅栏表皮细胞(palisade epidermal cells)和沙漏细胞(hourglass cells)中发现了伸展蛋白(Cassab和Varner, 1987)。这些细胞具有相对较厚的次生壁,为包裹的胚提供机械保护。编码烟草伸展蛋白的基因在侧根尖端的一两层细胞中特异性表达。有人认为,伸展蛋白的沉积可能会加强细胞壁,并有助于皮层(cortex)和表皮(epidermis)的机械穿透(Keller和Lamb, 1989)。
所有三种结构性的细胞壁蛋白——HRGPs、PRPs和GRPs——都在茎的维管组织(vascular tissues)中被发现(Showalter, 1993; Cassab, 1998)。HRGPs主要与韧皮部、形成层和厚壁组织(sclerenchyma)相关,而PRPs和GRPs最常定位于木质部。GRPs定位于早期管状分子(protoxylem elements)的修饰初生壁(primary walls)中(Ryser等, 1997)(第10章)。曾经认为GRPs的沉积与木质部的木质化(lignification)有关,但现在已证明GRPs的沉积和木质化是两个独立的过程。在豆类下胚轴(hypocotyls)中,GRP显然不是由管状分子产生的,而是由木质部薄壁细胞(xylem parenchyma cells)产生的,这些细胞将蛋白质输出到早期管状分子的初生壁中(Ryser和Keller, 1992)。PRPs与木质化有关。一些PRPs构成了豆科植物根瘤(nodule)细胞壁的一部分,可能在根瘤形成中起作用(Showalter, 1993)。
与上述蛋白质不同,广泛分布于植物界的阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGPs)没有明显的结构功能。AGPs是可溶的和可扩散的,存在于质膜(plasma membrane)、细胞壁和细胞间隙(intercellular spaces)中(Serpe和Nothnagel, 1999);因此,它们是分化过程中细胞间相互作用中充当信使的良好候选者。已发现AGPs对胡萝卜(Daucus carota)的体细胞胚胎发生(somatic embryogenesis)很重要(Kreuger和van Holst, 1993),在拟南芥(Arabidopsis thaliana)根表皮细胞扩张的控制中起作用(Ding, L., 和Zhu, 1997),并参与百合(Lilium longiflorum)花粉管(pollen tubes)的尖端生长(tip growth)(Jauh和Lord, 1996)。AGPs显然在植物发育中起多种作用(MajewskaSawka和Nothnagel, 2000)。另一类细胞壁蛋白,命名为扩张蛋白(expansin)(Li等, 2002),已被证明具有松弛细胞壁的功能,可促进细胞扩张(见下文)。
在初生细胞壁中已经报道了许多酶,包括过氧化物酶(peroxidases)、漆酶(laccases)、磷酸酶(phosphatases)、转化酶(invertases)、纤维素酶(cellulases)、果胶酶(pectinases)、果胶甲酯酶(pectin methylesterases)、苹果酸脱氢酶(malate dehydrogenase)、几丁质酶(chitinases)和(1→3)β-葡聚糖酶((1→3)β-glucanases) (Fry, 1988; Varner and Lin, 1989)。一些细胞壁酶,如几丁质酶、(1→3)β-葡聚糖酶和过氧化物酶,可能参与植物的防御机制。过氧化物酶和漆酶也可能催化木质化(lignification) (Czaninski et al., 1993; O’Malley et al., 1993; Østergaard et al., 2000)。纤维素酶和果胶酶在细胞壁降解中起主要作用,特别是在叶片脱落和发育中的导管分子穿孔板形成期间。
关于细胞壁蛋白的大部分信息来自对双子叶植物(eudicots)初生细胞壁的研究。对单子叶植物(monocots)和裸子植物(gymnosperms)的细胞壁蛋白知之甚少,尽管伸展蛋白(extensins, HRGPs)和PRPs显然存在于这两类植物中,而GRPs存在于单子叶植物中(Levy and Staehelin, 1992; Keller, 1993; Showalter, 1993)。关于次生细胞壁中的蛋白质知之甚少。一种类似伸展蛋白的蛋白质已被定位在成熟火炬松(Pinus taeda)木材的次生细胞壁中(Bao et al., 1992)。
胼胝质是一种广泛分布的细胞壁多糖
胼胝质(callose)是一种线性(1→3)β-D-葡聚糖,沉积在质膜和现有的纤维素细胞壁之间(Stone and Clarke, 1992; Kauss, 1996)。它最广为人知的是在被子植物韧皮部的筛管分子中,它与发育中的筛孔相关(图4.3),并且通常发现衬在完全发育的筛孔上(第13章; Evert, 1990)。胼胝质在机械损伤和环境或病原体诱导的应激反应中迅速沉积,封闭相邻细胞之间的胞间连丝(plasmodesmata) (Radford et al., 1998)或在真菌试图侵入宿主细胞的部位形成细胞壁附着物("乳头状突起") (Perry and Evert, 1983)。与完全发育的筛孔相关的胼胝质也可能是"伤口"胼胝质。
除了与发育中的筛孔相关外,胼胝质也出现在花粉管发育的正常过程中(Ferguson et al., 1998),在棉花纤维次生壁合成的早期阶段(Maltby et al., 1979),以及在小孢子发生(microsporogenesis)和大孢子发生(megasporogenesis)期间暂时出现(Rodkiewicz, 1970; Horner and Rogers, 1974)。胼胝质也短暂地与分裂细胞的细胞板相关(Samuels et al., 1995)。胼胝质在组织学上以其与间苯二酚蓝(resorcin blue)作为染料或碱性苯胺(alkaline aniline)作为荧光染料的染色反应为特征(Eschrich and Currier, 1964; Kauss, 1989)。在透射电子显微镜切片中,胼胝质可以通过使用特异性抗体探针进行免疫金标记(Benhamou, 1992; Dahiya and Brewin, 2000)。
木质素是主要沉积在支持和传导组织细胞壁中的酚类聚合物
木质素(lignin)是由三种主要单体单元聚合而成的酚类聚合物(phenolic polymers),这三种单体分别是\pmb{p}-香豆醇(\pmb{p}-coumaryl alcohol)、松柏醇(coniferyl alcohol)和芥子醇(sinapyl alcohol)(Ros Barcel6, 1997; Whetten et al., 1998; Hatfield and Vermerris, 2001)。通常,根据木质素是来自裸子植物(gymnosperms)、木本被子植物(woody angiosperms)还是草本植物(grasses),将其分为愈创木基木质素(guaiacyl lignin)(主要由松柏醇形成)、愈创木基-紫丁香基木质素(guaiacyl-syringyl lignin)(松柏醇和芥子醇的共聚物)或愈创木基-紫丁香基-对羟基苯基木质素(guaiacyl-syringyl-phydroxyphenyl lignins)(由所有三种单体形成)。然而,必须谨慎对待这种广泛的概括。"裸子植物木质素"和"被子植物木质素"的结构充其量只适用于相应木材的次生木质部()中的木质素(Monties, 1989)。不同物种、器官、组织甚至细胞壁组分的木质素单体组成存在很大差异(Wu, 1993; Terashima et al., 1998; Whetten et al., 1998; Sederoff et al., 1999; Grünwald et al., 2002)。所有木质素都含有一些对羟基苯基木质素(\boldsymbol{p}-hydroxyphenyl lignins),尽管它们通常被忽视。此外,在裸子植物和被子植物中都发现了愈创木基木质素和愈创木基-紫丁香基木质素(Lewis and Yamamoto, 1990)。
典型的木质化(lignification)过程始于细胞角落的胞间物质(intercellular substance),并延伸到角落之间的中层(intercorner middle lamellae);然后扩散到最初形成的(初生)壁层(primary wall layers),最后扩散到最后形成的(次生)壁层(secondary wall layers)(Terashima et al., 1993; Higuchi, 1997; Terashima, 2000; Grünwald et al., 2002)。也有报道了其他木质化模式(Calvin, 1967; Vallet et al., 1996; Engels and Jung, 1998)。显然,木质素与壁多糖(wall polysaccharides)共价连接(Iiyama et al., 1994)。在烟草和拟南芥(Arabidopsis thaliana)纤维次生壁形成过程中,通过基因下调肉桂酰GA还原酶(cinnamoyl GA reductase)的实验结果表明,木质素聚合模式可能在决定多糖基质的三维组织中起重要作用(Ruel et al., 2002)。
木质素不仅限于沉积次生壁的细胞的初生壁。例如,据报道,在快速扩展的玉米胚芽鞘薄壁细胞(maize coleoptile parenchyma cells)的整个初生壁中都存在木质素(Müsel et al., 1997)。此外,木质素通常沉积在薄壁组织(parenchymatous elements)的初生壁中,以响应受伤或寄生虫或病原体的攻击(Walter, 1992)。
木质化是一个不可逆的过程,通常先于纤维素和非纤维素基质成分(半纤维素(hemicelluloses)、果胶(pectins)和结构蛋白(structural proteins))的沉积(Terashima et al., 1993; Hafrén et al., 1999; Lewis, 1999; Grünwald et al., 2002)。木质素是一种疏水性填充物,取代了壁中的水(图4.4)。在胞间物质中,木质素作为粘合剂,赋予木质茎抗压强度(compressive strength)和弯曲刚度(bending stiffness)。木质素对壁的抗拉强度(tensile strength)没有影响(Grisebach, 1981)。
通过使木质部壁防水,木质素限制了横向扩散,从而促进了导水木质部中水分的纵向运输。有人认为,这可能是木质素在进化过程中的主要功能之一。
木质素在植物进化中起着重要作用(Monties, 1989)。木质素的机械刚性增强了木质部的强度,使得管状分子能够承受蒸腾作用产生的负压而不会导致组织塌陷。木质化的细胞壁对微生物攻击具有抵抗力(Vance 等,1980;Nicholson 和 Hammerschmidt,1992)。木质素最初可能作为抗菌剂发挥作用,后来在陆地植物的进化中才承担起水分运输和机械支持的作用(Sederoff 和 Chang,1991)。
两种测试,Wiesner 测试和 Mäule 测试,通常用于木质素的定性测定(Vance 等,1980;Chen,1991;Pomar 等,2002)。Wiesner 测试适用于所有木质素。在该测试中,含有木质素的组织细胞壁在浓盐酸中与间苯三酚反应时会呈现明亮的紫红色。主要是紫丁香基木质素的反应较弱。Mäule 测试对紫丁香基团具有特异性。在该测试中,含有紫丁香基木质素的组织细胞壁在依次用高锰酸钾水溶液、盐酸和氨水处理后,会呈现深玫瑰红色。多克隆木质素抗体也可用于不同木质素类型的免疫金标记(Ruel 等,1994;Grünwald 等,2002)。
角质和木栓质是不溶性脂质聚合物,最常见于植物的保护性表面组织中
角质和木栓质的主要功能是形成一种基质,其中嵌入了蜡质——长链脂质化合物(Post-Beittenmiller,1996)。角质-蜡或木栓质-蜡的组合共同形成屏障层,有助于防止植物地上部分的水分和其他分子的流失(Kolattukudy,1980)。
角质及其嵌入的蜡质形成角质层,覆盖所有地上部分表皮表面。角质层包含数层,含有不同量的角质、蜡质和纤维素(第9章)。
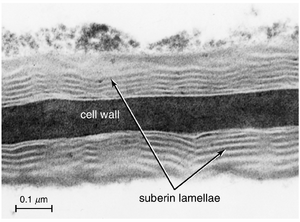
木栓质(Suberin)是次生保护组织——木栓(phellem)(第15章)、根的内皮层和外皮层细胞,以及许多莎草科(Cyperaceae)、灯心草科(Juncaceae)和禾本科(Poaceae)植物叶脉周围的维管束鞘细胞壁的主要成分。除了减少植物地上部分的水分流失外,木栓质还限制了水和溶质通过细胞壁的质外体(apoplastic)运动,并形成了一道阻止微生物入侵的屏障。细胞壁中的木栓质以存在两个结构域为特征:一个多酚(polyphenolic)结构域和一个多脂肪族(polyaliphatic)结构域(Bernards and Lewis, 1998; Bernards, 2002)。多酚结构域整合在初生壁内,并与多脂肪族结构域共价连接,后者沉积在初生壁的内表面,即初生壁与质膜之间。在电子显微镜下观察,多脂肪族结构域呈现片层状或层状外观,明暗带交替出现(图4.5)。据推测,明带主要由脂肪族区域组成,而暗带则富含酚类物质,并且非常长链的脂肪酸和蜡质可能跨越连续的片层带或嵌入多脂肪族结构域的聚酯网络中(Bernards, 2002)。过去,人们认为明带主要由蜡质组成,而暗带则由木栓质组成(Kolattukudy and Soliday, 1985)。一些角质层也具有片层状外观。
❙ 细胞壁的层
植物细胞壁的厚度差异很大,部分取决于细胞所起的作用,部分取决于单个细胞的年龄。通常,年轻细胞的壁比发育完全的细胞薄,但在某些细胞中,细胞停止生长后壁不会明显增厚。每个原生质体从外向内形成其壁,因此给定壁的最年轻层位于最内侧,紧邻原生质体。最初形成的纤维素层构成了初生壁。相邻细胞初生壁的结合区域称为中层(middle lamella)或胞间物质(intercellular substance)。许多细胞会沉积额外的壁层;这些形成了次生壁。次生壁在初生壁之后沉积,由细胞的原生质体沉积在初生壁的内表面(图4.1)。
中层通常难以与初生壁区分
在发育出厚次生壁的细胞中,尤其难以区分中层和初生壁。在中层和初生壁之间的区别变得模糊的细胞中,两个相邻的初生壁和中层,也许还有次生壁的第一层,可能被称为复合中层(compound middle lamella)。因此,复合中层一词有时意味着三层结构,有时意味着五层结构(Kerr and Bailey, 1934)。
电子显微镜很少能显示出中层(intercellular layer)是一个界限分明的层,除非在细胞角落处,那里的细胞间物质最为丰富。中层的识别主要基于微量化学测试和浸解技术。中层主要由果胶质(pectic substance)组成,但在具有次生壁的细胞中常常会木质化(lignified)。
初生壁在细胞体型增大期间沉积
初生壁(primary wall)由最早形成的壁层组成,在细胞生长之前和生长期间沉积。活跃分裂的细胞通常只有初生壁,大多数参与光合作用(photosynthesis)、分泌(secretion)和储存(storage)等代谢过程的成熟细胞也是如此。这些细胞的初生壁相对较薄,具有次生壁的细胞初生壁通常也很薄。然而,初生壁可能达到相当大的厚度,例如在茎和叶的厚角组织(collenchyma)以及一些种子的胚乳(endosperm)中,尽管有些人认为这些壁的增厚是次生的(Frey-Wyssling, 1976)。厚的初生壁可能显示出分层或多层结构(polylamellate texture),这是由于纤维素微纤丝(cellulose microfibrils)的取向在不同层之间发生变化所致(见下文)。无论壁的厚度如何,只有初生壁的活细胞可能会移除先前获得的增厚,失去其特化的细胞形态,分裂并分化成新的细胞类型。因此,主要是只有初生壁的细胞参与植物的伤口愈合(wound healing)和再生(regeneration)。
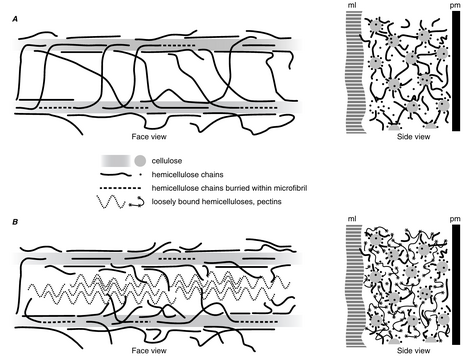
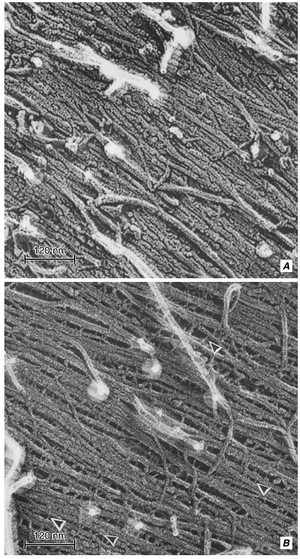
目前关于初生(生长)细胞壁结构的模型设想了一个由纤维素微纤丝与半纤维素(hemicellulose)(如木葡聚糖(xyloglucan))交织而成的网络,并嵌入果胶(pectin)凝胶中。在一个模型中(图4.6A),半纤维素包覆在纤维素表面,与其非共价结合,并形成交联(cross-links)或系链(tethers),将纤维素微纤丝结合在一起。据估计,这种纤维素-木葡聚糖网络可能贡献了正常初生壁总强度的70%(Shedletzky et al., 1992)。电子显微镜提供了纤维素-半纤维素交联的证据(图4.7; McCann et al., 1990; Hafrén et al., 1999; Fujino et al., 2000)。Pauly等人(1999)在Pisum sativum的茎细胞壁中发现了三个不同的木葡聚糖组分。大约8%的壁干重由可通过木葡聚糖特异性内切葡聚糖酶(xyloglucan-specific endoglucanase)处理溶解的木葡聚糖组成。这种材料对应于被提议形成纤维素微纤丝之间交联的木葡聚糖域。简而言之,第二个域(占壁干重的10%)由被提议与纤维素微纤丝表面紧密相关的木葡聚糖组成,第三个域(占壁干重的3%)由被提议困在纤维素微纤丝内部或之间的木葡聚糖组成。
在另一种初生壁(primary wall)的模型中(图4.6B),没有直接的微纤丝-微纤丝连接。相反,与微纤丝紧密结合的半纤维素(hemicellulose)被包裹在一层结合较松的半纤维素中,后者又嵌入果胶基质(pectin matrix)中,填充微纤丝之间的空隙(Talbott and Ray, 1992)。在这个模型中,壁的强度可能部分取决于横向排列的基质分子(matrix molecules)之间的许多非共价相互作用(noncovalent interactions)(Cosgrove, 1999)。值得注意的是,一项利用固态^{13}{C}核磁共振波谱(nuclear magnetic resonance spectroscopy)的研究发现,在三种单子叶植物(Italian ryegrass、pineapple和onion)和一种真双子叶植物(eudicot)(cabbage)的初生细胞壁中,纤维素和半纤维素之间几乎没有实质性相互作用的证据(Smith, B. G., et al., 1998)。然而,作者认为,相对少量的半纤维素分子就足以交联纤维素微纤丝。在拟南芥(Arabidopsis thaliana)的初生细胞壁中也报道了类似的发现(Newman et al., 1996)。纤维素微纤丝的平均取向显然是决定细胞壁机械性能的关键因素(Kerstens et al., 2001)。
次生壁(secondary wall)主要在初生壁停止增加表面积后沉积在初生壁内部
虽然通常认为次生壁是在初生壁表面积停止增加后沉积的,但长期以来就有证据表明,次生壁的初始层会略微延伸,因为其沉积在壁表面积停止增加之前就开始了(Roelofsen, 1959)。在针叶树管胞(conifer tracheids)(Abe et al., 1997)和竹秆纤维(bamboo culms fibers)(MacAdam and Nelson, 2002; Gritsch and Murphy, 2005)中,都报道了次生壁沉积在细胞扩张停止之前就开始了。
次生壁在具有强化功能的特化细胞和参与水分传导的细胞中尤为重要;在这些细胞中原生质体()在次生壁()沉积后通常会死亡。次生壁中的纤维素(cellulose)含量比初生壁(primary wall)中更丰富,而果胶物质(pectic substances)则缺失;因此次生壁较为坚硬且不易拉伸。在初生细胞壁()中相对丰富的结构蛋白()和酶(),在次生壁中显然要么缺失,要么含量很少。如前所述,一种类似于伸展蛋白(extensin-like protein)的蛋白质已被定位在成熟火炬松(Pinus taeda)木材的次生壁中(Bao et al., 1992)。木质素(lignin)在木材细胞的次生壁中很常见。
在厚壁木材细胞中,次生壁通常可以区分为三个不同的层——分别称为S1、S2和S3,分别代表外层、中层和内层。S2层是最厚的。S3层可能非常薄或完全缺失。一些木材解剖学家认为S3层与S1和S2层有足够大的区别,可以称为三生壁(tertiary wall)。
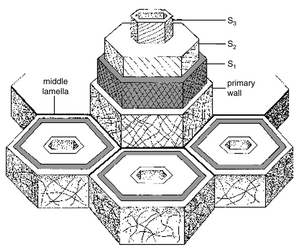
次生壁分为三个S层主要是由于这三层中微纤丝()的不同取向(Frey-Wyssling, 1976)。通常,微纤丝在各层中呈螺旋状排列(图4.8)。在S1中,纤维沿着交叉螺旋排列,与细胞长轴形成大角度,因此这一层具有高度的双折射性(birefringent)。在S2中,角度较小且螺旋的斜率较陡;因此这一层中的纤维素微纤丝在偏光显微镜下不显现。在S3中,微纤丝的沉积方式与S1类似,与细胞长轴形成大角度。至少在某些木材纤维中,S1和S2层通过具有螺旋纹理的过渡区相互连接(Vian et al., 1986; Reis and Vian, 2004)。初生壁与次生壁的不同之处在于其微纤丝的排列较为随机。在大多数木本植物的纤维和管胞中,S3层的内表面覆盖着一层非纤维素膜,通常带有称为疣状突起(warts)的块状物。这些疣状突起曾被认为是由分解的原生质体残留的细胞质碎片组成,但现在被认为是主要由木质素前体(lignin precursors)形成的细胞壁突起(Frey-Wyssling, 1976; Castro, 1991)。
❙ 纹孔(PITS)和初生纹孔场(PRIMARY PIT-FIELDS)
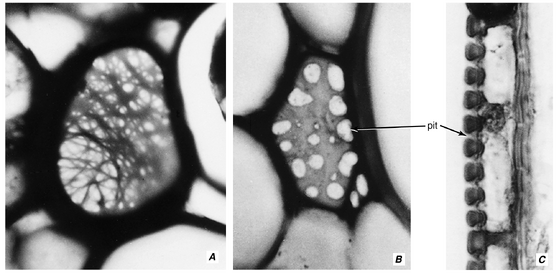
次生细胞壁通常以存在称为纹孔(pits)的空腔为特征(图4.9B-D和4.10B,C)。细胞壁中的纹孔通常与相邻细胞壁中的纹孔相对出现,两个相对的纹孔构成一个纹孔对(pit-pair)。两个纹孔腔之间的中层(middle lamella)和两个初生壁(primary walls)称为纹孔膜(pit membrane)。纹孔在细胞个体发育(ontogeny)过程中产生,是次生壁物质差异性沉积的结果;纹孔膜上没有沉积任何物质,因此纹孔是次生壁中的实际不连续处。
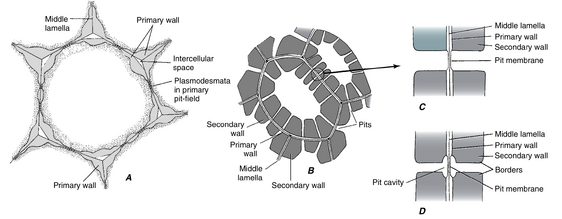
次生壁有纹孔,而初生壁有初生纹孔(primary pits),它们是初生壁中的薄区域,而不是中断处(图4.9A和4.10A)。在本书中,术语初生纹孔场(primary pit-field)用于描述单个初生纹孔和初生纹孔簇。在次生壁沉积过程中,纹孔在初生纹孔场上形成。一个初生纹孔场上可能会产生多个纹孔。
胞间连丝(plasmodesmata)通常聚集在初生纹孔场中(图4.9A)。当次生壁发育时,胞间连丝保留在纹孔膜中,作为相邻细胞原生质体(protoplasts)之间的连接。胞间连丝不仅限于初生纹孔场。在厚度均匀的壁中,胞间连丝分散分布是很常见的。此外,在许多情况下,初生壁在胞间连丝出现的地方会特别增厚。
纹孔的大小和详细结构各不相同(第8章和第10章),但在具有次生壁的细胞中可识别出两种主要类型:单纹孔(simple pits)和具缘纹孔(bordered pits)(图4.9C,D)。这两种纹孔的基本区别在于,在具缘纹孔中,次生壁拱起覆盖纹孔腔,并缩小其通向细胞内部的开口。拱起的次生壁构成缘(border)。在单纹孔中,没有这种拱起。在具缘纹孔中,由缘包围的腔体部分称为纹孔室(pit chamber),缘中的开口称为纹孔口(aperture)。
单纹孔的组合称为单纹孔对(simple pit-pair),而两个相对的具缘纹孔则称为具缘纹孔对(bordered pit-pair)。在木质部中可以发现单纹孔和具缘纹孔的组合,称为半具缘纹孔对(half-bordered pit-pair)。一个纹孔可能没有互补结构,例如当它与细胞间隙相对时。这种纹孔称为盲纹孔(blind pits)。此外,两个或多个纹孔可能与相邻细胞中的单个纹孔相对,这种组合被称为unilaterally compound pitting。
单纹孔存在于某些薄壁组织细胞、木质部外纤维和石细胞(sclereids)中(第8章)。在单纹孔中,腔的宽度可能是均匀的,或者朝向细胞腔可能略变宽或略变窄。如果它朝向细胞腔变窄,这个单纹孔在结构上即与具缘纹孔有过渡。根据次生壁的厚度,单纹孔可能较浅,也可能形成从细胞腔延伸到纹孔膜的管道。随着壁厚度的增加,纹孔可能会合并并形成分枝(branched或ramiform,来自拉丁语ramus,意为分支)的纹孔(第8章)。
单纹孔和具缘纹孔都存在于管状分子(tracheary elements)的次生壁中(第10章和第11章)。在针叶树管胞中,具缘纹孔对具有特别复杂的结构(第10章)。
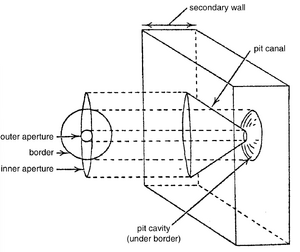
如果次生壁非常厚,纹孔缘也相应地厚。这种纹孔的腔室相当小,并通过纹孔缘中的狭窄通道(纹孔道)与细胞腔相连。纹孔道有一个通向纹孔腔的外开口和一个面向细胞腔的内开口。在某些纹孔中,纹孔道类似于压缩的漏斗,其两个开口在大小和形状上有所不同(图4.11)。外开口小而圆形,内开口则延伸且呈狭缝状。在纹孔对中,两个纹孔的内开口相互交叉(第10章)。这种排列与次生壁中微纤丝的螺旋沉积有关。
❙ 细胞分裂过程中细胞壁的起源
细胞质分裂通过形成成膜体和细胞板进行
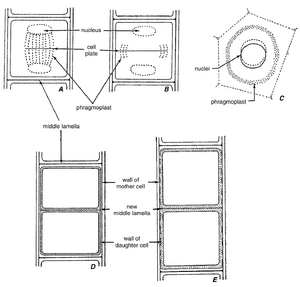
在营养生长期间,细胞分裂(cytokinesis)通常紧随核分裂(karyokinesis,或有丝分裂(mitosis))之后。母细胞分裂,形成两个子细胞。细胞质分裂在后期晚期开始,伴随着成膜体(phragmoplast)的形成,成膜体最初是一个桶状微管系统——有丝分裂纺锤体的残余——出现在两组子染色体之间(图4.12A)。成膜体与之前的有丝分裂纺锤体一样,由两组相对且重叠的微管组成,这些微管在分裂平面的两侧形成(图4.12A中未描绘)。肌动蛋白丝也是成膜体的重要组成部分,它们同样垂直于分裂平面排列。与微管不同,肌动蛋白丝虽然组织成两组相对的结构,但并不重叠。
phragmoplast(成膜体)作为细胞板(cell plate)组装的框架,是子细胞之间的初始分隔(图4.13)。细胞板由高尔基体来源的囊泡融合形成,这些囊泡显然是由phragmoplast微管(microtubules)引导到分裂平面的,可能还得到了马达蛋白(motor proteins)的帮助。肌动蛋白丝(actin filaments)的作用尚不明确。当细胞板开始形成时,phragmoplast并未延伸到分裂细胞的壁。在细胞板扩展过程中,phragmoplast微管在中心解聚,并在细胞板边缘重新聚合。细胞板——在phragmoplast的引导下(图4.12B, C)——向外(离心式)生长,直到到达分裂细胞的壁,完成两个子细胞的分离。值得注意的是,除了微管和肌动蛋白丝外,一些研究者还将早期与发育中的细胞板相关的高尔基体来源的囊泡和内质网(endoplasmic reticulum)视为phragmoplast的一部分(Staehelin and Hepler, 1996; Smith, L. G., 1999)。
细胞板形成的实际过程相当复杂,包括几个阶段(图4.14;Samuels et al., 1995;Staehelin and Hepler, 1996;Nebenführ et al., 2000;Verma, 2001):
- 高尔基体来源的囊泡到达分裂平面;
- 形成20纳米的管状结构(融合管,fusion tubes),这些管状结构从囊泡中生长出来并与其他管状结构融合,形成一个连续的、交织的管状-囊泡网络,具有致密的纤维状外衣;
- 管状-囊泡网络转变为管状网络,然后转变为有孔的板状结构,在此期间,致密的膜外衣和相关的phragmoplast微管被解聚;
- 在细胞板边缘形成许多指状突起,这些突起与母细胞壁的质膜融合;
- 细胞板成熟为新的细胞壁。后一阶段包括孔的闭合。此时,管状内质网的片段被捕获在发育中的壁内,并形成胞间连丝(plasmodesmata)。在phragmoplast细胞骨架消失后不久,新形成的细胞板开始在cress(Lepidium sativum)和玉米的根细胞中成熟,肌球蛋白(myosin)开始定位在新形成的胞间连丝中(Reichelt et al., 1999;Baluška et al., 2000)。同时,肌动蛋白丝束似乎附着在胞间连丝上。
许多蛋白质被认为参与了细胞板的形成(Heese et al., 1998;Smith, L. G., 1999;Harper et al., 2000;Lee, Y.-R. J., and Liu, 2000;Otegui)。
图 4.13 烟草(Nicotiana tabacum)叶肉细胞早期胞质分裂的细节。细胞板仍由单个囊泡组成。成膜体微管(phragmoplast microtubules)出现在细胞板的两侧,有些穿过细胞板。图中显示了两个未来子核之一的染色体物质。(引自Esau, 1977。)
以及Staehelin, 2000; Assaad, 2001)。例如,phragmoplastin(一种类似于dynamin的蛋白质)与绿色荧光蛋白融合后,已被定位到烟草BY-2细胞中正在发育的细胞板上(Gu和Verma, 1997)。Phragmoplastin可能参与了细胞板上融合管(fusion tubes)的形成和囊泡的融合。在转基因烟草幼苗中过度表达phragmoplastin会导致细胞板上胼胝质(callose)的积累,并抑制植物生长(Geisler-Lee等, 2002)。更直接的功能证据表明,拟南芥(Arabidopsis thaliana)的KNOLLE蛋白参与了细胞板的形成(Lukowitz等, 1996)。KNOLLE是一种与syntaxin相关的蛋白质,显然作为成膜体运输的囊泡的对接受体(docking receptor)。在缺乏KNOLLE蛋白的情况下,囊泡无法融合(Lauber等, 1997)。
最初,胼胝质是发育中的细胞板中存在的主要细胞壁多糖
胼胝质在细胞板发育的管状囊泡阶段(tubulo-vesicular stage)开始积累,但在管状网络转化为网状片层(fenestrated sheet)时最为丰富。有人认为,胼胝质可能对膜施加了扩展力,促进它们转化为板状结构(Samuels等, 1995)。
纤维素和基质成分的沉积模式以及它们在发育中的细胞板中最终取代胼胝质的过程尚不明确。在烟草BY-2细胞中,木葡聚糖(xyloglucans)和果胶(pectins)从管状囊泡阶段开始定位,但它们的浓度似乎只有在细胞板完成后才显著增加(Samuels等, 1995)。当细胞板达到网状片层阶段时,纤维素开始大量合成。相比之下,在菜豆(Phaseolus vulgaris)根分生组织细胞中,据报道纤维素、半纤维素(hemicelluloses)和果胶同时沿细胞板沉积(Matar和Catesson, 1988)。
根据一个长期持有的观点(Priestly 和 Scott,1939),当子原生质体(daughter protoplasts)扩张时,初生壁(primary wall)在细胞板(cell plate)对面破裂,细胞板——被视为新的中层(middle lamella)——与母细胞壁融合。然后,新的、向心发展的中层与拉伸和破裂的母细胞壁外的母细胞中层接触。最近的研究表明,细胞板本身并不是中层,并且果胶中层(pectic middle lamella)直到细胞板与母细胞壁接触后才开始发育。然后,中层在与母细胞壁的连接处从细胞板内向心(从外向内)延伸(Matar 和 Catesson,1988)。在此之前,该连接处会形成一个支撑状区域(buttress-like zone)。支撑状区域是纤维结构(fibrillar architecture)一系列变化的起点,最终导致两个壁的纤维骨架(fibrillar skeleton)融合和连续。然后,母细胞壁的中层产生一个楔形突起,穿透支撑状区域并向细胞板推进。
早前期带(Preprophase Band)预测未来细胞板的分裂平面
在细胞分裂之前,细胞核会为分裂事件占据一个适当的位置。如果即将分裂的细胞高度液泡化,一层细胞质,即成膜体(phragmosome),
图 4.14
细胞板发育的阶段。A,高尔基体衍生的分泌小泡(sv)在赤道区融合,位于成膜体微管(mt)和细胞质模糊基质(fm)之间。B,融合的高尔基体衍生小泡形成覆盖有“模糊外衣”的管状-小泡网络。C,随着管状-小泡网络(TvN)的管腔被细胞壁多糖(尤其是胼胝质)填充,形成管状网络(TN)。围绕网络的模糊基质和微管消失,进一步将这一阶段与管状-小泡网络区分开来。D,管状区域扩张,形成几乎连续的片层。许多指状突起从细胞板的边缘延伸,并与母细胞壁(pcw)的质膜(pm)在早前期带先前占据的位置融合。E,细胞板成熟为新细胞壁。(改编自 Samuels 等,1995。经 The Journal of Cell Biology 1995, vol. 130, 1345–1357 的版权许可转载,版权归洛克菲勒大学出版社所有。)
横跨未来的分裂平面扩展,细胞核位于这一层中(图4.15;Sinnott和Bloch,1941;Gunning,1982;Venverloo和Libbenga,1987)。phragmosome(phragmosome)包含微管(microtubules)和肌动蛋白丝(actin filaments)(Goosen-de Roo等,1984),这两者显然都与其发育有关。此外,大多数营养细胞显示出前前期带(preprophase band),即微管和肌动蛋白丝的皮层带,它预测了未来细胞板(cell plate)的平面(Gunning,1982;Gunning和Wick,1985;Vos等,2004)。通过共聚焦激光扫描显微镜(confocal-laser-scanning microscopy)检查Pinus brutia的根尖细胞分裂,使用免疫定位技术(immunolocalization techniques)识别微管和内质网(endoplasmic reticulum,ER),发现ER的管状结构在前前期带的位置形成了密集的环状结构(Zachariadis等,2001)。
图4.15
高度液泡化细胞中的细胞分裂。A,最初,细胞核位于细胞的一侧壁,细胞中含有一个大的中央液泡。B,细胞质丝穿透液泡,为细胞核迁移到细胞中心提供了路径。C,细胞核到达细胞中心,并通过许多细胞质丝悬浮在那里。一些细胞质丝开始合并形成phragmosome(phragmosome),细胞分裂将通过phragmosome进行。D,phragmosome完全形成,形成一个将细胞平分的层。E,当有丝分裂完成时,细胞将在phragmosome占据的平面分裂。(由W. H. Freeman提供;根据Venverloo和Libbenga,1987。© 1987,经Elsevier许可。)
“ER前前期带”(ER preprophase band)的发育与“微管前前期带”(microtubule preprophase band)的发育非常相似。前前期带在有丝分裂纺锤体(mitotic spindle)启动和核膜(nuclear envelope)破裂后消失(Dixit和Cyr,2002),远在细胞板(cell plate)启动之前,然而发育中的细胞板与母体壁精确地融合在早期由前前期带划定的区域。肌动蛋白丝(actin filaments)被发现连接了phragmoplast-cell plate(phragmoplast-cell plate)的前缘和该区域附近的皮层肌动蛋白网络(cortical actin network)(Lloyd和Traas,1988;Schmit和Lambert,1988;Goodbody和Lloyd,1990)。这些丝可能通过基于肌动蛋白-肌球蛋白(acto-myosinbased)的机制帮助引导细胞板的生长(Molchan等,2002)。在一些液泡化细胞中,有丝分裂纺锤体和phragmoplast(phragmoplast)横向位移,生长的细胞板在发育早期锚定在细胞的一侧,这种细胞质分裂(cytokinesis)模式被Cutler和Ehrhardt(2002)称为“极化细胞质分裂”(polarized cytokinesis)。
❙ 细胞壁的生长
在细胞板完成后,额外的壁物质沉积在其两侧,导致新分隔的厚度增加。新的壁物质以镶嵌方式沉积在每个子原生质体(protoplasts)周围,因此分生组织细胞(meristematic cells)的新壁以多糖(polysaccharides)的异质分布为特征(Matar和Catesson,1988)。
基质材料(matrix materials),包括糖蛋白(glycoproteins),通过高尔基体囊泡(Golgi vesicles)被输送到细胞壁。相比之下,纤维素微纤丝(cellulose microfibrils)由纤维素合酶复合体(cellulose synthase complexes)合成,这些复合体呈现为跨越质膜的六边形排列的六个颗粒组成的环状或玫瑰花结状结构(图4.16; Delmer and Stone, 1988; Hotchkiss, 1989; Fujino and Itoh, 1998; Delmer, 1999; Hafrén et al., 1999; Kimura et al., 1999; Taylor et al., 2000)。每个玫瑰花结从葡萄糖衍生物UDP-葡萄糖(uridine diphosphate glucose)合成纤维素。通过对突变体的分析,已经鉴定出拟南芥(Arabidopsis)中纤维素合成所需的两种酶,CesA糖基转移酶(CesA glycosyltransferases)和KOR膜相关内切-1,4-β-葡聚糖酶(KOR membrane-associated endo-1,4-β-glucanases) (Williamson et al., 2002)。CesA蛋白是纤维素合酶复合体的组成部分,该复合体可能包含18到36个这样的蛋白质。在发育中的拟南芥木质部导管(xylem vessels)的次生细胞壁(secondary cell wall)中,至少需要三种CesA蛋白来进行纤维素合成(Taylor et al., 2000, 2003)。此外,这三种CesA蛋白对于将这些蛋白质正确定位到与细胞壁增厚相关的质膜区域是必需的(Gardiner et al., 2003b)。在次生细胞壁形成开始之前,皮层微管(cortical microtubules)在次生细胞壁形成的位置组装,并且需要持续存在以维持正常的CesA蛋白定位(Gardiner et al., 2003b)。
在纤维素合成过程中,玫瑰花结在膜平面内移动,并在膜的外表面分泌微纤丝。由内质网(endoplasmic reticulum)形成的玫瑰花结通过高尔基体囊泡插入质膜(Haigler and Brown, 1986),并显然被纤维素微纤丝的合成(聚合)和结晶力推动前进(Delmer and Amor, 1995)。
图4.16
与Zinnia elegans分化中的管状分子(tracheary element)中纤维素微纤丝生物发生相关的玫瑰花结的冷冻断裂复型(freeze fracture replicas)。这里显示的玫瑰花结存在于最接近细胞质的质膜双层(plasma membrane bilayer)的叶片中(PF面)。主显微照片中显示了几个玫瑰花结(用圆圈包围)。插图显示了一个在超低温下用最小量的铂/碳进行高分辨率旋转阴影(rotary shadowing)后的玫瑰花结的更高放大倍数图像。(由Mark J. Grimson和Candace H. Haigler提供)
在伸长植物细胞和木质部导管次生壁加厚下的纤维素微纤丝取向通常与下方的皮层微管(cortical microtubules)平行。这一观察结果导致了一个被广泛接受的假说——由Baskin (2001)命名为对齐假说(alignment hypothesis)——即新生纤维素微纤丝的取向由下方的皮层微管决定(Abe et al., 1995a, b; Wymer and Lloyd, 1996; Fisher, D. D., and Cyr, 1998),这些微管通过质膜(plasma membrane)平面引导玫瑰花结(rosettes) (Herth, 1980; Giddings and Staehelin, 1988)。然而,对齐假说似乎不足以解释非伸长植物细胞中壁的沉积,在这些细胞中皮层微管与新生微纤丝不平行(综述见Emons et al., 1992和Baskin, 2001)。此外,使用药物和拟南芥(Arabidopsis)温度敏感突变体(mor1-1)的研究表明,皮层微管的紊乱或完全丧失对扩展根细胞中纤维素微纤丝的平行排列几乎没有影响(Himmelspach et al., 2003; Sugimoto et al., 2003)。
其他假说也被提出来解释纤维素微纤丝沉积的机制。其中之一是液晶自组装假说(liquid crystalline self-assembly hypothesis)。注意到螺旋细胞壁(helicoidal cell walls)(见下文)的相似性,其纤维素微纤丝与皮层微管不匹配,以及胆甾型液晶(cholestric liquid crystals),Bouligand (1976)提出螺旋壁结构可能源于液晶自组织原理。(参见Emons和Mulder, 2000对该假说的批评。)
Baskin (2001)提出了一个模板结合机制(template incorporation mechanism),其中新生微纤丝可以通过微管定向,或者通过结合到围绕已经结合的微纤丝或膜蛋白或两者构建和定向的支架上而结合到细胞壁中。在这个模型中,皮层微管用于结合和定向质膜上的支架成分。微管对于纤维素合成或纤维素微纤丝的形成不是必需的。
基于对木贼(Equisetum hyemale)根毛螺旋(次生)细胞壁结构的广泛观察,已经制定了一个纤维素微纤丝沉积的几何模型(Emons, 1994; Emons和Mulder, 1997, 1998, 2000, 2001)。该模型纯粹是数学的,定量地将纤维素微纤丝的沉积角度(相对于细胞轴)与(1)质膜中活性合酶(synthases)的密度,(2)层内单个微纤丝之间的距离,以及(3)细胞的几何形状联系起来。该模型中的关键因素是玫瑰花结轨迹的耦合,从而将正在沉积的微纤丝的取向与活性玫瑰花结的局部数量或密度联系起来。这为细胞提供了一种通过创建活性玫瑰花结数量的受控局部变化来操纵细胞壁结构的途径(Emons和Mulder, 2000; Mulder和Emons, 2001; Mulder et al., 2004)。反馈机制将防止玫瑰花结的密度超过由细胞几何形状决定的最大值。
电子显微镜显示,皮质微管(cortical microtubules)通过蛋白质交联桥(protein cross-bridges)连接到质膜(plasma membrane)的内小叶(inner leaflet)上(Gunning 和 Hardham,1982;Vesk 等,1996)。对烟草(Nicotiana tabacum)(Marc 等,1996;Gardiner 等,2001;Dhonukshe 等,2003)和拟南芥(Arabidopsis)(Gardiner 等,2003a)质膜的研究表明,这种蛋白质是一种分子量为90 kDa的蛋白质,即磷脂酶D(phospholipase D, PLD)。研究表明,PLD产生的信号分子磷脂酸(phosphatidic acid, PA)可能是拟南芥中微管正常组织和正常生长所必需的(Gardiner 等,2003a)。
初生壁中纤维素微纤丝的排列方向影响细胞扩展的方向
在向各个方向均匀扩展的细胞中,微纤丝以随机排列(多方向性)的方式沉积,形成不规则的网络。这种细胞存在于茎的髓部、贮藏组织以及组织培养中。相比之下,在许多伸长的细胞中,侧壁或侧壁的微纤丝以近似垂直于伸长轴的方向(横向)沉积。随着壁表面积的增加,外层微纤丝的排列方向逐渐接近纵向,或与细胞的长轴平行,仿佛被细胞扩展被动地重新定向(多网生长假说(multinet growth hypothesis))(Roelofsen,1959;Preston,1982)。微纤丝的纵向排列主要促进横向扩展(Abe 等,1995b)。
初生细胞壁的结构并不总是像多网生长假说所描述的细胞那样简单。在许多细胞中,纤维素微纤丝沉积的方向会周期性变化,从而形成具有螺旋结构(helicoidal structure)的壁,这种结构由排列成一层微纤丝厚度的片层(lamellae)的纤维素微纤丝组成。每个片层内的纤维素微纤丝在一个平面上大致平行排列,并围绕细胞形成螺旋。在连续的片层之间,倾斜角度相对于前一片层发生旋转(Satiat-Jeunemaitre 等,1992;Vian 等,1993;Wolters-Arts 等,1993;Emons,1994;Wymer 和 Lloyd,1996)。
这种被称为多片层(polylamellate)的螺旋状壁结构也存在于各种初生壁和次生壁中。
最显著的螺旋型壁纹结构见于次生壁(图4.2和4.17;Roland等,1989;Emons和Mulder,1998;Reis和Vian,2004)。多片层或螺旋型初生细胞壁已在薄壁组织(Deshpande,1976b;Satiat-Jeunemaitre等,1992)、厚角组织(Chafe,1970;Deshpande,1976a;Vian等,1993)和表皮(Chafe和Wardrop,1972;Satiat-Jeunemaitre等,1992)细胞以及筛管的珠光壁层(Deshpande,1976c)中记录到。厚角组织细胞的初生壁通常被描述为具有交叉多片层结构,其中微纤丝一般呈横向排列的片层与一般呈纵向或垂直排列的片层交替出现。这些取向可能分别代表浅螺距和陡螺距的螺旋(Chafe和Wardrop,1972)。在细胞扩展或伸长过程中,初生壁的螺旋组织可能完全分散,逐渐从螺旋型转变为随机模式。当厚角组织细胞的延伸停止时,螺旋沉积模式通常会继续加厚细胞壁(Vian等,1993)。
螺旋型细胞壁的存在,其连续层中的纤维素微纤丝以不同角度排列,使得观察微管经历如此快速的重新取向变得困难。微管阵列的角度确实会发生变化以匹配每一新微纤丝层的角度,这一点已在针叶树Abies sachalinensis(日本黑松)的管胞(Abe等,1995a,b)和被子植物Aesculus hippocastanum(七叶树)次生木质部的纤维(Chaffey等,1999)中得到证实。此外,在对Pisum sativum微注射表皮细胞的研究中,发现一些罗丹明标记的微管从横向到纵向的重新排列速度可快至40分钟,这反映了微管的动态特性(Yuan等,1994)。此外,通过FRAP(光漂白后荧光再分布)技术测定,Tradescantia雄蕊毛细胞中皮层微管的半衰期仅为约60秒(Hush等,1994)。
在考虑细胞壁生长机制时,有必要区分表面生长(壁扩展)和厚度生长
厚度的增长在次生壁(secondary walls)中尤为明显,但在初生壁(primary walls)中也很常见。随着生长细胞的初生壁扩展,它们通常保持其厚度。根据经典概念,壁厚度的增加通过两种壁物质沉积方式发生:外加(apposition)和内填(intussusception)。在外加过程中,构建单元一个接一个地堆叠;在内填过程中,新材料的单元被插入到现有结构中。当木质素(lignin)或角质(cutin)被纳入壁时,内填可能是主要方式。木聚糖(xylan)和木质素(lignin)已被证明同时渗透到Fagus crentata纤维的分化次生壁中,积累在最近沉积的微纤丝(microfibrils)上或周围(Awano et al., 2002)。就纤维素微纤丝(cellulose microfibrils)而言,内填将导致纤维的交织。在某些壁中,微纤丝似乎交织在一起,但这可能是由于纤维素沉积过程中片层(lamellae)的压缩所致。
❙ 初生细胞壁的扩展
细胞壁的扩展(expansion)或延伸(extension)是一个复杂的过程,需要呼吸作用(respiration)、多糖(polysaccharide)和蛋白质合成(protein synthesis)、壁应力松弛(wall stress relaxation)(壁结构的松弛)以及膨压(turgor pressure)(McQueen-Mason, 1995; Cosgrove, 1997, 1998, 1999; Darley et al., 2001)。壁应力松弛至关重要,因为它是细胞降低其水势(water potential)的手段,导致原生质体(protoplast)吸收水分,并通过膨压驱动的壁扩展。单个细胞的扩展速率由以下因素控制:(1) 细胞内推动细胞壁的膨压大小;(2) 壁的延展性(extensibility)。延展性是壁的物理特性,指的是当施加力时,壁永久扩展或延伸的能力。* 生长细胞的壁表现出稳定、长期的延伸,称为蠕变(creep)(Shieh and Cosgrove, 1998)。
在生长过程中,初生壁必须足够屈服以允许适当的扩展,同时保持足够的强度以约束原生质体。许多因素能够影响壁的延展性。这些因素包括植物激素(plant hormones)(Shibaoka, 1991; Zandomeni and Schopfer, 1993)。尽管激素可以影响细胞壁的延展性,但它们对膨压几乎没有直接影响。生长素(auxin)和赤霉素(gibberellins)增加细胞壁的延展性,而脱落酸(abscisic acid)和乙烯(ethylene)则降低其延展性。一些激素影响皮层微管(cortical microtubules)的排列。例如,赤霉素促进横向排列,导致更大的伸长。
激素如何改变细胞壁的延展性(extensibility)的机制尚不清楚。关于植物激素对细胞壁延展性影响的最连贯的解释是酸生长假说(acid-growth hypothesis)(Brett and Waldron, 1990; Kutschera, 1991),即生长素(auxin)激活质膜(plasma membrane)中的质子泵ATP酶(proton-pumping ATPase)。质子从细胞质(cytosol)泵入细胞壁。由此导致的{pH}下降被认为会引起细胞壁结构的松弛,从而允许膨压(turgor)驱动的壁聚合物网络延伸。另一种假说认为,生长素激活了特定基因的表达,这些基因以影响细胞壁延展性的方式影响新壁物质的输送(Takahashi et al., 1995; Abel and Theologis, 1996)。支持第二种假说的实验证据很少。相比之下,毫无疑问的是,在酸性pH(低于5.5)下生长的细胞壁比在中性pH下生长得更快。
一类被称为扩展蛋白(expansins)的新型壁蛋白被发现是酸生长的主要蛋白质介质(Cosgrove, 1998, 1999, 2000, 2001; Shieh and Cosgrove, 1998; Li et al., 2002)。扩展蛋白显然通过松弛壁多糖之间的非共价结合来引起壁的蠕变(wall creep)。鉴于上述初生壁(primary wall)结构的第一个模型,一个合理的目标是纤维素(cellulose)与一种或多种半纤维素(hemicelluloses)之间的界面。除了在生长组织中松弛细胞壁的作用外,扩展蛋白还与叶片起始(leaf initiation)(Fleming et al., 1997, 1999; Reinhardt et al., 1998)、叶片脱落(leaf abscission)(Cho and Cosgrove, 2000)、果实成熟(fruit ripening)(Rose and Bennett, 1999; Catalá et al., 2000; Rose et al., 2000; Brummell and Harpster, 2001)以及花粉管(pollen tubes)(Cosgrove et al., 1997; Cosgrove, 1998)和棉纤维(cotton fibers)(Shimizu et al., 1997)的生长有关。
Cosgrove (1999)提出区分初生和次生壁松弛剂(primary and secondary wall-loosening agents)。他将初生壁松弛剂定义为那些在体外(in vitro)能够并足以诱导壁延伸的物质和过程。扩展蛋白是主要的例子。次生壁松弛剂不具备这种活性,被定义为那些修饰壁结构以增强初生剂作用的物质和过程。植物内切葡聚糖酶(endoglucanases)、木葡聚糖内切转糖基酶(xyloglucan endotransglycoylases, XETs)和果胶酶(pectinases),以及特定壁聚合物的分泌和羟基自由基(hydroxyl radicals)的产生,可能作为次生壁松弛剂发挥作用。XETs特别受关注,因为它们可以切割和重新连接木葡聚糖(xyloglucan)链,使细胞壁在不破坏其结构的情况下扩展(Campbell and Braam, 1999; Bourquin et al., 2002)。
❙ 壁扩展的停止
细胞成熟过程中生长的停止通常是不可逆的,这归因于壁延展性(plasticity)的丧失。生长停止不是由于膨压(turgor pressure)的下降,而是由于细胞壁的机械硬化或刚性化(rigidication)(Kutschera, 1996)。有几个因素可能导致伴随壁成熟的物理变化。这些包括(1)壁松弛过程的减少,(2)细胞壁组分交联(cross-linking)的增加,以及(3)壁组成的变化,导致更刚性的结构或更不易于壁松弛的结构(Cosgrove, 1997)。
细胞壁在接近成熟时会失去酸诱导延伸的能力(Van Volkenburgh等,1985;Cosgrove,1989),这种状态无法通过外源扩展蛋白(expansin)的施加来恢复(McQueen-Mason,1995)。因此,细胞壁扩展的停止与扩展蛋白表达的丧失和细胞壁的硬化有关。多种修饰可能导致细胞壁硬化,包括半纤维素和纤维素之间形成更紧密的复合物、果胶的去酯化、果胶更广泛的Ca++交联、扩展蛋白的交联以及木质化。
❙ 细胞间隙
植物体的大部分体积被细胞间隙系统占据,这些空气间隙对于内部组织的通气至关重要。尽管细胞间隙最典型地出现在成熟组织中,但它们也延伸到分生组织中,这些分生组织的细胞正在进行强烈的呼吸作用。具有大且良好连接的细胞间隙的组织例子可以在叶子和水生植物的沉水器官中找到(第7章)。
最常见的细胞间隙是通过中层(middle lamella)分离相邻的初生壁而形成的(图4.18)。该过程通常从三个或更多细胞的交界处开始,并扩展到其他壁部分。这种类型的细胞间隙被称为裂生型(schizogenous),即通过分裂产生,尽管通常认为它是由果胶的酶促去除引发的。中层可能直接参与细胞间隙的起始,也可能不直接参与。壁分离可能先于电子密集的壁内物质的积累和随后的降解(Kollöffel和Linssen,1984;Jeffree等,1986)或特殊的“分裂层”(splitting layer),这与果胶中层不同(Roland,1978)。分裂层的裂解导致相邻壁的分离。叶片叶肉中大型裂生型细胞间隙的形成与细胞形态发生直接相关。由于壁增厚的差异导致的壁延伸性的局部差异,导致叶状细胞的产生,同时产生机械张力,从而引发细胞间隙(Jung和Wernicke,1990;Apostolakos等,1991;Panteris等,1993)。
图4.18
一种薄壁型薄壁组织,具有规则形状的细胞和裂生型细胞间隙,来自芹菜(Apium)的叶柄。(来自Esau,1977。)
大量的果胶形成可能导致果胶溶胶(pectic sol),它可能部分或完全填充较小的细胞间隙。一些完全意想不到的物质在细胞间隙中被发现,例如在玉米根尖填充的细胞间隙中发现的富含苏氨酸的羟脯氨酸糖蛋白(Roberts,1990)。在组织扩展过程中,随着细胞间隙的形成,可能会发展出几种类型的细胞间隙果胶突起(Potgieter和Van Wyk,1992)。
一些细胞间隙是由整个细胞的分解产生的,称为溶生间隙(通过溶解产生)。一些根具有广泛的溶生细胞间隙。细胞间隙也可能由细胞的撕裂或断裂产生。这种间隙称为裂生间隙。裂生细胞间隙的例子包括在植物部分伸长过程中由最初形成的初生木质部元素(原木质部元素)撕裂产生的原木质部腔隙,以及在一些树木的树皮中发现的相对较大的细胞间隙,这些间隙是在扩张生长过程中产生的。裂生、溶生和/或裂生可能在间隙形成过程中结合。
图 4.19
柿子(Diospyros)胚乳厚初生壁中的胞间连丝的光学显微照片,胚乳是种子内的营养组织。胞间连丝表现为穿过细胞壁从细胞到细胞的细线。(\times620.)
❙ 胞间连丝
如前所述,相邻植物细胞的原生质体通过称为胞间连丝(单数:plasmodesma)的狭窄细胞质链相互连接,这些链为物质从细胞到细胞的传递提供了潜在途径(van Bel 和 van Kesteren, 1999; Haywood 等, 2002)。尽管这些结构长期以来在光学显微镜下可见(图 4.19)——它们最早由 Tangl 在 1879 年描述——但直到它们可以用电子显微镜观察时,它们作为细胞质链的性质才得到确认。
胞间连丝是动物细胞之间发现的间隙连接的结构和功能类似物(Robards 和 Lucas, 1990)。在间隙连接处,相邻细胞的质膜在具有称为“连接子”的狭窄通道的斑块中相关联,通过这些通道,两个细胞的原生质体进行通信。细胞壁的存在阻止了相邻植物细胞质膜之间的直接接触;因此,植物体基本上被划分为两个部分,即共质体(symplast 或 symplasm)和质外体(apoplast 或 apoplasm)(Münch, 1930)。共质体由质膜结合的原生质体及其相互连接——胞间连丝组成;质外体由细胞壁连续体和细胞间隙组成。因此,通过胞间连丝进行的物质从细胞到细胞的移动称为共质运输(symplastic transport 或 symplasmic transport),而在细胞壁连续体中的物质移动称为质外运输(apoplastic transport 或 apoplasmic transport)。
胞间连丝可根据其起源分为初生或次生
许多胞间连丝在胞质分裂过程中形成,作为管状内质网的链被捕获在发育中的细胞板内(图 4.20)。在胞质分裂过程中形成的胞间连丝称为初生胞间连丝。胞间连丝也可以从头形成穿过现有的细胞壁。这些在胞质分裂后形成的胞间连丝称为次生胞间连丝,它们的形成对于建立发育上无关的细胞之间的通信至关重要(Ding, B., 和 Lucas, 1996)。
次生胞间连丝(secondary plasmodesmata)的形成通常发生在不来自同一细胞谱系或前体细胞的相邻细胞之间。根据一种提出的机制,次生胞间连丝的发育涉及局部壁降解酶(pectinases, hemicellulases, 可能还有cellulases)的活性,这些酶允许细胞质丝穿透原本完整的细胞壁。这些酶的控制可能是由质膜(plasma membrane)介导的(Jones, 1976)。然而,对再生原生质体培养(Monzer, 1991; Ehlers and Kollmann, 1996)和嫁接界面(Kollmann and Glockmann, 1991)的研究表明,连续的次生胞间连丝是由相邻细胞同时形成的相对的次生半胞间连丝融合而成的。在这些部位,内质网(endoplasmic reticulum)的一段附着在极窄细胞壁两侧的质膜上。随着该部位壁物质的去除,质膜和
图4.20
莴苣(Lactuca sativa)根细胞中细胞板形成的渐进阶段,显示内质网与发育中的细胞板的关联以及胞间连丝的起源。A,细胞板形成的相对早期阶段,有许多小的、融合的高尔基体(Golgi)囊泡和松散排列的管状(平滑)内质网元件。B,细胞板形成的高级阶段,揭示了内质网和融合囊泡之间持续的密切关系。管状内质网的丝在细胞板巩固过程中被捕获。C,成熟的胞间连丝,由质膜内衬的通道和内质网的管状结构(desmotubule)组成。(来自Hepler, 1982。)
两个细胞的质膜和相关的内质网融合,形成连续的胞间连丝。相邻细胞之间的协调失败可能导致半胞间连丝的形成。次生胞间连丝通常是分支的,许多次生胞间连丝的特征是在中层(middle lamella)区域存在一个中央腔(图4.21)。
初生胞间连丝(primary plasmodesmata)也可能发生分支。Ehlers和Kollmann(1996)已经证明了这种分支可能发生的机制(图4.22)。简而言之,在正常的壁增厚过程中,初生胞间连丝及其包含的内质网管状结构必须伸长,需要在细胞板的原始胞间连丝结构上添加新的部分。如果原始的无分支内质网管状结构与细胞质的分支内质网相连,新壁物质对分支内质网的包围将导致分支胞间连丝的形成。
初生胞间连丝(primary plasmodesmata)也可能通过在中胶层(middle lamella)区域相邻胞间连丝的侧向融合,修饰成高度分枝的胞间连丝。这种胞间连丝的显著例子见于发育中的叶片(Ding, B., et al., 1992a, 1993; Itaya et al., 1998; Oparka et al., 1999; Pickard and Beachy, 1999)。显然,一些这样的"分枝胞间连丝"通过细胞壁上新形成的额外内质网(endoplasmic reticulum)链进一步修饰。有人建议将这种胞间连丝聚集体称为"复杂次生胞间连丝(complex secondary plasmodesmata)"(Ding, B., 1998; Ding, B., et al., 1999)。
初生和次生胞间连丝都可以是不分枝或分枝的,有时很难确定它们的起源,即它们是初生的
白松(Pinus strobus)次生韧皮部射线薄壁细胞径向壁中的分枝胞间连丝。注意中胶层区域的中央腔(mc)。其他细节:ob,油体;pl,质体。(来自Murmanis和Evert, 1967, 图10. © 1967, Springer-Verlag.)
图4.21
还是次生的。在这种情况下,它们可以简单地称为"分枝"或"不分枝"(或"单生")。Ehlers和Kollmann(2001)对初生和次生胞间连丝的结构、起源和功能进行了详细综述。
胞间连丝包含两种类型的膜:质膜和连丝小管
胞间连丝是一种由质膜(plasma membrane)内衬的通道,通常被一种称为连丝小管(desmotubule)的紧密收缩的内质网管状链穿过(图4.23和4.24)。在大多数胞间连丝中,连丝小管与相邻的内质网不同。它的直径要小得多,并且包含一个中央的棒状结构。关于中央棒的解释存在很大争议(Esau和Thorsch, 1985)。大多数研究者认为它代表了内小叶或内孔的合并
图4.22
初生胞间连丝的分枝。最初不分枝(A),分枝从新沉积的壁物质内分枝的ER小管的包围中发育(B)。细节:gb,高尔基体;gv,高尔基小泡;ML,中胶层;NW,随后形成的新壁层;PM,质膜;W,最初形成的壁层。(来自Ehlers和Kollmann, 1996, 图35a,b. © 1996, Springer-Verlag.)
内质网(ER)的双层膜形成连丝微管(desmotubule)。如果这种解释是正确的,那么连丝微管缺乏管腔或开口,物质通过胞间连丝(plasmodesmata)在细胞间移动的主要途径是连丝微管和质膜之间的区域。这个区域被称为胞质套(cytoplasmic sleeve),被嵌入质膜和连丝微管中的球状颗粒分割成直径为2.5纳米的微通道,并通过辐条状延伸相互连接(Tilney et al., 1990; Ding, B., et al., 1992b; Botha et al., 1993)。一些胞间连丝在其末端或开口处明显变窄,形成所谓的颈部收缩(neck constrictions)。然而,颈部收缩可能是由于组织操作或固定过程中诱导的创伤胼胝质(wound callose)沉积所致(Radford et al., 1998)。关于胞间连丝结构的大多数信息来自对不分枝的初生胞间连丝(primary plasmodesmata)的研究。对次生胞间连丝(secondary plasmodesmata)的亚结构知之甚少。
图4.23
初生胞间连丝的纵向(A)和横向(B)示意图。球状整合膜蛋白(g)分别位于质膜和连丝微管的内外小叶中,并通过辐条状延伸相互连接。注意胞质套被分割成多个微通道。
连丝微管并不总是完全收缩的。在一些胞间连丝中,例如玉米(Evert et al., 1977)和甘蔗(Robinson-Beers and Evert, 1991)叶片中叶肉细胞之间以及叶肉细胞和维管束鞘细胞之间的胞间连丝,连丝微管仅在颈部收缩处出现收缩;在颈部收缩之间,它们表现为开放的管状结构(图4.25)。在Nicotiana clevelandii叶片的毛状体细胞胞间连丝中,连丝微管在整个长度上都是开放的(Waigmann et al., 1997)。
尽管有时有人提出开放的连丝微管作为运输途径(Gamalei et al., 1994),但没有直接证据支持这一点。相比之下,已经表明,通过胞间连丝增强豌豆根尖蔗糖的细胞间运输的渗透处理是由于胞质套的扩大,而不是连丝微管直径的变化(Schulz, A., 1995)。此外,在Nicotiana tabacum叶片中,靶向内质网的绿色荧光蛋白被限制在单个细胞中,表明连丝微管不是绿色荧光蛋白通过单个或分枝胞间连丝运输的功能途径(Oparka et al., 1999)。然而,脂质分子的运输可以通过连丝微管的脂双层进行(Grabski et al., 1993)。
图4.24
甘蔗(Saccharum)叶片细胞壁中的胞间连丝(plasmodesmata)的纵切面(A)和横切面(B)。注意内质网(endoplasmic reticulum, er)与连丝微管(desmotubules)之间的连接(箭头)以及A图中细微的颈部收缩。在B图中,连丝微管的内层呈现为中心位置的点(cr,中央杆)。胞质套(cytoplasmic sleeve)看起来有些斑驳,部分原因是存在电子致密的、辐条状结构,这些结构从连丝微管的外层延伸到质膜(plasma membrane, pm)的内层,并与电子透明的区域交替出现。(来自Robinson-Beers和Evert, 1991, 图14和15。© 1991, Springer-Verlag。)
胞间连丝使细胞能够相互通信
多细胞生物的成功存在依赖于单个细胞之间相互通信的能力。尽管细胞分化依赖于基因表达的控制,但植物细胞的命运——即它将成为何种类型的细胞——是由其在发育器官中的最终位置决定的,而不是由谱系关系决定的。因此,植物细胞相互作用的一个方面是位置信息从一个细胞到另一个细胞的通信或信号传递。
通过胞间连丝进行细胞间运输的早期证据来自利用荧光染料(Goodwin, 1983; Erwee和Goodwin, 1985; Tucker和Spanswick, 1985; Terry和Robards, 1987; Tucker等, 1989)和电流(Spanswick, 1976; Drake, 1979; Overall和Gunning, 1982)的研究。电流脉冲从一个细胞传递到另一个细胞的过程可以通过放置在相邻细胞中的接收电极来监测。电力的大小随胞间连丝的频率或密度以及注射电极和接收电极之间的细胞数量和细胞长度而变化,这表明胞间连丝可以作为植物细胞之间电信号传递的路径。
图4.25
玉米(Zea mays)叶片两个叶肉细胞之间共同壁中的胞间连丝。注意连丝微管的开放外观(箭头)。细节:er,内质网;pm,质膜。(来自Evert等, 1977, 图8。© 1977, Springer-Verlag。)
在染料耦合实验(dye-coupling experiments)中,不易穿过质膜(plasma membrane)的染料可以被观察到从注射的细胞移动到邻近细胞及更远的地方。这类研究的结果很早就确定了通过被动扩散(passive diffusion)在这些细胞之间自由流动的分子大小约为1 kDa(1000道尔顿;道尔顿是单个氢原子的重量)。这种大小排阻限制(size exclusion limits)允许糖类、氨基酸、植物激素(phytohormones)和营养物质自由穿过胞间连丝(plasmodesmata)。最近的研究表明,不同细胞类型中的胞间连丝可能具有不同的基础大小排阻限制。例如,大约7{kDa}的荧光葡聚糖(fluorescent dextrans)可以在Nicotiana clevelandii的叶片毛状体细胞(leaf trichome cells)之间扩散(Waigmann和Zambryski,1995),而至少10{kDa}的葡聚糖可以通过连接Vicia faba茎韧皮部中筛管元素(sieve elements)和伴胞(companion cells)的胞间连丝移动(Kempers和van Bel,1997)。此外,胞间连丝的大小排阻限制可能会随着生长条件的变化而波动(Crawford和Zambryski,2001)。
现在已知胞间连丝还具有介导大分子(包括蛋白质和核酸)在细胞间运输的能力(Lucas等,1993;Mezitt和Lucas,1996;Ding,1997;Lucas,1999;Haywood等,2002)。基于这些发现,Lucas及其同事(Ding等,1993;Lucas等,1993)提出了植物作为超细胞(supracellular)生物而非多细胞(multicellular)生物运作的假说。因此,植物体的动态过程,包括细胞分化(cell differentiation)、组织形成(tissue formation)、器官发生(organogenesis)和特殊生理功能(specialized physiological functions),都受到胞间连丝的调控。胞间连丝可能通过运输信息分子(informational molecules)来完成这种调控作用,这些信息分子“协调”代谢活动和基因表达。
对胞间连丝动态功能的初步认识来自于对植物病毒的研究。长期以来,人们已经知道植物病毒通过胞间连丝在细胞之间相对短距离地移动(图4.26;Wolf等,1989;Robards和Lucas,1990;Citovsky,1993;Leisner和Turgeon,1993)。这些研究揭示了植物病毒编码非结构蛋白(nonstructural proteins),称为运动蛋白(movement proteins),它们在感染物质的细胞间传播中发挥作用。当在转基因植物中表达时,运动蛋白被靶向到胞间连丝,导致其大小排阻限制增加。大量证据表明,内质网(endoplasmic reticulum)和细胞骨架(cytoskeletal)元素(微管(microtubules)和肌动蛋白丝(actin filaments))在将运动蛋白以及可能的病毒核酸-蛋白质复合物靶向到胞间连丝中起着重要作用(Reichel等,1999)。
关于胞间连丝(plasmodesmata)在植物细胞间内源蛋白运输中作用的证据来自对韧皮部运输的研究。在韧皮部渗出液(筛管液)中已发现200多种分子量从10到200{kDa}不等的蛋白质(Fisher等,1992;Nakamura等,1993;Sakuth等,1993;Ishiwatari等,1995;Schobert等,1995)。由于成熟的筛管分子缺乏细胞核和核糖体(Evert,1990),这些蛋白质中的大多数(如果不是全部的话)很可能是在伴胞中合成的,然后通过它们共同壁上的孔-胞间连丝连接运输到相关的筛管分子中(第13章)。已发现筛管液中的蛋白质能够增加叶肉细胞胞间连丝的大小排斥限制,并能够在细胞间运输(Balachandran等,1997;Ishiwatari等,1998)。在南瓜(Cucurbita maxima)中,所有筛管液蛋白质,无论大小,似乎都能诱导胞间连丝大小包容限制的类似增加,大约25{kDa}(Balachandran等,1997)。由于其中一些蛋白质的大小可达200{kDa},较大的蛋白质可能需要展开才能通过胞间连丝运输。在几种植物物种的筛管液中发现了分子伴侣(Schobert等,1995,1998),据信它们介导了伴胞和筛管分子之间蛋白质运输的展开/重折叠过程(Crawford和Zambryski,1999;Lee等,2000)。
胞间连丝在发育中起作用的观点得到了对植物转录因子KNOTTED1(KN1)的分子、遗传和显微注射研究的支持。在玉米中,KN1参与维持茎尖分生组织处于未分化状态(Sinha等,1993)。在发育过程中,编码KN1的RNA存在于分生组织的所有细胞层中,除了最外层(L1)层。然而,KN1蛋白存在于所有层中,包括L1层,这表明在内层产生的KN1蛋白运输到了L1层(Jackson等,1994)。将KN1蛋白显微注射到玉米或烟草的叶肉细胞中表明,KN1蛋白确实可以在细胞间运输,并将胞间连丝的大小排斥限制从1 kDa增加到大于40{kDa}(Lucas等,1995)。最近的两项研究,一项使用嫁接实验研究番茄显性叶突变体Mouse ears(Me)的自主性(Kim,M.等,2001),另一项研究SHORT-ROOT(SHR)基因在拟南芥根模式形成中的作用(Nakajima等,2001),为胞间连丝在发育中的作用提供了进一步的证据。
目前,关于胞间连丝(plasmodesmata)扩张或传导性(conductivity)发生瞬时变化(门控,gating)的机制知之甚少(Schulz, A., 1999)。已有研究表明,多种因素会影响胞间连丝的大小排阻限(size exclusion limit),包括细胞质中Ca++水平的变化(Holdaway-Clarke et al., 2000)和ATP酶(ATPase)的变化(Cleland et al., 1994)。肌动蛋白(actin)和肌球蛋白(myosin)都已被定位在胞间连丝上或内部(White et al., 1994; Radford and White, 1998; Overall et al., 2000; Baluška et al., 2001),并且两者都与胞间连丝通透性(permeability)的调控有关。关于肌动蛋白,已有实验证据表明肌动蛋白丝(actin filaments)参与了烟草叶肉(tobacco mesophyll)中胞间连丝通透性的调控(Ding et al., 1996)。显然,胞间连丝与细胞骨架(cytoskeleton)之间存在密切关系(Aaziz et al., 2001)。
胞间连丝通透性的调控被认为发生在颈部区域(neck region)(White et al., 1994; Blackman et al., 1999)。一些研究者提出,在某些物种中,颈部区域的括约肌样结构(sphincter-like structures)调控着胞间连丝的运输(Olesen, 1979; Olesen and Robards, 1990; Badelt et al., 1994; Overall and Blackman, 1996)。大分子通过胞间连丝的运输与蛋白质和核酸通过核孔复合体(nuclear pore complexes)穿过核膜(nuclear envelope)的运输之间存在功能上的相似性(Lee et al., 2000)。
共质体(Symplast)在植物生长发育过程中经历重组
对植物胚胎的研究表明,最初幼小植物体的所有细胞都通过胞间连丝相互连接,并整合成一个单一的共质体(Schulz and Jensen, 1968; Mansfield and Briarty, 1991; Kim et al., 2002)。随着植物恢复生长并进一步发育,单个细胞或细胞群在共质体上或多或少地变得孤立,从而使植物被划分为共质体域(symplastic domains)的马赛克(Erwee and Goodwin, 1985)。共质体域的建立通常被认为是细胞亚群追求特定发育途径并在植物体内作为不同区室(function as distinct compartments)所必需的(Fisher and Oparka, 1996; McLean et al., 1997; Kragler et al., 1998; Nelson and van Bel, 1998; Ding et al., 1999)。
域之间的通讯和运输与胞间连丝的频率、分布和功能密切相关。尽管胞间连丝的频率经常被用作不同界面处共质体连续性(symplastic continuity)的指标,但此类数据的使用是推测性的,因为假定所有胞间连丝都具有细胞间运输的能力。共质体连续性的变化可以通过最初与其他细胞共质体连接的细胞的孤立而发生,如保卫细胞(guard cells)(Palevitz and Hepler, 1985)和根毛(root hairs)(Duckett et al., 1994)的情况,或者通过新的次级胞间连丝(secondary plasmodesmata)的建立而发生,如叶片成熟期间(Turgeon, 1996; Volk et al., 1996)以及侧根和母根维管组织(vascular tissues)的联合期间(Oparka et al., 1995)。
