第六章 顶端分生组织
顶端分生组织是指位于芽和根顶端的一组分生干细胞,它们通过细胞分裂奠定了初生植物个体的基础。如第5章所述,分生组织由使分生组织得以延续的原始细胞(initials)及其衍生物(derivatives)*组成。此外,衍生物通常会分裂并产生一代或多代细胞,然后细胞学变化(表示特定细胞和组织的分化)才会在芽或根的顶端附近发生。分裂在已可分辨出此类变化的所有层面上继续进行。因此,就细胞分裂而言,生长并不局限于芽或根的最顶端,而是延伸至通常被称为顶端分生组织的区域之外的水平面。事实上,距顶端一定距离处的分裂比顶端要更多(Buvat,1952 年)。在枝条中,在新叶萌发的水平面上观察到的分生组织活动比在顶端更强烈,并且在茎的伸长过程中,细胞分裂扩展到顶端分生组织下方的几个节间(Sachs,1965 年)。从顶端分生组织到成熟初生组织的变化是渐进的,涉及细胞分裂、细胞增大和细胞分化等现象的相互影响,因此不能将分生组织一词限制在枝条和根的顶端。枝条和根部中,未来的组织和器官分化已经部分确定,但细胞分裂和细胞增大仍在进行的部分也是分生性的。
*此处,“衍生物”其实应理解为“子细胞”,但采取了直译的方式。
大量有关顶端分生组织的文献中,术语繁多且不一致,反映了该主题的复杂性(Wardlaw,1957;Clowes,1961;Cutter,1965;Gifford and Corson,1971;Medford,1992;Lyndon,1998)。最通常的说法是,“顶端分生组织”这一术语的含义不仅仅限于指代原始细胞及其直接的衍生物,它还包括枝条和根中靠近顶端的或长或短的一部分。茎尖(shoot apex)和根尖(root apex)通常被用作顶端分生组织的同义词,尽管有时会在茎尖分生组织和茎尖之间做出区分:顶端分生组织仅表示位于最年轻的叶原基远端的茎部分,而茎尖包括顶端分生组织以及含幼叶原基的亚顶端区域(Cutter,1965 年)。在确定茎尖的尺寸时,仅测量最年轻的叶原基或最年轻的节(node)之上的部分。
当需要区分顶端分生组织分化程度最小的部分时,使用术语原分生组织(promeristem 或 protomeristem)(Jackson,1953):它指的是原始细胞及其最近产生的衍生物,这些衍生物没有任何组织分化的迹象,并被认为与原始细胞处于相同的生理状态(Sussex and Steeves,1967;Steeves and Sussex,1989)。Johnson 和 Tolbert (1960)的元分生组织(metameristem)指代与原分生组织相同的细胞群。他们将其具体定义为“茎尖的中心部分,它保持自身,有助于顶端的生长和组织,但没有或几乎没有组织分化的迹象。”因此,顶端分生组织中这个分化程度最小的部分对应于茎尖中被称为中心区的一般区域(见下文)。另一方面,Clowes(1961)的原分生组织仅包括原始细胞。
顶端组织概念的演变
顶端分生组织最初被设想为有单一的原始细胞
根据 Wolff(1759)的认识,茎尖是植物生长的未开发区域,并且在无籽维管植物的顶端发现了一个形态不同的原始细胞,因此人们认为这种细胞也存在于种子植物中。顶端细胞(apical cell)(图 6.1)被解释为顶端分生组织的一致结构和功能单位,控制着整个生长过程(顶端细胞理论,the apical-cell theory)。后来的研究人员驳斥了单个顶端细胞普遍存在的假设,并用植物体不同部分独立起源的概念取而代之。
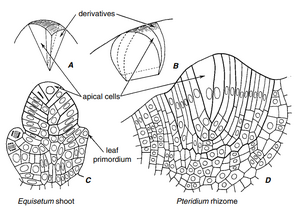
顶端细胞理论被组织原理论取代
组织原理论(Histogen theory)是由Hanstein(1868年、1870年)在对被子植物茎尖和胚胎进行广泛研究的基础上发展起来的。根据这一理论,植物的主体不是来自表层细胞,而是来自一个在相当深处的巨大的分生组织,该分生组织由三个部分组成,即组织原(histogen),可根据其起源和发育过程进行区分。最外层的部分是dermatogen(来自希腊语,意为皮肤和产生),是表皮的前身;第二层是periblem(来自希腊语,意为衣服),形成皮层;第三层是plerome(来自希腊语,意为填充物),构成轴的内层。dermatogen,每一层periblem,和plerome源自一个或多个原始细胞,这些原始细胞分布在顶端分生组织最远端的叠层中。
Hanstein 的“dermatogen”与 Haberlandt(1914 年)的“protoderm”并不等同。 Haberlandt 的protoderm是指顶端分生组织的最外层,无论这一层是否来自独立的原始细胞,也无论它是否产生表皮或一些表皮下组织。在许多茎尖,表皮确实起源于顶端分生组织中独立的一层;在这样的顶端,dermatogen和protoderm可能重合。Hanstein定义上的periblem and plerome在许多根中都可以辨别,但在芽中很少被界定。因此, dermatogen、periblem和plerome的细分并不具有普遍适用性。但 Hanstein的组织原理论的致命缺陷在于,它假设植物体不同区域的命运由这些区域在顶端分生组织中的离散起源决定。
顶端组织的原套-原体概念主要适用于被子植物
顶端细胞和组织原理论的发展均参考了根尖和茎尖两者。第三种顶端结构理论,即 A. Schmidt(1924)的原套-原体理论(the tunica-corpus theory),是观察被子植物茎尖的结果。它指出,顶端分生组织的起始区域由(1)原套(tunica),由一层或多层外围细胞组成,这些细胞在垂直于分生组织表面的平面上分裂(垂周分裂,anticlinal division),以及(2)原体(corpus),有几层深,细胞在各个平面上分裂(图 6.2)。因此,虽然原体通过增加体积增大了顶端分生组织,但一层或多层原套通过表面生长在不断扩大的大块细胞上保持连续性。每层原套都来自一小组独立的原始细胞,而原体有自己的原始细胞,位于原套的原始细胞之下。换句话说,初始细胞层数等于原套层数加一,即原体初始细胞层。与组织原理论相反,原套-原体理论并不暗示顶the configuration of cells at the apex and histogenesis below the apex之间存在任何关系。虽然表皮通常来自原套的最外层,因此与 Hanstein 的dermatogen相吻合,但下层组织可能起源于原套或原体或两者,这取决于植物种类和原套层数。
随着越来越多的植物被研究,原套-原体概念经历了一些修改,特别是在原套定义的严格性方面。一种观点认为,原套应仅包括中间位置(即高于叶原基起源水平)从未出现任何周缘分裂的层(Jentsch,1957)。如果顶端包含周期性平周分裂分裂的额外平行层,则这些层被分配给原体,而原体则被描述为分层的(Sussex,1955;Tolbert 和 Johnson,1966)。其他工作者对原套的处理更为宽松,并将其描述为层数波动:原套的一个或多个内层可能平周分裂,从而成为原体的一部分(Clowes,1961)。由于术语 tunica 的用法不同,Popham (1951) 质疑了它在准确描述茎尖生长关系方面的实用性,他提出术语 mantle 包括“顶端顶部的所有层,其中平周分裂足够频繁,导致确定的细胞层永存”;mantle 覆盖着称为core的细胞团。避免使用术语 corpus。
大多数裸子植物和被子植物的茎尖显示细胞组织学分区
参考被子植物茎尖开发的 tunica-corpus 概念被证明在很大程度上不适合描述裸子植物的顶端分生组织(Foster,1938 年、1941 年;Johnson,1951 年;Gifford 和 Corson,1971 年;Cecich,1980 年)。除少数例外(买麻藤、麻黄和几种针叶树)外,裸子植物在茎尖不显示原套组织;也就是说,它们没有稳定的只进行垂向分裂的表面层。顶端分生组织的最外层经历平周分裂和垂周分裂,并为茎的外周和内部组织提供细胞。位于顶端分生组织中间位置的表面细胞被解释为初始细胞。对裸子植物顶端的研究导致了对分区的识别——称为细胞组织学分区 cytohistological zonation——不仅基于分裂平面,还基于细胞学和组织学分化以及组成细胞复合体的分生活动程度(图 6.3)。此后,在大多数被子植物中都观察到了类似的分区,这些分区叠加在原套-原体的组织模式上(Clowes,1961;Gifford 和 Corson,1971)。
在茎尖分生组织中可以识别的细胞学区域在分化程度和细胞分组细节上有所不同。分区可以简洁地描述为将顶端分生组织分为一个中心区和两个从中心区衍生的区域。其中一个是肋区或肋(髓)分生组织 rib zone, or rib (pith) meristem,出现在中心区的正下方,位于顶端的中心位置。它通常在发生额外的分生活动后变成髓。另一个是外围区或外围分生组织peripheral zone, or peripheral meristem,环绕着其他区域。外围区域通常是所有三个区域中分生组织最强的区域,具有最密集的原生质体和最小的细胞尺寸。它可以被描述为真分生组织eumeristem。叶原基和原形成层以及皮层基本组织都出现在这里。在具有膜-体组织的物种中,中心区域对应于原体和覆盖在原体上的原套的部分。
对茎顶端分生组织解释的进一步发展源于法国细胞学家(Buvat, 1955a; Nougarède, 1967)的努力。分生组织活动是这项工作的主要关注点。通过有丝分裂计数、细胞学、组织化学和超微结构研究,提出了一个理论,即在胚胎中组织好顶端结构后,中央区的细胞成为等待分生组织(méristème d’attente)(图6.4)。等待分生组织保持在静止状态,直到生殖阶段到来,分生组织活动在远端细胞中恢复。在营养阶段,分生组织活动集中在起始环(anneau initial),对应于周边区,以及髓(髓)分生组织(méristème medullaire)。关于顶端分生组织中不活跃的中央区的概念从被子植物的茎扩展到裸子植物(Camefort, 1956;他将中央区称为“zone apicale”)和无种子维管植物(Buvat, 1955b),以及根(Buvat和Genevès, 1951; Buvat和Liard, 1953)。后来,这一概念有所修改,因为中央区的不活跃程度与顶端的大小及其发育阶段的关系被认识到(Catesson, 1953; Lance, 1957; Loiseau, 1959)。关于根顶端,不活跃的中央区的出现也被观察到。
图6.3
Pinus strobus 茎尖的纵切面。A中的细胞细节,B中的解释图。顶端初始细胞通过垂周分裂(anticlinal divisions)向表层贡献细胞,并通过平周分裂(periclinal divisions)向中央母细胞区(central mother-cell zone)贡献细胞。母细胞区(cells with nuclei)向由活跃分裂细胞组成的过渡区(transitional zone)贡献细胞,这些细胞从母细胞区呈放射状排列。这些分裂的产物形成肋分生组织和周边区的次表层。(A, \times139。A,根据A. R. Spurr的幻灯片绘制;B,来自Esau, 1977。)
图6.4
根据méristème d’attente概念解释的Cheiranthus cheiri茎尖示意图。细节:ai,anneau initial(初始环);ma,méristème d’attente(等待分生组织);mm,méristème medullaire(髓分生组织)。(引自Buvat, 1955a. \copyright Masson, Paris.)
分生组织中心的研究在许多研究中得到了证实,这导致了Clowes(1961)提出的静止中心(quiescent center)概念的发展。
法国研究者对顶端初始细胞(apical initials)概念的修订极大地促进了顶端分生组织(apical meristem)的进一步研究(Cutter, 1965; Nougarède, 1967; Gifford and Corson, 1971)。通过对茎尖不同区域的有丝分裂(mitosis)计数、使用放射性标记化合物喂养根尖以检测DNA、RNA和蛋白质的合成位置、组织化学测试、实验操作以及对固定和活体茎尖细胞模式的追踪,提供了本质上支持中央区(central zone)有丝分裂活动相对稀少的假设的数据(表6.1)(Davis et al., 1979; Lyndon, 1976, 1998)。
对中央区有丝分裂活动相对稀少的认识并未导致放弃最远端细胞是真正初始细胞(true initials)和茎中所有体细胞的最终来源的概念。考虑到茎尖的几何形状,可以推断,由于顶端分生组织衍生物的指数增长,最远端细胞的少数分裂将导致这些细胞的任何独特基因组特征在大规模细胞群体中传播。如前所述,tunica-corpus理论假设顶端分生组织的每一层中都存在一小群初始细胞。克隆分析(clonal analysis)常被引用为每层中存在一到三个初始细胞的证据(Stewart and Dermen, 1970, 1979; Zagórska-Marek and Turzanska, 2000; Korn, 2001)。
表6.1 ■ 被子植物营养茎顶端分生组织(vegetative shoot apical meristem)顶部和侧翼的细胞倍增时间(平均细胞世代时间)
<html><body><table><tr><td></td><td colspan="2">细胞倍增时间(小时)</td></tr><tr><td>物种</td><td>顶部c</td><td>侧翼d</td></tr><tr><td>Trifoliumrepens</td><td>108</td><td>69</td></tr><tr><td>Pisum(probablyP.sativum)</td><td>69</td><td>28</td></tr><tr><td>Pisum (主茎尖)</td><td>49</td><td>31</td></tr><tr><td>Pisum (腋芽,初始)</td><td>127</td><td>65</td></tr><tr><td>Pisum (腋芽,释放)</td><td>40</td><td>33</td></tr><tr><td>Oryza (水稻)</td><td>86</td><td></td></tr><tr><td>Rudbeckiabicolor</td><td>>40</td><td>30</td></tr><tr><td>Solanum (马铃薯)</td><td>117</td><td>74</td></tr><tr><td>Daturastramonium</td><td>76</td><td>36</td></tr><tr><td>Coleus blumei</td><td>250</td><td>130</td></tr><tr><td>Sinapis alba</td><td>288</td><td>157</td></tr><tr><td>Chrysanthemum?</td><td>144</td><td>50</td></tr><tr><td>Chrysanthemumb</td><td>102</td><td>32</td></tr><tr><td>Chrysanthemum</td><td>139</td><td>48</td></tr><tr><td>Chrysanthemumsegetum</td><td>140</td><td>54</td></tr><tr><td>Helianthusannuus</td><td>83</td><td>37</td></tr></table></body></html>
来源:引自Lyndon, 1998。° 光子通量 =70\upmu\mathrm{mol}/\mathrm{m}^{2}。b 光子通量 =200\upmu\mathrm{mol}/\mathrm{m}^{2}。c 或中央区。d 或外周区。
顶端分生组织中的初始细胞(initial)与其直接衍生物之间的关系是灵活的。一个细胞之所以作为初始细胞发挥作用,并不是因为其固有的特性,而是因为其位置。(参见维管形成层中初始细胞的类似概念,第12章。)在初始细胞分裂时,无法预测两个子细胞中哪一个会“继承”初始细胞的功能,哪一个会成为衍生物。已知的是,一个给定的初始细胞可能会被一个在先前历史中被归类为初始细胞衍生物的细胞所取代(Soma and Ball, 1964; Ball, 1972; Ruth et al., 1985; Hara, 1995; Zagorska-Marek and Turzanska, 2000)。
由于没有细胞是永久的初始细胞,Newman (1965)认为,为了理解分生组织的结构和功能,必须区分“持续分生组织残留物”(continuing meristematic residue)——即作为初始细胞发挥作用的细胞结构来源——和“一般分生组织”(general meristem),后者是一个精细化的区域。从持续分生组织残留物中产生新细胞是一个非常缓慢、持续时间长的连续过程,而一般分生组织中的细胞通过则是一个非常快速、持续时间短的连续过程。这一概念被用于Newman设计的适用于所有维管植物类群的顶端分生组织分类:(1)单轴型(monopodial),如蕨类植物——残留物位于表层,任何类型的分裂都有助于长度和宽度的增长;(2)单层型(simplex),如裸子植物——残留物位于单一的表层,需要垂周分裂(anticlinal)和平周分裂(periclinal)来进行体积增长;(3)双层型(duplex),如被子植物——残留物至少存在于两个表层,具有两种对比的生长模式,靠近表面的垂周分裂和顶端分生组织深处至少两个平面的分裂。
❙ 营养茎尖
营养茎尖是一个动态结构,除了向初生植物体添加细胞外,还重复产生称为植物节(phytomere)的单位或模块(图6.5)。每个植物节由一个节(node)、
图6.5
双子叶植物茎尖纵切面示意图。顶端分生组织的活动重复产生叶和芽原基,导致一系列重复的单位,称为植物节。每个植物节由一个节、其附着的叶、该叶下方的节间和节间基部的芽组成。植物节的边界由虚线表示。注意,节间的长度随着距离顶端分生组织越远而增加。节间伸长是茎长度增加的主要原因。
附着的叶、下方的节间和节间基部的芽组成。芽位于下一个较低植物节叶的腋部,可能发育成侧枝。在种子植物中,第一个茎的顶端分生组织在胚胎中组织形成,无论是在子叶出现之前还是之后(Saint-Côme, 1966; Nougarède, 1967; Gregory and Romberger, 1972)。
营养枝顶端(vegetative shoot apices)在形状、大小、细胞学分区(cytologic zonation)和分生组织活性(meristematic activity)方面各不相同(图6.6)。针叶树的枝顶端通常相对较窄且呈圆锥形;在Ginkgo和苏铁类植物中,它们则较为宽大且扁平。一些单子叶植物(禾本科、Elodea)和真双子叶植物(Hippuris)的顶端分生组织(apical meristem)狭窄而细长,远端部分远高于最年轻的节。在许多真双子叶植物中,远端部分几乎不高于叶原基(leaf primordia),甚至看起来凹陷(Gifford, 1950)。在一些植物中,轴在接近顶端处宽度增加,承载叶原基的外围区域高于顶端分生组织,使后者处于坑状凹陷中(Ball, 1941;真双子叶植物的莲座型,Rauh和Rappert, 1954)。在最年轻叶原基着生处测量的顶端宽度示例如下:280微米,Equisetum hiemale;1000微米,Dryopteris dilatata;2000至3300微米,Cycas revoluta;280微米,Pinus mugo;140微米,Taxus baccata;400微米,Ginkgo biloba;288微米,Washingtonia filifera;130微米,Zea mays;500微米,Nuphar lutea(Clowes, 1961)。在发芽时,Arabidopsis thaliana(Wassilewskija生态型)胚胎的枝顶端分生组织大小约为35×55微米(Medford等, 1992)。顶端的形状和大小在植物从胚胎到繁殖的发育过程中、在连续叶的起始之间以及与季节变化相关时都会发生变化。Phoenix canariensis在生长过程中宽度变化的示例如下(Ball, 1941):胚胎中直径为80微米,幼苗中为140微米,成年植物中为528微米。
在接下来的段落中,我们将考虑维管植物主要类群枝顶端分生组织的结构和功能的更多方面。我们从无种子维管植物开始。
顶端细胞的存在是无种子维管植物枝顶端的特征
在大多数无种子维管植物——薄囊蕨类(更特化的蕨类)、Osmunda——中,枝顶端的生长来自一层表面的大而高度液泡化的细胞,中心有一个或多或少明显的顶端细胞(apical cell),即初始细胞(initial cell)。在一些无种子维管植物(Equisetum、Psilotum、Selaginella的物种)中,顶端细胞增大且相当显眼;在其他植物(厚囊蕨类、Lycopodium、Isoetes)中,缺乏明显的顶端细胞,情况不太清楚(Guttenberg, 1966)。在Lycopodium的同一物种中(Schüepp, 1926; Härtel, 1938)和一些厚囊蕨类中(Campbell, 1911; Bower, 1923; Bhambie和Puri, 1985),既有单个顶端细胞也有顶端初始细胞群的报道。然而,几乎所有无种子维管植物的枝顶端都可能存在单个顶端细胞(Bierhorst, 1977; White, R. A., 和 Turner, 1995)。
最常见的顶端细胞(apical cell)呈金字塔形(四面体形)(图6.1A, C)。金字塔的基部朝向自由表面,其他三个面向下。在具有四面体顶端细胞的顶端,衍生细胞形成有序的模式,这是由顶端细胞分裂的有序性引发的:
连续的分裂沿着螺旋线以向顶顺序(acropetal sequence)依次进行。术语"merophyte"用于指代顶端细胞的直接单细胞衍生物,也指由它们衍生的多细胞结构单元(Gifford, 1983)。四面体顶端细胞见于Equisetum和大多数薄囊蕨类(leptosporangiate ferns)。
顶端细胞可能是三面的,有两个面可以切下新细胞。这种顶端细胞是两侧对称(bilaterally symmetrical)枝条的特征,如水蕨类Salvinia、Marsilea和Azolla(Guttenberg, 1966; Croxdale, 1978, 1979; Schmidt, K. D., 1978; Lemon and Posluszny, 1997)。Pteridium的扁平根状茎顶端也有一个三面顶端细胞(图6.1B, D; Gottlieb和Steeves, 1961)。
一些研究者基于分区(zonation)描述了蕨类植物的枝条顶端(McAlpin和White, 1974; White, R. A., 和Turner, 1995)。根据这一概念,原分生组织(promeristem)由两层分生组织细胞组成,即表层和亚表层。在原分生组织下方是明显的分生组织区,"过渡到皮层(cortex)、中柱(stele)和髓(pith)的发育组织"(White, R. A., 和Turner, 1995)。第二个概念是在研究Matteuccia struthiopteris和Osmunda cinnamomea的枝条顶端时提出的,认为原分生组织仅由表层组成,该层具有单个顶端细胞(Ma和Steeves, 1994, 1995)。紧接表层下方的是前中柱组织(prestelar tissue),由原维管组织(provascular tissue)(定义为维管化初始阶段并在其中随后形成原形成层(procambium)的组织)和髓母细胞(pith mother cells)组成,后者代表髓的初始分化。
尽管早期植物形态学家认为无种子维管植物枝条和根顶端分生组织顶端的顶端细胞是枝条和根中所有细胞的最终来源,但随着"méristème d'attente"概念的出现,顶端细胞的形成作用开始受到质疑。一些研究者得出结论,顶端细胞仅在非常年轻的植物中有丝分裂活跃,然后变得有丝分裂不活跃,并构成一个"静止中心(quiescent center)",类似于被子植物根中的多细胞静止中心。据报道,某些蕨类植物的顶端细胞由于内复制(endoreduplication)而高度多倍体(第5章),这种情况支持顶端细胞有丝分裂不活跃的观点(D'Amato, 1975)。然而,随后的研究涉及有丝分裂指数(mitotic index)、细胞周期和有丝分裂持续时间以及某些蕨类植物枝条和根顶端DNA含量的测定,清楚地表明顶端细胞在活跃的枝条和根生长期间仍然有丝分裂活跃(Gifford等, 1979; Kurth, 1981)。在发育过程中没有发现顶端分生组织内复制的证据。这些研究,加上"重新发现"merophyte作为顶端细胞的单一衍生物(Bierhorst, 1977),重申了顶端细胞作用的经典概念。
银杏顶端的区域化为其他裸子植物茎尖的解释提供了基础
顶端分生组织(apical meristem)中细胞学区域的存在首次由Foster (1938)在Ginkgo biloba的茎尖中识别(图6.7)。在银杏中,顶端的所有细胞都来源于一组表面原始细胞(apical initial group)。由表面原始细胞产生的下方细胞群构成了中央母细胞区(central mother cell zone)。这整个细胞群,包括顶端原始细胞群的侧向衍生物,都明显具有液泡化特征,这与相对较低的有丝分裂活动速率有关。此外,中央母细胞区的细胞通常具有增厚且明显具纹孔的细胞壁。顶端表面原始细胞和中央母细胞构成了原分生组织(promeristem)。围绕中央母细胞区的是周边区(peripheral zone, peripheral meristem),其下方是肋状或髓分生组织(rib or pith meristem)。周边区部分来源于顶端原始细胞的侧向衍生物,部分来源于中央母细胞。在母细胞区基部产生的衍生物在通过肋状分生组织形式的生长过程中成为髓细胞。在活跃生长期间,一个杯状的有序分裂细胞区域,即过渡区(transitional zone),界定了母细胞区,并可能延伸到顶端区的表面。
刚刚回顾的结构模式细节在不同的裸子植物类群中有所不同。苏铁类具有非常宽的顶端,大量表面细胞通过平周分裂(periclinal divisions)向深层贡献衍生物。Foster (1941, 1943)将这种扩展的表面及其直接衍生物解释为起始区(initiation zone);而其他人则将原始细胞限制在相对较少的表面细胞中(Clowes, 1961; Guttenberg, 1961)。表层的平周衍生物向母细胞区汇聚,这种模式显然是苏铁类的特征。在其他种子植物中,细胞层通常从起始点发散。这种汇聚模式是由于表面细胞及其近期衍生物中的大量垂周分裂(anticlinal divisions)造成的——
图6.7
Ginkgo biloba茎尖的纵切面。顶端原始细胞群(ai)通过垂周分裂贡献于表层。它还通过平周分裂向中央母细胞群(mc)添加细胞。体积的增长是通过细胞扩大实现的,中央母细胞区的特征是在各个平面上偶尔发生分裂。该区最外层的分裂产物被推向过渡区(tr),在那里它们相对于母细胞区进行平周分裂。这些分裂的衍生物形成周边亚表层和未来的髓,即肋状分生组织区。(\times430。来自Foster, 1938。)
通过一定深度的组织进行表面生长的证据。这种生长似乎与顶端的较大宽度有关。苏铁类的母细胞群相对不明显。广泛的周边区来源于表面原始细胞的直接衍生物和母细胞。肋状分生组织在母细胞区下方或多或少较为明显。
大多数针叶树(conifers)的表层具有平周分裂(periclinal division)的顶端原始细胞(apical initials)。在Araucaria、Cupressus、Thujopsis (Guttenberg, 1961)、Agathis (Jackman, 1960)和Juniperus (Ruth et al., 1985)中描述了一种相反的组织结构,其细胞层几乎完全或主要进行垂周分裂(anticlinal division)。在这些植物中,顶端被解释为具有原套-原体(tunica-corpus)结构。在针叶树中,母细胞群(mother cell group)可能分化良好,并且可能存在过渡区(transitional zone)。在具有狭窄顶端的针叶树中,母细胞数量较少,可能膨大和液泡化(vacuolated),也可能不膨大和液泡化。在这样的顶端中,一个小的母细胞群,深度为三到四个细胞,突然被高度液泡化的髓细胞(pith cells)所取代,没有插入肋状分生组织(rib meristem),外围区(peripheral zone)也只有几个细胞宽。
关于针叶树枝条顶端的结构季节性变化已有研究。在一些物种中(Pinus lambertiana和P. ponderosa, Sacher, 1954; Abies concolor, Parke, 1959; Cephalotaxus drupacea, Singh, 1961),基本的分区(zonation)没有变化,但在生长期间,顶端圆顶(apical dome)在最年轻节(youngest node)上方的高度比休眠期(dormancy)更大(图6.8)。由于这种差异,分区在两种顶端中相对于最年轻节的分布不同:在休眠的顶端中,肋状分生组织出现在该节下方,而在活跃的顶端中部分出现在该节上方。这一观察结果引起了对术语问题的关注。如果严格定义顶端分生组织(apical meristem)为最年轻节上方的顶端部分,则必须解释为在不同生长阶段其组成会发生变化(Parke, 1959)。据报道,在Tsuga heterophylla (Owens和Molder, 1973)和Picea mariana (Riding, 1976)的休眠分生组织中,分区消失并出现类似原套-原体的结构。
买麻藤纲(Gnetophyta)通常具有明确的表层(surface layer)和由其自身原始细胞(initials)衍生的内部核心(inner core)的分离。因此,Ephedra和Gnetum的枝条顶端被描述为具有原套-原体生长模式(Johnson, 1951; Seeliger, 1954)。原套(tunica)为单层,原体(corpus)在形态和分裂方式上与中央母细胞区(central mother cell zone)相当。Welwitschia的枝条顶端通常只产生一对叶状叶(foliage leaves),并且没有明显的分区。在表层中观察到平周分裂(Rodin, 1953)。
图6.8
Abies枝条顶端在季节性生长的第一阶段(A)和冬季休眠阶段(B)的纵切面。在A中,正在形成鳞片原基(scale primordia, sc),髓中的单宁含量将该区域与顶端和外围区(peripheral zone, pz)区分开来。顶端中最近分裂的结果很明显。B中的分区不如A中明显。其他细节:ai,顶端原始细胞群(apical initial group); mc,母细胞(mother cells)。(A, ×270; B, ×350。B, 来自Parke, 1959。)
在原套-原体结构上叠加分区是被子植物枝条顶端的特征
如前所述,原体(corpus)和每一层原套(tunica)都被视为具有各自的原始细胞(initials)。在原套中,原始细胞位于中轴位置。通过垂周分裂(anticlinal divisions),这些细胞形成新的细胞后代,其中一些仍保留在顶端作为原始细胞;其他细胞则作为衍生细胞(derivatives),通过后续的分裂,为茎的外周部分贡献细胞。原体的原始细胞位于原套原始细胞的下方。通过平周分裂(periclinal divisions),这些原始细胞向下方的原体提供衍生细胞,原体的细胞在不同平面上分裂。原体分裂产生的细胞被添加到轴的中心,即肋状分生组织(rib meristem),以及外周分生组织(peripheral meristem)。原体和覆盖在原体上的原套层共同构成了分生组织的中央区(central zone)或原分生组织(promeristem)。
原体的原始细胞可能形成一个明确的层,与原体中排列较不规则的细胞形成对比。当这种模式存在时,原套和原体之间的界限可能难以确定。然而,如果在不同发育阶段收集顶端,会发现原体的最上层正在进行周期性的平周分裂。在这种分裂之后,原体中会暂时出现第二个有序的层。
被子植物(angiosperms)中原套的层数有所不同(Gifford and Corson, 1971)。在真双子叶植物(eudicots)中,超过一半的研究物种具有两层原套(图6.9)。关于更高层数(四层和五层或更多)的报道(Hara, 1962)需要加以限定,因为一些研究者将最内层的平行层包括在原套中,而另一些则将其包括在原体中。单子叶植物(monocots)中,一层和两层原套是常见的层数。在羊茅类禾草(festucoid grasses)中,两层原套是常见的,而在黍类禾草(panicoid grasses)中,单层原套是常见的(图6.10)(Brown et al., 1957)。也观察到缺乏原套-原体组织的情况,最外层进行平周分裂(Saccharum, Thielke, 1962)。茎尖的平行层数可能在植物的个体发育(ontogeny)过程中发生变化(Mia, 1960; Gifford and Tepper, 1962),并受季节性生长变化的影响(Hara, 1962)。也可能存在与叶片起始相关的分层周期性变化(Sussex, 1955)。
关于具有原套-原体组织的顶端分生组织(apical meristem)中的层是克隆上不同的细胞层的观点,得到了平周细胞嵌合体(periclinal cytochimeras)观察的支持(第5章)。大多数通过细胞嵌合体研究的植物是具有两层原套的真双子叶植物。在这些植物中,平周细胞嵌合体清楚地揭示了三个独立层(两层原套和一层原体原始细胞)的存在。
图6.9
马铃薯(Solanum tuberosum)茎尖的纵切面,显示顶端分生组织的原套-原体组织和叶片原基(leaf primordium)起始的两个阶段;A中的叶片基座(leaf buttress)阶段,B中的向上生长开始阶段。在叶片基座下方可以看到一个原形成层束(procambial strand),它将向上分化到发育中的叶片中。(来自Sussex, 1955。)
图6.10
玉米(Zea mays)茎尖的纵切面,这是一种具有单层原套(tunica)的黍亚科(panicoid)禾草。由于叶片在生长过程中环绕茎轴,因此每片叶子的部分出现在轴的两侧。(引自Esau, 1977。)
在顶端分生组织(apical meristem)中(图5.11;Satina等,1940),这三层细胞通常被命名为L1、L2和L3,最外层为L1,最内层为L3。一些研究者错误地将整个原体(corpus)命名为L3,而不仅仅是原体的初始层(initial layer)(例如,Bowman和Eshed,2000;Vernoux等,2000a;Clark,2001)。
植物发育阶段中,营养茎尖的分区(zonation)在不同物种中可能有所不同。例如,在仙人掌科(Cactaceae)中,某些物种在萌发时已经建立了分区,而在其他物种中,此时仅存在原套-原体(tunica-corpus)组织(Mauseth,1978)。在一些仙人掌物种中,分区直到产生超过30片叶子后才完成。同样,在彩叶草(Coleus)的茎尖中,分区直到五对叶子开始形成后才完成(Saint-Come,1966)。因此,尽管分区是这些分生组织的特征,但它对于叶子的产生或分生组织的正常功能并不是必需的。Sekhar和Sawhney(1985)未能在番茄(Solanum lycopersicum)的茎尖中识别出分区模式。
如第5章所述,许多植物生物学家采用术语“干细胞(stem cell)”来指代顶端分生组织中的初始细胞(initials)和/或其近期衍生物。一些研究者在描述茎顶端分生组织时混淆地使用了这两个术语。以下是一些例子:“干细胞不是永久性的初始细胞……”(Fletcher,2004)。“现在普遍认为中央区(central zone)作为干细胞群体……生成其他两个区的初始细胞,同时维持自身”(Vernoux等,2000a)。“中央区作为干细胞的储存库,补充外围区(peripheral zone)和肋区(rib zone),同时维持中央区的完整性。需要注意的是,这些细胞并不作为永久性的初始细胞,而是其行为受位置依赖的方式调控”(Bowman和Eshed,2000)。“现在广泛认为中央细胞作为干细胞,并作为茎顶端分生组织其他两个区的初始细胞或来源细胞”(Laufs等,1998a)。在将茎顶端分生组织描述为“一组干细胞”时,另一位研究者(Meyerowitz,1997)将中央区命名为“初始区(zone of initials)”。
一些研究者注意到“干细胞”这一术语在植物中的模糊性,并且在大多数情况下,避免在其对茎顶端分生组织的描述中使用该术语(Evans, M. M. S., 和 Barton, 1997)。为了避免在植物生物学中使用“干细胞”这一术语时固有的混淆,Barton(1998)采用了术语“原分生组织(promeristem)”,她指出这一概念上由顶端初始细胞及其近期衍生物组成,“用于指代尚未被指定为叶或茎的假设细胞群体……”。这是完全合适的,因为术语“原分生组织”和“中央区”本质上是同义词。如前所述,本书未采用“干细胞”这一术语。
❙ 拟南芥(Arabidopsis thaliana)的营养茎尖
Arabidopsis 的营养茎尖具有两层原套(tunica)覆盖在浅层的原体(corpus)之上(Vaughn, 1955; Medford et al., 1992)。在原套-原体组织的基础上,叠加了被子植物茎尖的三个特征区域:一个中央区(central zone),在纵切面上可见约5个细胞深、3-4个细胞宽;一个染色较深的外周区(peripheral zone);以及一个肋状分生组织(rib meristem)。对Arabidopsis茎尖的形态计量学研究表明,外周区的有丝分裂指数(mitotic index)(在给定时间内处于分裂状态的细胞核百分比)比中央区高约50%(Laufs et al., 1998b)。关于茎顶端分生组织(shoot apical meristem)功能的宝贵信息来自于Arabidopsis thaliana的遗传和分子研究。
图6.11
Arabidopsis胚胎发生过程中茎顶端分生组织(SAM)的形成。SAM发育的第一个迹象是在16细胞阶段WUS表达的启动,远在SAM可辨认之前。随后STM和CLV1表达启动。STM表达的启动独立于WUS活性,而CLV1表达的启动独立于STM。条形表示检测到每个基因mRNA的阶段。注意,合子的分裂产生一个较小的顶端细胞和一个较大的基部细胞。顶端细胞是胚胎本身的先导。顶端细胞的垂直和横向分裂导致一个8细胞的早期胚胎。上部的四个细胞是顶端分生组织和子叶的来源,下部的四个细胞是下胚轴的来源。丝状胚柄的最上部细胞横向分裂,上部细胞成为胚根原(hypophysis)。胚根原产生根顶端分生组织的中央细胞和柱状根冠(columella rootcap)。其余的根分生组织和侧根冠来源于胚胎本身。(见图1.7。)(引自Lenhard和Laux, 1999。\copyright 1999,经Elsevier许可。)
这里只考虑少数此类研究的结果。
Arabidopsis的初生茎顶端分生组织在胚胎发生过程中相对较晚才显现,在子叶启动之后(图6.11;Barton和Poethig, 1993)。(关于被子植物胚胎发生过程中茎顶端分生组织和子叶起源的讨论,见Kaplan和Cooke, 1997。)茎顶端分生组织的建立需要SHOOTMERISTEMLESS (STM)基因的活性,该基因首先在晚期球形胚的一两个细胞中表达(Long et al., 1996; Long和Barton, 1998)。严重的功能缺失stm突变导致幼苗具有正常的根、下胚轴和子叶,但缺乏茎顶端分生组织(Barton和Poethig, 1993)。STM mRNA存在于所有营养茎尖的中央区和外周区,但在发育中的叶原基中不存在(Long et al., 1996)。
虽然STM基因对于茎顶端分生组织(Shoot Apical Meristem)的建立是必需的,但WUSCHEL (WUS)基因与STM基因一起,对于初始细胞(Initials)功能的维持也是必要的。在wus突变体中,初始细胞会发生分化(Laux et al., 1996)。WUS的表达始于胚胎发育的16细胞阶段,早于STM的表达,并且远在分生组织显现之前(图6.11)。在完全发育的分生组织中,WUS的表达仅限于L3层(分生组织体的初始层)下方的一小群中央区细胞,并在整个茎发育过程中持续存在(Mayer et al., 1998; Vernoux et al., 2000a)。因此,WUS不在初始细胞中表达,这表明两组细胞之间必须存在信号传导(Gallois et al., 2002)。
除了促进分生组织的基因,如STM和WUS,其他基因通过抑制初始细胞活性来调节分生组织的大小(图6.12)。这些是CLAVATA (CLV)基因(CLV1、CLV2、CLV3),它们的突变会导致中央区未分化细胞的积累,从而使分生组织的大小增加(Clark et al., 1993, 1995; Kayes and Clark, 1998; Fletcher, 2002)。细胞的积累显然是由于未能促进外周区细胞向分化方向发展。CLV3的表达主要局限于L1和L2层以及中央区的少数L3细胞,可能标记了这些层中的初始细胞;表达CLV1的细胞位于L1和L2层下方(Fletcher et al., 1999)。WUS在分生组织的最深层区域表达。有观点认为,表达WUS的细胞充当了"组织中心(Organizing Center)",赋予上覆邻近细胞初始细胞的身份,而来自CLV1/CLV3区域的信号则起到负向调节作用,抑制这种活性(Meyerowitz, 1997; Mayer et al., 1998; Fletcher et al., 1999)。更具体地说,有观点认为,由顶端初始细胞分泌的CLV3蛋白通过质外体移动,并与下方细胞质膜上的CLV1/CLV2受体复合物结合(Rojo et al., 2002)。CLV3通过CLV1/CLV2受体复合物的信号传导导致WUS的下调,从而在整个发育过程中维持适当的初始细胞活性。因此,通过这种反馈回路,在分生组织细胞的增殖与通过分化和外周区侧器官起始导致的分生组织细胞损失之间保持了平衡(Schoof et al., 2000; Simon, 2001; Fletcher, 2004)。
❙ 叶的起源
茎尖(Shoot apex)产生侧生器官,因此茎尖分生组织(Shoot apical meristem)的结构和活动必须与侧生器官的起源联系起来考虑,尤其是叶(Leaf),它们在茎尖的外周区(Peripheral zone)起始。本章仅讨论与顶端分生组织(Apical meristem)的结构和活动相关的叶起源特征。
含有同源异型框(Homeobox)的植物基因KNOTTED1类基因的下调(Down-regulation)——最初在玉米(Zea mays)中发现——为茎尖分生组织中的叶起始提供了早期分子标记(Smith et al., 1992; Brutnell and Langdale, 1998; van Lijsebettens and Clarke, 1998; Sinha, 1999)。玉米中的KN1基因在叶原基(Leaf primordium)起始部位特异性地下调。拟南芥(Arabidopsis thaliana)中KNOTTED1类基因KNAT1和STM1的下调也标志着原基起始部位(Long and Barton, 2000)。在针叶树云杉(Picea abies)的茎尖分生组织中发现的HBK1基因可能起着与被子植物(Angiosperms)中KNOTTED基因类似的作用(Sundås-Larsson et al., 1998)。
在整个营养期(Vegetative period),茎尖分生组织以规则的顺序产生叶片
茎上叶的顺序或排列称为叶序(Phyllotaxis或Phyllotaxy;来自希腊语phyllon,叶,和taxis,排列;Schwabe, 1984; Jean, 1994)。最常见的叶序是螺旋状(Spiral),每个节(Node)上有一片叶,叶片围绕茎形成螺旋状图案,连续叶片之间的发散角为137.5^{\mathrm{\circ}} (栎属Quercus, 巴豆属Croton, 桑Morus alba, 丛生Hectorella caespitosa)。在其他每个节上有一片叶的植物中,叶片以180^{\mathrm{o}}的角度相对排列成两列,如禾草类(Grasses)。这种叶序称为二列叶序(Distichous)。在一些植物中,每个节上的叶片以90^{\mathrm{o}}的角度成对排列,这种叶序称为对生叶序(Opposite)(槭属Acer, 忍冬属Lonicera)。如果每对连续叶片与前一对成直角排列,这种排列称为交互对生叶序(Decussate)(唇形科Labiatae,包括鞘蕊花属Coleus)。每个节上有三片或更多叶片的植物(夹竹桃Nerium oleander, 弗吉尼亚婆婆纳Veronicastrum virginicum)被称为轮生叶序(Whorled)。
通常与叶起始相关的第一个组织学事件是顶端分生组织外周区细胞分裂速率和分裂面的变化,导致在轴的一侧形成突起(称为叶基(Leaf buttress))(图6.9)。在具有螺旋叶序的茎中,分裂在顶端分生组织周围的不同区域交替进行,从上方看,顶端由此产生的周期性扩大是不对称的。在具有交互对生叶序的茎中,扩大是对称的,因为分生组织活动的增强同时发生在相对的两侧(图6.13)。因此,叶的起始导致茎尖大小和形态的周期性变化。两个连续叶原基(或具有对生或轮生叶序的原基对或轮)起始之间的周期或间隔称为叶间隔期(Plastochron)。在一个叶间隔期内发生的茎尖形态变化可称为叶间隔期变化(Plastochronic changes)。
术语“plastochron”最初是以一种相当普遍的意义提出的,用于指代在一系列相似的周期性重复事件中,两个连续相似事件之间的时间间隔(Askenasy, 1880)。在这个意义上,该术语可以应用于连续叶片发育中各种对应阶段之间的时间间隔,例如,原基起源部位分裂的开始、原基从基部向上生长的开始以及叶片开始的启动。Plastochron
图6.13
Hypericum uralum 茎尖的叶片起始,具有对生(opposite,交替的叶对彼此成直角)的叶片排列。在新叶原基起始之前,顶端分生组织表现为一个小圆丘(A)。它逐渐变宽(B, C)。然后在其侧面起始叶片基部(D)。当新叶原基从基部向上生长时,顶端分生组织再次呈现出小圆丘的外观(E)。黑色显示的叶对早期阶段在\mathbf{A}^{1}中,并在黑色显示的叶对出现后不久结束在\boldsymbol{\mathrm{E}}^{1}中。\mathbf{A}^{1}{-}\mathbf{E}^{1}中的切片为横切,\mathbf{A}^{2}{-}\mathbf{E}^{2}和\mathrm{\mathbf{A}}^{3}\mathrm{-\mathbf{E}}^{3}中的切片为纵切。\mathrm{\mathbf{A}}^{3}\mathrm{-\mathbf{E}}^{3}中,点状表示corpus的外边界细胞(初始层)及其直接衍生物。\mathrm{E}^{3}中,四边形表示腋芽的假定起源位置。(改编自Zimmermann, 1928。)
Plastochron也可用于指代节间和腋芽的发育、茎的维管化阶段以及花部发育的阶段。
Plastochron的长度通常测量为原基起始速率的倒数。连续的plastochron可能具有相同的持续时间,至少在遗传上均匀的材料在受控环境中生长的营养生长期间(Stein和Stein, 1960)。已知植物的发育阶段和环境条件会影响plastochron的长度。例如,在Zea mays中,胚胎中的连续plastochron从3.5天延长到13.5天,而在幼苗中则从3.6天缩短到0.5天(Abbe和Phinney, 1951; Abbe和Stein, 1954)。在Lonicera nitida中,plastochron的持续时间从1.5天到5.5天不等,显然与温度变化有关(Edgar, 1961)。温度也影响了Glycine max(Snyder和Bunce, 1983)和Cucumis sativus(Markovskaya等, 1991)中原基起始的速率。叶片的产生速率也受到光的影响(Mohr和Pinnig, 1962; Snyder和Bunce, 1983; Nougarède等, 1990; Schultz, 1993)。水稻中的PLASTOCHRON1 (PLA1)基因通过控制分生组织中叶片的产生速率来调节营养阶段的持续时间(Itoh等, 1998)。
一个常用的发育时间测量指标,与茎尖相关的是叶间隔期(phyllochron),它特指在完整植物中连续叶片可见出现或萌发之间的时间间隔,其倒数即为叶片出现速率(rate of leaf appearance) (Lyndon, 1998)。叶原基间隔期(plastochron)和叶间隔期的持续时间不一定对应。只有当两个事件之间的时间间隔恒定时,原基起始速率和叶片萌发速率才相似,但这种情况往往并不存在。例如,在Cyclamen persicum中,生长季早期原基起始速率超过叶片萌发速率,原基在茎尖积累;这一趋势在生长季晚期逆转(Sundberg, 1982)。在Triticum aestivum和Hordeum vulgare中,发现较早的叶片比较晚的叶片萌发更快,而在Brassica napus中观察到相反的模式(Miralles et al., 2001)。可能叶原基间隔期和叶间隔期持续时间之间最大的差异表现在针叶树中。例如,在Picea sitchensis中,秋季芽形成期间积累了大量针叶原基(Cannell and Cahalan, 1979)。春季芽萌发时,情况相反,叶片迅速扩大。
如果茎尖经历叶原基间隔期的大小变化,其体积和表面积都会发生变化。为了描述这些变化,引入了最大面积期(maximal-area phase)和最小面积期(minimal-area phase)的表达(Schmidt, A., 1924)。对于具有对生叶序(decussate phyllotaxy)的茎,茎尖在一对叶原基出现之前达到最大面积期(图6.13B)。随着叶原基的隆起,顶端分生组织(apical meristem)的宽度减小(图6.13E)。茎尖进入叶原基间隔期生长的最小面积期。在形成一对新原基之前,茎尖返回到最大期。现在的延伸发生在前一个最大期最长直径的垂直方向上,但顶端分生组织的扩大在叶片对成员之间也很明显,这些叶片的生长先前导致了茎尖大小的减小。
生长中的叶原基和顶端分生组织之间的关系在不同物种中差异很大。图6.14展示了一个极端情况,其中顶端分生组织在扩大的叶原基之间几乎消失(图6.14D)。在另一个物种中,顶端分生组织受到的影响要小得多(图6.9),而在顶端分生组织显著高于器官发生区(organogenic region)的物种中,茎尖不会经历叶原基间隔期的大小变化(图6.10)。
叶原基的起始与起始部位周缘分裂(periclinal divisions)频率的增加有关
在具有两层原套(tunica)的真双子叶植物和单子叶植物中,第一次平周分裂(periclinal divisions)最常发生在L2层,随后是L3层的类似分裂和L1层的垂周分裂(anticlinal divisions)(Guttenberg, 1960; Steward and Dermen, 1979)。在一些单子叶植物中,叶原基(leaf primordia)由L1层的平周分裂启动。在Triticum aestivum(Evans, L. S., and Berg, 1972)和Zea mays(Sharman, 1942; Scanlon and Freeling, 1998)中,第一次平周分裂发生在L1层,随后是分生组织一侧L2层的类似分裂。然后平周分裂在两层中横向扩展,形成一个环绕分生组织的环。由于被子植物中叶的启动遵循相对一致的模式,而原套的深度是可变的,因此原套和原体(corpus)与叶的形成有不同的关系,这取决于它们在特定顶端中的数量关系。因此,叶原基由跨越分生组织中两个或多个细胞层的细胞群启动。在棉花(Dolan and Poethig, 1991, 1998)、烟草(Poethig and Sussex, 1985a, b)和Impatiens(Battey and Lyndon, 1988)中,涉及的细胞总数估计约为100个,在玉米(Poethig, 1984; McDaniel and Poethig, 1988)中为100到250个,在拟南芥(Hall and Langdale, 1996)中为30个。这些细胞——叶原基的直接前体——被一些研究者称为创始细胞(founder cells)(有时不恰当地称为“anlagen”,意为原基)。
与叶原基启动相关的平周分裂同时或之前,一个或多个原形成层束(procambial strands)(叶迹(leaf traces))可能已经存在于叶位点的基部,这些束将向上分化进入发育中的叶片(图6.9)。早熟的原形成层束在真双子叶植物(Garrya elliptica, Reeve, 1942; Linum usitatissimum, Girolami, 1953, 1954; Xanthium chinense, McGahan, 1955; Acer pseudoplatanus, White, D. J. B., 1955; Xanthium pennsylvanicum, Millington and Fisk, 1956; Michelia fuscata, Tucker, 1962; Populus deltoides, Larson, 1975; Arabidopsis thaliana, Lynn et al., 1999)和单子叶植物(Alstroemeria, Priestly et al., 1935; Andropogon gerardii, Maze, 1977)中都有观察到。在拟南芥中,早熟的叶迹被检测为PINHEAD (PNH)表达的高密度区域(Lynn et al., 1999)。PNH的表达先于叶位点STM的下调,因此可以被视为比STM表达缺失更早的叶形成标志。
图6.14
Kalanchoë发育中叶原基的轮廓,来自第八对叶启动和发育过程中采集的茎的纵切面(A-E)和横切面(F)。A,第7个间隔期(plastochron)后;顶端处于最大期。B,第8个间隔期早期;第8对叶已启动。C,第8对叶稍伸长。D,第8个间隔期中期;顶端处于最小期。E,第9个间隔期早期;第9对原基与第8对交替,因此未出现在图E的平面中;两个第8对原基之间扩大的顶端可见。F,第8个间隔期早期,阶段与B相似。(来自Esau, 1977; 根据Stein和Stein, 1960的显微照片。)
在裸子植物(gymnosperms)中,叶片也起源于周边区(peripheral zone)。根据Owens (1968)的研究,在花旗松(Pseudotsuga menziesii)中,叶片起始(leaf initiation)的第一个迹象是周边区中一个原形成层束(procambial strand)的分化,"以供应假定的原基(presumptive primordium)"。在其他裸子植物中也观察到了早熟的原形成层束(红杉Sequoia sempervirens, Crafts, 1943; 银杏Ginkgo biloba, Gunckel和Wet-more, 1946; 花旗松Pseudotsuga taxifolia, Sterling, 1947)。与裸子植物叶原基(leaf primordia)起始相关的分裂通常发生在表面以下的第二或第三层。表层可能通过平周分裂(periclinal division)和其他分裂方式为原基的内部组织贡献细胞(Guttenberg, 1961; Owens, 1968)。在无种子维管植物(seedless vascular plants)中,叶片起源于单个表层细胞或细胞群,其中一个细胞增大并成为原基的显著顶端细胞(apical cell)(White和Turner, 1995)。
值得注意的是,尽管细胞分裂速率和方向的变化长期以来一直与叶原基的起始相关,但有证据表明,在没有细胞分裂的情况下也可以起始新的原基(Foard, 1971)。此外,已经证明,细胞周期活性下调的已有叶片(Hemerly等, 1995)和具有干扰正确细胞板(cell plate)定向的突变的叶片(Smith等, 1996)可以发育出几乎正常的形状。这些观察结果支持了植物发育过程中形状的获得独立于细胞分裂模式的概念(Kaplan和Hagemann, 1991)。显然,负责原基起始以及植物及其器官最终形状和大小的,是细胞扩张的调节,而不是细胞分裂的模式(Reinhardt等, 1998)。
叶原基的起始伴随着外表皮细胞壁中纤维素微纤丝(cellulose microfibrils)方向和模式的变化,因为表皮转移了纤维素强化(cellulose reinforcement)以适应新器官的形成(Green和Brooks, 1978; Green, 1985, 1989; Selker等, 1992; Lyndon, 1994)。微纤丝的方向可以通过与顶端表面平行的薄切片中的偏振光(polarized light)观察到(Green, 1980)。在Graptopetalum中,新定向的微纤丝排列成圆形阵列,标志着新一对叶原基将出现的位置(Green和Brooks, 1978)。其他营养顶端(vegetative apices)也被研究以追踪伴随叶片起始的微纤丝方向变化,包括Vinca(Green, 1985; Sakaguchi等, 1988; Jesuthasan和Green, 1989)和Kalanchoë(Nelson, 1990),它们都表现出对生叶序(decussate phyllotaxis),以及Ribes(Green, 1985)和Anacharis(Green, 1986)具有螺旋叶序(spiral phyllotaxis)。无论叶序类型如何,叶片都起源于茎尖(shoot apex)表面特定的纤维素强化区域(Green, 1986)。
叶原基起源于与茎叶序相关的位置
长期以来,植物学家一直对顶端分生组织周围叶片有序起始的机制感兴趣。早期基于手术操作结果的观点认为,新的叶原基(leaf primordium)产生于"第一个可用的空间";也就是说,当达到足够的宽度和与顶端顶点的距离时,新的原基就会产生(Snow and Snow, 1932)。在证实这些早期观察结果的同时,Wardlaw (1949)提出了"生理场理论(physiological field theory)"。随着每个新叶的起始,它被一个生理场所包围,在该场内新原基的起始受到抑制。直到下一个叶原基的位置位于现有场之外时,才能起始一个新的原基。最近有人提出,生长顶端中的"生物物理力(biophysical forces)"决定了叶起始位点(Green, 1986)。在这个假说中,当原套(tunica)表面的一个区域隆起或弯曲时,叶原基就起始了,这种情况部分是由于表层抵抗下方组织压力的能力局部降低所致(Jesuthasan and Green, 1989; Green, 1999)。有人认为,由弯曲产生的局部应力变化触发了通常与侧向器官形成相关的平周分裂(periclinal divisions)(Green and Selker, 1991; Dumais and Steele, 2000)。
生物物理力假说的支持部分来自于一些研究,这些研究表明,局部施用扩张蛋白(expansin)到番茄茎顶端分生组织(shoot apical meristem)可诱导叶状突起的形成(Fleming et al., 1997, 1999)。显然,扩张蛋白促进了原套外层细胞壁的伸展性,导致组织向外隆起。原位杂交(in situ hybridization)分析表明,扩张蛋白基因在番茄(Fleming et al., 1997; Reinhardt et al., 1998; Pien et al., 2001)和水稻(Cho and Kende, 1997)的原基起始位点特异性表达。此外,在转化植物中表达的扩张蛋白诱导了能够发育成正常叶的原基(Pien et al., 2001)。这些研究进一步支持了形态发生(morphogenesis)中的主要事件是组织的扩张,然后通过细胞分裂将其细分为更小的单位的观点(Reinhardt et al., 1998; Fleming et al., 1999)。
多项研究表明生长素(auxin)参与了叶序(phyllotaxis)的调控(Cleland, 2001)。其中一项研究发现,当番茄营养枝顶端分生组织在含有特定生长素运输抑制剂的合成培养基上培养时,叶片生成被完全抑制,导致形成针状裸露茎,但其顶端分生组织仍保持正常(Reinhardt et al., 2000)。在这些顶端表面微量施用IAA可恢复叶片形成。外源IAA也能诱导拟南芥pin-formed1 (pin1)花序顶端形成花。pin1顶端由于假定的生长素运输蛋白发生突变而阻碍了花的形成。PIN1本身在发育中的叶原基(leaf primordia)中上调表达(Vernoux et al., 200ob),表明必须有足够量的生长素积累才能启动细胞扩张和叶原基形成。为了使生长素在该部位积累,必须从已有的叶原基和发育中的叶片(生长素的来源)运输到那里。有人提出一个模型,其中生长素外排载体(efflux carriers)控制生长素向茎顶端分生组织(shoot apical meristem)的输送,而内流(influx)和外排载体则调节其在分生组织内的分布(Stieger et al., 2002)。外排载体在分生组织内生长素的重新分布中起作用,而内流载体可能对正确的叶片定位或叶序是必需的。
叶片的排列与茎中维管系统的结构相关,因此叶片之间的空间关系是枝条组织整体模式的一部分(Esau, 1965; Larson, 1975; Kirchoff, 1984; Jean, 1989)。叶片与茎中叶迹(leaf traces)之间的发育关系表明,与预期原基位点相关的原形成层束(procambial strands)(叶迹)为生长素或某些促进原基起始的其他物质提供了运输途径("原形成层束假说",Larson, 1983)。显然,叶片的规律起始涉及多种因素和事件,它们不一定局限于顶端区域。
❙ 分枝的起源
在无种子维管植物中,例如Psilotum、Lycopodium、Selaginella以及某些蕨类植物,分枝发生在顶端,与叶片无关(Gifford and Foster, 1989)。原始的顶端分生组织(apical meristem)通过中部分裂形成两个相等的部分,每个部分形成一个枝条。这种分枝类型或过程被称为二歧分枝(dichotomous)。当分枝从顶端侧向发生时,这种分枝被称为单轴分枝(monopodial)。单轴分枝是种子植物中最常见的分枝类型。分枝通常起源于叶腋(axils of leaves)中的芽,在其初生状态时被称为腋芽(axillary buds)。根据大多数研究,术语“腋生”(axillary)有些不准确,因为芽通常起源于茎上(图6.13E和6.15),但通过随后的生长调整,它们会移动到更靠近叶基的位置,甚至移动到叶片本身。这种关系已在蕨类植物(Wardlaw, 1943)、真双子叶植物(eudicots)(Koch, 1893; Garrison, 1949a, 1955; Gifford, 1951)和禾本科植物(Poaceae)(Evans and Grover, 1940; Sharman, 1942, 1945; McDaniel and Poethig, 1988)中观察到。在禾本科植物中,芽与支持叶(subtending leaf)之间缺乏发育关系尤为明显。芽起源于靠近其上方叶片的位置(图6.16)。随后,芽通过节间(internode)的插入与叶片分离。在其他单子叶植物(monocots)中也观察到了类似侧芽的起源(Tradescantia, Guttenberg, 1960; Musa, Barker and Steward, 1962)。在针叶树中,芽的发育与真双子叶植物相似。
在大多数种子植物中,腋生分生组织起源于分离的分生组织
腋芽在顶端分生组织(apical meristem)的不同叶序距离(plastochronic distances)上产生,最常见于顶端第二或第三片叶的叶腋中;因此,它们通常比支持叶稍晚形成。在某些种子植物中,芽在顶端分生组织本身中立即在支持叶形成后开始发育,因此芽与顶端分生组织连续形成(Garrison, 1955; Cutter, 1964)。然而,在大多数种子植物中,腋芽在稍后的时间从顶端分生组织衍生的分生组织(meristematic tissue)中开始发育,但通过液泡化细胞(vacuolated cells)与顶端分生组织分离(Garrison, 1949a, b; Gifford, 1951; Sussex, 1955; Bieniek and Millington, 1967; Shah and Unnikrishnan, 1969, 1971; Remphrey and Steeves, 1984; Tian and Marcotrigiano, 1994)。这些在空间上与叶腋相关的分生细胞群被称为分离分生组织(detached meristems)。较少见的是,有报道称芽从部分分化的液泡化细胞中发育而来,这些细胞去分化并重新获得分生活性(Koch, 1893; Majumdar and Datta, 1946)。在少数情况下,腋生分生组织似乎起源于叶原基(leaf primordia)的近轴(adaxial)表面;也就是说,它们显然起源于叶片(Heracleum, Leonurus, Majumdar, 1942; Majumdar and Datta, 1946; Arabidopsis, Furner and Pumfrey, 1992; Irish and Sussex, 1992; Talbert et al., 1995; Evans and Barton, 1997; Long and Barton, 2000)。
尽管不同的分生细胞群可能产生腋芽及其支持叶,但实验证据表明,腋芽由其叶片决定(Snow and Snow, 1942)。例如,如果通过手术移除叶原基(leaf primordium),
第一对原基的节
图 6.15
Hypericum uralum 腋芽的起源。它由主茎顶端分生组织的外三层衍生而来。最外两层进行垂周分裂(anticlinal division),并保持其独立性,成为芽的两层外层(A–C)。第三层进行平周分裂(periclinal division)和其他分裂,产生芽的第三和第四层以及芽的体部(corpus)。第三层在C中的芽中明显可见;第四层稍后出现。C中,第二对叶原基正在形成。第一对叶原基的排列方向与绘图表面垂直。(改编自Zimmermann, 1928.)
图 6.16
Agropyron repens (匍匐冰草)侧芽的发育。中纵切面。A,茎尖的低倍视图,显示多个叶原基。点状部分表示芽的位置。它由两层顶端分生组织(tunica)和体部(corpus)的衍生细胞形成。B–G,顶端分生组织第二层的衍生细胞用点状表示,体部的衍生细胞在每个细胞中用单点表示。芽的起始由体部衍生细胞的平周分裂引起\mathbf{\Omega}(\mathbf{B},\mathbf{C})。顶端分生组织衍生细胞发生垂周分裂。芽从茎表面突出\mathbf{(D)}。通过肋状分生组织(ribmeristem)的生长,体部衍生细胞延长了芽的核心(E–G)。它们还组织了芽的体部。顶端分生组织衍生细胞在芽的顶端保持双列排列,并形成其两层顶端分生组织(\mathbf{E},\mathbf{G})。叶原基在芽上形成(E–G)。(改编自Sharman, 1945. \copyright 1945 by The University of Chicago. 版权所有。)
如果在其芽起始之前移除叶片,芽将无法发育。另一方面,如果仅保留叶基部的极小部分,通常足以促进芽的形成(Snow and Snow, 1932)。拟南芥(Arabidopsis)的phabulosa-1d (phb-1d)突变提供了叶片和腋芽发育之间诱导关系的进一步证据。在拟南芥中,腋芽分生组织通常与叶基部的近轴面(adaxial surface)紧密相关。在phb1d中,远轴面(abaxial)的叶命运转化为近轴面命运,导致在叶片下表面形成异位腋芽分生组织(McConnell and Barton, 1998)。显然,近轴基部的叶命运在促进腋芽发育中起着重要作用。
芽并不总是在每个叶片的叶腋中发育(Cutter, 1964; Cannell and Bowler, 1978; Wildeman and Steeves, 1982);在极少数情况下,芽完全缺失(Champagnat et al., 1963; Rees, 1964)。在
Stellaria media 中,第一对叶片通常缺乏腋芽,而在后期形成的叶对中,通常只有一对叶片中的一个具有芽(Tepper, 1992)。将苄基腺嘌呤(benzyladenine)应用于五至七天龄的Stellaria幼苗的茎尖,促进了通常在空叶腋中的腋芽发育,表明细胞分裂素(cytokinins)在正常植物发育过程中腋芽起始中的作用(Tepper, 1992)。
一些叶片的腋部有一个芽,而另一些则没有,但在某些物种中,一个叶片可能与多个芽(除了腋芽外,还有附属芽)相关联并不罕见(Wardlaw, 1968)。在某些物种中,第一个附属芽的分生组织起源于腋芽,而第二个附属芽则起源于第一个附属芽(Shah and Unnikrishnan, 1969, 1971)。在其他物种中,腋芽和附属芽都起源于同一组分生细胞,这些细胞来自顶端分生组织(Garrison, 1955)。
当芽形成时,叶片腋部的细胞层会发生平周分裂(periclinal division)和垂周分裂(anticlinal division),芽的分生组织会升高到表面以上,并且芽的顶端分生组织会组织起来(图6.15、6.16和6.17B)。在许多植物中,有序的分裂发生在初生芽的基部和侧缘,并形成一层平行的弯曲层(图6.16C和6.17A),由于其壳状形状,被称为壳区(shell zone)(Schmidt, A., 1924; Shah and Patel, 1972)。在一些植物中,壳区在芽经历一定发育后才会出现。尽管一些研究者认为壳区是发育中芽的组成部分,但其他人则不这么认为(Remphrey and Steeves, 1984)。壳区在不同物种的芽发育的不同阶段消失。在许多物种中,初生芽通过两条原形成层细胞束与主轴的维管系统相连,这些细胞束称为芽迹(bud traces),在芽的早期发育中提供了潜在的传导通道(Garrison, 1949a, b, 1955; Shah and Unnikrishnan, 1969; Larson and Pizzolato, 1977; Remphrey and Steeves, 1984)。如果腋芽不处于休眠状态,其向上生长后会开始形成叶原基,首先是前叶(prophylls)。
茎可能从不定芽发育而来
不定芽(adventitious buds)的产生与顶端分生组织没有直接关系。不定芽可能在根、茎、下胚轴和叶片上发育。它们起源于插条的愈伤组织或伤口附近,或在维管形成层或维管柱的外围。表皮也可能产生不定芽。根据起始组织的深度,这些芽被描述为具有外生起源(来自相对浅表的组织)或内生起源(来自母轴深处的组织)(Priestley and Swingle, 1929)。如果不定芽在成熟组织中产生,它们的起始涉及去分化现象。
❙ 根尖
与茎的顶端分生组织不同,根的顶端分生组织不仅向轴方向产生细胞,还向远离轴的方向产生细胞,因为它启动了根冠(rootcap)。由于根冠的存在,根顶端分生组织的远端部分不是终端的,而是亚终端的,即它位于根冠下方。根尖与茎分生组织的进一步区别在于它不形成类似于叶片的侧生附属物,也不形成分枝。根的分枝通常在生长最活跃的区域之外启动,并且是内生的。由于没有叶片,根尖不会显示出茎常见的形状和结构的周期性变化。
图6.17
马铃薯(Solanum tuberosum)腋芽的起源。显示芽发育早期(A)和晚期(B)阶段的节纵切面。(引自Sussex, 1955)
与叶片起始相关的顶端。根也不产生节和节间,因此比茎生长得更均匀,茎的节间比节伸长得多。肋分生组织(rib-meristem)类型的生长是伸长根皮层的特征。
根的顶端分生组织(apical meristem)的远端部分,像茎的一样,可以称为原分生组织(promeristem),并以此与下面的初生分生组织(primary meristematic tissues)形成对比。幼根轴或多或少清楚地分为未来的中柱(central cylinder)和皮层(cortex)。在分生组织状态下,这两个区域的组织分别由原形成层(procambium)和基本分生组织(ground meristem)组成。如果这个中柱最终分化成实心的维管核心,那么原形成层这个术语可以应用于根的整个中柱。然而,许多根的中心有髓(pith)。这个区域通常被解释为潜在的维管组织,在进化过程中停止分化。在这种情况下,髓被认为是源自原形成层的维管柱的一部分。相反的观点认为,根中的髓是与茎中的髓相似的基本组织(ground tissue),并从基本分生组织分化而来。如果原表皮(protoderm)这个术语用于指定表层而不考虑其与其他组织的发育关系,则可以应用于幼根的外层(第9章)。通常,根原表皮不是从原分生组织的单独一层产生的。它与皮层或根冠(rootcap)有共同的起源。
根的顶端组织可以是开放的或封闭的
根顶端分生组织的结构或细胞构型(cellular configuration)最常被研究以揭示组织系统的起源,并用于建立所谓的类型(Schüepp, 1926; Popham, 1966)以及讨论根顶端组织进化的趋势(Voronine, 1956; Voronkina, 1975)。通过分析顶端分生组织中的细胞模式,可以追踪细胞分裂的平面和生长方向。在一种类型的分析中,分化组织被追踪到根的顶端,以确定是否有特定的细胞似乎是一个或多个离散组织的来源。因此,这意味着组织与顶端某些细胞或细胞群的空间相关性表明了两者之间的个体发育关系,换句话说,顶端细胞作为起始细胞(initials)发挥作用。
从根尖不同原始细胞(initials)的角度分析根组织的起源,与Hanstein (1868, 1870)提出组织原理论(histogen theory)时所采用的方法相对应。正如本章前面所讨论的,Hanstein认为植物体起源于一个巨大的分生组织(meristem),该分生组织由三个组织区域的前体(precursors)组成,即组织原(histogens),每个组织原在根尖以一个或几个原始细胞开始,呈叠加层排列。这些组织原是表皮原(dermatogen)(表皮(epidermis)的前体)、中柱原(plerome)(中央维管柱(central vascular cylinder)的前体)和皮层原(periblem)(皮层(cortex)的前体)。尽管将组织分为三个组织原并不具有普遍适用性——在茎中很少能辨别出来,而且许多根缺乏Hanstein (1870)意义上的表皮原,即产生表皮的独立层——但它经常被用于描述根中的组织区域。
图6.18描绘了根尖组织区域与细胞之间空间关系的主要模式。在大多数蕨类植物和木贼属(Equisetum)中,所有组织都来源于一个顶端细胞(apical cell)(图6.18A, B; Gifford, 1983, 1993)。这些植物通常在根和茎中具有相同的结构。在一些裸子植物(gymnosperms)和被子植物(angiosperms)中,根的所有组织区域或除中央柱外的所有组织区域似乎都来源于一个共同的分生组织细胞群(图6.18C, D);而在其他植物中,一个或多个这些区域可以追溯到独立的原始细胞(图6.18E–H)。这两种组织结构分别被分类为开放型(open)和闭合型(closed)(Guttenberg, 1960)。开放型和闭合型分生组织之间的区别并不总是明确的(Seago and Heimsch, 1969; Clowes, 1994)。据报道,这两种类型的分生组织都起源于胚胎根或侧根或不定根原基中的闭合模式。在根随后的伸长过程中,闭合模式可能被保留或被开放模式取代(Guttenberg, 1960; Seago and Heimsch, 1969; Byrne and Heimsch, 1970; Armstrong and Heimsch, 1976; Vallade et al., 1983; Verdaguer and Molinas, 1999; Baum et al., 2002; Chapman et al., 2003)。在豌豆(Pisum sativum)中,胚胎根和成年根都具有开放型分生组织(Clowes, 1978b)。
在大多数蕨类植物中,顶端细胞是四面体(tetrahedral)的(Gifford, 1983, 1991)。它在三个侧面(近端)切割出片段或分生体(merophytes),从而产生根主体的组织(图6.18A, B)。根冠(rootcap)要么来源于顶端细胞的第四面(远端)(Marsilea, Vallade et al., 1983; Asplenium, Gifford, 1991),要么来源于根发育早期形成的独立分生组织(Azolla, Nitayangkura et al., 1980)。木贼属根的四面体顶端细胞既贡献于根的主体,也贡献于根冠,但木贼属的早期根发育与大多数蕨类植物明显不同(Gifford, 1993)。由于Azolla的根冠与根的其余部分是分离的,因此Azolla根的顶端分生组织被分类为闭合型。相反,木贼属和具有从所有四个面切割细胞的顶端细胞的蕨类植物的根尖被分类为开放型(Clowes, 1984)。
另一种分析根尖细胞模式与生长关系的方法是Schüepp (1917)提出的体-帽(Körper-Kappe)概念,该方法强调了在根分生区中负责增加垂直细胞列数的分裂面。许多细胞列会分裂成两列,当它们分裂时,细胞会横向分裂;然后其中一个新细胞会纵向分裂,这次分裂的每个子细胞都会成为新细胞列的来源。横向和纵向分裂的结合形成了近似T形(或Y形)的壁模式,因此这种分裂被称为T分裂。T形顶部笔画(水平条)的方向在根的不同部位有所不同。在根冠中,它朝向根的基部,而在体中则朝向顶端(图6.19)。尽管在某些根中(那些具有独立根冠原始细胞的根),体与帽之间存在明显的边界,但在其他根中,边界并不清晰(例如,在Fagus sylvatica中,体与帽之间的过渡非常渐进;Clowes, 1950)。
被子植物中的两种顶端组织结构,即封闭式和开放式,需要分别考虑。封闭式模式通常以存在三层或三层原始细胞为特征(图6.20)。一层出现在中央柱的顶端,第二层终止于皮层,第三层则产生根冠。三层分生组织可能是
图6.18
(续)
根据表皮(一些作者称之为根表皮;第9章;Clowes, 1994)的起源进行分组。在一组中,表皮与根冠有共同的起源,并在根周围发生一系列T分裂后变得明显(图6.18E, F, 6.19C和6.21A)。在第二组中,表皮和皮层有共同的原始细胞(图6.18G, H和6.21B),而根冠则来自其自身的原始细胞,这些原始细胞构成了根冠分生组织(meristem)或calyptrogen(来自希腊语calyptra,面纱,和tenos,后代;Janczewski, 1874)。如果根冠和表皮有共同的起源,则相关的细胞层称为dermatocalyptrogen(Guttenberg, 1960)。正如Clowes(1994)简明扼要地指出的那样,"如果有一个分生组织的离散区域只产生帽细胞或帽和表皮细胞,则该分生组织被称为封闭的。"
具有dermatocalyptrogen的根在真双子叶植物(eudicots)中很常见(蔷薇科(Rosaceae)、茄科(Solanaceae)、十字花科(Brassicaceae)、玄参科(Scrophulariaceae)和菊科(Asteraceae)的代表;Schüepp, 1926)。具有calyptrogen的根是单子叶植物(monocots)的特征(禾本科(Poaceae)、姜科(Zingiberaceae)、一些棕榈科(Palmae);Guttenberg, 1960;Hagemann, 1957;Pillai等, 1961)。有时表皮似乎在其自身的原始细胞中终止于远端区域(Shimabuku, 1960)。在一些水生单子叶植物(水鳖科(Hydrocharitaceae)的水鳖属(Hydrocharis)和水螅属(Stratiotes)、天南星科(Avaceae)的大薸属(Pistia)、浮萍科(Lemnaceae)的浮萍属(Lemna))中,表皮通常独立于皮层和根冠(Clowes, 1990, 1994)。
根据体-帽概念(body-cap concept)对根分生组织的分析揭示了表皮起源的差异。在具有calyptrogen的根中,帽仅包括根冠(图6.19A),而在具有dermatocalyptrogen的根中,帽延伸到表皮(图6.19C)。体-帽配置显示了其他变化,阐明了根的生长模式。在一些根中,根冠的中央核心与外围部分不同,几乎没有或没有纵向分裂。如果足够明显,这样的核心被称为columella(图6.19)(Clowes, 1961)。在columella中发生的少数T分裂可能根据体模式定向;然后只有根冠的外围部分显示帽模式。在具有dermatocalyptrogen层的拟南芥(Arabidopsis)根中,根冠的columella部分来自所谓的columella原始细胞,而根冠的外围部分和原表皮(protoderm)来自所谓的根冠/原表皮原始细胞,这些原始细胞在columella原始细胞周围形成一个环(Baum和Rost, 1996;Wenzel和Rost, 2001)。columella和根冠/原表皮原始细胞及其子细胞中的细胞分裂以高度协调的模式发生(Wenzel和Rost, 2001)。
图6.19
根据体-帽概念对玉米(Zea)(A)、葱属(Allium)(B)和烟草(Nicotiana)(C)根尖的解释。体(body),T的上划指向根尖;帽(cap),T的上划指向根基部。原表皮(protoderm)用点表示。在A中它是体的一部分,可能在B中也是,在C中是帽的一部分。所有三个根冠都有一个明显的核心,即columella。
具有开放型组织的顶端(apices)难以分析(图6.18C、D,6.19B和6.22)。一种常见的解释是,这种根具有横向分生组织(transversal or transverse meristem),与根的衍生区域没有任何边界(Popham, 1955)。另一种观点认为,中央柱(central cylinder)有自己的原始细胞(initials)。在一些这样的根中,中央柱似乎与帽细胞(cap cells)的中央列(central files)相邻,而在同一物种的其他根中,在"柱极"(stelar pole)和可辨别的帽中央列之间出现一层或多层皮层细胞(cortical cells)(Clowes, 1994)。Clowes (1981)将这种细胞模式的差异归因于帽和根其余部分之间边界的不稳定性,这是由于该区域的细胞只是暂时处于静止状态(quiescent)。对体-帽(body-cap)构型的分析表明,单子叶植物(monocots)的开放分生组织在表皮(epidermis)和皮层(cortex)之间表现出更密切的亲缘关系,而真双子叶植物(eudicots)的开放分生组织在表皮和帽之间表现出更密切的亲缘关系(Clowes, 1994)。后一种情况以白三叶草(Trifolium repens)根的开放顶端分生组织为例(Wenzel et al., 2001)。
Groot等人(2004)区分了真双子叶植物中两种类型的开放根顶端分生组织(open root apical meristems),即基本开放型(basic-open)和中间开放型(intermediate-open)。在基本开放型分生组织中,细胞列(cell files)顶端终止于一个相对较大的原始细胞区域,原始细胞衍生细胞(derivatives)的命运并不立即显现。在中间开放型分生组织中,原始细胞区域比基本开放型短得多,因此衍生细胞的命运通常在其从原始细胞分离后立即显现。中间开放型分生组织中的细胞列似乎汇聚在原始细胞区域,但原始细胞在根帽(rootcap)、皮层和维管柱(vascular cylinder)之间共享。通过将根顶端分生组织组织映射到系统发育树上,Groot等人(2004)确定中间开放型分生组织是祖先类型,而基本开放型和闭合型(closed types)是衍生类型。
裸子植物(gymnosperms)的根顶端分生组织具有开放的组织结构(图6.18C、D),缺乏真正的表皮(epidermis per se)(Guttenberg, 1961; Clowes, 1994)。这是因为在分生组织中没有单独的表皮前体(dermatogen or protoderm)。相反,作为表皮的任何组织都是由皮层/根帽复合体(cortex/rootcap complex)的外层细胞脱落而暴露的组织,如黄杉属(Pseudotsuga)(Allen, 1947; Vallade et al., 1983)、冷杉属(Abies)(Wilcox, 1954)、麻黄属(Ephedra)(Peterson and Vermeer, 1980)和松属(Pinus)(Clowes, 1994)。
在真双子叶植物(代表有芭蕉科Musaceae、棕榈科Palmae; Pillai和Pillai, 1961a, b)和一些裸子植物(Guttenberg, 1961; Wilcox, 1954)中,已经描述了没有单独原始细胞的根顶端分生组织。在一些裸子植物根中,似乎只有中央柱有单独的原始细胞层(Vallade et al., 1983)。
图6.20
Nicotiana tabacum (A) 和 Zea mays (B) 根尖分生组织的纵切面。这些顶端具有封闭的组织结构,具有三个不同的初始细胞层或层次,在A中分别标记为a、b和c。在Nicotiana (A)中,表皮(epidermis)和根冠(rootcap)具有共同的初始细胞(c);a产生中柱(central cylinder),b产生皮层(cortex)。在Zea \mathbf{(B)}中,表皮和皮层具有共同的初始细胞(b),而根冠由根冠原(calyptrogen)产生;a表示中柱的初始细胞层。(见图6.21)(A,\times455;B,\times280。B,由Ernest M. Gifford制作的切片。)
静止中心在正常情况下并非完全没有分裂
通过对根尖组织的组织发生(histogen)和体冠(body-cap)概念的分析,可以获得关于已经发生并产生当前可识别模式的生长信息。Clowes(1954年,1956年)发现根尖中存在静止中心(quiescent center),这带来了关于根分生组织行为的根本性观点转变。对正常发育的根、经过手术处理的根、受辐射的根以及摄入与DNA合成相关的标记化合物的根进行的广泛研究表明,作为一种普遍现象,负责原始细胞模式的初始细胞——Clowes(1954年)的最小构建中心(minimal constructional center)——在根的后期生长中基本上停止了有丝分裂活动(图6.23)(Clowes,1961年,1967年,1969年)。这些活动被相对不活跃区域或静止中心边缘的细胞所取代。
静止中心在初生根中会出现两次,第一次是在胚胎发生(embryogeny)期间,第二次是在种子萌发的早期阶段。在种子萌发时,根没有静止中心。
图6.21
Nicotiana tabacum (A) 和 Zea mays \mathbf{(B)} 根尖的纵切面,展示了两种不同的表皮起源方式。A,表皮通过平周分裂(periclinal division)与根冠分离。B,表皮与皮层通过皮层初始细胞的近期衍生物的平周分裂来自相同的初始细胞。B中密集的点状区域表示根冠与原表皮(protoderm)之间的胶化壁。(A,\times285;B,\times210。)
图6.22
Allium sativum 根尖分生组织的纵切面。该顶端具有开放的组织结构;组织区域在共同的初始细胞(i)组中合并。(\times600。来自Mann,1952年。Hilgardia 21 (8),195–251。\copyright 1952年加州大学董事会。)
图6.23
静止中心。Allium sativum 根尖的放射自显影图,纵切面显示,摄入氚标记的胸苷(tritiated thymidine)48小时。在静止中心周围的快速分裂细胞中,放射性物质迅速被整合到核DNA中。(来自Thompson和Clowes,1968年,经牛津大学出版社许可。)
中心 (quiescent center) (Jones, 1977; Clowes, 1978a, b; Feldman, 1984)。在 Zea mays 的侧根原基中,中心 (quiescent center) 也会出现两次,第一次是在原基仍嵌入皮层时,第二次是在从母根突出之前或之后 (Clowes, 1978a)。
中心 (quiescent center) 不包括根冠 (rootcap) 的初始细胞,形状为半球形或盘状,在某些研究的物种中仅包含四个细胞 (Petunia hybrida, Vallade et al., 1978; Arabidopsis thaliana, Benfey and Scheres, 2000),而在其他物种中则超过一千个 (Zea mays, Feldman and Torrey, 1976)。中心 (quiescent center) 的体积显然与根的大小有关,因为在细根中它较小或完全缺失 (Clowes, 1984)。在 Euphorbia esula 的根系中,强壮的多年生长根具有明显的中心 (quiescent center),而有限的侧根(短根)在其短暂的发育过程中缺乏这种中心 (Raju et al., 1964, 1976)。具有四面体顶端细胞的无种子维管植物缺乏中心 (quiescent center) (Gunning et al., 1978; Kurth, 1981; Gifford and Kurth, 1982; Gifford, 1991)。
表 6.2 ■ 通过使用阻断有丝分裂的抑制剂处理后,从根分生组织 (root meristem) 中分裂核的中期积累计算的有丝分裂周期平均持续时间(小时)
<html><body><table><tr><td colspan="3"></td><td colspan="2">中央柱 (Central Cylinder)</td></tr><tr><td>物种 (Species)</td><td>中心 (Quiescent Center)</td><td>根冠初始细胞 (Rootcap Initials)</td><td>紧靠中心上方 (Just above? QCb)</td><td>中心上方 200-250μm (200-250μm above° QC)</td></tr><tr><td>Zea mays</td><td>174</td><td>12</td><td>28</td><td>29</td></tr><tr><td>Vicia faba</td><td>292</td><td>44</td><td>37</td><td>26</td></tr><tr><td>Sinapis alba</td><td>520</td><td>35</td><td>32</td><td>25</td></tr><tr><td>Allium sativum</td><td>173</td><td>33</td><td>35</td><td>26</td></tr></table></body></html>
来源:摘自 Esau, 1977;改编自 Clowes, 1969。a 向根基部。b 中心 (quiescent center)。
中心 (quiescent center) 细胞的相对不活跃状态并不意味着它们已经永久失去功能。中心 (quiescent center) 细胞偶尔会分裂,并用于更新周围更活跃分裂的区域,这些区域的细胞不稳定且不时被替换 (Barlow, 1976; Kidner et al., 2000)。在 Euphorbia esula 的长根中,中心 (quiescent center) 显然会经历细胞产生的季节性波动 (Raju et al., 1976)。在生长季节的高峰期,它们表现出一个发育良好的中心 (quiescent center),但在生长季节初期的重新激活期间,中心 (quiescent center) 不可见。在通过辐射或手术处理实验性损伤的根中,中心 (quiescent center) 能够重新填充分生组织 (meristem) (Clowes, 1976)。它还在从寒冷诱导的休眠期恢复期间恢复分裂 (Clowes and Stewart, 1967; Barlow and Rathfelder, 1985)。当根冠 (rootcap) 被移除时,中心 (quiescent center) 的细胞开始生长并经历一系列受控的分裂,从而再生根冠 (Barlow, 1973; Barlow and Hines, 1982)。
通过用氚标记的胸腺嘧啶标记细胞核,并用抑制剂将细胞周期阻滞在中期(metaphase),可以获得根分生组织(meristem)不同区域有丝分裂周期(mitotic cycle)持续时间的定量数据(Clowes, 1969)。这些数据表明,静止中心(quiescent center)的细胞分裂速度比邻近细胞慢约10倍(表6.2)。胸腺嘧啶脉冲标记(pulse labeling)还表明,有丝分裂周期持续时间的差异主要由\mathbf{G}_{1}期(phase)的持续时间差异引起,\mathbf{G}_{1}期是指有丝分裂结束到DNA合成开始之间的阶段。
静止中心有丝分裂活动的稀少使Clowes(1954, 1961)提出,根尖(root apex)的原始细胞(initials)位于静止中心边缘的外侧,他将这组细胞命名为根的原始分生组织(promeristem)。然而,Barlow(1978)和Steeves与Sussex(1989)指出,将静止中心缓慢分裂的细胞——这些细胞可能是整个根细胞的最终来源——视为真正的原始细胞,而将其周围更活跃分裂的细胞视为它们的衍生物(derivatives),这种观点更为现实,这一观点早先由Guttenberg(1964)提出。采用这种观点,根的静止中心与茎的中央区(central zone)或原始分生组织非常相似,可被视为根的原始分生组织。一些研究者认为根的原始分生组织包括静止中心及其邻近的活跃分裂的衍生物(Kuras, 1978; Vallade et al., 1983)。在无种子维管植物(seedless vascular plants)中,原始分生组织仅由顶端细胞(apical cell)组成。如今,在描述种子植物(seed plants)根中缓慢分裂的区域及其活跃分裂的衍生物时,术语的使用并不统一。更常见的是,将静止中心边缘的活跃分裂细胞称为原始细胞,而将静止中心的细胞简单地称为静止中心细胞。
关于生长根中静止中心(quiescent center)出现的可能原因,已有许多观点被提出。根据基于根尖生长模式分析的一项提议,根分生组织(meristem)特定位置的静止是由于分生组织各部分细胞生长的拮抗方向所致(Clowes, 1972, 1984; Barlow, 1973),根冠(rootcap)或根冠分生组织在抑制生长方面尤为重要。在胚胎发生(embryogenesis)过程中,静止中心的出现与根冠分生组织的出现同时发生(Clowes, 1978a, b)。此外,如前所述,如果根冠受损或被移除,静止中心会激活并产生新的根冠分生组织,进而产生新的根冠;然后静止状态恢复。这种行为促使Barlow和Adam (1989)提出,在根冠受损或移除后,静止中心的激活是由于根冠或其原始细胞与静止中心之间的信号传递(可能是激素)被中断或改变所致。该激素的一个可能候选者是生长素(auxin),它被认为在胚胎发生过程中根极(root pole)的形成和拟南芥(Arabidopsis)幼苗根中组织结构的维持中起作用(Sabatini et al., 1999; Costa and Dolan, 2000)。有假设认为,玉米根尖中静止中心的起源和维持是极性生长素供应的结果,并且根冠原始细胞在调节向根尖的极性生长素运动中起重要作用(Kerk and Feldman, 1994)。高水平的生长素导致抗坏血酸氧化酶(ascorbic acid oxidase, AAO)水平升高,从而导致静止中心内抗坏血酸(ascorbic acid)的耗竭。由于抗坏血酸对于根尖细胞周期中\mathrm{{G}_{1}}到S期的转变是必需的(Liso et al., 1984, 1988),Kerk和Feldman (1995)提出,根尖中抗坏血酸的耗竭可能是静止中心形成和维持的原因。最近,Kerk等人(2000)报道,AAO还在玉米根尖中氧化脱羧生长素,从而提供了另一种调节静止中心和其他根组织中生长素水平的机制。这一代谢过程的发生必须有完整的根冠存在。
❙ 拟南芥(Arabidopsis thaliana)的根尖
拟南芥根的顶端分生组织(apical meristem)具有封闭的结构,包含三层原始细胞(initials)(图6.24)。下层是表皮根冠原始细胞(dermatocalyptrogen),由柱状根冠原始细胞(columella rootcap initials)和侧根冠细胞及表皮的原始细胞组成。中层由皮层(cortex)的原始细胞组成(从中衍生出薄壁组织和内皮层皮质细胞),上层由维管柱(pericycle and vascular tissue)的原始细胞组成,有时被错误地称为维管束(vascular bundle) (van den Berg et al., 1998; Burgeff et al., 2002)。在中层的中心是一组四个细胞,在根发育早期很少分裂。有多个术语被用来描述这些位于中心的细胞,包括“中央细胞”(central cells) (Costa and Dolan, 2000; Kidner et al., 2000)、“静止中心细胞”(quiescent-center cells) (Dolan et al., 1993; van den Berg et al., 1998; Scheres and Heidstra, 2000)、“中央基本分生组织原始细胞”(central ground meristem initial cells) (Baum and Rost, 1997)、“中央皮层原始细胞”(central cortex initials) (Zhu et al., 1998a)和“中央原始细胞”(central initials) (Baum et al., 2002)。
拟南芥(Arabidopsis)初生根的胚胎起源已有详细记载(Scheres et al., 1994)。简而言之,胚胎发生始于合子的不对称横向分裂,产生一个小的顶端细胞和一个较大的基部细胞。顶端细胞产生胚胎本体,基部细胞产生一个柄状的胚柄(suspensor),其最上端的细胞称为胚根原(hypophysis)或胚根原细胞(hypophyseal cell)(图6.11)。在胚胎发生的心形早期(三角形期),胚根原分裂形成一个透镜状细胞,这是四个中央细胞的祖细胞。胚根原细胞的下部衍生物产生根冠中央部分(columella)的原始细胞。分生组织的所有其他原始细胞都来自胚胎本体,并在心形晚期可识别。
激光消融实验清楚地表明,在拟南芥根中,位置信息(positional information)而非细胞谱系关系(cell lineage relationships)在细胞命运决定中起最重要的作用(van den Berg et al., 1995, 1997a; Scheres and Wolkenfelt, 1998)。在这些实验中,用激光消融特定细胞并观察对邻近细胞的影响。例如,当所有四个静止中心(quiescent-center)细胞被消融时,它们被维管柱(vascular cylinder)的原始细胞取代。消融的皮层原始细胞被中柱鞘(pericycle)细胞取代,然后这些细胞转换命运并表现为皮层原始细胞。
图6.24
A,拟南芥根尖的纵切面。B,原分生组织(promeristem)的示意图,显示了原始细胞层与根组织区域的关系。上层由维管柱的原始细胞组成,中层由中央细胞(星号)和皮层的原始细胞组成,下层由根冠中央原始细胞以及侧根冠细胞和表皮的原始细胞组成。虚线表示皮层原始细胞和侧根冠/表皮原始细胞中的细胞分裂平面。(经许可转载;A,来自,B,改编自Schiefelbein et al., 1997. \copyright 美国植物生物学家学会。)
消除单个静止中心细胞(quiescent-center cell)会导致与其接触的柱状和皮层初始细胞(cortical cell initials)停止分裂并开始分化。这些结果表明,静止中心细胞的主要作用是通过单细胞范围内的信号抑制接触的初始细胞的分化(van den Berg et al., 1997b; Scheres and Wolkenfelt, 1998; van den Berg et al., 1998)。消除皮层初始细胞的单个子细胞对该初始细胞的后续分裂没有影响,该初始细胞与邻近皮层初始细胞的其他皮层子细胞接触。然而,当与皮层初始细胞相邻的所有皮层子细胞都被消除时,该初始细胞无法产生薄壁组织和内皮层细胞(cortical cells)的细胞列。显然,皮层初始细胞——也许所有初始细胞——都依赖于同一细胞层内更成熟的子细胞的位置信息。换句话说,根尖分生组织(root apical meristem)的初始细胞显然缺乏内在的模式生成信息(van den Berg et al., 1995, 1997b)。这与将分生组织视为自主模式生成机器的传统观点相反。
在拟南芥(Arabidopsis)初生根(primary root)的生长过程中,曾经静止的中心细胞变得有丝分裂活性,它们和初始细胞变得无序和液泡化,因为根尖从封闭组织转变为开放组织(Baum et al., 2002)。正如Baum等人(2002)所指出的,这些变化以及伴随的胞间连丝(plasmodesmata)数量减少(Zhu et al., 1998a),是与根确定性(root determinacy)相关的现象,即根生长的最终发育阶段。确定性初生根的存在并非拟南芥独有。与顶端分生组织从封闭组织转变为开放组织相关的确定性根生长显然是一种常见现象(Chapman et al., 2003)。
生成新的细胞列。这种分裂被称为形成性分裂(formative divisions),因为它们在决定模式形成(pattern formation)方面很重要(Gunning et al., 1978)。径向分裂(radial divisions)增加了单个细胞层中的细胞数量,而平周分裂(periclinal divisions)增加了层数,从而增加了根的直径。通过横向分裂(transverse divisions),每个细胞列中的细胞数量增加。横向分裂,称为增殖性分裂(proliferative divisions),决定了分生组织的范围。在一些根中,在细胞列中识别出了具有共同祖先的细胞群,称为细胞包(cell packets)(图6.25; Barlow, 1983, 1987)。每个细胞包都来自单个母细胞,对研究根中的细胞分裂很有用。
尽管根结构的传统模型将根尖分为三个或多或少不同的区域——细胞分裂(分生组织)、伸长和成熟(Ivanov, 1983)——但在根的同一水平上,这些过程不仅在不同的组织中重叠
❙ 根尖的生长
图6.25
Petunia hybrida 根尖的生长模式。数字表示通过横向分裂(增殖分裂)在根冠柱状体和皮层中形成细胞的顺序,其中具有共同祖先的细胞以包的形式出现。箭头表示侧根冠-表皮复合体的生长。细节:qc,静止中心;i,初始细胞。(来自Vallade等,1983年。)
活跃分裂的细胞区域——顶端分生组织(apical meristem)——从顶端向基部(即根的较老部分)延伸相当长的距离。在某一组织水平上,根冠和根本身都可以被视为由原分生组织(promeristem)发出的细胞列组成。相对靠近原分生组织的地方,一些细胞列通过T分裂纵向分裂——无论是径向还是周向——以形成新的细胞。
不仅在组织区域之间存在差异,而且在同一组织区域的不同细胞列之间,甚至在单个细胞中也存在差异。通常,分生组织的皮层在靠近顶端的地方液泡化并形成细胞间隙,而中央柱分生组织(原形成层,procambium)仍然显得密集。在中央柱中,最内层木质部导管(后生木质部导管,metaxylem vessels)的前体细胞停止分裂、扩大并显著液泡化,比其他前体细胞提前。第一个筛管通常在细胞分裂仍在进行的根部区域成熟。在单个细胞中,分裂、伸长和液泡化是结合在一起的。
如前所述,沿根轴横向分裂停止的水平因组织而异。例如,在大麦(Hordeum vulgare)根尖中,中央后生木质部细胞在距离初始细胞300至350微米处停止分裂,而表皮细胞在600至750微米处停止分裂。中柱鞘(pericycle)表现出最长的细胞分裂持续时间,分裂距离可达1000至1150微米,最长的是在木质部极的对面(Luxová,1975年)。在蚕豆(Vicia faba)根中,中柱鞘也分裂时间最长,但原生韧皮部(protophloem,最早形成的韧皮部)细胞最先停止分裂。成熟的原生韧皮部筛管在距离顶端600至700微米处被发现(Luxová和Murín,1973年)。
在Pisum sativum的根中,细胞分裂的分布模式被发现与相应圆柱体和维管组织区域的组织分化模式相对应(图6.26;Rost等,1988)。在距离根冠交界处约350至500微米的水平,木质部的管状分子以及髓和中皮层的薄壁细胞已经停止分裂。在这个水平上,细胞分裂基本上被限制在两个圆柱体中,一个是“外皮层圆柱体”(由内根冠、表皮和外皮层组成),另一个是“内皮层圆柱体”(由内皮层、中柱鞘和维管组织组成)。随着原生韧皮部的成熟,“内皮层圆柱体”韧皮部区域的所有细胞,包括那里的单层中柱鞘、内皮层和韧皮部薄壁细胞,都已经停止分裂。在木质部区域,3至4层的中柱鞘继续分裂,直到大约10毫米的水平,随着原生木质部管状分子的成熟。由于不同组织或细胞列中的增殖分裂不会在距离根尖完全相同的位置停止,因此分生组织或细胞分裂区域的基部边界并不明确(Webster和MacLeod,1980)。Rost和Baum(1988)在Pisum sativum中使用了“相对分生组织高度”这一术语来描述这种模糊的边界。
使用运动学方法(kinematic method)的研究——通过该方法可以同时测量局部细胞分裂和细胞扩展的速率(Baskin,2000)——已经明确证实,尽管不同组织或细胞列在距离根尖不同距离处停止分裂,但在它们分裂时,所有组织中的细胞都以大致相同的速率分裂。与细胞分裂速率的恒定性相反,分生组织中分裂细胞的数量变化很大,这表明根必须在分生组织基部控制细胞周期的退出(Baskin,2000)。此外,现在已经明确证实,细胞分裂在细胞长度迅速增加的区域内继续进行(Ivanov和Dubrovsky,1997;Sacks等,1997;Beemster和Baskin,1998)。因此,在分生组织的基部和细胞迅速扩展的区域之间显然存在一个过渡区(transition zone)(Baluška等,1996),或者更准确地说,“细胞正在进行最后一次分裂并迅速扩展”的区域(Beemster和Baskin,1998)。有人假设分裂区和伸长区是耦合的,实际上可能构成一个发育区(Scheres和Heidstra,2000)。
在根中,细胞分裂的控制以及组织和细胞列之间的发育协调,与植物体其他部位一样,需要细胞间的通讯(communication),很可能涉及位置依赖性信号(position-dependent signals)的定向移动,如转录因子(transcription factors)或激素(hormones) (Barlow, 1984; Lucas, 1995; van den Berg et al., 1995; Zhu et al., 1998a)。这些假定的位置信号的潜在移动途径是胞间连丝(plasmodesmata),它们将细胞共质体(symplastically)连接起来。在拟南芥(Arabidopsis)根中,初始细胞虽然均匀地相互连接,但它们共同壁中的胞间连丝数量少于它们与衍生细胞之间的壁中的胞间连丝数量(Zhu et al., 1998a, b)。胞间连丝的频率在细胞列的横向壁(primary plasmodesmata)中最高。细胞列之间的纵向壁和相邻组织之间的共同壁则由次级胞间连丝(secondary plasmodesmata)贯穿。毫不奇怪,发现小的共质体可移动荧光染料优先扩散通过基本分生组织细胞(ground meristem cells)及其子代皮层细胞(cortical cells)的横向壁(Zhu et al., 1998a)。
随着拟南芥根年龄的增加,所有胞间连丝的频率都会降低(Zhu et al., 1998b),这种现象与外根冠细胞(outer rootcap cells)的程序性细胞死亡(programmed cell death)有关(Zhu and Rost, 2000)。早先Gunning (1978)提出,满江红(Azolla pinnata)有限寿命的根是由于与顶端细胞(apical cell)及其侧向衍生细胞之间胞间连丝频率逐渐减少相关的程序性衰老(programmed senescence)所致。胞间连丝频率的减少大约在第三十五次细胞分裂时开始,最终导致顶端细胞的共质体隔离(symplastic isolation),该细胞不再分裂。
根的尖端并不以相同的速率持续生长,特别是在多年生植物(perennial plants)中(Kozlowski and Pallardy, 1997)。例如,在北美冷杉(Abies procera)中,根表现出周期性生长减速,并有休眠期(dormancy) (Wilcox, 1954)。休眠之前是细胞壁的木质化(lignification)和木栓质(suberin)的沉积——这一双重过程称为后角质化(metacutization)——发生在与内皮层(endodermis)连续并完全覆盖顶端分生组织(apical meristem)的一层细胞中的皮层(cortex)和根冠(rootcap)中。因此,后者除了朝向根的基部外,被保护层完全封闭。从外部看,这样的根尖呈棕色。当生长恢复时,棕色覆盖层破裂,根尖突破它。对离体根的研究表明,根可能具有不依赖于季节变化但由内部因素决定的生长节律(growth rhythm) (Street and Roberts, 1952)。
图6.26
豌豆(Pisum sativum)根的横切面,显示不同水平的发育圆柱体和扇形变化。细节:c,中皮层(middle cortex);e,表皮(epidermis);icc,内皮层/中柱鞘/维管组织圆柱体(inner cortex/pericycle/vascular tissue cylinder);mx,成熟后生木质部(mature metaxylem);occ,根冠/表皮/外皮层圆柱体(rootcap/epidermis/outer cortex cylinder);p,韧皮部扇形(phloem sector);pi,髓(pith);pp,成熟原生韧皮部(mature protophloem);px,成熟原生木质部(mature protoxylem);rc,根冠(rootcap);x,木质部扇形(xylem sector)。(来自Rost et al., 1988。)
