(未显示2个用户的7个中间版本) 第1行:
第1行: 幼苗和幼年植物倾向于将更多的光合产物分配给垂直生长而不是横向生长,因为这有助于它们更有效地争夺地上的阳光和地下的水。随着植物生物量的增加,不确定的生长通过额外的芽轴和根轴(shoot and root axes)的出现来维持,这一过程称为分枝。在枝条中,分枝从位于叶腋(腋芽)的芽表面长出,而在根中,分枝则在位于内皮层内侧的一层细胞(称为中柱鞘)中内部开始(见第 1 章)。
幼苗和幼年植物倾向于将更多的光合产物分配给垂直生长而不是横向生长,因为这有助于它们更有效地争夺地上的阳光和地下的水。随着植物生物量的增加,不确定的生长通过额外的芽轴和根轴(shoot and root axes)的出现来维持,这一过程称为分枝。在枝条中,分枝从位于叶腋(腋芽)的芽表面长出,而在根中,分枝则在位于内皮层内侧的一层细胞(称为中柱鞘)中内部开始(见第 1 章)。
分枝的空间排列、角度和形态的变化产生了枝条和根系的结构。枝条结构是一种复杂的适应性特征,它取决于确定性侧生器官(如叶子)的受控生产,以及不确定分枝系统的受控形成和生长。20 世纪中叶的“绿色革命”是全球农业产量急剧增加的时期,这是由于引进高产品种而发生的,部分原因是对主要谷类作物的枝条结构的有意修改(见 WEB 主题 19.1)。根拱结构具有类似的复杂程度,这些复杂程度源于不确定侧根的受控形成和生长。这些包括从主根分支出来的侧根,以及从先前形成的侧根分支出来的侧根。一些根系还包括不定根,它们形成于根以外的结构中——例如,单子叶植物和真双子叶植物的地下茎节,以及附生植物的地上茎或枝。
分枝的空间排列、角度和形态的变化产生了枝条和根系的结构。枝条结构是一种复杂的适应性特征,它取决于确定性侧生器官(如叶子)的受控生产,以及不确定分枝系统的受控形成和生长。20 世纪中叶的“绿色革命”是全球农业产量急剧增加的时期,这是由于引进高产品种而发生的,部分原因是对主要谷类作物的枝条结构的有意修改(见 WEB TOPIC 19.1)。根拱结构具有类似的复杂程度,这些复杂程度源于不确定侧根的受控形成和生长。这些包括从主根分支出来的侧根,以及从先前形成的侧根分支出来的侧根。一些根系还包括不定根,它们形成于根以外的结构中——例如,单子叶植物和真双子叶植物的地下茎节,以及附生植物的地上茎或枝。
初生生长的一个决定性特征是,除了木质部传导元件之外,初生组织中几乎没有木质化细胞壁。草本植物相对缺乏木质素,限制了它们长得很高或支撑大枝的能力。对于一年生草本植物、二年生草本植物,甚至一些体型较小或依赖其他植物支撑的攀缘植物的多年生植物而言,营养生长阶段完全由初生生长组成。然而,在多年生植物(树木和灌木)中,初生生长很快会接着是次生生长——周长增长。次生生长源于两个形成层的活动:维管形成层,产生次生木质部和韧皮部;木栓形成层,产生周皮,即取代表皮作为茎和根的外部保护层的木栓层(见第 1 章)。另一种类型的次生生长见于乔木型单子叶植物,如棕榈树。棕榈树没有由维管形成层产生的次生木质部(即木材)和韧皮部环,而是在皮层中具有专门的初始细胞,这些细胞产生次生维管束。这些额外的维管束含有木质化木质部,可提供足够的结构加固,使棕榈树长到很高的高度。
初生生长的一个决定性特征是,除了木质部传导元件之外,初生组织中几乎没有木质化细胞壁。草本植物相对缺乏木质素,限制了它们长得很高或支撑大枝的能力。对于一年生草本植物、二年生草本植物,甚至一些体型较小或依赖其他植物支撑的攀缘植物的多年生植物而言,营养生长阶段完全由初生生长组成。然而,在多年生植物(树木和灌木)中,初生生长很快会接着是次生生长——周长增长。次生生长源于两个形成层的活动:维管形成层,产生次生木质部和韧皮部;木栓形成层,产生周皮,即取代表皮作为茎和根的外部保护层的木栓层(见第 1 章)。另一种类型的次生生长见于乔木型单子叶植物,如棕榈树。棕榈树没有由维管形成层产生的次生木质部(即木材)和韧皮部环,而是在皮层中具有专门的初始细胞,这些细胞产生次生维管束。这些额外的维管束含有木质化木质部,可提供足够的结构加固,使棕榈树长到很高的高度。
第7行:
第7行: 在本章中,我们继续第 18 章开始的营养生长调查,研究分枝和次生生长的机制。尽管枝条和根的分枝来自非常不同的结构(分别是腋芽和中柱鞘),但这两种发育途径都汇聚在一个共同的终点:产生新的顶端分生组织,这大大提高了植物生物量的增长率。我们将看到,这两条途径在激素反应和遗传控制机制方面也有关键的相似之处。
在本章中,我们继续第 18 章开始的营养生长调查,研究分枝和次生生长的机制。尽管枝条和根的分枝来自非常不同的结构(分别是腋芽和中柱鞘),但这两种发育途径都汇聚在一个共同的终点:产生新的顶端分生组织,这大大提高了植物生物量的增长率。我们将看到,这两条途径在激素反应和遗传控制机制方面也有关键的相似之处。
我们通过描述一些次生木质部和韧皮部产生的调控途径来结束对营养生长的讨论。二次生长通过大大扩展高度限制,使植物生物量进一步增加。即使在达到物种的高度极限后,树木生物量仍会继续在横向增加,因为维管形成层的活动会持续到树木死亡(见第 23 章)。
我们通过描述一些次生木质部和韧皮部产生的调控途径来结束对营养生长的讨论。次生生长通过大大扩展高度限制,使植物生物量进一步增加。即使在达到物种的高度极限后,树木生物量仍会继续在横向增加,因为维管形成层的活动会持续到树木死亡(见第 23 章)。
== 19.1 枝条分枝和结构 ==
== 19.1 枝条分枝和结构 ==
开花植物的枝条和花序结构在很大程度上取决于胚后发育期间建立的分枝模式。最原始的分枝类型是二分枝,通常仅存在于非维管植物和非种子植物中,但也出现在仙人掌等几种种子植物类群中。在二分枝过程中,茎尖分生组织 (SAM) 扩大并一分为二,产生两个相等的茎(参见 WEB 主题 19.2)。
开花植物的枝条和花序结构在很大程度上取决于胚后发育期间建立的分枝模式。最原始的分枝类型是二分枝,通常仅存在于非维管植物和非种子植物中,但也出现在仙人掌等几种种子植物类群中。在二分枝过程中,茎尖分生组织 (SAM) 扩大并一分为二,产生两个相等的茎(参见 WEB TOPIC 19.2)。
相反,种子植物的茎结构以称为phytomer<ref>Some authors use the alternative term metamer.</ref> 的基本模块的迭代为特征,该模块由节间、节、叶和腋芽组成(图 19.1)。单个植物单体的位置、大小和形状的修改,加上腋芽生长模式的变化,解释了种子植物中枝条结构的显着多样性。营养和花序分支以及花序产生的花原基都来自叶腋中起始的腋生分生组织。在营养发育过程中,腋生分生组织与顶端分生组织一样,启动叶原基的形成,从而产生腋芽(见第 18 章)。这些芽要么休眠,要么发育成侧芽,这取决于它们沿枝条轴的位置、植物的发育阶段和环境因素。在生殖发育过程中,腋生分生组织启动花序枝和花的形成。因此,枝条结构不仅取决于腋生分生组织形成的模式,还取决于分生组织的身份和随后的生长特征。枝条(和根,如第 19.2 节所述)的一个重要生长特征是'''gravitropic setpoint angle''','''即重力器官相对于重力保持的角度'''。'''枝gravitropic setpoint angle的变化会导致各种各样的枝条结构'''(图 19.2)。正如我们在第 19.2 节中讨论的那样,树枝生长的角度由遗传和环境因素决定。
相反,种子植物的茎结构以称为phytomer<ref>Some authors use the alternative term metamer.</ref> 的基本模块的迭代为特征,该模块由节间、节、叶和腋芽组成(图 19.1)。单个植物单体的位置、大小和形状的修改,加上腋芽生长模式的变化,解释了种子植物中枝条结构的显着多样性。营养和花序分支以及花序产生的花原基都来自叶腋中起始的腋生分生组织。在营养发育过程中,腋生分生组织与顶端分生组织一样,启动叶原基的形成,从而产生腋芽(见第 18 章)。这些芽要么休眠,要么发育成侧芽,这取决于它们沿枝条轴的位置、植物的发育阶段和环境因素。在生殖发育过程中,腋生分生组织启动花序枝和花的形成。因此,枝条结构不仅取决于腋生分生组织形成的模式,还取决于分生组织的身份和随后的生长特征。枝条(和根,如第 19.2 节所述)的一个重要生长特征是'''gravitropic setpoint angle''','''即重力器官相对于重力保持的角度'''。'''枝gravitropic setpoint angle的变化会导致各种各样的枝条结构'''(图 19.2)。正如我们在第 19.2 节中讨论的那样,树枝生长的角度由遗传和环境因素决定。
=== 生长素,细胞分裂素和独角金内酯调节侧芽生长 ===
=== 生长素,细胞分裂素和独角金内酯调节侧芽生长 ===
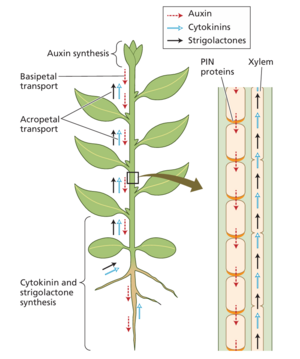
[[文件:Taiz19.3.png|缩略图|图19.3 调节枝条分枝的三种激素的长距离运输:生长素、细胞分裂素和独脚金内酯。生长素主要在幼嫩的展开叶中产生,并通过 PIN1 介导的极性生长素运输向基部运输。独脚金内酯和细胞分裂素主要在根部合成,并可在木质部中向枝条顶端转移。这两种激素也可以在腋芽附近的枝条组织中合成。]]
一旦腋生分生组织形成,它们可能会进入高度受限的生长阶段(休眠),或者它们可能会被释放以长成腋生分枝。“继续或不继续”的决定取决于发育程序和环境反应,这些反应由充当局部和长距离信号的植物激素介导。激素信号通路的相互作用协调不同分枝和茎尖的相对生长率,最终决定茎的结构。'''涉及的主要激素是生长素、细胞分裂素和独脚金内酯'''(见第 15 章)。这三种激素在根和芽中以不同数量产生,但它们的易位使它们能够在远离合成部位的地方发挥作用(图19.3)。
一旦腋生分生组织形成,它们可能会进入高度受限的生长阶段(休眠),或者它们可能会被释放以长成腋生分枝。“继续或不继续”的决定取决于发育程序和环境反应,这些反应由充当局部和长距离信号的植物激素介导。激素信号通路的相互作用协调不同分枝和茎尖的相对生长率,最终决定茎的结构。'''涉及的主要激素是生长素、细胞分裂素和独脚金内酯'''(见第 15 章)。这三种激素在根和芽中以不同数量产生,但它们的易位使它们能够在远离合成部位的地方发挥作用(图19.3)。
第23行:
第24行: === 来自茎尖的生长素保持顶端优势 ===
=== 来自茎尖的生长素保持顶端优势 ===
生长素在调节腋芽生长中的作用最容易在顶端优势实验中得到证明。顶端优势是茎尖对腋芽和下方枝条的控制。具有强顶端优势的植物通常分枝较弱,对去顶的响应强烈。顶端优势弱的植物则具有较多的分支,对去顶的响应弱或无。
生长素在调节腋芽生长中的作用最容易在顶端优势实验中得到证明。顶端优势是茎尖对腋芽和下方枝条的控制。具有强顶端优势的植物通常分枝较弱,对去顶的响应强烈。顶端优势弱的植物则具有较多的分支,对去顶的响应弱或无。
[[文件:Taiz19.3.png|居中|缩略图|调节枝条分枝的三种激素的长距离运输:生长素、细胞分裂素和独脚金内酯。生长素主要在幼嫩的展开叶中产生,并通过 PIN1 介导的极性生长素运输向基部运输。独脚金内酯和细胞分裂素主要在根部合成,并可在木质部中向枝条顶端转移。这两种激素也可以在腋芽附近的枝条组织中合成。]]
一个多世纪的实验证据表明,在顶端优势较强的植物中,茎尖产生的生长素会抑制腋芽的生长。在此类植物中,向根部生长素运输减少的突变体表现出分枝增加,而用生长素运输抑制剂处理茎尖会导致分枝增加。在顶端切除点向枝条添加生长素会抑制其向外生长,而向茎部施用生长素运输抑制剂会使下方的腋芽脱离顶端优势(图 19.4A)。园丁利用这种现象“掐掉”具有强顶端优势的菊花,从而形成密集的圆顶状花丛。
一个多世纪的实验证据表明,在顶端优势较强的植物中,茎尖产生的生长素会抑制腋芽的生长。在此类植物中,向根部生长素运输减少的突变体表现出分枝增加,而用生长素运输抑制剂处理茎尖会导致分枝增加。在顶端切除点向枝条添加生长素会抑制其向外生长,而向茎部施用生长素运输抑制剂会使下方的腋芽脱离顶端优势(图 19.4A)。园丁利用这种现象“掐掉”具有强顶端优势的菊花,从而形成密集的圆顶状花丛。
[[文件:Taiz19.4B.png|居中|缩略图|(B) 使用在独脚金内酯生物合成或信号传导方面有缺陷的突变体进行嫁接实验,这些突变体的分枝有所增加。将独脚金内酯生物合成突变体 (max1、max3 或 max4) 的枝条嫁接到野生型根上,可将突变体的枝条分枝恢复到野生型水平。将独脚金内酯信号传导突变体 max2 的根嫁接到野生型和合成突变体 max1、max3 或 max4 的枝条上,也可以防止芽的生长,这表明 max2 可以在根部产生信号,即使它无法对其作出反应。'''分枝抑制激素也可以在枝条中产生,因为将野生型枝条嫁接到缺乏独脚金内酯的根 (max1、max3 或 max4) 上不会增加分枝数量。''' ]]
'''激活侧枝的一个关键要求是其与现有脉管系统的连接。枝条的生长需要从芽中正在发育的叶子中输出生长素。因此,正在生长的芽充当生长素源,将生长素输出到主茎的生长素运输流中,主茎本身由于其运输生长素的能力而成为生长素库。'''已经提出了一个理论模型来描述生长素在调节芽生长中的作用(参见 WEB TOPIC 19.3)。'''也有证据表明蔗糖在此过程中发挥了作用。''' [[文件:Taiz19.4B.png|居中|缩略图|图 19.4 生长素和独脚内酯抑制腋芽生长。(A) 经典的生理实验证明了生长素在顶端优势中的作用。在去尖的芽中,腋芽从顶端优势中释放出来。用生长素(吲哚-3-乙酸,或 IAA)替换缺失的芽尖可防止腋芽生长。将极性生长素转运抑制剂 (PAT) 涂抹在茎上会导致芽在施用部位下方生长。 (B) 使用在独脚金内酯生物合成或信号传导方面有缺陷的突变体进行嫁接实验,这些突变体的分枝有所增加。将独脚金内酯生物合成突变体 (max1、max3 或 max4) 的枝条嫁接到野生型根上,可将突变体的枝条分枝恢复到野生型水平。将独脚金内酯信号传导突变体 max2 的根嫁接到野生型和合成突变体 max1、max3 或 max4 的枝条上,也可以防止芽的生长,这表明 max2 可以在根部产生信号,即使它无法对其作出反应。'''分枝抑制激素也可以在枝条中产生,因为将野生型枝条嫁接到缺乏独脚金内酯的根 (max1、max3 或 max4) 上不会增加分枝数量。''' |601x601像素 ]]
'''激活侧枝的一个关键要求是其与现有脉管系统的连接。枝条的生长需要从芽中正在发育的叶子中输出生长素。因此,正在生长的芽充当生长素源,将生长素输出到主茎的生长素运输流中,主茎本身由于其运输生长素的能力而成为生长素库。'''已经提出了一个理论模型来描述生长素在调节芽生长中的作用(参见 WEB 主题 19.3)。也有证据表明蔗糖在此过程中发挥了作用。
=== 独脚金内酯局部作用以抑制腋芽生长 ===
=== 独脚金内酯局部作用以抑制腋芽生长 ===
独脚金内酯被认为在顶端优势期间与生长素一起起作用。独脚金内酯生物合成缺陷(max1[更多腋芽生长 more axillary growth1]、max3 或 max4)或信号传导缺陷(max2)的拟南芥突变体表现出在没有去顶的情况下的分枝增加(图 19.4B)。将生物合成突变体的芽嫁接到野生型根上可恢复顶端优势,这表明独脚金内酯可以从根部移动到芽部。然而,根衍生的独脚金内酯不是芽抑制所必需的,因为嫁接到缺乏独脚金内酯的根上的野生型芽具有正常的顶端优势。
独脚金内酯被认为在顶端优势期间与生长素一起起作用。独脚金内酯生物合成缺陷(max1[更多腋芽生长 more axillary growth1]、max3 或 max4)或信号传导缺陷(max2)的拟南芥突变体表现出在没有去顶的情况下的分枝增加(图 19.4B)。将生物合成突变体的芽嫁接到野生型根上可恢复顶端优势,这表明独脚金内酯可以从根部移动到芽部。然而,根衍生的独脚金内酯不是芽抑制所必需的,因为嫁接到缺乏独脚金内酯的根上的野生型芽具有正常的顶端优势。
=== 细胞分裂素拮抗独脚金内酯的作用 ===
=== 细胞分裂素拮抗独脚金内酯的作用 ===
直接将细胞分裂素应用于腋芽可刺激其生长,这表明细胞分裂素参与了打破顶端优势的作用。与此假设一致,两种细胞分裂素生物合成基因(异戊烯基转移酶 1 和 2 [IPT1 和
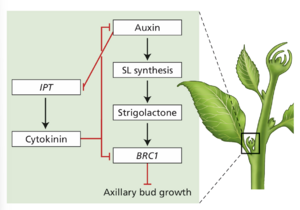
直接将细胞分裂素应用于腋芽可刺激其生长,这表明细胞分裂素参与了打破顶端优势的作用。与此假设一致,豌豆去顶后,两种细胞分裂素生物合成基因(异戊烯基转移酶 1 和 2 [IPT1 和IPT2]的表达增加,表明来自茎尖的生长素通常会抑制这些基因。通过在有和没有生长素的情况下孵育切除的茎段证实了这一点;IPT1 和 IPT2 表达仅在没有生长素孵育的节段中持续存在。此外,在节间周围施用生长素转运抑制剂 2,3,5 -三碘苯甲酸 (TIBA) 导致施用部位以下的 IPT1 和 IPT2 表达增加,表明这些基因通常受到从茎尖向下运输的生长素的抑制。因此,似乎参与打破顶端优势的细胞分裂素是在节点局部合成的。[[文件:Taiz19.5.png|缩略图|图 19 .5 调节顶端优势的激素网络。'''来自茎尖的生长素通过 max4 基因促进节区独脚金内酯的合成。在真双子叶植物中,生长素上调 BRANCHED 1 (BRC1) 基因并下调 IPT 基因。BRC1 抑制腋芽生长。独脚金内酯还抑制细胞分裂素的生物合成,否则细胞分裂素会阻止 BRC1 的产生。''']]
图 19.5 显示了细胞分裂素和独脚金内酯之间的拮抗相互作用的简化方案。'''生长素通过刺激独脚金内酯的合成来维持顶端优势。'''在真双子叶植物中,'''独脚金内酯随后激活 BRANCHED 1 (BRC1) 基因,这是一种抑制腋芽生长的转录因子'''。除了激活 BRC1 之外,独脚金内酯还通过'''负向调节 IPT 基因来抑制细胞分裂素的生物合成'''。相反,细胞分裂素抑制 BRC1 的作用,并阻止生长素诱导的独脚金内酯生物合成。'''水稻中的 BRC1 同源物FINE CULM 1 (FC1) 和玉米中的 TEOSINTE BRANCHED 1 (TB1) 是调控这些作物分枝的主要基因。'''TB1 还负责玉米驯化中涉及的一个主要性状,将高度分枝的玉米祖先 '''teosinte大刍草'''转化为更理想的现代玉米分枝减少表型 (图 19.6)。
19_Taiz7e-Ch19.indd 571
SL 合成
独脚金内酯
=== 环境和激素分支信号的整合是植物适应性所必需的 ===
[[文件:Taiz19.5.png|居中|缩略图]]
在某些情况下,植物可以根据环境条件调整其默认的枝条分枝模式。'''两个典型的例子是避荫反应和营养缺乏反应'''。这两种反应都涉及前面描述的调节途径。
腋芽生长
图 19.5 调节顶端优势的激素网络。来自茎尖的生长素通过 max4 基因促进节区独脚金内酯的合成。在真双子叶植物中,生长素上调 BRANCHED 1 (BRC1) 基因并下调 IPT 基因。BRC1 抑制腋芽生长。
植物'''通过增强枝条伸长和抑制分枝来避免遮荫。避荫涉及光敏色素 B 信号传导''',以响应当阳光穿过含有叶绿素的绿叶时导致的 R:FR 光比降低。拟南芥的遗传研究表明,'''光敏色素 B 需要生长素和独脚金内酯信号传导途径和芽特异性 BRC1 和 BRC2 基因来抑制遮荫条件下腋芽的生长。'''
独脚金内酯还抑制细胞分裂素的生物合成,否则会阻止 BRC1 的产生。(S. El-Showk 等人
'''对营养缺乏的反应由独脚金内酯介导'''。'''营养充足的植物茂密,而在营养贫乏的条件下生长的植物往往分枝较弱。'''从进化的角度来说,'''独脚金内酯参与这种分枝反应可能与这些激素在增强营养吸收方面的作用有关。菌根植物物种将独脚金内酯分泌到根际以促进菌根共生,从而增强营养吸收。'''不同物种之间的细节各不相同,但'''即使在非菌根植物物种中,在低营养条件下,枝条中的独脚金内酯浓度也会升高'''。独脚金内酯浓度的增加会抑制腋芽的生长。由于营养不足而减少分枝是一种适应性行为,因为植物能够将其资源集中在主枝和现有枝条的发育上,而不是促进营养供应无法支持的额外枝条的生长。'''在促进分枝的高氮条件下,根部细胞分裂素的合成上调。多个细胞分裂素生物合成基因发生突变的植物无法在高氮条件下增加分枝,这表明存在功能性联系。'''
2013. Development 140: 1373–1383.)
=== 腋芽休眠受季节、位置和年龄因素的影响 ===
温带地区的许多木本多年生植物在冬季停止生长,并产生休眠的顶芽和腋芽,这些芽受到厚而坚韧的芽鳞的保护(图 19 .7A)。 这些芽通常在整个冬季都处于休眠状态。影响芽休眠的主要环境因素包括温度、光照、光周期、水和养分。芽的位置和植物年龄也是重要因素。昼夜节律基因和开花基因(见第 20 章)以及光敏色素 A 参与控制落叶乔木的休眠与光周期和温度的关系。例如,在白杨树中,该系统调节芽中的细胞周期。即使在草本植物中,调节响应光周期而开花的途径也会与调节腋芽生长的途径相互作用。例如,豌豆 (''Pisum sativum'' ) 的独脚金内酯相关分枝突变体在不同光周期下生长时,腋生分枝的位置和数量会发生显著变化,而开花基因会影响拟南芥茎节的分枝。
TZ7E 19.05
除了由茎尖分生组织形成的顶芽和腋芽(也称为'''sequential buds''')外,许多树木还会产生'''附芽accessory buds''',即在正常(即'''sequential''')腋芽附近和额外形成的芽(图 19.7B)。附芽可能形成在连续腋芽的疤痕上或芽鳞的腋窝中。腋芽和附芽可能在次生生长开始后被埋在树皮下。正如我们在第 19.3 节中讨论的那样,这些埋藏的休眠芽可能会在火灾和其他刺激下被激活。
植物生理学 7/E Taiz/Zeiger
== 19.2 根系分枝和结构 ==
大多数现存维管植物都有根系,可以将它们固定在土壤上并吸收生长所需的水分和养分。通过自然选择,植物根系已经进化出适应土壤成分变化、与其他根系竞争、非生物胁迫和根际生物相互作用的能力。因此,多样性和表型可塑性是根系结构的关键特征,对植物的生存至关重要。最近对根系结构的研究受到根系表型研究进展的推动(参见 WEB TOPIC 19.4)。这些研究和其他研究表明,植物已经进化出复杂的控制机制来调节根系结构。根系结构是整个根系在土壤中的空间配置。更具体地说,根系结构是指植物根系在三维土壤空间中单个根的几何排列。根系由不同的根类型组成,不同的植物物种能够控制它们产生的根的类型以及它们的生长速度、分枝程度和生长角度。
OUP/Sinauer Associates
从现有根中长出的胚后根称为 '''lateral or branch roots''',而从非根组织中长出的根称为'''不定根adventitious roots'''。一般来说,单子叶植物(如禾本科)具有主要由不定根组成的纤维根系,而不定根又会产生丰富的侧根。相比之下,拟南芥等真双子叶植物通常只产生一个显性主根或主根,从而产生所有侧根及其分支。
Morales Studio 日期 3-21-22
豌豆去顶后,第二节茎中 IPT2]) 的表达增加,表明来自茎尖的生长素通常会抑制这些基因。通过在有和没有生长素的情况下孵育切除的茎段证实了这一点;IPT1 和 IPT2 表达仅在没有生长素孵育的节段中持续存在。此外,在节间周围施用生长素转运抑制剂 2,3,5-三碘苯甲酸 (TIBA) 导致施用部位以下的 IPT1 和 IPT2 表达增加,表明这些基因通常受到从茎尖向下运输的生长素的抑制。因此,似乎参与打破顶端优势的细胞分裂素是在节点局部合成的。
图 19.5 显示了细胞分裂素和独脚金内酯之间的拮抗相互作用的简化方案。生长素通过刺激独脚金内酯的合成来维持顶端优势。在真双子叶植物中,独脚金内酯随后激活 BRANCHED 1 (BRC1) 基因,这是一种抑制腋芽生长的转录因子。除了激活 BRC1 之外,独脚金内酯还通过负向调节 IPT 基因来抑制细胞分裂素的生物合成。相反,细胞分裂素抑制 BRC1 的作用,并阻止生长素诱导的独脚金内酯生物合成。水稻中的 BRC1 同源物FINE CULM 1 (FC1) 和玉米 (corn; Zea mays) 中的 TEOSINTE BRANCHED 1 (TB1) 是调控这些作物分枝的主要基因。TB1 还负责玉米驯化中涉及的一个主要性状,将高度分枝的玉米祖先 teosinte 转化为更理想的现代玉米分枝减少表型 (图 19.6)。 4/29/22 10:22 AM
572 第 19 章
环境和
激素分支信号的整合是植物适应性所必需的
由 Paul Gepts,加州大学戴维斯分校提供
© YesKatja/iStock
大刍草 (Zea mays ssp. parviglumis)
玉米 (Zea mays ssp. mays)
图 19.6 大刍草 (Zea mays ssp. parviglumis) 和现代玉米 (Zea mays ssp. mays) 的比较。
TZ7E 19.06
连续
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
© C. J. Wheeler
/Alamy Stock
连续芽
附属芽
连续芽
附属芽
连续芽后的芽痕
图 19.7 休眠芽的类型。(A) 七叶树 (Aesculus hippocastanum) 的休眠腋芽被芽鳞包围。
(B) 连续腋芽、附属芽和次级附属芽的图表。
在某些情况下,植物可以根据环境条件调整其默认的枝条分枝模式。两个典型的例子是避荫反应和营养缺乏反应。这两种反应都涉及前面描述的调节途径。植物通过增强枝条伸长和抑制分枝来避免遮荫。避荫涉及光敏色素 B 信号传导,以响应当阳光穿过含有叶绿素的绿叶时导致的 R:FR 光比降低。拟南芥的遗传研究表明,光敏色素 B 需要生长素和独脚金内酯信号传导途径,以及芽特异性 BRC1 和 BRC2 基因来抑制遮荫条件下腋芽的生长。对营养缺乏的反应由独脚金内酯介导。营养充足的植物茂密,而在营养贫乏的条件下生长的植物往往分枝较弱。从进化的角度来说,独脚金内酯参与这种分枝反应可能与这些激素在增强营养吸收方面的作用有关。菌根植物物种将独脚金内酯分泌到根际以促进菌根共生,从而增强营养吸收。不同物种之间的细节各不相同,但即使在非菌根植物物种中,在低营养条件下,枝条中的独脚金内酯浓度也会升高。独脚金内酯浓度的增加会抑制腋芽的生长。由于营养不足而减少分枝是一种适应性行为,因为植物能够将其资源集中在主枝和现有枝条的发育上,而不是促进营养供应无法支持的额外枝条的生长。在促进分枝的高氮条件下,根部细胞分裂素的合成上调。多个细胞分裂素生物合成基因发生突变的植物无法在高氮条件下增加分枝,这表明存在功能性联系。腋芽休眠受季节、位置和年龄因素的影响。温带地区的许多木本多年生植物在冬季停止生长,并产生休眠的顶芽和腋芽,这些芽受到厚而坚韧的芽鳞的保护(图 19.7A)。 4/29/22 10:22 AM 19_Taiz7e-Ch19.indd 572
营养生长和器官发生:分枝和二次生长 573
这些芽通常在整个冬季都处于休眠状态。影响芽休眠的主要环境因素包括温度、光照、光周期、水和养分。芽的位置和植物年龄也是重要因素。昼夜节律基因和开花基因(见第 20 章)以及光敏色素 A 参与控制落叶乔木的休眠与光周期和温度的关系。例如,在白杨树中,该系统调节芽中的细胞周期。即使在草本植物中,调节响应光周期而开花的途径也会与调节腋芽生长的途径相互作用。例如,豌豆 (Pisum sativum) 的独脚金内酯相关分枝突变体在不同光周期下生长时,腋生分枝的位置和数量会发生显著变化,而开花基因会影响拟南芥茎节的分枝。除了由茎尖分生组织形成的顶芽和腋芽(也称为连续芽)外,许多树木还会产生附芽,即在正常(即连续)腋芽附近和额外形成的芽(图 19.7B)。附芽可能形成在连续腋芽的疤痕上或芽鳞的腋窝中。腋芽和附芽都是休眠芽在开始二次生长后,根系会被埋在树皮下。正如我们在第 19.3 节中讨论的那样,这些埋藏的休眠芽可能会在火灾和其他刺激下被激活。
19.2 根系分枝和结构
大多数活维管植物都有根系,可以将它们固定在土壤上并吸收生长所需的水分和养分。通过自然选择,植物根系已经进化出适应土壤成分变化、与其他根系竞争、非生物胁迫和根际生物相互作用的能力。因此,多样性和表型可塑性是根系结构的关键特征,对植物的生存至关重要。最近对根系结构的研究受到根系表型研究进展的推动(参见 WEB 主题 19.4)。这些研究和其他研究表明,植物已经进化出复杂的控制机制来调节根系结构。根系结构是整个根系在土壤中的空间配置。更具体地说,根系结构是指植物根系在三维土壤空间中单个根的几何排列。根系由不同的根类型组成,不同的植物物种能够控制它们产生的根的类型以及它们的生长速度、分枝程度和生长角度。19_Taiz7e-Ch19.indd 573从现有根中长出的胚后根称为侧根或分支根,而从非根组织中长出的根称为不定根。一般来说,单子叶植物(如禾本科)具有主要由不定根组成的纤维根系,而不定根又会产生丰富的侧根。相比之下,拟南芥等真双子叶植物通常只产生一个显性主根或主根,从而产生所有侧根及其分支。
在枝条中,叶原基和腋芽原基周期性地在顶端分生组织的侧面以螺旋排列或其他精确模式开始 - 这种现象称为叶序(见第 18 章)。侧根原基在生长根的分化区开始(见第 18 章)。侧根沿根表面的排列称为根系趋向,由内源性和环境因素共同决定。
在枝条中,叶原基和腋芽原基周期性地在顶端分生组织的侧面以螺旋排列或其他精确模式开始 - 这种现象称为叶序(见第 18 章)。侧根原基在生长根的分化区开始(见第 18 章)。侧根沿根表面的排列称为根系趋向,由内源性和环境因素共同决定。
第118行:
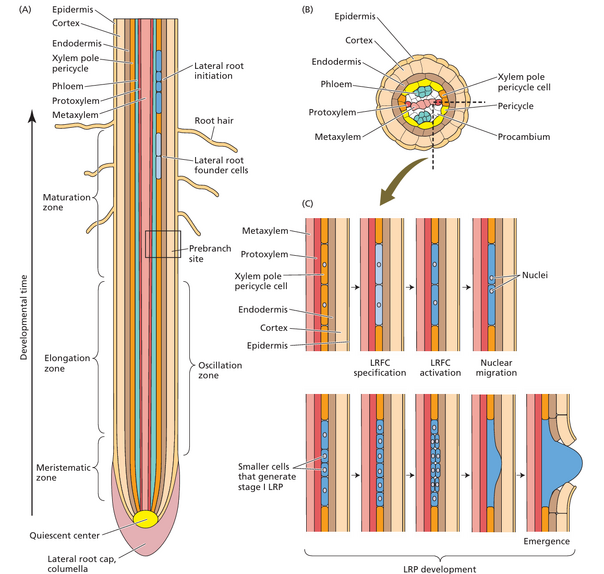
第55行: 在根生长过程中,发育区(分生 [细胞分裂]、伸长和成熟 [分化])通过在生长尖端添加新细胞而向上移动(见图 19.9A)。因此,发育中的侧根通过成熟区向根的完全成熟区域移动。(请注意,发育中的侧根不会改变其相对于根基的位置。)此过程在生长尖端附近最年轻的侧根原基和根基附近最老的侧根之间产生发育梯度。
在根生长过程中,发育区(分生 [细胞分裂]、伸长和成熟 [分化])通过在生长尖端添加新细胞而向上移动(见图 19.9A)。因此,发育中的侧根通过成熟区向根的完全成熟区域移动。(请注意,发育中的侧根不会改变其相对于根基的位置。)此过程在生长尖端附近最年轻的侧根原基和根基附近最老的侧根之间产生发育梯度。
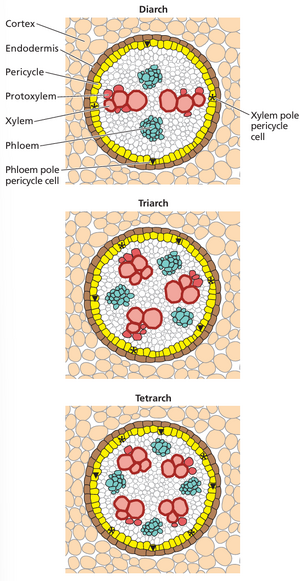
侧根原基来自木质部极柱中柱鞘细胞。在包括拟南芥在内的大多数植物中,侧根仅在柱鞘中开始,柱鞘是位于内皮层内的组织(见第 1 章)。根部维管组织的排列方式可分为二元维管(如拟南芥)、三元维管、四元维管等,具体取决于木质部臂的数量,而木质部臂的数量与原生木质部束的数量相对应(图 19.8)。韧皮部极中柱周细胞是位于韧皮部束附近的中柱周细胞,而木质部极中柱周细胞则位于木质部臂的尖端附近。在拟南芥和大多数其他真双子叶植物和非禾本科单子叶植物中,侧根起始仅发生在木质部极中柱周细胞中,而在禾本科植物(例如玉米和大麦)中,侧根起始仅限于韧皮部极中柱周细胞。这种差异提出了一个重要的问题:木质部极(大多数被子植物)或韧皮部极(某些单子叶植物)的中柱鞘细胞是如何与其他中柱鞘细胞区分开来的。由于该领域的大部分研究都是在拟南芥上进行的,因此我们将重点研究木质部极中柱鞘细胞发育成侧根的过程。
=== 侧根原基来自木质部极柱中柱鞘细胞 ===
[[文件 :Taiz19 .8 .png|缩略图|图19 .8 不同类型的初生木质部、初生韧皮部在根中的排列。]]
4/29/22 10:22 AM
在包括拟南芥在内的大多数植物中,侧根仅在柱鞘中开始,柱鞘是位于内皮层内的组织(见第 1 章)。根部维管组织的排列方式可分为二元 (拟南芥)、三元、四元等,具体取决于木质部臂 (xylem arms )的数量,而木质部臂的数量与原生木质部束的数量相对应(图 19.8)。'''韧皮部极中柱鞘细胞phloem pole pericycle'''是位于韧皮部束附近的中柱鞘细胞,'''而木质部极中柱鞘细胞xylem pole pericycle'''则位于木质部臂的尖端附近。<u>在拟南芥和大多数其他真双子叶植物和非禾本科单子叶植物中,侧根起始仅发生在木质部极中柱鞘细胞中,而在禾本科植物(例如玉米和大麦)中,侧根起始仅限于韧皮部极中柱鞘细胞< /u>'''。'''这种差异提出了一个重要的问题:木质部极(大多数被子植物)或韧皮部极(某些单子叶植物)的中柱鞘细胞是如何与其他中柱鞘细胞区分开来的。由于该领域的大部分研究都是在拟南芥上进行的,因此我们将重点研究木质部极中柱鞘细胞发育成侧根的过程。
574 第 19 章
内皮层
原生木质部
韧皮部极
中柱鞘细胞
木质部极
图 19.8 真双子叶植物根中不同原生木质部和原生韧皮部排列的例子。 (根据 M. Megías 等人 2019 年的《植物和动物组织学图集》。西班牙维哥大学功能生物健康科学系。<nowiki>https://mmegias.webs.uvigo.es/02-english/</nowiki>
2-organos-v/guiada_o_v_rprimario.php。)
侧根形成可分为四个不同的阶段
TZ7E 19.08
侧根原基在中柱鞘中从侧根创始细胞(木质部极中柱鞘细胞的一个子集)中产生。在规范化之前与创始细胞一样,侧根发育主要涉及不可见的细胞变化,这些变化使木质部极柱中轴细胞成为创始细胞。这些不可见的变化可能在细胞从分生区进入伸长区时分阶段发生。例如,有证据表明,当木质部极柱中轴细胞和韧皮部极柱中轴细胞仍处于根尖分生区时,它们的基因表达模式开始类似于它们各自的维管组织。然而,无论分生区发生什么变化,木质部极柱中轴细胞在到达伸长区之前都无法完全分化为侧根创始细胞。根部中木质部极柱中柱鞘细胞完全有能力成为创始细胞的位置称为前分枝位点,大致对应于成熟区的开始(图 19.9A)。正是在这里,一些木质部极柱中柱鞘细胞(图 19.9B)经历了启动,这使它们成为侧根创始细胞(图 19.9C)。当新的侧根原基在前分枝位点进行启动时,它会向着向茎方向移动。新的侧根创始细胞会定期分化形成新的前分枝位点,只要主根继续生长,这个过程就会重复。侧根的形成可以分为四个不同的阶段:
I. 侧根创始细胞的分化,它决定了前分枝位点沿根部的位置
II.侧根起始,涉及侧根创始细胞中的核迁移和不对称及反向细胞分裂
III. 侧根原基形成,产生垂直于亲本根的新根顶端分生组织
I V. 侧根出现,涉及侧根原基与周围组织之间的相互作用,从而允许穿过上覆细胞层并出现新的侧根
鉴于其对根系结构的重要性,创建前分支位点所涉及的机制已受到广泛关注。例如,现在有大量证据表明,前分支位点的指定需要生长素,并且主要发生在振荡区。已经提出了一种生长素时钟模型来解释前分支位点的间距。简而言之,该模型提出,
分枝前位点的间距由振荡区中生长素活性或生长素浓度的周期性振荡调节,振荡区大致从
分生区中部延伸到
分枝开始
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 574
营养生长和器官发生:分枝和二次生长 575
内皮层
木质部极
原生木质部
成熟
发育时间
伸长
分生
静止中心
侧根帽,
图 19.9 拟南芥侧根发育。
(A) 主根的纵向切片,显示其发育区。分枝前位点,如果得到适当的信号,就会在此形成分枝根,该位点在振荡区内生长素反应基因表达的振荡阶段之后形成。振荡区赋予木质部极中柱周细胞分化为侧根创始细胞(浅蓝色)的能力。(B)主根的横截面。
振荡生长素反应发生在原生木质部(红色)中;
然而,由于侧根起始发生在相邻的木质部极中柱周细胞(橙色)中,这两种细胞类型之间的信号传导可能是侧根创始细胞的指定所必需的。 (C) 根部小部分的纵向切片,显示侧根的起始和发育。特定的木质部极中柱鞘细胞(橙色)被指定为侧根创始细胞(LRFC;浅蓝色),然后被激活进行细胞分裂(深蓝色)。激活会导致一对垂直堆叠的 LRFC 的细胞核向它们共用的细胞壁迁移。然后这些细胞经历不对称的背斜分裂,产生几个较小的细胞(深蓝色)。持续的背斜和背斜分裂产生侧根原基 (LRP)。LRP 穿过主根的外层细胞层,直到从表皮中冒出来。(绘图)不按比例绘制。)
(J. M. Van Norman 等人,2013 年。发展 140:
4301–4310。)
4/29/22 10:22 AM
576 第 19 章
来自 J. M. Van Norman 等人,2013 年。发展 140:4301–4310
发光(ADU/6 分钟)
来自 M. A. Moreno-Risueno 等人。
2010 年。科学 329:1306–1311
图 19.10 前分枝位点形成于振荡区,
紧接着成熟区下方。(A)由生长素敏感的 DR5 启动子驱动的荧光素酶基因在拟南芥根中的表达。生长素信号水平(由荧光素酶活性引起的发光指示)在振荡区 (OZ) 中随时间波动。星号表示前分支位点,对应于生长素活性最大值。 (B) 通过发光测量的两个拟南芥根中的生长素信号水平在振荡区以大约 6 小时的周期振荡。 ADU,模拟数字单位。 (C) 根部生长素最大值(浅蓝色区域)对应于弯曲、侧根形成和侧根出现的位点。箭头表示侧根形成的位点。(B 源自 M. A. Moreno-Risueno 等人。 2010。科学 329:1306-1311。)成熟区(图 19.10)。根据该模型,只有暴露于生长素最大值(活性或浓度)的细胞才有能力形成前分支位点(参见 WEB 主题 19.5)。
TZ7E 19.10
侧根创始细胞经历不对称细胞分裂以启动侧根原基的形成
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
在拟南芥中,几个垂直的创始细胞files参与侧根生长的起始阶段。
=== 侧根形成可分为四个不同的阶段 ===
'''侧根原基在中柱鞘中从侧根创始细胞( lateral root founder cell,木质部极中柱鞘细胞的一个子集)中产生'''。在创始细胞特化之前,侧根发育涉及不可见的细胞变化,这些变化使木质部极中柱鞘细胞成为创始细胞。这些不可见的变化可能在细胞从分生区进入伸长区时分阶段发生。例如,有证据表明,当木质部极中柱鞘细胞和韧皮部极中柱鞘细胞仍处于根尖分生区时,它们的基因表达模式开始类似于它们各自的维管组织。然而,<u>无论分生区发生什么变化,木质部极中柱鞘细胞在到达伸长区之前都无法完全分化为侧根创始细胞。</u>[[文件:Taiz19.9.png|居中|缩略图|604x604像素|'''图 19.9''' 拟南芥的侧根发育。(A) 主根的纵切面,显示其发育区域。前分支位点在振荡区内生长素反应基因表达的振荡阶段之后形成,如果给予适当的信号,侧根将在这里形成。振荡区赋予木质部极周细胞分化为侧根创始细胞(浅蓝色)的能力。(B) 主根的横截面。振荡生长素反应发生在原生木质部(红色);然而,由于侧根起始发生在相邻的木质部极周周期细胞(橙色)中,因此可能需要这两种细胞类型之间的信号传导才能规范落叶根起始细胞。(C) 根的一小部分的纵切面,显示侧根的起始和发展。特定的木质部极周细胞(橙色)被指定为侧根创始细胞(LRFC;浅蓝色),然后被激活以进行细胞分裂(深蓝色)。活动导致一对垂直堆叠的 LRFC 的细胞核向它们共享的细胞壁迁移。然后这些细胞经历不对称的背斜分裂,产生几个较小的细胞(深蓝色)。持续的背斜和周围分裂产生侧根原基 (LRP)。LRP 生长,穿过外侧的细胞层,直到它从表皮中出现。]]
侧根创始细胞激活的第一个可见迹象是核向files中两个相邻的侧根创始细胞之间的细胞壁迁移,随后两个细胞中都发生形成细胞分裂(参见图 19.9C)。形成性分裂是一种不对称的细胞分裂,其中两个子细胞获得不同的细胞命运。侧根起始定义为第一次形成性分裂完成并且子细胞命运已确定时完成。侧根发育的这个阶段称为第二阶段。第二阶段还包括激活特定转录因子基因,这些基因是原基形成各个阶段协调所必需的。例如,PLETHORA (PLT) 转录因子家族的成员对于调节侧根形成的所有起始后步骤至关重要(见第 18 章)。侧根原基的形成标志着侧根开始生长。细胞生长和几轮增殖(垂向、周向和切向)细胞分裂相结合,产生了一个圆顶状的原基,在侧根生长的最后阶段,原基作为侧根出现。新生原基上方的皮质和表皮组织会产生细胞壁软化酶,使其向根表面和土壤中移动变得容易。一旦新的分生组织完全形成,它就获得了合成自身生长素的能力。因此,出现的侧根具有功能性的根尖分生组织(RAM),包括一个静止中心和周围的初始细胞,这些细胞会产生生长侧根的所有组织。单子叶植物和真双子叶植物的主要根系类型不同
根部中木质部极柱中柱鞘细胞完全有能力成为创始细胞的位置称为'''分枝前位点 prebranch site''',大致对应于成熟区的开始(图 19.9A)。正是在这里,一些木质部极柱中柱鞘细胞(图 19.9B)经历了'''启动(priming)''',这使它们成为侧根创始细胞(图 19.9C)。当新的侧根原基在分支前位点进行启动时, '''it is being displaced in the shootward direction.'''。新的侧根创始细胞会定期分化形成新的分支前位点,只要主根继续生长,这个过程就会重复。
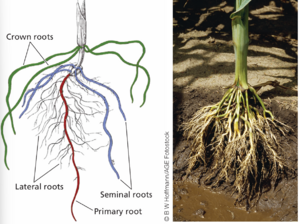
单子叶植物和真双子叶植物的根系结构大致相似,由胚根衍生的初生根(胚根)、侧根和从茎节衍生的不定根组成。然而,它们的根系也存在显著差异。单子叶植物的根系,尤其是谷类植物的根系,通常比真双子叶植物的根系更复杂。例如,玉米幼苗根系由从胚根发育而来的初生根、从盾片节分支的种子根和从茎的最下部节点分支的胚后衍生的冠根组成,冠根也称为不定根(图 19.11)。主根和种子根形成纤维根系统,高度分枝的系统,具有许多细侧根。冠根在幼苗中相对不重要,但与 4/29/22 10:22 AM
侧根的形成可以分为四个不同的阶段:
19_Taiz7e-Ch19.indd 576
I . '''侧根创始细胞的分化''',它决定了分支前位点沿根部的位置
营养生长和器官发生:分枝和二次生长 577
II.'''侧根起始''',涉及侧根创始细胞中的核迁移和不对称及垂周细胞分裂
摘自 F. Hochholdinger 和 R. Tuberosa。2009。Curr Opin. Plant Biol. 12:172–177
III . '''侧根原基形成''',产生垂直于亲本根的新根顶端分生组织
冠根
IV. '''侧根冒出表面''',涉及侧根原基与周围组织之间的相互作用,从而允许穿过上覆细胞层并出现新的侧根
侧根
鉴于其对根系结构的重要性,创建前分支位点所涉及的机制已受到广泛关注。例如,现在有大量证据表明,'''前分支位点的指定需要生长素,并且主要发生在振荡区oscillation zone'''。已经提出了一种生长素时钟模型来解释前分支位点的间距。简而言之,该模型提出,'''分枝前位点的间距由振荡区中生长素活性或生长素浓度的周期性振荡调节,振荡区大致从分生区中部延伸到'''紧接着成熟区下方。'''根据该模型,只有暴露于生长素最大值(活性或浓度)的细胞才有能力形成前分支位点(参见 WEB TOPIC 19.5)。'''
种子根
=== 侧根创始细胞经历不对称细胞分裂以启动侧根原基的形成 ===
在拟南芥中,几个垂直的创始细胞 files参与侧根生长的起始阶段。'''侧根创始细胞激活的第一个可见迹象是核向files中两个相邻的侧根创始细胞之间的细胞壁迁移,随后两个细胞中都发生 ''formative细胞分裂''(参见图 19.9C)。 formative分裂是一种不对称的细胞分裂,其中两个子细胞获得不同的细胞命运。'''侧根起始定义为第一次 formative分裂完成并且子细胞命运已确定时完成。侧根发育的这个阶段称为第二阶段。第二阶段还包括激活特定转录因子基因,这些基因是原基形成各个阶段协调所必需的。例如,PLETHORA (PLT) 转录因子家族的成员对于调节侧根形成的所有起始后步骤至关重要(见第 18 章)。
主根
侧根原基的形成标志着侧根开始生长。细胞生长和几轮增殖(垂向、周向和切向)细胞分裂相结合,产生了一个圆顶状的原基,在侧根生长的最后阶段,原基作为侧根出现。'''新生原基上方的皮质和表皮组织会产生细胞壁软化酶,使其朝着根表和土壤的移动变得容易'''。一旦新的分生组织完全形成,它就获得了合成自身生长素的能力。因此,出现的侧根具有功能性的根尖分生组织(RAM),包括一个静止中心和周围的初始细胞,这些细胞会产生生长侧根的所有组织。
=== 单子叶植物和真双子叶植物的主要根系类型不同 ===
单子叶植物和真双子叶植物的根系结构大致相似,由胚根衍生的初生根(胚根)、侧根和从茎节衍生的不定根组成。然而,它们的根系也存在显著差异。单子叶植物的根系,尤其是谷类植物的根系,通常比真双子叶植物的根系更复杂。例如,玉米幼苗根系由从'''胚根radicle'''发育而来的'''初生根primary root'''、从盾片节分支的'''种子根seminal roots'''和从茎的最下部节点分支的胚后衍生的'''冠根 crown roots''' 组成,冠根也称为不定根(图 19.11)。主根和种子根形成纤维根系统,高度分枝的系统,具有许多细侧根。冠根在幼苗中相对不重要,相比之下初生根和种子根持续在营养生长期间形成,发展和分支。
[[文件:Taiz19.11.png|居中|缩略图| (A)Root system of a 14-day-old maize seedling composed of primary root derived from the embryonic radicle, seminal roots derived from the scutellar node, postembryonically formed crown roots that arise at nodes above the mesocotyl, and lateral roots. (B) Mature maize root system]]
© B W Hoffmann/AGE Fotostock
图 19.11 单子叶植物根系。 (A) 14 天大的玉米幼苗的根系,由来自胚根的主根、来自胚轴节的种子根、在胚后形成的在中胚轴上方的节处长出的冠根和侧根组成。 (B) 成熟的玉米根系。主根和种子根在营养生长过程中不断形成、发育和分枝。
在发育后期,'''一种特殊的冠根,即支柱根,从土壤表面上方的节点出现'''。 支柱根具有独特的形态,被认为可以为较大的植物提供结构支撑。'''冠根系统占成年玉米植株根系的绝大部分(见图 19.11B)。'''
在发育后期,一种特殊的冠根,即支柱根,从土壤表面上方的节点出现。 支柱根具有独特的形态,被认为可以为较大的植物提供结构支撑。
幼年真双子叶植物的根系由 primary root (or taproot)及其分枝根组成。随着根系的成熟,基根 basal roots 从主根最老的部分(靠近与芽的连接处)产生。此外,不定根可以从地下茎或下胚轴产生;这些根与谷物中的不定冠根大致类似。图 19.12 显示了作为代表性真双子叶植物的大豆植物的根系,其中可以看到主根、分枝根、基根和不定根。
[[文件:Taiz19.12.png|居中|缩略图]]
不定根
=== 转录因子调节侧根和芽的重力设定点角度 ===
如第 19.1 节所述,芽系统和根系统的各种组成部分往往以特征性的重力设定点角度生长。按照惯例,'''垂直向下生长的主根的重力设定点角度为 0˚,而垂直向上生长的主枝的重力设定点角度为 180˚。侧枝和根的设定点角度往往偏离垂直方向。'''
TZ7E 19.11
'''在出现后,侧根尚未形成伸长区,这意味着它们无法进行重力弯曲。因此,新出现的侧根最初会以垂直于重力的角度远离主轴生长'''。这种水平生长有助于沿径向扩展根系,增加营养物质的获取并稳定植物。'''一旦侧根形成了伸长区,它们就会以预定的重力设定点角度弯曲,并以相同的角度继续生长一段时间,这段时间称为平台期。一般来说,早期侧根的生长平台期比晚期侧根长。最终,另一种重力反应开始起作用,导致第二次弯曲,向下生长更加明显,角度在 0˚ 到 30˚ 之间。'''
植物生理学 7/E Taiz/Zeiger
一般来说,如果重力反应枝(根或枝)从其重力设定点角度被向上或向下机械位移,它将经历向性生长,使其回到重力设定点角度。'''这意味着具有非垂直重力设定点角度的侧根可以呈负重力性,即逆重力矢量生长。相反,非垂直枝条可以呈正重力性,向下生长'''。这一观察结果简单地证明了维持重力响应非垂直生长的机制基础不能仅仅在于初级器官和侧生器官之间向重力性能力的差异。一定还有另一种未知的机制可以驱动侧根向上生长和侧芽向下生长。
OUP/Sinauer Associates
已经确定了几种调节因子,它们影响侧生器官在芽和根以及不同植物门中的重力设定点角度。''' 这些蛋白质属于 IGT 家族,以高度保守的 IGT 氨基酸基序命名'''。该家族有三个不同的分支,'''LAZY、DEEPER ROOT-ING (DRO) 和 TILLER ANGLE CONTROL (TAC),'''它们以不同的方式增加或减少根和芽侧生器官的生长角度(图 19.13)。破译这些转录因子的功能应该有助于揭示控制重力设定点角度的机制。操纵这些机制可能对提高作物产量和恢复力很有价值。例如,在水稻中,几种 IGT 转录因子基因座的遗传变异与重要的农艺性状有关:DRO1 可使根系更深,从而提高耐旱性;DRO1-LIKE 1 可增强土壤表面根系,从而提高耐旱性nce 适合盐渍土和涝渍土;TAC1 适合最佳枝条分枝角度,从而促进密集种植田地的光合作用。
Morales Studio 日期 4-19-22
Leon Kochian 提供
图 19.12 大豆根系显示主根
(主根)、支根、基根和不定根。
19_Taiz7e-Ch19.indd 577
冠根系统占成年玉米植株根系的绝大部分(见图 19.11B)。
幼年真双子叶植物的根系由主根(或主根)及其分枝根组成。随着根系的成熟,基根从主根最老的部分(靠近与芽的连接处)产生。此外,不定根可以从地下茎或下胚轴产生;这些根与谷物中的不定冠根大致类似。图 19.12 显示了作为代表性真双子叶植物的大豆植物的根系,其中可以看到主根、分枝根、基根和不定根。
转录因子调节侧根和芽的重力设定点角度
如第 19.1 节所述,芽系统和根系统的各种组成部分往往以特征性的重力设定点角度生长。按照惯例,垂直向下生长的主根的重力设定点角度为 0˚,而垂直向上生长的主枝的重力设定点角度为 180˚。侧枝和根的设定点角度往往偏离垂直方向。
在出现后,侧根尚未形成伸长区,这意味着它们无法进行重力弯曲。因此,新出现的侧根最初会以垂直于重力的角度远离主轴生长。这种水平生长有助于沿径向扩展根系,增加营养物质的获取并稳定植物。一旦侧根形成了伸长区,它们就会以预定的重力设定点角度弯曲,并以相同的角度继续生长一段时间,这段时间称为平台期。一般来说,早期侧根的生长平台期比晚期侧根长。最终,另一种重力反应开始起作用,导致第二次弯曲,向下生长更加明显,角度在 0˚ 到 30˚ 之间。
一般来说,如果重力反应枝(根或枝)从其重力设定点角度向上或向下机械位移,它将经历向性生长,使其回到重力设定点角度。
这意味着具有非垂直重力设定点角度的侧根可以呈负重力性,即逆重力矢量生长。相反,非垂直枝条可以呈正重力性,向下生长。这一观察结果简单地证明了维持重力响应非垂直生长的机制基础不能仅仅在于
4/29/22 10:22 AM
578 第 19 章
初级器官和侧生器官之间重力能力的差异。一定还有另一种未知的机制可以驱动侧根向上生长和侧芽向下生长。
已经确定了几种调节因子,它们影响侧生器官在芽和根以及不同植物门中的重力设定点角度。
这些蛋白质属于 IGT 家族,以高度保守的 IGT 氨基酸基序命名。该家族有三个不同的分支,LAZY、DEEPER ROOT-ING (DRO) 和 TILLER ANGLE CONTROL (TAC),它们以不同的方式增加或减少根和芽侧生器官的生长角度(图 19.13)。破译这些转录因子的功能应该有助于揭示控制重力设定点角度的机制。操纵这些机制可能对提高作物产量和恢复力很有价值。例如,在水稻中,几种 IGT 转录因子基因座的遗传变异与重要的农艺性状有关。来自 C. A. Hollender 等人。2020 年。科学报告 10:6051。CC BY 4.0
lazy1/dro1
来自 B. Yu 等人2007. Plant J. 52: 891–898
TAC1 过表达者
图 19.13 IGT 转录因子对茎部重力设定点角度的调节。(A) 拟南芥 tac1 突变体的分枝角度比野生型 (WT) 的分枝角度更直立,而 lazy1/dro1 双突变体的水平茎角度更多。 (B) 在水稻中,TAC1 过表达者的茎部和根系生长角度更水平。
性状:DRO1 可使根系更深,从而提高耐旱性;DRO1-LIKE 1 可增强土壤表面根系,从而提高耐旱性nce 适合盐渍土和涝渍土;
TAC1 适合最佳枝条分枝角度,从而促进密集种植田地的光合作用。
植物可以改变其根系结构以优化水和养分吸收
=== 植物可以改变其根系结构以优化水和养分吸收 ===
根系结构在物种内具有高度可塑性,因为植物可以调节根系发育以优化水和养分吸收(见第 7 章)。例如,土壤中的水分异质性可能是由气穴或土壤水势变化引起的,就像在部分干燥期间或响应盐度梯度时发生的那样。这种异质性可以刺激根系定向生长到湿度较高或水分充足的区域,这种行为称为向水性(见第 17 章)。如第 7 章所述,植物根部通常会形成菌根共生体,可以增强养分吸收,尤其是在磷酸根离子的情况下。这种关联通常涉及解剖学和形态学变化,以促进根系与其真菌共生体之间的营养交换。植物根系也可以与固氮细菌形成共生关系,如第 14 章所述。
根系结构在物种内具有高度可塑性,因为植物可以调节根系发育以优化水和养分吸收(见第 7 章)。例如,土壤中的水分异质性可能是由气穴或土壤水势变化引起的,就像在部分干燥期间或响应盐度梯度时发生的那样。这种异质性可以刺激根系定向生长到湿度较高或水分充足的区域,这种行为称为向水性(见第 17 章)。如第 7 章所述,植物根部通常会形成菌根共生体,可以增强养分吸收,尤其是在磷酸根离子的情况下。这种关联通常涉及解剖学和形态学变化,以促进根系与其真菌共生体之间的营养交换。植物根系也可以与固氮细菌形成共生关系,如第 14 章所述。
19.3 二次生长
== 19.3 次生生长 ==
所有裸子植物和大多数真双子叶植物(包括木本灌木和树木以及大型草本植物)都会发育出侧生分生组织,导致茎和根的径向生长(宽度增长)。侧生分生组织引起的周长增长称为次生生长(图 19.14),它有助于木本植物的不断增大,使其变得更厚实、更健壮。据估计,木材占世界生物量的一半以上,森林生物群落为世界约 80% 的生物多样性提供了家园。
所有裸子植物和大多数真双子叶植物(包括木本灌木和树木以及大型草本植物)都会发育出侧分生组织,导致茎和根的径向生长(宽度增长)。侧分生组织引起的周长增长称为二次生长(图 19.14),它有助于木本植物的不断增大,使其变得更厚实、更健壮。据估计,木材占世界生物量的一半以上,森林生物群落为世界约 80% 的生物多样性提供了家园。
负责次生生长的维管形成层的发育在维管植物的进化过程中反复发生(参见 WEB 主题 19.6)。
木材由具有增厚的次生细胞壁的次生木质部组织组成,其形成是动态和连续的。从生理学上讲,木材具有运输、储存和机械功能,木材对各种环境因素的反应反映了促进这些功能的变化。 (有关适应性次生生长对环境压力的反应的讨论,请参阅 WEB 主题 19.7。)
两种类型的侧分生组织参与
次生生长
次生生长由两种类型的侧分生组织的活动产生:维管形成层、
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 578
营养生长和器官发生:分枝和次生生长 579
形成层区
'''负责次生生长的维管形成层的发育在维管植物的进化过程中反复发生(参见 WEB TOPIC 19.6)'''。木材由具有增厚的次生细胞壁的次生木质部组织组成,其形成是动态和连续的。从生理学上讲,木材具有运输、储存和机械功能,木材对各种环境因素的反应反映了促进这些功能的变化。 (有关适应性次生生长对环境压力的反应的讨论,请参阅 WEB TOPIC 19.7。)
次生韧皮部
=== 两种类型的侧生分生组织参与次生生长 ===
次生生长由两种类型的侧生分生组织的活动产生:维管形成层,产生次生维管组织,以及木栓形成层,产生次生植物体的外部保护层,称为周皮(图 19.15A)。维管形成层和木栓形成层通常排列成同心圆柱体。然而,其他形式的次生木质部生长已经进化,产生了各种其他形状。这些形状可能具有适应性,如藤本植物参见 WEB TOPIC 19.8)。
初生韧皮部
由维管形成层产生的次生木质部和韧皮部使植物能够调节长距离运输能力,并适应不同的生态位和环境变化。由木栓形成层产生的周皮更浅,可保护植物免受生物和非生物胁迫并防止水分流失。这两种组织都增加了机械支撑,被认为是高大、健壮植物进化的关键解剖学创新。这样的植物可以活得更长,并且可以选择较少地繁殖,只有在条件最佳时才会这样做。
木皮层
裸子植物和真双子叶植物从初生生长到次生生长的转变在枝条轴线上清晰可见。杨树(Populus spp.),初次生长发生在顶部八个节间,距离茎尖分生组织 (SAM) 约 15 厘米。初次生长随后让位于次生 (木质) 生长,产生次生木质部和次生韧皮部(见图 19.15A)。初次和次生生长区在空间和时间上都是分开的,很容易辨别,并且在杨树等速生树种中发育迅速(1-2 个月内)。
韧皮射线
=== 维管形成层产生次生木质部和韧皮部 ===
与末端定位的 SAM 和 RAM 相反,维管形成层呈现出非常独特的分生组织组织,该组织几乎沿着植物顶端-基轴的整个长度延伸,并起到沿径向轴产生维管组织的作用。维管形成层由初始细胞(形成层初始细胞)组成,这些细胞以径向排列,形成围绕茎的连续圆柱体。形成层初始细胞分裂产生木质部、韧皮部和射线(稍后讨论)的母细胞,这些母细胞又经过几轮分裂形成形成层区,这是一个相对未分化的细胞区,每个径向细胞列的细胞数量不等。这些细胞在离开形成层区时分化成几种不同的细胞类型。
初生韧皮部
维管形成层显示两种主要分裂模式 - '''垂周anticlinal'''(垂直于茎表面)和'''平周periclinal'''(平行于茎表面)(见图 19.15B)。'''垂周分裂向形成层添加了更多细胞,以适应茎的不断增加的周长,并被认为表明了形成层初始细胞的位置''',否则从形态上讲,形成层初始细胞与形成层区中的其他细胞难以区分。垂向分裂的峰值通常位于靠近韧皮部的第一或第二个细胞列内,通常用于确定维管束形成层的大致位置。虽然其他分生组织只在一侧产生细胞,但参与次生生长的两个侧生分生组织'''都是bifacial的,在两侧都形成新细胞'''。维管形成层向内产生木质部,向外产生韧皮部(见图 1.5),而正如我们在本节后面讨论的那样,木栓形成层向外产生木栓层,向内产生栓内层。
次生韧皮部
木皮层
图 19.14 木质茎的内部解剖结构。
维管形成层(红色区域)由单层
的形成层初始细胞及其两侧的直接衍生物组成,并被外层的次生韧皮部细胞(黑色)和内层的次生木质部细胞(浅绿色)包围。图中还显示了初生韧皮部(深蓝色)、初生木质部(深绿色)和髓(浅蓝色)。
周皮包括木栓形成层(棕褐色细胞层)、木栓内层(粉红色)和木栓层(棕色木栓细胞)。
树皮层包括维管形成层外部的所有组织,包括初生韧皮部和次生韧皮部。大多数被子植物和裸子植物树种还含有射线细胞的径向files,这些射线细胞在营养运输和储存中发挥作用。 (J. P. M. Risopatron 等人,2010 年,Protoplasma 247:145–161 后。)
TZ7E 19.14
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 3-8-22
产生次生维管组织,以及木栓形成层或木栓形成层,产生次生植物体的外部保护层,称为周皮(图 19.15A)。维管形成层和木栓形成层通常排列成同心圆柱体。然而,其他形式的次生木质部
生长已经进化,产生了各种其他形状
19_Taiz7e-Ch19.indd 579
这些形状可能具有适应性,就像藤本植物一样
形成层
次生木质部
初生木质部
(参见 WEB 主题 19.8)。
由
维管形成层产生的次生木质部和韧皮部使植物能够调节
长距离运输能力,并适应不同的
生态位和环境变化。
由木栓形成层产生的周皮更浅,可保护植物免受生物和非生物胁迫并防止水分流失。这两种组织都增加了
机械支撑,被认为是高大、健壮植物进化的关键解剖学创新。
这样的植物可以活得更长,并且可以选择较少地繁殖,只有在条件最佳时才会这样做。
裸子植物和真双子叶植物从初生生长到次生生长的转变在枝条轴线上清晰可见。杨树(Populus spp.)例如,初次生长发生在顶部八个节间,距离茎尖分生组织 (SAM) 约 15 厘米。初次生长随后让位于次生 (木质) 生长,产生次生木质部和次生韧皮部(见图 19.15A)。初次和次生生长区在空间和时间上都是分开的,很容易辨别,并且在杨树等速生树种中发育迅速(1-2 个月内)。
维管形成层产生次生木质部和韧皮部
与末端定位的 SAM 和 RAM 相反,维管形成层呈现出非常独特的分生组织组织,该组织几乎沿着植物顶端-基轴的整个长度延伸,并起到沿径向轴产生维管组织的作用。
维管形成层由初始细胞(形成层初始细胞)组成,这些细胞以径向排列,形成围绕茎的连续圆柱体。形成层初始细胞分裂产生木质部、韧皮部和射线(稍后讨论)的母细胞,这些母细胞又经过几轮分裂形成形成层区,这是一个相对未分化的细胞区,每个径向细胞列的细胞数量不等。这些细胞在离开形成层区时分化成几种不同的细胞类型。
维管形成层显示两种主要分裂模式 - 垂向(垂直于茎表面)和周向(平行于茎表面)(见图 19.15B)。背斜分裂向形成层添加了更多细胞,以适应茎的不断增加的周长,并被认为表明了形成层初始细胞的位置,否则从形态上讲,形成层初始细胞与形成层区中的其他细胞难以区分。
垂向分裂的峰值通常位于靠近韧皮部的第一或第二个细胞列内,通常用于确定维管束的大致位置
4/29/22 10:22 AM
580 第 19 章
去年的
顶芽
初次生长
二次生长
前一年芽鳞留下的疤痕
垂向分裂
为形成层添加新的初始细胞
腋芽
周生分裂产生一个
初始细胞和一个木质部或韧皮部
母细胞
TZ7E 19.15
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 3-21-22
韧皮部细胞
韧皮部母细胞/
子细胞
形成层初始细胞
木质部母细胞/
子细胞
木质部细胞
图19.15 次生维管组织的发育。(A)木质茎中的初生木栓形成层在春季生长,随后进行二次生长。(B)形成层区细胞分裂面的方向保持了直径和周长增长之间的适当平衡。形成层细胞最初向后分裂,产生新的初始细胞并增加形成层的周长。相同的初始细胞也向后分裂,产生木质部和韧皮部母细胞,并始终留下另一个初始细胞。(B 源自 R. Spicer 和 A. Groover。2010 年。新植物学。186:577-592。)形成层。虽然其他分生组织只在一侧产生细胞,但参与次生生长的两个侧分生组织都是双面的,在两侧都形成新细胞。维管形成层向内产生木质部,向外产生韧皮部(见图 1.5),而正如我们在本节后面讨论的那样,木栓形成层向外产生木栓层,向内产生木栓内层。
除了韧皮部和木质部细胞外,维管形成层还产生射线细胞,这些薄壁细胞充当茎内横向运输的管道,并在冬季休眠等不利条件下储存。射线细胞可以排列成一列(单列)或多列(多列),形成一种称为射线的组织,它穿过韧皮部、形成层和木质部(见图 19.14)。
除了韧皮部和木质部细胞外,维管形成层还产生射线细胞,这些薄壁细胞充当茎内横向运输的管道,并在冬季休眠等不利条件下储存。射线细胞可以排列成一列(单列)或多列(多列),形成一种称为射线的组织,它穿过韧皮部、形成层和木质部(见图 19.14)。
第456行:
第123行: 树木面临的一个独特挑战是气候季节性,这会对树木在长期(季节性)不利或潜在致命条件下的生存构成风险,例如温带和寒带地区冬季遇到的条件。为了在冬季忍受脱水和冰冻压力,树木进入休眠期。维管形成层每年在活跃生长和休眠之间交替,形成年轮,记录树木每年的横向生长量。控制生长-休眠周期中维管形成层生长的分子机制尚不明确,但植物激素如生长素和赤霉素被认为起着主要作用。
树木面临的一个独特挑战是气候季节性,这会对树木在长期(季节性)不利或潜在致命条件下的生存构成风险,例如温带和寒带地区冬季遇到的条件。为了在冬季忍受脱水和冰冻压力,树木进入休眠期。维管形成层每年在活跃生长和休眠之间交替,形成年轮,记录树木每年的横向生长量。控制生长-休眠周期中维管形成层生长的分子机制尚不明确,但植物激素如生长素和赤霉素被认为起着主要作用。
移动转录因子预先形成维管形成层
=== 可移动的转录因子预先形成维管形成层 ===
虽然维管形成层负责木本植物的多年生生长模式,但许多草本植物也有维管形成层,尽管其形成通常是有条件的(例如,对压力的反应)或非常短暂。拟南芥虽然体型较小且为草本植物,但在several器官中表现出显着的次生生长,并且已被证明对于研究形成层发育和木材形成的分子基础非常有用。
虽然维管形成层负责木本植物的多年生生长模式,但许多草本植物也有维管形成层,尽管其形成通常是有条件的(例如,对压力的反应)或非常短暂。拟南芥虽然体型较小且为草本植物,但表现出显着的次生在许多
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 580
营养生长和器官发生:分枝和二次生长 581
器官中,并且已被证明对于研究形成层发育和木材形成的分子基础非常有用。
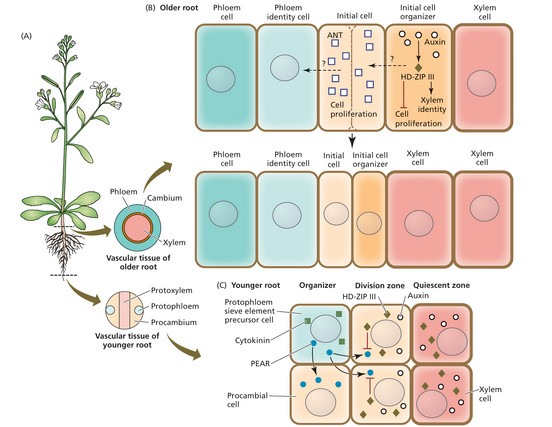
在二次发育开始之前,'''年轻的拟南芥根具有形成层的前体细胞(原形成层 procambium),位于原生韧皮部和原生木质部之间'''(图 19.16A)。产生原形成层细胞的分裂由移动的PHLOEM EARLY DOF(PEAR)蛋白——在 protophloem sieve element precursor细胞中表达的转录因子——通过细胞分裂素介导。PEAR蛋白随后移动到围绕着筛分子前体的细胞中,激活其分裂潜能,在 inner vascular cylinder中产生原形成层细胞。
[[文件:Taiz19.16.png|居中|缩略图|552x552px|(A)在幼根中,原形成层细胞将原生韧皮部和原生木质部分开,形成维管柱。在老根中,维管形成层被启动以产生新的韧皮部和木质部。 (B) 在较老的根中,生长素浓度较高的木质部细胞充当维管形成层的组织者,而 HD-ZIP III 蛋白使它们保持静止状态。未知信号从初始细胞组织者传递到相邻细胞,以指定它们为初始细胞,这些细胞表达 ANT 并分裂以在内侧产生木质部,在外侧产生韧皮部。模型中仅描绘了导致木质部产生的事件:从分裂区静止区 HD-ZIP III 双面干细胞产生韧皮部的机制未知,因此未在图中显示。 (C) 在较年轻的根中,PEAR 转录因子从具有高浓度细胞分裂素的原韧皮部筛管元素前体细胞传递到相邻细胞,其中 PEAR 促进细胞分裂,形成原形成层细胞并导致径向生长。正在发育的维管柱的更多中心细胞中生长素的高浓度和 PEAR 蛋白的存在激活了 HD-ZIP III 转录因子的转录,这些转录因子阻止了 PEAR 向相邻细胞移动,从而限制了分裂区。]]
原形成层细胞中的生长素和 class III homeodomain-leucine zipper transcription factors (HD-ZIP) 阻止了 PEAR 的进一步移动,从而形成了一个细胞分裂较少的静止区,与原生木质部相对应。因此,根尖中的原生韧皮部筛管分子前体细胞充当侧生分生组织的组织者,侧生分生组织通过平周细胞分裂产生原形成层细胞,在次生生长被激活之前预先形成径向生长。
在二次发育开始之前,年轻的
次生生长发生在根部较成熟的部分,靠近根-下胚轴连接处(见图 19.16A)。'''谱系追踪实验已确定成熟根维管形成层的初始细胞组织者是原生木质部细胞(图 19.16B)''','''而不是幼根中的原生韧皮部细胞。'''与根尖一样,'''组织者细胞是静止的,由生长素反应最大值定义'''。 HD-ZIP III 转录因子参与指定木质部身份,也负责组织者的静止,但这些转录因子的存在不足以自行建立形成层。相反,维管组织内生长素信号的局部峰值足以重新指定新的形成层组织者(见图 19.16B)。这是一个重要的特征,因为与其他分生组织中的组织者相反,形成层组织者是动态的。当木质部细胞经历程序性细胞死亡以分化为木质部导管时,先前的组织者被获得组织者身份的初始细胞取代,从而确保维管形成层的维持(参见 WEB TOPIC 19.9)。组织者在韧皮部细胞形成中的作用仍不太清楚。
拟南芥根具有形成层前体细胞(原形成层),位于原生韧皮部和原生木质部之间(图 19.16A)。产生原形成层细胞的分裂由移动的韧皮部
充当组织者的木质部细胞向相邻细胞发送移动信号(见图 19.16B,虚线箭头),使它们具有干细胞能力。所有与木质部有物理接触的细胞(木质部原形成层细胞和木质部极柱中柱细胞)都可以成为初始细胞并产生维管形成层。与木质部直接接触的要求表明,作为初始细胞发挥作用的能力取决于细胞位置和在二次分化期间从组织者接收到的信号二次发育。谱系追踪实验已证实,每个径向细胞files中的单个双面初始细胞(以转录因子AINTEGUMENTA(ANT)的表达为标志)能够分裂,交替产生韧皮部和木质部前体。
(B) 较老的根
=== 控制次生分生组织的基因网络与控制顶端分生组织的基因网络有相似之处和不同之处 ===
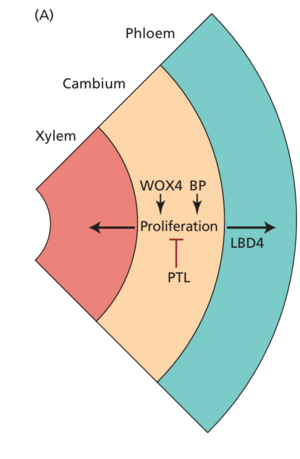
次生生长期间的生长和发育模式受与调节SAM和RAM发育的过程和基因相似的过程和基因控制(见第18章)。这种相似性有助于从分子上解析控制次生生长的机制。[[文件:Taiz19.17.png|居中|缩略图|图 19.17 利用小肽和 WOX 类转录因子之间的调节相互作用的三种不同模式化过程的比较。(A) WUS 促进 SAM 中的顶端初始。 (B) WOX5 促进 RAM 中的初始。 (C) WOX4 促进维管形成层中的初始。 |578x578像素]]正如我们在第 18 章中看到的,'''SAM 和 RAM 中原始细胞的活动都依赖于 WOXs的活动:WUSCHEL (WUS) 促进 SAM 中初始基因的活动(图 19.17A),而 WOX5 有助于 RAM 中初始基因的功能(图 19.17B)'''。'''维管形成层似乎依赖于类似的机制,即形成层的维持取决于 WOX4 的活性(图 19.17C)'''。WOX4 的激活促进原形成层和形成层细胞分裂,并且是形成层分生活动所必需的(图 19.18A)。在具有广泛次生生长的植物中,例如杨树,缺乏 WOX4 表达的植物具有较窄的形成层和减小的茎周长。与 WUS 和 WOX5 一样,WOX4 也通过小肽与受体激酶的相互作用进行调节。在这种情况下,'''受体激酶是PHLOEM INTERCALATED WITH XYLEM/TDIF RECEPTOR (PXY/TDR)(见图 19.18A),优先在原形成层和维管形成层中表达,而 CLAVATA3/胚胎周围区域相关 (Embryo Surrounding Region-Related,CLE) 肽在韧皮部中表达。'''然而,'''与顶端分生组织不同,CLE 肽的表达促进了 WOX4 活性,而不是抑制它。'''
EARLY DOF (PEAR) 蛋白 - 在细胞分裂素诱导后在原生韧皮部筛管元素前体细胞中表达的转录因子(图 19.16C)。然后,PEAR 蛋白移动到筛管分子前体周围的细胞,激活它们的分裂潜能,从而在内维管柱中产生原形成层细胞。生长素和 III 类同源域亮氨酸 身份细胞 初始细胞 增殖 初始细胞 HD-ZIP III 增殖 身份细胞 初始细胞 老根的维管组织 原生木质部 原生韧皮部 原形成层 年轻根的维管组织 (C) 年轻根 原生韧皮部 筛管分子 前体细胞 原形成层 图 19.16 根部形成层组织的发育。
初始细胞维持、增殖和分化也需要空间分离,这是通过定义发育边界的转录因子实现的。在 SAM 中,具有此功能的一类转录因子是侧器官边界 (LBD ) 家族。LBD 基因有助于在 SAM 中未分化细胞与叶原基分化组织之间建立边界。LBD 家族成员通过将形成层区与分化的次生韧皮部和木质部分开,在次生生长中发挥类似作用。pxy 突变体的一种表型是韧皮部和木质部层相互插入(即,一层韧皮部可以插入两层木质部之间,反之亦然)。 PXY 调控的基因之一是 LBD4,它也受 WOX14 和 TARGET OF MONOPTEROS6 (TMO6 ) 控制,并促进韧皮部的形成(见图 19.18A)。LBD4 在韧皮部-原形成层边界表达,可能参与定义此边界。同样,主要在韧皮部和形成层中表达的 LBD1 被发现可促进杨树中次生韧皮部的形成。
(A) 在幼根中,原形成层细胞将原生韧皮部和原生木质部分开,形成维管柱。在老根中,维管形成层被开启以产生新的韧皮部和木质部。 (B) 在较老的根中,生长素浓度较高的木质部细胞充当维管形成层的组织者,而 HD-ZIP III 蛋白使它们保持静止状态。未知信号从初始细胞组织者传递到相邻细胞,以指定它们为初始细胞,这些细胞表达 ANT 并分裂以在内侧产生木质部,在外侧产生韧皮部。模型中仅描绘了导致木质部产生的事件:从分裂区静止区 HD-ZIP III 双面干细胞产生韧皮部的机制未知,因此未在图中显示。 (C) 在较年轻的根中,PEAR 转录因子从具有高浓度细胞分裂素的原韧皮部筛管元素前体细胞传递到相邻细胞,其中 PEAR 促进细胞分裂,形成原形成层细胞并导致径向生长。正在发育的维管柱的更多中心细胞中生长素的高浓度和 PEAR 蛋白的存在激活了 HD-ZIP III 转录因子的转录,这些转录因子阻止了 PEAR 向相邻细胞移动,从而限制了分裂区。(A 和 C 源自 S. Wolf 和 J. U. Lohmann。2019 年。《自然》565:433-435;B 源自 O. Smetana 等人。2019 年。《自然》565:485-489。)
包括 WOX4、SHORTVEGETATIVE PHASE (SVP) 和 PETAL LOSS (PTL) 在内的几种转录因子在调节形成层细胞增殖和木质部分化方面具有双重功能。当形成层激活剂 WOX4 的过度表达与 PTL 形成层抑制剂的去除相结合时,产生的双突变体表现出增强的径向生长(图 19.18B)。
[[文件 :TAIZ19 .818 .png|居中|缩略图| 图 19.18 可以通过修改关键转录因子的表达来增强径向生长。 (A) WOX4 和 BP 促进形成层增殖
19_Taiz7e-Ch19.indd 581
4/29/22 10:22 AM
582 第 19 章
原形成层细胞中的拉链转录因子 (HD-ZIP) 阻止了 PEAR 的进一步移动,从而形成了一个细胞分裂较少的静止区,与原生木质部相对应。因此,根尖中的原生韧皮部筛管分子前体细胞充当侧分生组织的组织者,侧分生组织通过平周细胞分裂产生原形成层细胞,在二次生长被激活之前预先形成径向生长。二次生长发生在根部较成熟的部分,靠近根-下胚轴连接处(见图 19.16A)。谱系追踪实验已确定成熟根维管形成层的初始细胞组织者是原生木质部细胞(图 19.16B),而不是幼根中的原生韧皮部细胞。与根尖一样,组织者细胞是静止的,由生长素反应最大值定义。 HD-ZIP III 转录因子参与指定木质部身份,也负责组织者的静止,但这些转录因子的存在不足以自行建立形成层。相反,维管组织内生长素信号的局部峰值足以重新指定新的形成层组织者(见图 19.16B)。这是一个重要的特征,因为与其他分生组织中的组织者相反,形成层组织者是动态的。当木质部细胞经历程序性细胞死亡以分化为木质部导管时,先前的组织者被获得组织者身份的初始细胞取代,从而确保维管形成层的维持(参见 WEB 主题 19.9)。组织者在韧皮部细胞形成中的作用仍不太清楚。充当组织者的木质部细胞向相邻细胞发送移动信号(见图 19.16B,虚线箭头),使它们具有干细胞能力。所有与木质部有物理接触的细胞(木质部原形成层细胞和木质部极柱中柱细胞)都可以成为初始细胞并产生维管形成层。与木质部直接接触的要求表明,作为初始细胞发挥作用的能力取决于细胞位置和在二次分化期间从组织者接收到的信号二次发育。谱系追踪实验已证实,每个径向细胞files中的单个双面初始细胞(以转录因子AINTEGUMENTA(ANT)的表达为标志)能够分裂,交替产生韧皮部和木质部前体。控制次生分生组织的基因网络与控制顶端分生组织的基因网络有相似之处和不同之处。二次生长期间的生长和发育模式受与调节SAM和RAM发育的过程和基因相似的过程和基因控制(见第18章)。这种相似性有助于从分子上解析控制二次生长的机制。正如我们在第 18 章中看到的,SAM 和 RAM 中初始基因的活动都依赖于 WOX 的活动:WUSCHEL (WUS) 促进 SAM 中初始基因的活动(图 19.17A),而 WOX5 有助于 RAM 中初始基因的功能(图 19.17B)。维管形成层似乎依赖于类似的机制,即形成层的维持取决于 WOX4 的活性(图 19.17C)。WOX4 的激活促进原形成层和形成层细胞分裂,并且是形成层分生活动所必需的(图 19.18A)。在具有广泛次生生长的植物中,例如杨树,缺乏 WOX4 表达的植物具有较窄的形成层和减小的茎周长。与 WUS 和 WOX5 一样,WOX4 也通过小肽与受体激酶的相互作用进行调节。在这种情况下,受体激酶与木质部/TDIF 受体 (PXY/TDR) 插入韧皮部(见图 19.18A),优先在原形成层和维管形成层中表达,而 CLAVA TA3/胚胎周围区域相关 (CLE) 肽在韧皮部中表达。然而,与顶端分生组织不同,CLE 肽的表达促进了 WOX4 活性,而不是抑制它。初始细胞维持、增殖和分化也需要空间分离,这是通过定义发育边界的转录因子实现的。在 SAM 中,具有此功能的一类转录因子是侧器官边界 (LBD) 家族。LBD 基因有助于在 SAM 中未分化细胞与叶原基分化组织之间建立边界。LBD 家族成员通过将形成层区与分化的次生韧皮部和木质部分开,在次生生长中发挥类似作用。pxy 突变体的一种表型是韧皮部和木质部层相互插入(即,一层韧皮部可以插入两层木质部之间,反之亦然)。 PXY 调控的基因之一是 LBD4,它也受 WOX14 和 TARGET OF MONOPTEROS
6 (TMO6) 控制,并促进韧皮部的形成(见图 19.18A)。LBD4 在韧皮部-原形成层边界表达,可能参与定义此边界。同样,主要在韧皮部和形成层中表达的 LBD1 被发现可促进杨树中次生韧皮部的形成。
包括 WOX4、SHORT
VEGETATIVE PHASE (SVP) 和 PETAL LOSS (PTL) 在内的几种转录因子在调节形成层细胞增殖和木质部分化方面具有双重功能。当形成层激活剂 WOX4 的过度表达与 PTL 形成层抑制剂的去除相结合时,产生的双突变体表现出增强的径向生长(图 19.18B)。
尽管顶端分生组织和形成层分生组织之间存在广泛的相似性,但也存在显着差异。
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 582
营养生长和器官发生:分枝和二次生长 583
(A) 茎尖分生组织 (SAM)
中心区
初始细胞
外围
组织
初始细胞
初始细胞
(B) 根尖分生组织 (RAM)
中心 (QC)
静止中心细胞
(C) 原形成层/形成层
原形成层
初始细胞
小柱干细胞
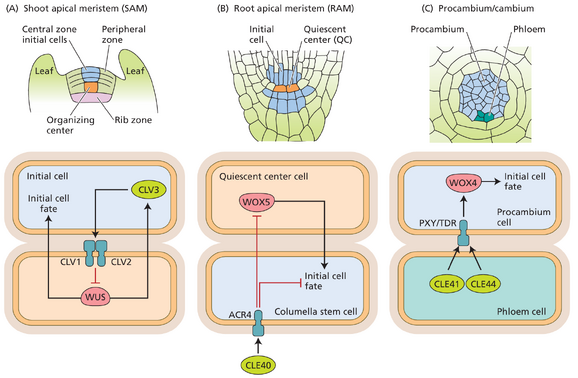
图 19.17 利用小肽和 WOX 类转录因子之间的调节相互作用的三种不同模式化过程的比较。(A) WUS 促进 SAM 中的顶端初始。 (B) WOX5 促进 RAM 中的初始。 (C) WOX4 促进维管形成层中的初始。 (根据 S. Miyashima 等人 2013 年。EMBO J. 32:178–193。)
TZ7E 19.17
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-12-22
增殖
CLE41 CLE44
初始细胞
原形成层
韧皮部细胞
WOX4-OE/ptl
来自 J. Zhang 等人 2019 年。
Nat. Plants 5:1033–1042
图 19.18 可以通过修改关键转录因子的表达来增强径向生长。 (A) WOX4 和 BP 促进形成层增殖
和木材生产,这种刺激在 PETAL LOSS (PTL) 发生突变的植物中可以进一步增强,PTL 编码一种 MYB 样转录因子
和木材生产,这种刺激在 PETAL LOSS (PTL) 发生突变的植物中可以进一步增强,PTL 编码一种 MYB 样转录因子
第560行:
第146行: ,可作为径向生长的负调节剂。LBD4 有利于韧皮部的形成。
,可作为径向生长的负调节剂。LBD4 有利于韧皮部的形成。
(B) 钌野生型 (WT) 植物和在野生型 (WOX4-OE) 和 ptl (WOX4-OE/ptl) 背景中过表达 WOX4 的植物的红染拟南芥根部横截面。在此发育阶段,表皮和皮层已被周皮和次生维管组织取代。请注意 WOX4-OE/ptl 根部的径向生长要大得多。19_Taiz7e-Ch19.indd 5834/4/29/22 10:22 AM584 第 19 章例如,两个激酶受体家族 PXY 和 ERECTA 在遗传上相互作用以指导次生维管发育。然而,这两个基因家族之间的相互作用在茎和下胚轴中的连接方式不同,导致每个器官的表型不同。几种植物激素调节维管形成层活动和次生木质部和韧皮部的分化。与植物中的许多其他过程一样,激素在调节次生生长方面发挥着重要作用。几种激素为不同细胞类型和组织的生长和分化提供位置提示和信号(图 19.19)。这里我们重点关注四种激素,因为大量的实验证据支持它们在调节次生生长中的作用。虽然树木中的生长素运动尚未得到广泛研究,但据推测生长素是在叶子和顶端分生组织中产生的,并通过极性生长素运输到茎和维管
(B) 钌野生型 (WT) 植物和在野生型 (WOX4-OE) 和 ptl (WOX4-OE/ptl) 背景中过表达 WOX4 的植物的红染拟南芥根部横截面。在此发育阶段,表皮和皮层已被周皮和次生维管组织取代。请注意 WOX4-OE/ptl 根部的径向生长要大得多。19_Taiz7e-Ch19.indd 5834/4/29/22 10:22 AM584
血管干细胞初始
干细胞起始/分化
血管干细胞
原形成层/形成层
细胞增殖
维持
细胞命运决定
韧皮部前体
赤霉素
木质部前体
细胞分化
细胞分化
图 19.19 激素参与调节次生维管组织发育的关键阶段。蛋白质 ARABI
DOPSIS 组氨酸磷酸转移蛋白 6 (AHP6) 充当细胞分裂素信号抑制剂,限制细胞分裂素活性域,从而允许原生木质部以空间特定的方式分化。
形成层。在被子植物和裸子植物的维管形成层和分化木质部和韧皮部中,都测量了生长素浓度。
与最近确定的指定拟南芥形成层组织者的生长素反应最大值类似,树木中的生长素浓度峰值出现在形成层的木质部表面,并朝着分化木质部和韧皮部的方向降低。朝向韧皮部的下降幅度更大,而朝向木质部的下降幅度则要平缓得多。这种跨越形成层带的生长素浓度梯度导致人们推测,生长素在木质部和韧皮部分化中的作用是基于径向形态发生素梯度的。
外源处理也支持了生长素的关键作用,表明在断头树中施用生长素会诱导形成层的重新激活,因为断头树的维管形成层已经失去活性。
最近,直接操纵转基因杨树中生长素的反应表明,生长素敏感性对于形成层的周缘分裂和背斜分裂都至关重要,并影响木质部细胞的生长和分化。
赤霉素在二次生长中也发挥着重要而独特的作用。与生长素一样,生物活性赤霉素在木材形成区表现出浓度梯度,但与生长素不同的是,峰值向发育中的木质部移动。用赤霉素对缺乏生长素的断头幼苗进行外源处理可激活形成层细胞分裂。然而,分裂细胞失去了其典型形状,无法分化成木质部。同时施用生长素和赤霉素可防止在单独使用赤霉素处理时观察到的异常,并刺激形成层分裂,其程度是单独使用赤霉素或生长素处理时未观察到的,这表明两种激素具有协同作用(见图 19.19)。 赤霉素生物合成途径中几种基因的代谢谱和表达表明,木材形成组织中的赤霉素代谢还涉及赤霉素前体从韧皮部横向通过射线运输到分化木质部,然后在那里转化为生物活性形式。外源处理和转基因操作均表明赤霉素对纤维细胞的伸长有积极影响,纤维细胞在植物中具有结构功能,具有厚的细胞壁和高的长径比(见第 1 章)。这表明赤霉素在木质部细胞分化和生长中起着作用。细胞分裂素也与调节二次生长有关(见图 19.19)。转基因杨树形成层区细胞分裂素浓度的特定降低导致
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 584
营养生长和器官发生:分枝和二次生长 585
严重损害了凸轮的径向生长和细胞分裂形成层。该结果与细胞分裂素浓度在形成层的韧皮部侧达到峰值以及编码细胞分裂素受体和参与细胞分裂素信号传导的主要反应调节剂的基因在形成层区的表达有关。这表明细胞分裂素是形成层细胞增殖的重要调节剂。乙烯是另一种激素,它被强烈地暗示为次生生长的调节剂。发现乙烯前体 1-氨基环丙烷-1-羧酸 (ACC) 的浓度在形成层区很高,但与生长素和赤霉素不同,没有检测到梯度。乙烯处理和 ACC 喂养实验表明乙烯是形成层活动、径向生长和次生木质部形成的正调节剂。这些结果也与
(A) 周皮发育
木栓层
内皮层
中柱鞘/
图 19.20 拟南芥根部周皮的形成。
(A) 木栓形成层是一种双面分生组织,在外部产生木栓层,在内部产生木栓层。周皮由中柱鞘(维管柱(中柱)的外层)形成。在第 2 阶段,内皮层经历程序性细胞死亡,在第 4 阶段消失。皮层和表皮在第 3/4 阶段脱落,而组织仍然活着。
第 5 阶段由完整的木栓化细胞环定义,而第 6 阶段的周皮已完全形成,没有任何表皮
19_Taiz7e-Ch19.indd 585
转基因操作乙烯生物合成和杨树中的
作用。乙烯在张力木的形成中起着重要作用,张力木是被子植物中一种特殊的反应木,在茎弯曲或倾斜引起的组织中形成(参见 WEB
主题 19.7)。乙烯生物合成和信号基因的表达在张力木形成区均升高,对乙烯不敏感的转基因杨树无法产生张力木。
木栓形成层产生称为周皮的外层木栓层
大多数木本真双子叶植物和裸子植物都会形成一种称为木栓形成层的次生形成层,从而产生周皮。周皮在次生生长过程中取代了表皮的保护功能。
周皮由木栓形成层、木栓层和木栓内皮组成(图 19.20A)。木栓层或木栓、
内皮层
来自单个中柱鞘细胞的细胞区
来自 O. Smetana 等人,2019 年。《自然》565:485–489
或皮层细胞。(B)根横截面示意图突出显示了初始中柱鞘细胞,随后在下面的显微照片中进行了谱系追踪。谱系追踪实验表明,
任何中柱鞘细胞都可以形成木栓形成层。在这种情况下,木栓层
包含来自单个中柱鞘细胞(上图中的橙色)的细胞区(蓝色)。黄色虚线标记形成层,而初生韧皮部和初生木质部分别用黄色和绿色标记。(根据 A. Campilho 等人 2020 年。Curr. Opin. Plant Biol. 53: 10–14。)
4/29/22 10:22 AM
586 第 19 章
是具有木栓化壁的死细胞的多层保护组织,由木栓形成层向外形成。木栓层是向内形成的活薄壁组织。
木栓形成层产生的木栓量因树种而异,栓皮栎 (Quercus suber) 代表了一个极端的例子,它包含一个永久的木栓形成层,可以无限期地产生软木或木栓。由此产生的厚厚的软木层可能保护栓皮栎的主干免于在炎热干燥的地中海气候中脱水。它也是一种极好的绝缘体,密度低,渗透性好,用于建筑、服装和葡萄酒保存。软木塞可防止葡萄酒污染,并允许少量氧气渗透,刚好足以保持葡萄酒的发酵,同时避免氧化。周皮还可以防止病原体渗透,方法是简单地用额外的层加厚表面屏障,或通过增加栓化作用(如凯氏带的情况;见第 4 章)或其他活性代谢物的含量。虽然周皮在枝条中直接起源于表皮下,但在根中,它的起源更深,来自中柱鞘,中柱鞘被三个同心组织层(内皮层、皮层和表皮层)包围。通过谱系追踪实验,可以确认所有中柱鞘细胞都对木栓形成层谱系有贡献(图 19.20B),这意味着木质部极中柱鞘细胞既是维管形成层又是木栓形成层的初始细胞。木质部极中柱鞘细胞的可塑性非常显著,因为除了对两种次生分生组织有贡献外,它们还在植物组织培养中产生再生愈伤组织,并在某些物种中产生侧根(尽管侧根有时可以从其他中柱鞘细胞衍生)。当根部木质部极中柱鞘细胞平周分裂,层数呈放射状增加时,内皮细胞开始变平(见图 19.20A,第 1 阶段)。在韧皮部极中柱鞘侧,内皮细胞在第 2 阶段启动程序性细胞死亡,然后随着新分生组织的进展逐渐死亡。在内皮层已经消失且存在木栓化(分化)木栓的区域,皮层和表皮细胞开始脱落,可能是通过脱落,因为这些细胞仍然活着(第 3 和第 4 阶段),导致以前的保护层逐渐消失。第 5 阶段最终形成完整的分化木栓层,表皮完全消失,而任何剩余的皮层和内皮层在第 6 阶段被消除。有趣的是,侧根的出现也涉及程序性细胞死亡和脱落的结合(见第 18 章)。现在正在揭示周皮形成背后的调控网络,这将表明分子机制是否也得到了保留。
树皮具有多种保护和储存功能
树木的外部保护层通常被称为树皮。这个术语经常被错误地单独用于周皮,实际上包括维管形成层以外的所有组织,包括功能性次生韧皮部、破碎的非功能性次生韧皮部、破碎的初生韧皮部和周皮。因此,树皮起源于两种不同的分生组织,即木栓形成层和维管形成层。树皮往往很容易从树上剥落,因为维管形成层及其分裂细胞层比两侧的次生组织脆弱得多。尽管这种组织阵列对于保护韧皮部和保护木本植物免受生物和非生物威胁非常重要,但树皮的组成和控制其形成的遗传途径尚不明确,主要是因为不同物种之间的树皮高度多样化。例如,在某些树木中,如橡树,树皮厚而有裂纹,而在其他树木中,如樱桃树和桦树,树皮则光滑。树皮也可能有不同的颜色,即使是在密切相关的树种之间也是如此。树皮所含的次生代谢物的种类和数量也各不相同。虽然植物产生这些物质是为了防御机制,但人类也发现它们很有用。树皮衍生药物的经典例子是防腐和抗炎水杨酸(来自柳树)、抗疟药奎宁(来自金鸡纳树)和化疗药物紫杉醇(来自太平洋红豆杉)。最近的一项研究分析了桦木科不同物种树皮中的基因表达和代谢物,发现桦木醇(造成白桦树呈白色的三萜)在该科的其他物种(如黑桤木)中含量要少得多。该研究还强调了木栓层在产生植物防御的次生代谢产物方面的重要性,因为许多相关的代谢途径都在这种组织的形成中发挥作用。树皮还可以作为储存器官。生长季节性对多年生植物在养分利用、储存和循环利用方面提出了重大挑战。
尽管所有植物物种在生长季节都有循环、储存和重新动员养分的机制,但氮(最丰富的常量营养素)的季节性循环是多年生生命习性的标志。
例如,衰老叶片中的氮以树皮储存蛋白(BSP)的形式储存在韧皮部薄壁组织(内皮)的小液泡中。这些蛋白质在秋季初合成,但在春季随着生长重新开始而迅速动员。
树皮覆盖的嫩芽
可以在森林火灾后发芽
在第 19.2 节中,我们区分了分枝根(在中柱鞘内部出现)和分枝芽(从腋生的外部芽出现)
4/29/22 10:22 AM
19_Taiz7e-Ch19.indd 586
营养生长和器官发生:分枝和二次生长 587
© John O’Neill/Wikimedia/GFDL-1.2
来自 S. Fink。1983. Am. J. Bot. 70: 532–542
图 19.21 嫩枝和芽。 (A) 2003 年澳大利亚维多利亚东部高山丛林大火发生 2 年后桉树。 (B) 椴树的萌芽,覆盖
TZ7E 19.21
植物形态的多样性很大程度上来自于它们在一生中能够产生和塑造新器官(如分枝或侧根)的能力。这些器官是由分生组织产生的,分生组织的建立和维持方式与第 18 章中看到的与初级发育相关的方式相似。产生新器官的触发需要通过移动信号的作用整合环境和内部信号,其方式与塑造细胞类型、组织结构的机制相当细胞结构、器官形状和初生发育过程中的生长素。特定的信号通路在进化过程中也被反复改变,以控制发育的不同方面。例如,根、芽和维管形成层中的分生组织都使用类似的受体激酶-WOX反馈环来调节初始细胞数量和位置,而生长素激素则形成血管结构、定位侧器官和调节分枝生长等许多其他功能。总的来说,这种移动信号分子与叶子的整合。然而,有些类型的分枝可以从位于树干树皮下的表生芽内部产生。这些被称为表生枝,来自希腊语,意为“在树干上”。在老树的树干和树桩上,长出嫩枝和“茎芽”(没有顶芽时产生的侧芽),这种现象在被子植物和针叶树中很普遍,在塑造树木结构方面发挥着重要作用。对于适应易发生火灾的生态系统的树木来说尤其如此,例如生长在澳大利亚草原和森林中的桉树。桉树有能力在严重烧伤后长出大量嫩芽(图 19.21A)。与腋芽不同,嫩芽通常能在火灾中存活下来,因为它们被树的厚厚的树皮层与高温隔绝(图 19.21B)。外生枝可由两种外生芽产生:预防芽,即在二次生长期间保持休眠状态并被树皮覆盖的腋芽;不定芽,即从成熟茎组织或伤口处的愈伤组织中新生的芽。后者的一个例子是红木树瘤,它在树干地上部分因受伤而形成。相反,在树根处形成的红木树瘤是由大簇腋芽产生的,这些腋芽开始在子叶腋中形成,然后蔓延到上方的叶腋。这会引起肿胀和二次生长,从而形成基节。这些基节充满了预防外生芽簇,它们可以在火灾后或主干被砍伐后再生出新树。
保守的局部信号通路使植物能够做出分散的发育决策,并根据不断变化的环境快速调整其发育,同时保持强健的器官形状和组织模式。
19.1 枝条分枝和结构
■ 在种子植物中,枝条结构基于称为植物单体的重复单元,由节间、
节、叶和腋芽组成(图 19.1)。
■ 有强有力的实验证据表明,来自枝尖的生长素和来自根部的独脚金内酯保持顶端优势(图 19.3–19.5)。
■ 细胞分裂素打破顶端优势并促进腋芽优势(图 19.5)。
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
19_Taiz7e-Ch19.indd 587
■ 环境信号可以覆盖默认激素
信号来塑造植物结构。例如,
植物的氮状态会改变分枝。
(续)
4/29/22 10:22 AM
588 第 19 章
摘要(续)
19.2
根分枝和结构
■ 有两种类型的胚后根:侧根或分枝根从现有根中产生,以及
不定根从非根组织中产生。
■ 侧根原基从木质部极中柱鞘细胞中产生(图 19.8、19.9)。
■ 振荡区内的生长素时钟使木质部极柱中柱细胞成为侧根创始细胞(图 19.10)。
■ 根据分枝模式和重力设定点角度,芽系统和根系统表现出不同的结构,这些结构因物种和环境而异。
■ 单子叶植物根系主要由种子根和冠根组成,而真双子叶植物根系主要来自主根(主根)(图 19.11、19.12)。
■ 重力设定点角度是植物结构的基础,由 IGT 转录因子控制(图 19.13)。
■ 根系结构对水环境中的异质性高度敏感。
■ 根系之间的菌根关系无处不在,涉及沿源-库梯度的营养运输。 19.3 次生生长
■ 宽度的增长由维管形成层和木栓形成层完成,它们是次生双面分生组织,分别产生次生维管组织和周皮(图 19.14、19.15)。
■ 移动转录因子建立了维管形成层的前模式(图 19.16)。
网状材料
■ 原韧皮部筛管分子前体细胞是根尖内侧分生组织的组织者,可产生原韧皮部通过周细胞分裂形成形成层细胞,从而预先形成次生生长(图 19.16)。
■ 在更成熟的根中,形成层初始细胞组织者具有木质部身份,其特征是静止和生长素最大值(图 19.16)。
■ 任何靠近木质部的细胞类型都可以成为形成层初始细胞,而周皮起源于中柱鞘(图 19.16、19.20)。
■ WOX 转录因子和小肽信号模块在多种情况下用于促进 SAM 和 RAM 中的初始细胞身份,以及维管形成层的维持(图 19.17)。
■ 可以通过改变几个关键转录因子的表达来操纵径向生长和木材形成(图 19.18)。
■ 生长素、赤霉素、细胞分裂素和乙烯调节
维管形成层活动和
次生维管组织的分化(图 19.19)。
■ 周皮由中柱鞘产生。在此过程中,
内皮层经历 PCD,皮层和
表皮断裂(图 19.20)。
■ 森林火灾后,通过激活长期休眠的表生芽,树木结构可以再生(图 19.21)。
■ 维管形成层活动对刺激(例如重力、重量)敏感,最终影响木材特性。
■ 网络主题 19.1 植物结构、作物产量和环境可持续性 绿色革命的主要遗传基础是谷物作物的半矮化突变,这种突变改变了枝条结构,这要么是由于赤霉素激素浓度降低,要么是由于信号传导。
■ 网络主题 19.2 二分枝 维管植物中最早的分枝类型是二分枝,这是早期维管植物和一些现代被子植物的特征。
■ 网络主题 19.3 生长素调节分枝模型。描述生长素通量、PIN 蛋白浓度和侧芽激活之间关系的模型可以解释实验观察结果。
■ 网络主题 19.4 根系表型分析的进展 现代根系图像捕获方法包括二维 (2D) 和三维 (3D) 成像技术。
■ 网络主题 19.5 用于前分支位点间距的生长素时钟模型 根据生长素时钟模型,迁移通过根振荡区的细胞会暴露于波动的生长素活性或生长素浓度水平。
■ 网络主题 19.6 二次生长的进化 从化石记录来看,二次生长在许多谱系中独立出现过几次,早于现代种子植物。
■ 网络主题 19.7 反应木 树木可以形成一种称为“反应木”的特殊木材,以应对重力或水分胁迫。
■ WEB 主题 19.8 藤本植物的二次生长
藤本植物中出现了各种二次生长模式,以适应攀爬高大的树木。
■ WEB 主题 19.9 根维管形成层的组织者 根尖附近的组织者细胞促进附近细胞的细胞分裂。在这种情况下,组织者是木质部细胞,它们诱导邻近的初始细胞向根内部和外围产生木质部子细胞。
有关更多学习辅助,请访问 oup.com/he/taiz7e。
2022 年 4 月 29 日上午 10:22
19_Taiz7e-Ch19.indd 588
营养生长和器官发生:分枝和二次生长 589
推荐阅读
Aloni,R.(2021 年)维管分化和植物激素。
施普林格自然,瑞士。
阿隆索-塞拉,J.,石,X.,波塞尔,A.,拉斯塔斯,P.,布尔登,M.,
Immanen, J.、Takahashi, J.、Koivula, H.、Eswaran, G.、Muranen,
S.,Help,H.,Smolander,O.-P.,Su,C.,Safronov,O.,Gerber,L.,
Salojärvi, J.、Hagqvist, R.、Mähönen, A. P.、Helariutta, Y. 和
Nieminen, K. (2020) 垂直方向需要 ELIMÄKI Locus
白桦树的本体感受反应。电流。生物。 30:589-599。
Bao, Y., Aggarwal, P., Robbins, N. E., Sturrock, C. J., Thompson,
M. C., Tan, H. Q., Tham, C., Duan, L., Rodriguez, P. L., Vernoux,
T., Mooney, S. J., Bennett, M. J., 和 Dinneny, J. R. (2014) 植物根系使用一种模式化机制将侧根分支定位到可用水源。美国国家科学院院刊 111:
9319–9324。
Barlow, P. W. (1994) 植物顶端分生组织中结构初始细胞的进化。理论生物学杂志 169: 163–177。
Campilho, A.、Nieminen, K. 和 Ragni, L. (2020) 周皮的发育:植物与其环境之间的最后边界。Curr. Opin. Plant Biol. Growth Dev. 53: 10–14。
Chery, J. G.、Pace, M. R.、Acevedo-Rodríguez, P.、Specht, C. D. 和 Rothfels, C. J. (2020) 植物早期发育过程中的变异促进了自然界最复杂木材的进化。Curr. Biol. 30: 237–244。
迪曼布罗,R.,德鲁沃,M.,帕西菲奇,E.,萨尔维,E.,索扎尼,R.,
Benfey, P. N.、Busch, W.、Novak, O.、Ljung, K.、Di Paola, L.、
Marée, A. F. M.、Costantino, P.、Grieneeisen, V. A. 和 Sabatini,
S. (2017) 生长素最小值触发发育开关
从细胞分裂到细胞拟南芥根中的分化。
程序国家学院科学。美国 114:E7641–E7649。
Hirakawa, Y., Kondo, Y., 和 Fukuda, H. (2010) TDIF 肽
信号通过调节血管初始细胞增殖
拟南芥中的 WOX4 同源框基因。植物细胞
22:2618–2629。
Miyashima, S.、Roszak, P.、Sevilem, I.、Toyokura, K.、Blob, B.、
Heo, J.、Mellor, N.、Help-Rinta-Rahko, H.、Otero, S.、Smet, W.、
Boekschoten, M., Hooiveld, G., Hashimoto, K., Smetana, O.,
Siligato, R.、Wallner, E.-C.、Mähönen, A. P.、Kondo, Y.、Melnyk,
19_Taiz7e-Ch19.indd 589
J. W.、Greb, T.、Nakajima, K.、Sozzani, R.、Bishop, A.、
De Rybel, B. 和 Helariutta, Y. (2019) Mobile PEAR
转录因子整合位置线索到启动子
形成层生长。自然 565: 490–494。
Prusinkiewicz, P.、Crawford, S.、Smith, R. S.、Ljung, K.、Bennett,
T., Ongaro, V., 和 Leyser, O. (2009) 芽激活的控制
通过生长素运输开关。程序国家学院科学。美国 106:
17431–17436。
Risopatron, J. P. M., Sun, Y., 和 Jones, B. J. (2012) 血管
形成层:细胞结构的分子控制。原生质
247: 145–161。
斯美塔那,O.、马基拉,R.、刘,M.、阿米尤塞菲,A.、桑切斯
Rodriguez, F.、Wu, M.-F.、Solé-Gil, A.、Leal Gavarrón, M.、
Siligato, R.、Miyashima, S.、Roszak, P.、Blomster, T.、Reed,
J. W.、Broholm、S. 和 Mähönen、A. P. (2019) 高水平的
生长素信号传导定义血管的干细胞组织者
形成层。自然 565:485-489。
Uga, Y., Sugimoto, K., Ogawa, S., Rane, J., Ishitani, M., Hara, N.,
Kitomi, Y., Inukai, Y., Ono, K., Kanno, N., Inoue, H., Takehisa,
H.、Motoyama、R.、Nagamura、Y.、Wu、J.、Matsumoto、T.、Takai、
T., Okuno, K., 和 Yano, M. (2013) 根系控制
DEEPER ROOTING 1 的建筑提高了水稻产量
在干旱条件下。纳特。基因。 45:1097–102。
Verna, J.、Ravichandran, S. J.、Sawchuk, M. G.、Linh, N. M. 和
Scarpella, E. (2019) 生长素对组织细胞极性的协调
传输和信号。埃莱夫 8:51061。
吴凯、王胜、宋伟、张建、王燕、刘倩、余建、叶
Y.、李胜、陈建、赵燕、王建、吴晓玲、王明、张
Y.、Liu, B.、Wu, Y.、Harberd, N. P. 和 Fu, X. (2020) 增强版
通过氮响应实现可持续绿色革命产量
水稻染色质的调节。科学 367:eaaz2046。
Zhang, J.、Eswaran, G.、Alonso-Serra, J.、Kucukoglu, M.、Xiang, J.、
Yang , W. , Elo , A. , Nieminen , K. , Damén , T. , Joung , J.-G. , Yun , J.
Y.、Lee, J.-H.、Ragni, L.、Barbier de Reuille, P.、Ahnert, S. E.、Lee,
J.-Y.、Mähönen、A. P. 和 Helariutta、Y. (2019) 转录
维管形成层发育的调控框架
拟南芥的根。纳特。植物 5:1033–1042。
22 年 4 月 29 日上午 10:22
19_Taiz7e-Ch19.indd 590
22 年 4 月 29 日上午 10:22
开花控制
和花卉发育
大多数人都期待着春天的到来和
它带来了繁茂的花朵。许多度假者小心翼翼
安排旅行时间以配合特定的花开季节
儿子:南加州的 Blossom Trail 沿途的柑橘,
荷兰。在华盛顿特区和日本各地,樱花
用热烈的仪式迎接花朵。随着春天
进入夏季,夏季进入秋季,秋季进入冬季,
野花在指定的时间绽放。开花于
正确的时间对于生殖健康至关重要
植物;异花授粉的植物必须同步开花
与其他同类个体以及花粉
在一年中最适合结籽的季节进行。
尽管开花和季节之间存在很强的相关性
是众所周知的,这一现象构成了根本
我们在本章中讨论的问题:
● 植物如何追踪一年四季的变化
以及一天中的时间?
● 哪些环境信号影响开花,以及如何影响
这些信号能被感知到吗?
● 环境信号如何传递以引起
与开花相关的发育变化?
在第 19 章中,我们讨论了根和芽顶端的作用
分生组织在营养生长和发育中。转型
开花涉及形态发生模式的重大变化
以及茎尖分生组织的细胞分化。最终,作为
我们将会看到,这个过程导致了花卉的产生
器官——萼片、花瓣、雄蕊和心皮。
20.1 花卉召唤:整合
环境线索
工厂生产过程中一个特别重要的发展决策
生命周期就是何时开花。茎尖
分生组织致力于形成花,被称为花
招魂。推迟开花的承诺将增加
可供调动的碳水化合物储备,
使更多、条件更好的种子成熟。拖延
然而,开花也可能增加
植物将被吃掉、因非生物胁迫而死亡或在竞争中被淘汰
shankz/快门stock
20_Taiz7e-Ch20.indd 591
4/29/22 10:24 AM
592 第 20 章
在繁殖之前,它必须先被其他植物所利用。反映这一点,植物已经进化出一系列非凡的生殖适应性——例如,一年生和多年生的生命周期。
一年生植物,如千里光 (Senecio vulgaris) ,可能在发芽后几周内开花。但树木可能要生长 20 年或更长时间才能开始开花。在整个植物界,不同物种的开花年龄范围很广,这表明植物的年龄,或者可能是大小,是控制转向生殖发育的内部因素。
开花严格响应内部发育因素而独立于任何特定环境条件的情况被称为自主调节。对于为了开花而绝对需要一组特定环境线索的物种,开花被认为是一种强制性或定性反应。如果开花是由某些环境线索促进的,但最终会在没有此类线索的情况下发生,则开花反应是兼性或定量的。具有兼性开花反应的物种,如拟南芥,依赖环境和自主信号来促进生殖生长。
光周期和春化是季节性反应的两个最重要的机制。
光周期(见第 16 章)是对白天或夜晚长度的反应;春化是通过长时间的低温促进开花。其他信号,如光质、环境温度和非生物胁迫,也是植物发育的重要外部线索。内部(自主)和外部(环境感应)控制系统的进化使植物能够精确调节开花,使其在最佳时间开花,以实现繁殖成功。例如,在特定物种的许多种群中,开花是同步的,这有利于异花授粉。响应环境线索而开花也有助于确保种子在有利条件下产生,特别是在水和温度方面。然而,这使得植物特别容易受到全球变暖等快速气候变化的影响,这可能会改变控制开花时间的调节网络(参见网络主题 20.1)。
20.2 茎尖和阶段变化
所有多细胞生物都会经历一系列或多或少明确的发育阶段,每个阶段都有其特征。在人类中,婴儿期、儿童期、青少年期和成年期代表了四个一般的发展阶段,青春期是非生殖期和生殖期的分界线。同样,植物也会经历不同的发育阶段。然而,与动物不同,植物不断从茎尖分生组织产生新器官。这种能力使植物能够通过控制相变的时间来使其发育与不断变化的环境同步。此外,植物必须整合来自环境的信息以及自主信号,以最大限度地提高其生殖适应性。本节描述了控制这些决策的主要途径。植物经历三个发育阶段
植物的胚后发育可分为三个阶段:
1. 幼年期
2. 成年营养期
3. 成年生殖期
从一个阶段到另一个阶段的过渡称为阶段
幼年期和成年营养期的主要区别在于后者具有形成生殖结构的能力:被子植物的花,裸子植物的球果。然而,开花代表成年期生殖能力的表达,通常取决于特定的环境和发育信号。因此,开花本身的缺失并不是幼年期的可靠指标。
从幼体到成体的转变经常伴随着营养特征的变化,例如叶形态、叶序(叶在茎上的排列)、多刺性、生根能力和落叶植物(如英国常春藤)的叶片保留(图 20.1;另见网络主题 20.2)。
这种变化在木本多年生植物中最为明显,但在许多草本植物中也很明显。
与从成年营养阶段到生殖阶段的突然转变不同,从幼体到成年营养阶段的转变通常是渐进的,涉及中间形式。
幼体组织首先产生,位于枝条的基部。
三个发育阶段的时间顺序导致沿枝条轴的幼体空间梯度。由于高度的生长受限于顶端分生组织,最先形成的幼年组织和器官位于在枝条基部。在快速开花的草本植物中,幼年期可能仅持续几天,并且产生的幼年结构很少。相比之下,木本植物的幼年期更长,在某些情况下可持续 30 至 40 年(表 20.1)。在这些情况下,幼年结构可以占成熟植物的很大一部分。一旦分生组织转换到成年期,就只产生成年营养结构,最终开花。成株和生殖期
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 592
开花和花卉发育的控制 593
卵形成株叶
裂片幼叶
由 L. Rignanese 提供
图 20.1 英国常春藤 (Hedera helix) 的幼株和成株。 幼株具有裂片掌状叶,交替排列,攀爬生长习性,无花。
成株具有整个卵形叶,排列成螺旋状,直立生长习性,花发育成果实。 因此位于枝条的上部和外围区域。
在确定向成株阶段的过渡时,获得足够大的尺寸似乎比植物的实际年龄更重要。阻碍生长的条件,例如矿物质缺乏、弱光、
TZ7E 20.01
表 20.1 一些木本植物的幼年期长度
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
玫瑰 (Rosa [杂交茶])
葡萄 (Vitis spp.)
苹果 (Malus spp.)
柑橘属
英国常春藤 (Hedera helix)
红杉 (Sequoia sempervirens)
幼年期
20–30 天
5–10 年
5–15 年
梧桐 (Acer pseudoplatanus) 15–20 年
英国橡树 (Quercus robur)
欧洲山毛榉 (Fagus sylvatica)
25–30 年
30–40 年
来源:J. R. Clark 著。1983 年。J. Arboriculture 9:201–205
20_Taiz7e-Ch20.indd 593
水分胁迫、落叶和低温往往会延长幼年期,甚至导致成年枝条恢复到幼年期。相反,促进旺盛生长的条件会加速向成年期的过渡。当生长加速时,接受正确的花诱导处理可导致开花。
虽然植物大小似乎是最重要的因素,但并不总是清楚与大小相关的哪个特定成分是关键的。在某些烟草属物种中,似乎植物必须产生一定数量的叶子才能将足够量的花刺激传递到顶端。
一旦达到成株期,它就会相对稳定,并在无性繁殖或嫁接期间保持。例如,从成熟英国常春藤植物的基部区域采集的插枝会发育成幼株,而从尖端采集的插枝会发育成成年植物。当从开花的银桦树 (Betula verrucosa) 的基部采集接穗并将其嫁接到幼苗砧木上时,前两年嫁接枝上没有花。相反,从成熟树的顶部取下的嫁接枝则自由开花。
“幼年期”一词对草本和木本物种有不同的含义。幼年草本分生组织嫁接到开花成年植物上时很容易开花(参见 WEB 主题 20.3),而幼年木本分生组织通常不会开花。因此,幼年木本分生组织被认为缺乏开花能力(参见 WEB 主题 20.4)。
阶段变化可能受到营养物质、赤霉素和其他信号的影响
茎尖从幼年期到成年期的过渡可能受到来自植物其余部分的可传递因素的影响。在许多植物中,暴露在低光照条件下会延长幼年期或导致幼年期的逆转。低光照条件的一个主要后果是减少顶端碳水化合物的供应;因此,碳水化合物供应,特别是蔗糖,可能在幼年期和成熟期之间的过渡中发挥作用。碳水化合物供应作为能量和原材料的来源,会影响顶端的大小。例如,在花店菊花 (Chrysanthemum morifolium) 中,花原基直到达到最小顶端尺寸才会开始。在拟南芥中,植物中的碳水化合物状态由小信号分子海藻糖 6-磷酸 (一种二糖) 传递。缺乏海藻糖 6-磷酸的植物即使在诱导条件下也会表现出非常延迟的开花,而海藻糖 6-磷酸可激活叶片和茎尖的开花途径。顶端除了碳水化合物和其他营养物质外,还从植物的其他部分接收各种激素和其他因素。实验证据表明,施用赤霉素会导致几种针叶树科的幼年植物形成生殖结构(球果)。内源性赤霉素参与控制生殖加速松树球果产生的其他处理方法(例如根部去除、水分胁迫和氮缺乏)也常常导致植物中赤霉素的积累,这一事实也表明了这一点。 控制植物相变的一类主要保守分子是微小 RNA。微小 RNA 是小型非编码 RNA 分子,它们通过短序列同源区域靶向其他基因的 mRNA 转录本,从而干扰其功能(见第 3 章)。在拟南芥和许多其他植物(包括树木)中,微小 RNA156(miR156)是控制幼年到成年转变的关键(图 20.2)。miR156 的一些靶基因促进了向开花的转变。 miR156 的水平会随时间降低,一旦低于阈值,目标基因就会表达,并且相变成为可能。过度表达 microRNA 足以大大延迟拟南芥和杨树的相变。除了 miR156,microRNA172 (miR172) 也与拟南芥的相变有关(见图 20.2)。在发育过程中,miR172 水平会随着 miR156 水平下降而增加。与 miR156(其丰度受植物年龄控制)相反,miR172 似乎受到光周期控制(第 20.4 节中讨论)。miR172 的靶标包括几种转录本,它们编码参与抑制开花的转录因子。因此,
miR172 促进了从成年营养生长到生殖生长的阶段转变。
20.3 昼夜节律:
植物体内的时钟
营养
生殖
能力
成年叶片形态
图 20.2 microRNA 对拟南芥阶段变化的调节。
(A)在发育的最初阶段,miR156 的水平非常高,而 miR172 的水平非常低,从而促进了幼年营养生长阶段。幼年叶片小而圆,仅在近轴侧有毛状体。随着时间的推移,miR156 的水平下降,而 miR172 的水平上升,从而促进了向成年营养阶段的过渡。成年营养叶更大、更长,具有远轴毛状体。 (B) miR156 水平的下降使得 SQUAMOSA 启动子结合蛋白样 9 (SPL9) 和 SPL10 基因得以表达,从而上调 miR172。miR172 下调抑制开花的六种 AP2 样转录因子。抑制的解除,加上促进开花的基因 SPL3–5 的上调,使植物能够开花,从而过渡到开花。成年叶片大小的下降反映了糖分从叶片向发育中的生殖结构分配的逐渐转变。 TZ7E 20.02
20_Taiz7e-Ch20.indd 594
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
生物体通常受到光和黑暗的每日循环的影响,植物和动物通常都会表现出与这些变化相关的节律行为。由光照期和黑暗期组成的 24 小时节律称为昼夜节律。昼夜节律的例子包括叶子和花瓣的运动(白天和夜晚的位置)、气孔的打开和关闭、真菌(例如 Pilobolus 和 Neurospora)的生长和孢子形成模式、蛹羽化的时间(果蝇)和啮齿动物的活动周期,以及光合作用和呼吸等代谢过程速率的每日变化。当生物体从每日的明暗循环转变为连续的黑暗或连续的光照时,许多这样的节律至少会持续数天。在这种均匀的条件下,节律的周期接近 24 小时,因此使用术语昼夜节律(来自拉丁语 circa,“大约”,和 diem,“一天”)(见第 4 章)。由于这些昼夜节律在恒定的光照或黑暗环境中持续,因此它们不能直接响应光的存在或不存在,而必须基于内部起搏器,通常称为内源性振荡器。 单个振荡器机制可以与不同时间的多个下游过程相关联。 内源性振荡器被认为是由黎明、早晨、下午和晚上表达的四组基因的相互作用调节的。 光可以通过激活早晨和晚上的基因来增加振荡的幅度(图 20.3)。 4/29/22 10:24 AM 开花和花卉发育的控制 595 黎明和下午基因的相互抑制。 这个主题被称为“拨动开关”。 当一对中的一个为高时,另一个为低。仅此基序不会振荡。开关位于四元环内,其中每组基因都会关闭之前表达的组。在稳定状态下,单独的环也不会振荡:对角线 o相反的配对打开或关闭。 (A) 可防止出现此结果。
夜间基因在夜间早些时候关闭除黎明基因之外的所有基因,
“清理甲板”,然后在午夜至深夜再次开始黎明基因表达。
(D) 每日循环,一步一步
1. 黎明基因表达在午夜至深夜开始,
继续抑制下午基因 (A)。
2. 光激活早晨和晚上基因表达。
夜间基因受到黎明基因 (B) 的抑制,因此只有早晨基因表达。
3. 早晨基因关闭黎明基因 (B),允许下午基因 (A) 和晚上基因 (B) 表达。持续的光线激活晚上基因也有帮助。
内源振荡器与各种生理过程(如叶片运动或光合作用)相结合,并保持节律。因此,内源振荡器可以被视为时钟机制,而正在调节的生理功能(如叶片运动或光合作用)有时被称为时钟指针。
TZ7E 20.03
昼夜节律表现出特征
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-10-22
昼夜节律源于由三个参数定义的周期性现象:
1. 周期是重复周期中可比点之间的时间。通常,周期被测量为连续最大值(峰值)或最小值(谷值)之间的时间(图 20.4A)。
20_Taiz7e-Ch20.indd 595
4. 下午基因关闭早晨基因(B),同时保持黎明基因关闭(A)。
5. 晚上基因关闭除黎明基因之外的所有基因(C)。
6. 黎明基因在深夜再次表达。
图 20.3 内源性昼夜节律振荡器模型。圆圈代表 24 小时周期,以 6 小时为间隔标记(0 小时、6 小时、12 小时和 18 小时);白天从 0 小时到 12 小时。
(基于 O. Purcell 等人,2010 年。J. R. Soc. Interface 7:1503–1524;以及 Andrew Millar,
个人通信。)
2. 相位是周期中可以通过其与周期其余部分的关系识别的任何点。
最明显的相位点是峰值和
波谷位置。
3. 振幅通常被认为是峰值和波谷之间的距离。
生物节律的振幅通常会发生变化,而周期保持不变(例如,如图 20.4B 所示)。
在恒定的光照或黑暗中,节律会偏离
精确的 24 小时周期。然后,节律会相对于太阳时漂移,根据周期是短于还是长于 24 小时而增加或减少时间。
在自然条件下,内源振荡器被环境信号
带动(同步)到真正的 24 小时周期,其中最重要的是
4/29/22 10:24 AM
596 第 20 章
12D 12L 12D 12L
12D 12L 12D 12L 12D 12L
图 20.4 昼夜节律的一些特征。
TZ7E 20.04
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
黄昏时由亮到暗的过渡和黎明时由暗到亮的过渡(图 20.4C)。
这种环境信号被称为 zeitgebers (德语意为“时间给予者”)。当这些信号被移除时(例如,通过转移到持续黑暗中),节律被称为自由运行,并恢复到特定生物体特有的昼夜节律(见图 20.4C)。
虽然节律是在内部产生的,但它们通常需要环境信号来启动它们的表达。此外,当生物体出现异常时,许多节律会减弱(即振幅减小)。
典型的昼夜节律。
周期是重复周期中可比点之间的时间;相位是重复周期中任何可通过其与周期其余部分的关系识别的点;振幅是峰和谷之间的距离。在持续明亮的光线下暂停昼夜节律,并在转换到连续的强光后释放或重新启动节律。 昼夜节律被训练为 24 小时明暗 (L-D) 循环,并在转换到连续的
后恢复到自由运行周期 (本例中为 26 小时) 。 在转换到黑暗后不久,对光脉冲的典型相移响应。 节律被重新定相 (延迟),而其周期没有受到恒定环境的影响,持续几个周期。 发生这种情况时,需要环境时间赋予者,例如从光到暗的转换或温度变化,来重新启动节律 (见图 20.4B)。 如果生物体在自然条件下经历的波动温度下无法保持准确的时间,那么昼夜节律对生物体来说就毫无价值。事实上,温度对自由运行节奏的周期几乎没有影响。使时钟能够在不同温度下计时的功能称为温度补偿离子。
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 596
开花和花卉发育的控制 597
相移将昼夜节律调整为不同的昼夜循环
在昼夜节律中,生理反应与内源振荡器的特定时间点耦合,因此反应发生在一天中的特定时间。
单个振荡器可以耦合到多个昼夜节律,这些节律甚至可能彼此不同步。
当每日光明和黑暗的持续时间随着季节而变化时,这种反应如何保持准时?研究人员通常通过将生物体置于持续黑暗中并检查对自由运行节律中不同相位点给出的短脉冲光(通常少于 1 小时)的反应来测试内源振荡器的反应。当生物体适应 12 小时光照和 12 小时黑暗的循环,然后让其在恒定的光照或黑暗中自由运行时,与前一个适应循环的光照周期相吻合的节律阶段称为主观白天,与黑暗周期相吻合的阶段称为主观夜晚。
如果在主观夜晚的最初几个小时内发出光脉冲,节律就会延迟;生物体会将光脉冲解释为前一天的结束(图 20.4D)。相反,在主观夜晚结束时发出的光脉冲会提前节律阶段。换句话说,生物体会将光脉冲解释为第二天的开始。
如果光脉冲允许节律在季节变化时保持当地时间,那么这正是预期的反应。这些相移响应使节律能够被调整到大约 24 小时的周期,具有不同的光照和黑暗持续时间,并且它们表明节律可以适应日照长度的季节性变化。
植物色素和隐花色素调整时钟
光信号引起相移的分子机制尚不清楚,但拟南芥的研究已经确定了昼夜节律振荡器及其输入和输出的一些关键元素(见第 16 章)。可以诱导相移的低水平和特定波长的光表明光响应必须由特定的光感受器而不是光合速率介导。例如,红光对亚热带豆科树 Samanea 有节奏的昼夜叶片运动的调整是一种由植物色素介导的低通量响应(见第 16 章)。每种光敏色素都充当红光、远红光或蓝光的特定光受体。植物也通过隐花色素 (CRY) 感知光线,CRY1 和 CRY2 蛋白参与植物中时钟的蓝光同步,就像它们在昆虫中一样(见第 16 章)。相比之下,哺乳动物中的 CRY 似乎不作为昼夜节律光受体发挥作用。令人惊讶的是,CRY 蛋白 20_Taiz7e-Ch20.indd 597 似乎也是红光正常同步所必需的。由于这些蛋白质不吸收红光,因此这一要求表明 CRY1 和 CRY2 可能在时钟同步过程中充当光敏色素信号传导的中间体。在果蝇中,CRY 蛋白与时钟组件发生物理相互作用,因此构成振荡器机制的一部分。然而,拟南芥的情况似乎并非如此,在拟南芥中,cry1/cry2 双突变体在同步方面受损,但其他方面具有正常的昼夜节律。在植物中,光激活的 CRY2 通过直接上调关键开花基因 FLOWERING LOCUS T (FT) 的表达来激活对蓝光的开花反应(详细讨论见第 20.6 节)。
20.4 光周期现象:监测日长
正如我们所见,昼夜节律使生物体能够在白天或夜晚的特定时间重复特定的分子或生化事件。光周期现象,或生物体检测日长的能力,使事件有可能在一年中的特定时间发生,从而允许季节性反应。昼夜节律和光周期具有响应光明和黑暗循环的共同特性。
在赤道,昼夜长度相等且全年恒定。随着人们从赤道向两极移动,夏季白天变长,冬季白天变短(图 20.5)。植物物种已经进化出检测这些季节性日照变化的能力,它们特定的光周期反应受到它们起源的纬度的强烈影响。
动物和植物中都存在光周期现象。在动物界,日照长度控制着冬眠、夏季和冬季皮毛的发育以及生殖活动等季节性活动。
受日照长度控制的植物反应很多;它们包括启动n 开花、无性繁殖、储存器官的形成和休眠的开始。
植物可以根据其光周期反应进行分类
许多植物物种在夏季长日照期间开花,多年来,植物生理学家认为长日照和开花之间的相关性是长日照期间合成的光合产物积累的结果。
怀特曼·加纳和亨利·阿拉德于 20 世纪 20 年代在马里兰州贝尔茨维尔的美国农业部实验室进行的研究证明这一假设是错误的。加纳和阿拉德
4/29/22 10:24 AM
598 第 20 章
日照时间
月份
图 20.5 根据纬度的季节和日照长度之间的相关性。 (A) 纬度对北半球一年中不同时间日照长度的影响。每月 20 日测量日照长度。
(B) 显示经度和纬度的全球地图。
TZ7E 20.05
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
发现一种突变烟草品种‘马里兰猛犸象’长势旺盛,高度达到约 5 米,但在夏季的普遍条件下无法开花(图 20.6)。然而,这些植物在冬季自然光照条件下在温室中开花。
这些结果最终促使 Garner 和 Allard 测试了人工缩短日照的影响,方法是从下午晚些时候到第二天早上用不透光的帐篷覆盖在夏季长日照期间生长的植物。这些人工短日照也导致植物开花。Garner 和 Allard 得出结论,日照长度,
图片由 Richard Amasino 提供
图 20.6 ‘Maryland Mammoth’ 烟草突变体
(右)与野生型烟草(左)的比较。
两种植物都是在夏季在温室中生长的。
(威斯康星大学研究生用作比例。)
而不是光合产物的积累,是开花的决定因素。他们能够在许多不同的物种和条件下证实他们的假设。这项工作为随后对光周期反应的广泛研究奠定了基础。
尽管植物发育的许多其他方面也可能受到日照长度的影响,但开花是研究最多的反应。开花物种往往属于两种主要的光周期反应类别之一:短日照植物和长日照植物。
● 短日植物 (SDP) 仅在短日照下开花
(定性 SDP),或者其开花因短日照而加速(定量 SDP)。
TZ7E 20.06
● 长日照植物 (LDP) 仅在长日照下开花
(定性 LDP),或者其开花因长日照而加速(定量 LDP)。
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
长日照植物和短日照植物之间的本质区别在于,只有当日照长度超过每 24 小时周期中的某个持续时间(称为临界日照长度)时,LDP 中的开花才会得到促进,而 SDP 中促进开花需要日照长度小于临界日照长度。临界日照长度的绝对值在不同物种间差异很大,只有对不同日照长度范围内的开花进行检查,才能确定正确的光周期分类(图 20.7)。
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 598
开花和花卉发育的控制 599
开花百分比
日照长度
夜长
长日植物
当日照长度超过(或夜长小于)24 小时周期内某个临界持续时间时,长日植物就会开花。
短日植物
当日照长度小于(或夜长超过)24 小时周期内某个临界持续时间时,短日植物就会开花。
LDP 可以有效地测量春季或初夏日照长度的延长,并延迟开花,直到达到临界日照长度。许多小麦品种 (Triticum aestivum) 都有这样的表现。SDP 通常在秋季日照长度缩短到临界日照长度以下时开花,就像许多菊花品种一样。然而,单独的日照长度是一个模糊的信号,因为它无法区分春季和秋季。植物表现出几种避免日照长度信号模糊性的适应性。一种是存在幼年期,阻止植物在春季对日照长度作出反应。另一种避免日照长度模糊性的机制是将温度要求与光周期反应结合起来。某些植物物种,如冬小麦,直到寒冷期 (春化或越冬) 发生后才对光周期作出反应。
(我们将在第 20.7 节讨论春化作用。)
其他植物通过区分白天变短和变长来避免季节模糊性。例如“双日照植物”分为两类:
图 20.7 长日照植物和短日照植物的光周期反应。临界持续时间因物种而异。在这个例子中,SDP 和 LDP 都会在 12 到 14 小时的光周期内开花。
日中性物种,如芸豆 (Phaseolus vulgaris),在赤道附近进化,那里的日照长度全年保持不变。许多沙漠一年生植物,如沙漠画笔 (Castilleja chromosa) 和沙漠马鞭草 (Abronia villosa),只要有足够的水,就会迅速发芽、生长和开花。这些也是 DNP。
叶子是感知光周期信号的部位
LDP 和 SDP 中的光周期刺激都由叶子感知。例如,用短光周期处理 SDP 苍耳的单片叶子足以引起花朵的形成,即使植物的其余部分暴露在长日照下也是如此。因此,作为对光周期的反应,叶子会传递一个信号,调节茎尖向开花的过渡。
发生在叶子中的光周期调节过程导致将花刺激传递到茎尖,这些过程统称为光周期诱导。
● 长短日植物 (LSDP) 仅在
TZ7E 20.07
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
在一系列长日和短日之后开花。 LSDP,例如 Bryophyllum、Kalanchoe 和
夜开茉莉 (Cestrum nocturnum),
在夏末和秋季开花,此时白天变短。
● 短长日植物 (SLDP) 仅在
一系列短日和长日之后开花。
SLDP,例如白三叶草 (Trifolium repens)、
坎特伯雷风铃草 (Campanula medium) 和 Echeveria harmsii,在早春开花,以响应白天变长。
最后,在任何光周期条件下开花的物种被称为日中性植物。
日中性植物 (DNP) 对日照长度不敏感。
DNP 中的开花通常受自主调节 - 即内部发育控制。一些
20_Taiz7e-Ch20.indd 599
光周期诱导可以在与植物分离的叶子中进行。例如,在 SDP 紫苏脆叶(薄荷家族的成员)中,暴露在短日照下的切除叶子随后嫁接到在长日照下保持的非诱导植物上会导致开花。该结果表明光周期诱导取决于仅在叶子中发生的事件。
夜晚的长度对于花卉诱导很重要
在自然条件下,白天和夜晚的长度构成了 24 小时的光明和黑暗循环。原则上,植物可以通过测量光照或黑暗的持续时间来感知关键的日照长度。早期光周期研究中的许多实验工作都致力于确定光照黑暗周期的哪一部分是开花的控制因素。结果
4/29/22 10:24 AM
600 第 20 章
黑暗
短日植物
当夜晚长度超过关键黑暗期时,短日(长夜)植物就会开花。通过短暂的光照处理(夜间休息)中断黑暗期可防止
光照处理
TZ7E 20.08
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
开花反应
营养
营养
营养
营养
营养
表明 SDP 的开花主要取决于黑暗持续时间(图 20.8A)。如果光照时间长于临界值,则有可能在 SDP 中诱导开花,前提是这些光照时间之后是足够长的夜晚(图 20.8B)。
同样,当白天短而夜晚短时,SDP 不会开花。更详细的实验表明,SDP 中的光周期计时就是测量黑暗持续时间的问题。例如,只有当长日植物的黑暗期超过 8.5 小时时,才会开花。如果夜晚长度短于临界期,长日(短夜)植物就会开花。在某些长日植物中,缩短夜晚并进行夜间休息会诱导
图 20.8 光周期调节开花。
(A) 对 SDP 和 LDP 的影响。 (B) 黑暗期持续时间对开花的影响。用不同的光周期处理 SDP 和 LDP 清楚地表明,关键变量是黑暗期的长度。
苍耳 (Xanthium strumarium) 或大豆 (Glycine max) 中的 10 小时。黑暗时间的长短也对 LDP 很重要(见图 20.8)。研究发现,这些植物在短日照下开花,前提是伴随的夜晚也很短;然而,长日照后紧接着长夜的制度是无效的。
夜间休息可以抵消黑暗期的影响
这是强调黑暗期的重要性的一个原因是,可以通过短暂的光照中断(称为夜间休息)使其无效(见图 20.8A)。相反,用短暂的黑暗期打断漫长的一天并不能消除长日的影响(见图 20.8B)。仅几分钟的夜间休息处理可有效防止许多 SDP(包括苍耳和牵牛花)开花,但通常需要更长时间的暴露才能促进 LDP 开花。此外,夜间休息的效果因时间而异。对于 LDP 和 SDP,在 16 小时黑暗期的中间附近进行夜间休息被发现最有效(图 20.9)。夜间休息效应的发现
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 600
开花和花卉发育的控制 601
最大开花百分比
苍耳 (SDP)
16 小时黑暗期
夜间休息:
1 分钟红光
光照期
紫红色 (LDP)
16 小时黑暗期
夜间休息:
1 小时红光
从黑暗期开始的夜间休息时间 (h)
导致了商业方法的发展,用于调节园艺物种的开花时间,
例如 Kalanchoe、菊花和一品红 (Eu
phorbia pulcherrima)。
夜间的光周期计时取决于昼夜节律时钟
TZ7E 20.09
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
夜晚长度对开花的决定性影响表明,测量黑暗中的时间流逝对于光周期计时非常重要。大多数现有证据都支持基于昼夜节律的机制。根据时钟假说,光周期计时取决于第 20.3 节讨论的内源性昼夜节律振荡器(见图 20.3;另见第 16 章)。中央振荡器与涉及基因表达的各种生理过程相结合,包括光周期物种的开花。测量夜间休息对开花的影响可用于研究昼夜节律在光周期计时中的作用。例如,当大豆植物(SDP)从 8 小时光照期转变为延长的 64 小时黑暗期时,开花对夜间休息的反应表现出昼夜节律(图 20.10)。这种类型的实验为时钟假设提供了强有力的支持。如果此 SDP 只是通过黑暗中特定中间体的积累来测量夜晚的长度,那么任何大于临界夜晚长度的黑暗期都应导致开花。然而,如果光照中断的时间与内源性昼夜节律的某个阶段不完全一致,那么长时间的黑暗期就不会诱导开花。
最大开花百分比
图 20.9 夜间中断的时间决定了开花反应。在长时间黑暗期间,夜间中断会促进 LDP 开花,并抑制 SDP 开花。在这两种情况下,对开花的最大影响发生在 16 小时黑暗期中间附近夜间中断时。LDP 紫红色在 16 小时黑暗期内暴露于红光 1 小时。苍耳在 16 小时黑暗期内暴露于红光 1 分钟。 (Fuchsia 的数据来自 D. Vince-Prue。1975 年。植物的光周期性。伦敦:McGraw-Hill;Xanthium 的数据来自 F. B. Salisbury。1963 年。Planta 49:518-524;H. D. Papenfuss 和 F. B. Salisbury。1967 年。Plant Physiol. 42:1562-1568。)
开花光敏感度
夜间休息时间(小时)
图 20.10 响应夜间光敏感度而发生的节律性开花。在本实验中,SDP 大豆(Glycine max)接受了 8 小时光照周期和 64 小时黑暗周期的循环。在漫长的诱导黑暗期的不同时间,我们进行了 4 小时的夜间休息。然后绘制了每次夜间休息的开花反应,以最大值的百分比表示。请注意,26 小时的夜间休息可诱导最大开花,而 40 小时的夜间休息则未观察到开花。此外,该实验表明,对夜间休息影响的敏感性表现出昼夜节律。这些数据支持一种模型,在该模型中,只有在光敏期结束后的黎明(或夜间休息)时,SDP 中的开花才会被诱导。在 LDP 中,光照休息必须与光敏期相吻合才能开花。 (数据来自 M. W.
Coulter 和 K. C. Hamner。1964 年。植物生理学 39:848–856。)
TZ7E 20.10
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
20_Taiz7e-Ch20.indd 601
4/29/22 10:24 AM
602 第 20 章
振荡器。这一发现表明,SDP 中的开花需要足够长时间的黑暗期
和 d在昼夜节律周期的适当时间发出 awn 信号(见图 20.3)。
昼夜节律振荡器在光周期测量中的作用的进一步证据是,光周期响应可以通过光处理发生相移(见 WEB 主题 20.5)。
外部巧合模型基于振荡光敏感度 24 小时周期的振荡如何测量 8 到 9 小时的临界黑暗持续时间,如 SDP Xanthium?1936 年,Erwin Bünning 提出,光周期对开花的控制是通过对光具有不同敏感度的阶段的振荡来实现的。该提议已演变为外部巧合模型,其中昼夜节律振荡器控制光敏感和光不敏感阶段的时间。
光促进或抑制开花的能力取决于光的相位。当在节律的光敏相位期间施加光信号时,其效果要么是促进 LDP 开花,要么是阻止 SDP 开花。如图 20.10 所示,对光的敏感和不敏感相位在黑暗中继续振荡。只有在节律的光敏相位完成后,从夜间休息或黎明开始暴露于光线时,SDP 才会开花。如果对 LDP 进行类似的实验,只有在节律的光敏相位期间发生夜间休息时,才会诱导开花。换句话说,当光照与节律的适当相位一致时,SDP 和 LDP 都会诱导开花。在没有黎明和黄昏光信号的情况下,敏感和不敏感阶段的持续振荡是昼夜节律振荡器控制的各种过程的特征(见图 20.3)。
CONSTANS 表达和光的巧合促进了 LDP 中的开花
日照时间本身就是一种强大的外部刺激,可帮助植物感知季节何时变化以及何时是开花的正确时间。
根据外部巧合模型,植物开花反应仅在昼夜循环的某些时间对光敏感。促进拟南芥在长日照下开花的调控途径的关键组成部分是一种名为 CONSTANS (CO) 的基因,它编码一种锌指转录因子。 CO 首次在拟南芥突变体 co 中发现,该突变体无法进行光周期开花反应。 CO 的表达受昼夜节律钟控制,其 mRNA 丰度的每日波动表明了这一点(图 20.11A 和 B,顶部曲线)。然而,遗传学和分子研究表明,在 LDP 拟南芥中,CO 蛋白仅在长日照下积累(见图 20.11A 和 B,中间曲线),这就是加速开花的原因。外部巧合机制的一个关键特征是,当 CO 昼夜节律的光敏阶段(在叶子中产生,即感知光周期刺激的位置)与光(外部信号)的存在相吻合时,LDP 中的开花得到促进。在短日照期间发生的 CO mRNA 增加不会导致 CO 蛋白增加,因为 CO 表达完全发生在黑暗中。相反,在长日照期间,CO 基因表达会伴随 CO 蛋白水平的急剧增加,因为至少有一部分 CO 表达期与光照期重叠(见图 20.11B)。长日照对拟南芥开花有诱导作用,因为在这些条件下 CO 蛋白水平会增加,外部巧合模型的一个重要特征是光可以使活性 CO 蛋白积累到促进开花的水平。CO mRNA 的昼夜节律振荡解释了光周期感知和昼夜节律钟之间的联系,使植物能够测量日照长度的变化。但光是如何引起 CO 蛋白积累的呢?有证据表明,在长日照条件下,CO 蛋白的丰度在整个昼夜循环中都会波动,在光照期间会出现两个峰值诱导,这为光的功能提供了线索。一个峰值出现在黎明前,另一个峰值出现在一天结束时(见图 20.11B)。昼夜 CO 蛋白谱部分基于光照和黑暗条件下 CO 降解速率的差异。在黑暗中,CO 被泛素标记并被 26S 蛋白酶体快速降解(见第 4 章)。光照似乎增强了 CO 蛋白的稳定性,使其能够在白天积累。这解释了为什么 CO 仅在其 mRNA 在光照期间积累时才促进开花。然而,情况比简单的光照-黑暗开关调节 CO 蛋白周转更复杂。光照对 CO 稳定性的影响取决于几种不同光感受器的功能。早晨,当 CO 达到黎明前的峰值时,植物色素 B (phyB) 和 ZEITLUPE (ZTL)(后者是一种光、氧或伏特 (LOV) 域蓝光光感受器(见第 16 章))似乎会促进光诱导的 CO 降解,通过未知机制急剧降低其水平。相比之下,傍晚时分,隐花色素 phyA 和 FLAVIN-BINDING
KELCH REPEAT, F-BOX 1 (FKF1)(一种 ZTL 同源蓝光光感受器)会拮抗这种降解并允许 CO 蛋白积聚(见图 20.11B;另见网络主题 20.6)。调控
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 602
开花和花发育的控制 603
拟南芥
CO 蛋白
CO 蛋白
营养
营养
图 20.11 拟南芥(A 和 B)和水稻(C 和 D)外部巧合模型的分子基础。(A) 在短日照下的拟南芥中,CO mRNA 表达与日照之间几乎没有重叠。 CO 蛋白在韧皮部中积累的水平不足以促进可传递的花刺激 FT 蛋白的表达,并且植物保持营养状态。 (B) 在长日照下,CO mRNA 丰度的峰值与日照重叠(白天早些时候和下午晚些时候),从而使 CO 蛋白得以积累。
(清晨 CO 蛋白的急剧上升是由于黎明时暴露在光线下时蛋白质的短暂增加造成的。)CO 激活韧皮部中的 FT mRNA 表达,当 FT 蛋白转移到顶端分生组织时,导致开花。(C)在短日照条件下的水稻中,缺乏与日照长度相关的 CO 表达和 CO 积累的巧合是拟南芥能够测量日照长度变化的核心机制。植物生理学 7/E Taiz/Zeiger OUP/Sinauer Associates Morales Studio 日期 4-20-22 SDP 使用巧合机制来抑制长日照条件下的开花对 SDP 水稻开花的研究表明,水稻和拟南芥中光周期感应的基本外部巧合机制是保守的。水稻基因 Heading-date1 (Hd1) 和 Heading-date3a (Hd3a) 分别编码与拟南芥 CO 和 FT (FLOWERING LOCUS T) 同源的蛋白质。在转基因植物中,拟南芥中 FT 的过度表达和水稻中 Hd3a 的过度表达导致快速开花,而与光周期无关,表明 FT 和 Hd3a 都是开花的强启动子。此外,Hd1 mRNA 表达和日光之间的表达刺激了编码水稻可传递花刺激物和 FT 相关基因 Hd3a 的表达。在这种情况下,Hd1 充当 Hd3a 的激活剂,使 Hd3a 蛋白(未显示)积累,然后转移到顶端分生组织,在那里引起开花。(请注意,在 Hd1 激活 Hd3a 表达之前有一个滞后时间。)(D)在长日照下,Hd1 mRNA 表达与日光的巧合会抑制 Hd3a 表达。作为对长日照的反应,Hd1 的功能转换为 Hd3a 表达的抑制。结果,Hd3a mRNA 不会积累,植物保持营养状态。 (A 和 B 来自 Y. H. Song. 等人,2015 年。Ann. Rev. Plant Biol. 66: 441–464 和 Y. H. Song 等人,2018 年。Nat. Plants 4: 824
835;C 和 D 来自 H. Wei 等人,2020 年。aBIOTECH 1: 219–232。)
在诱导光周期(拟南芥长日照,水稻短日照)期间,天然 FT 和 Hd3a 基因显著升高(图 20.11C)。此外,水稻 Hd1 和拟南芥 CO 表现出相似的 mRNA 积累昼夜模式。水稻和拟南芥的区别在于,在 SDP 水稻中,Hd1 在长日照下充当 Hd3a 表达的抑制剂(图 20.11D),而在短日照下充当其表达的激活剂(见图 20.11C)。与拟南芥中发生的情况相反,在水稻中,长日照下 Hd1 表达与光照的巧合通过抑制 Hd3a 的表达来抑制开花。因此,SDP 水稻中的开花仅在短日照条件下发生,此时 Hd1 主要在黑暗中表达。此外,Hd1 对 Hd3a 表达的影响(抑制与诱导)似乎根据日照长度而以不同的方式调节。 Hd1
在光照期间积累,与光照周期无关,但处于生化活性状态,仅在短日照下启动 Hd3a 转录。值得注意的是,
SDP 和
LDP 对光周期的不同反应部分是由于日照长度对光周期传感系统中 CO/Hd1 活性的相反影响。
然而,值得注意的是,光周期现象更加复杂,其他调节机制肯定会存在,这些机制可以微调 SDP 和 LDP 对日照长度变化的反应(方框 20.1)。
方框 20.1 参考自然环境中光周期开花的分子机制
如本章所示,开花受光质、光周期、温度等环境因素组合控制。
与实验室动物一样,生理研究中使用的植物通常在受控的环境条件下生长,例如固定温度的明暗循环。事实上,大多数生物研究实验室都采用简化的环境条件,以尽量减少环境变化并获得可靠和可重复的数据。这种方法在模型植物中的应用在阐明各种基本生理过程方面非常成功。
然而,与动物一样,植物在实验室和自然环境中在生理和分子水平上的反应往往不同。例如,最近的研究表明,LDP 拟南芥在自然长日照下比在受控条件下的长日照下开花更早。
此外,令人惊讶的是,FT 转录本的丰度在室外的早晨和黄昏达到峰值(图 A)。在实验室条件下,通常不会观察到一天早些时候 FT mRNA 的高积累(见正文中的图 20.11)。实验室和室外条件下开花时间和 FT 表达谱的差异是由红光:远红光 (R:FR) 比率和日温度变化的综合作用造成的。阳光下的 R:FR 比率接近 1.0,但在实验室通常使用的光源下则超过 2.0,这表明研究中使用的实验室生长条件是红光富集的。这可以部分解释与室外相比,实验室条件下拟南芥开花延迟的原因,因为红光通过破坏 CO 蛋白的稳定性来抑制开花。此外,在自然环境下,早晨 CO 蛋白的降解率降低,表明在此条件下 CO 稳定性的增加与 FT 诱导之间存在相关性(见图 A)。此外,全天的温度波动强烈影响 FT 表达模式。通过调整 R:FR 比率和每日温度循环的设置,使其更接近自然条件,可以在受控实验室条件下重现户外观察到的开花反应。
拟南芥
CO 蛋白
图 A 自然长日照下的 FT 表达谱。
在户外,FT mRNA 丰度在早晨和黄昏达到峰值。与传统实验室长日照条件下的 FT 表达模式相比,户外 FT 的额外早晨峰值加速了拟南芥的开花。在自然的长日照条件下,早晨 CO 蛋白的降解率降低,这表明这种条件下 FT 峰值的诱导是由于 CO 稳定性的增加。此外,作为吸收远红光的主要光受体,phyA 似乎有助于响应 R:FR 比率为 1.0 和室外每日温度循环而产生 FT 早晨峰值。(根据 Y. H. Song 等人 2018 年。自然植物 4:824–835。)
TZ7E Bx20.01
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 12-28-21
PhyA 是负责吸收远红光的主要光受体,可能也参与温度感应。在拟南芥中,PHYA 基因中功能丧失的等位基因在生长室中长日照条件下表现出开花略微延迟。相比之下,phyA 突变体在田间开花延迟更为明显。此外,在自然条件下,早晨的 FT 转录本水平因 phyA 突变而大大降低,这表明 phyA 在开花调节中起着至关重要的作用,而这种作用在实验室条件下一直被低估。显然,在自然条件下研究植物对于提高我们对植物生物学和生理学的理解至关重要,并将帮助我们为气候变化下的粮食安全制定未来方案。 ■
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 604
开花和花卉发育的控制 605
短日照(长夜)植物
光的相对有效性
TZ7E 20.12
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 10-22-21
长日照(短夜)植物
夜间休息对开花的抑制
夜间休息抑制的逆转
苍耳 苍耳
波长(nm)
图 20.13 夜间休息控制开花的作用光谱表明光敏色素与开花有关。在诱导期内进行短光处理(夜间休息)可抑制 SDP 中的开花。在 SDP Xanthium
strumarium 中,620 至 640 nm 的红光夜间休息最有效。红光效应的逆转在
725 nm。在黑暗中生长的 SDP Pharbitis nil 中,由于缺乏叶绿素,且叶绿素不会干扰光吸收,因此 660 nm 的夜间休息最有效。这个 660 nm 的最大值与植物色素的吸收最大值相吻合。(苍耳数据来自 S. B. Hendricks 和 H. W.
Siegelman。1967 年。Comp. Biochem. 27: 211–235;Pharbitis 数据来自 H. Saji 等人。1983 年。Plant Cell Physiol. 24: 1183–1189。)
20_Taiz7e-Ch20.indd 605
图 20.12 植物色素通过红光 (R) 和远红光 (FR) 控制开花。关键的夜晚长度
黑暗时期的红光闪烁会诱导 LDP 开花,而远红光闪烁会逆转这种效果。这种反应表明植物色素的参与。在 SDP 中,红光闪烁会阻止开花,而远红光闪烁会逆转这种效果。
植物色素是光周期现象中的主要光感受器
夜间休息实验非常适合研究光周期反应期间接收光信号的光感受器的性质(见第 16 章)。夜间休息对 SDP 开花的抑制是第一个被证明受植物色素控制的生理过程之一(图 20.12)。
在许多 SDP 中,只有当提供的光照剂量足以使 Pr(吸收红光的光敏色素)的光转化饱和为 Pfr(吸收远红光的光敏色素)时,夜间休息才会有效(见第 16 章)。随后暴露于远红光,将色素光转化回生理上不活跃的 Pr 形式,从而恢复开花反应。图 20.13 显示了 SDP 中开花反应的抑制和恢复作用光谱。当使用暗生长的牵牛幼苗来避免叶绿素的干扰时,在 660 nm 处获得峰值,即 Pr 的最大吸收值。相反,苍耳的光谱提供了绿色植物中反应的一个例子,其中叶绿素的存在会导致 Pr 的作用光谱和吸收光谱之间出现一些差异。这些作用光谱加上夜间休息反应的红光/远红光可逆性证实了光敏色素作为光受体的作用,参与了 SDP 的光周期测量。LDP 的夜间休息实验也表明光敏色素参与了这一过程。因此,在某些 LDP 中,夜间红光休息会促进开花,而随后暴露于远红光会阻止这种反应。在 LDP 大麦 (Hordeum vulgare)、黑麦草 (Lolium temulentum) 和拟南芥中观察到了远红光促进开花的昼夜节律 (图 20.14)。该响应与远红光的辐照度和持续时间成正比,因此是高辐照度响应 (HIR;见第 16 章)。与其他 HIR 一样,phyA 是介导对远红光响应的光敏色素。与 phyA 在促进 LDP 开花中的作用一致,PHYA 基因突变会延迟拟南芥的开花。相反,当 phyB 吸收红光时,它会延迟开花,与红光和远红光的拮抗作用一致,phyB 突变会促进拟南芥的开花。然而,在某些 LDP 中,光敏色素的作用比在 SDP 中更复杂,因为蓝光光感受器也参与了响应。蓝光光感受器调节某些 LDP 的开花
在某些 LDP 中,例如拟南芥,蓝光可以促进开花,这表明蓝光光感受器可能参与开花的控制。正如我们在第 16 章中讨论的那样,由 CRY1 和 CRY2 基因编码的隐花色素是控制拟南芥幼苗生长的蓝光光感受器。如第 20.3 节所述,CRY 蛋白也与昼夜节律振荡器的同步有关。已经使用 WEB 主题 20.7 中提到的荧光素酶报告基因构建体研究了蓝光在开花中的作用及其与昼夜节律的关系。拟南芥开花时间突变体 ztl 的研究也支持蓝光对昼夜节律和开花的调节作用(见 WEB 主题 20.7 和 20.8)。几种蓝光光感受器参与了拟南芥中诱导光周期的感应。一种隐花色素基因 CRY2 的突变(见第 18 章)导致长日照下的开花延迟。此外,cry1/cry2 双突变体在长日照下的开花时间比 cry2 稍晚,表明 CRY1 和 CRY2 在促进拟南芥开花时间方面存在一些功能冗余。另一种蓝光光感受器在拟南芥的光周期开花中起着至关重要的作用。 FKF1 的功能是将 CO 表达的诱导与长日照期相一致,而不是短日照期,从而使拟南芥sis 来区分季节。在长日照下,功能丧失的 fkf1 突变体开花非常延迟,并且无法感知诱导光周期。相反,FKF1 蛋白的过量产生促进了长日照下的开花。此外,FKF1 同源物 ZTL 似乎在开花调节中拮抗了 FKF1。与 fkf1 突变体一样,携带高 ZTL 蛋白水平的植物比野生植物开花晚得多
口芽数量相对增加(对照的百分比)
灵敏度
远红光照射时间(小时)
对光的敏感性
图 20.14 远红光对拟南芥花诱导的影响。在连续 72 小时日照期间的指定时间,添加 4 小时远红光。图中的数据点绘制在 4 小时处理的中心。数据显示,对远红光促进开花的敏感性存在昼夜节律(红线)。这支持了一种模型,即当光处理(在这种情况下为远红光)与光敏感性的峰值相吻合时,LDP 中的开花会得到促进。(G. Deitzer 著,1984 年。《光与开花过程》,D. Vince-Prue 等人 [编辑],Academic Press,纽约,第 51-63 页。)在长日照下,开花类型会发生变化。相反,ZTL 基因的功能丧失等位基因会导致早开花。隐花色素 FKF1 和 ZTL 很可能通过调节 CO 蛋白的稳定性来调节开花,从而使其在长日照条件下积累。如前所述,CO 蛋白在 LDP 中起着促进开花的作用。
TZ7E 20.14
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-27-22 20.5 长距离信号传导参与开花
虽然花的诱导发生在枝条的顶端分生茎,但在光周期植物中,诱导光周期是由叶子感知的。这表明必须从叶子向顶端传输长距离信号,这已通过在许多不同植物物种中进行的广泛嫁接实验得到实验证明。这种信号的生化性质长期困扰着生理学家。这个问题最终通过分子遗传学方法得到解决,花刺激物被鉴定为一种蛋白质。在本节中,我们回顾了发现花刺激物(称为成花素)的背景,成花素在开花期间充当长距离信号。
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 606
开花和花卉发育的控制 607
嫁接研究为可传递的花刺激物提供了第一个证据
光周期诱导叶片产生的生化信号被传送到远处的目标组织(茎尖),在那里刺激反应(开花),满足了激素效应的重要标准。 20 世纪 30 年代,Mikhail Chailakhyan 假设存在一种通用的开花激素,他将其命名为成花素。支持成花素的证据主要来自实验,在这些实验中,通过将光周期诱导的供体植物的叶子或枝条嫁接到非诱导受体植物上来刺激其开花。
例如,在 SDP 紫苏脆叶中,将在诱导短日照下生长的植物的叶子嫁接到在非诱导长日照下生长的植物上会导致后者开花(图 20.15A)。此外,在具有不同光周期要求的植物中,开花刺激似乎相同。因此,将在长日照下生长的 LDP 烟叶的诱导枝嫁接到 SDP ‘Maryland Mammoth’ 烟草上会导致后者在非诱导(长日照)条件下开花。 DNP 的叶子也被证明会产生嫁接传递的花刺激(表 20.2)。例如,将开花日中性品种大豆‘Agate’的单片叶子嫁接到短日品种‘Biloxi’上,即使后者在非诱导性长日照下生长,也会导致‘Biloxi’开花。同样,将开花日中性品种烟草(Nicotiana tabacum,cv. Trapezond)的枝条嫁接到LDP Nicotiana sylvestris上,可诱导后者在非诱导性短日照下开花。嫁接研究还表明,在某些物种中,例如苍耳(SDP)、落叶松(SLDP)和蝇子草(LDP),不仅可以通过嫁接诱导开花,而且诱导状态本身似乎可以自我传播(参见网络主题 20.9)。在少数情况下,开花甚至可以通过不同属之间的嫁接来诱导。
SDP Xanthium strumarium 在长日照条件下开花,而开花金盏花的枝条
图片由 J. A. D. Zeevaart 提供
图 20.15 两个嫁接实验展示了叶子产生的花刺激的易位。
(A)在左侧,将短日照下生长的植物的诱导叶嫁接到非诱导枝上,导致腋生枝产生花朵。供体叶子已被修剪嫁接实验中,嫁接株上部叶片被摘除,以促进接穗韧皮部向受体枝条转移。右图为嫁接长日照条件下生长的植物的非诱导叶片,结果只形成营养枝条。(B)该嫁接实验展示了不同属之间花刺激物的转移。砧木(左枝)为未春化天仙子(Hyoscyamus niger),需要冷处理才能开花。接穗(右枝)为LDP矮牵牛。在室温下长日照条件下保持嫁接组合,导致花刺激物从接穗转移到砧木。嫁接在苍耳营养砧木上。类似地,将 LDP 矮牵牛的嫩枝嫁接到喜冷的二年生天仙子 (Hyoscy
amus niger) 砧木上,会导致后者在长日照下开花,
尽管它没有经过春化处理 (图 20.15B)。 TZ7E 20.15
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
表 20.2 开花信号的传递通过嫁接连接发生
在诱导开花条件下维持的供体植物
向日葵
烟草‘Delcrest’
烟草
光周期类型a,b
诱导开花的营养受体植物
H. tuberosus
N. sylvestris
烟草‘Maryland Mammoth’ SDP in SD
N. tabacum ‘Maryland
N. sylvestris
光周期类型a,b
注意:通过嫁接在不同光周期反应组植物之间成功转移开花诱导信号表明存在可传递的花激素有效。
aLDPs = 长日照植物;SDPs = 短日照植物;DNPs = 日照中性植物。
bLD,长日照;SD,短日照。
20_Taiz7e-Ch20.indd 607
由 J. A. D. Zeevaart 提供
4/29/22 10:24 AM
608 第 20 章
在紫苏脆叶中(见图 20.15A),花刺激物从供体叶片到嫁接处移位与 14C 标记同化物从供体移位密切相关,并且这种移位取决于嫁接处维管连续性的建立。这些结果证实了早期环剥研究的结果,表明花刺激物与韧皮部中的光同化物一起移位。
成花素在韧皮部中转移
叶片产生的光周期成花刺激物通过韧皮部转移到茎尖分生组织,在那里促进成花。
阻止韧皮部转移的处理,例如环剥或局部热灭活,通过阻止成花刺激物移出叶片来阻止开花。
可以通过在诱导后的不同时间去除叶片,并比较信号到达距离诱导叶片不同距离的两个芽所需的时间来测量成花素的移动速率。 这种测量的基本原理是,尽管去除了叶片,但当开花时,阈值量的信号化合物已经到达芽。 通过这种方式,可以确定足够量的信号离开叶片的时间。
此外,比较两个不同位置芽的诱导时间可以测量信号沿茎移动的速率。
使用此方法的研究表明,开花信号的移动速率与韧皮部中糖的转运速率相当或略慢(见第 11 章)。例如,SDP 藜成年叶片中的花刺激物在长夜开始后的 22.5 小时内完成输出。在 LDP Sinapis 中,花刺激物从叶片中的移动早在长日处理开始后 16 小时就已完成。
由于花刺激物与韧皮部中的糖一起转运,因此它受源库关系的影响。靠近茎尖的诱导叶比通常为根部提供养分的茎基部的诱导叶更容易引起开花。
同样,位于诱导叶和顶芽之间的非诱导叶将倾向于抑制开花,因为它们是芽的首选源叶,从而阻止来自更远端诱导叶的花刺激物到达其目标。
20.6 成花素的鉴定
20.5 节中描述的开创性嫁接实验确定了从叶子到顶端分生组织的长距离信号对刺激开花的重要性。 自 20 世纪 30 年代以来,已经进行了许多分离和表征成花素的尝试,但均未成功。
一个重大突破是通过基因筛选鉴定了拟南芥中的成花位点 T (FT)。拟南芥的开花蛋白 FLOWERING
LOCUS T (FT) 是成花素
根据外部巧合ce 模型中,当 CONSTANS 基因在光照期间表达时,拟南芥等 LDP 就会开花。CO 基因的表达似乎在叶和茎韧皮部的伴生细胞中最高。一组实验表明,通过在成熟叶片的小脉韧皮部中特异性表达 CO,可以挽救 co 突变体对光周期不敏感的开花。相反,在 co 突变体的顶端分生组织中表达 CO 并没有恢复开花表型,这支持了以下观点:CO 专门在叶片韧皮部中起作用,以刺激响应长日照而开花。其他研究表明,当将叶韧皮部中表达 CO 的转基因枝条嫁接到 co 突变体上时,所有枝条都会诱导开花,而不仅仅是那些表达 CO 的枝条。这一观察结果表明,CO 表达会产生一种可通过嫁接传递的花刺激,从而导致顶端分生组织开花。CO 活性的信号输出直接由 FT 的表达介导,FT 的表达也只在伴生细胞中观察到。在拟南芥中,长日照期间的 CO 表达会导致 FT mRNA 增加(见图 20.11)。然而,与 CO 不同,FT 在伴生细胞或顶端分生组织中表达时都会刺激开花。 FT 基因(或其相关基因,如前面讨论过的水稻中的 Hd3a)的表达在多种物种的花诱导光周期中被诱导。当 FT 基因被引入到开花不受光周期影响的多种植物物种中时,它会加速开花。此外,FT 蛋白可以从叶子移动到顶端分生组织,从而表现出成花素所具有的所有特性。根据目前的模型,在诱导光周期下,FT 蛋白通过韧皮部从叶子移动到分生组织。该过程有两个关键步骤:FT 从伴生细胞输出到筛管分子,以及在茎尖激活 FT 靶基因,从而触发花的发育。内质网 (ER) 是蛋白质从伴生细胞运输到筛管分子的主要途径之一。内质网定位蛋白 FT INTERACTING PROTEIN1 (FTIP1) 是 FT 进入韧皮部转运流所必需的,韧皮部转运流将其带到分生组织(图 20.16)。一旦进入花分生组织,FT 蛋白就会进入细胞核并与 FLOWERING D (FD) 形成复合物,FLOWERING D (FD) 是一种在分生茎中表达的碱性亮氨酸拉链 (bZIP) 转录因子。FT 和 FD 形成的复合物随后激活花身份基因,例如 APETALA1 (AP1)。 4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 608
开花和花发育的控制 609
在花序中
赤霉素
原基
数量 低
温度
1. FT mRNA 在叶脉的
伴生细胞中表达,以响应多种信号,
包括日照长度、光
质和温度。
2. FTIP1 介导 FT 通过伴生细胞和筛管分子之间的连续 ER 网络进行运输。
3. FT 在韧皮部中从
叶子移动到顶端分生组织。
4. FT 从分生组织的韧皮部中卸载并与 FD 相互作用。
5. FT-FD 复合物激活花序分生组织中的 SOC1 和口部分生组织中的 AP1,从而触发 LFY 基因表达。
6. LFY 和 AP1 触发口部同源异型基因的表达。自主途径和春化途径对 FLC 进行负向调节,而 FLC 则在分生组织中充当 SOC1 的负调节剂,在原基中充当 FT 的负调节剂
• 光质
• 日照长度
• 温度
胞间连丝
伴胞筛管
图 20.16 多种因素调节拟南芥开花。
红色箭头表示 FT 运输的方向。ER,内质网;
SER,筛管。
叶脉显微照片(底部)显示
FT-GFP 融合在
伴生细胞中的表达(绿色荧光)。
(根据 L. Liu 等人 2013 年。Curr. Opin. Plant Biol. 16:607–613。)
来自 L. Liu 等人 2013 年。Curr. Opin. Plant Biol. 16:607–613
叶脉(横向视图)
TZ7E 20.16
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
20_Taiz7e-Ch20.indd 609
4/29/22 10:24 AM
610 第 20 章
在拟南芥中,这些事件启动了正反馈回路,使分生组织保持开花状态。在被 FT 蛋白激活后,FD 触发了抑制 CONSTANS1 (SOC1) 和 AP1 过度表达的表达。这两个目标都激活了 LEAFY(LFY;我们将在本章后面讨论的花身份基因),LFY 直接激活 AP1 和 FD 的表达,形成两个正反馈回路(见图 20.16)。由于这些正反馈回路的作用,拟南芥的花芽分化是不可逆的le。然而,一些物种的分生组织缺乏这样的正反馈回路,因此,在没有连续诱导光周期的情况下,会恢复产生叶子。此外,在宿主植物中合成的 FT 蛋白很可能能够进入附着在其上的寄生植物的茎中。一旦到达那里,宿主 FT 蛋白就会通过与寄生虫产生的 FD 蛋白发生物理相互作用来触发开花相关基因的激活。通过使用植物间移动信号——FT 蛋白——寄生植物可以使其开花与宿主植物的开花同步,并优化其生殖适应性。 20.7 春化:利用冷处理促进开花
春化是通过对水合种子(即吸水的种子)或生长中的植物(干种子对冷处理没有反应,因为春化是一个活跃的代谢过程)进行长时间的冷处理来缓解开花抑制的过程。没有冷处理,需要春化的植物会延迟开花或保持营养状态,并且它们无法对诱导光周期等开花信号做出反应。在许多情况下,这些植物会长成莲座状,茎不会伸长(图 20.17)。在本节中,我们将研究开花对冷需求的一些特征,包括诱导温度的范围和持续时间、感知位置、与光周期的关系以及可能的分子机制。
春化作用使茎尖具备开花能力
植物对春化作用敏感的年龄差异很大。冬季一年生植物,如谷类的冬季形式(在秋季播种,在随后的夏季开花),在其生命周期的早期对低温作出反应。事实上,如果种子已经吸收水分并变得具有代谢活性,许多冬季一年生植物可以在发芽(即种子长出胚根)之前进行春化。其他植物,包括大多数二年生植物(在播种后的第一个季节长成莲座状,在随后的夏季开花),必须达到最小尺寸,然后才能对低温敏感以进行春化。
春化作用的有效温度范围为
从略低于冰点到约 10°C,最适温度通常为 1 至 7°C。冷处理时间越长,冷效应越强,直至反应饱和。反应通常需要暴露于低温下数周,但确切的持续时间因物种和品种而异。
暴露于高温等去春化条件(图 20.18)会导致春化作用丧失,但暴露于低温下的时间越长,春化作用越持久。
春化作用似乎主要发生在茎尖分生组织中。当只有茎尖受冷时,局部冷却会导致开花,这种影响似乎与植物其余部分所经历的温度基本无关。切除的茎尖已成功进行春化处理,在可以进行种子春化处理的地方,主要由茎尖组成的胚胎碎片对低温敏感。
从发育的角度来看,春化处理导致分生组织获得进行花转变的能力。然而,正如本章前面所讨论的,开花能力并不能保证开花。春化要求通常与特定光周期的要求有关。最常见的组合是要求
冬季一年生拟南芥
没有春化
冬季一年生拟南芥
有春化
由 Coleen Bizze l 提供
图 20.17 春化诱导拟南芥冬季一年生类型的开花。左边的植物是冬季一年生类型,未暴露于寒冷中。右边的植物是遗传上相同的冬季一年生类型,幼苗时暴露于略高于冰点(4°C)的温度下 40 天。它在冷处理结束 3 周后开花,主茎上约有 9 片叶子。
20_Taiz7e-Ch20.indd 610
4/29/22 10:24 AM
开花和花卉发育的控制 611
去春化处理后保持春化的种子百分比
冷处理持续时间(周)
图 20.18 暴露于低温的持续时间增加了春化效果的稳定性。冬黑麦 (Secale cereale) 接受冷处理的时间越长,在冷处理后进行去春化处理时,保持春化的植物数量就越多。
在这个实验中,将吸水的黑麦种子暴露在 5°C 下不同时间,然后立即在 35°C 下进行 3 天的去春化处理。(数据来自
O. N. Purvis 和 F. G. Gregory。1952 年。Ann. Bot. 1:569–592。)
冷处理后需要长日照——这种组合导致高纬度地区在初夏开花(参见 WEB TOPIC 20.10)。在某些小麦和大麦品种中,短日照可以取代冷介导的春化,这一过程称为谷物中的 SD 春化。
TZ7E 20.18
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-7-22
冬季一年生植物
40 天寒冷后
冬季一年生植物
没有寒冷
春化可能涉及基因表达的表观遗传变化
要发生春化,在冷处理期间需要主动代谢。需要能量来源(糖)和氧气,而低于冰点的温度会抑制代谢活动,对春化无效。此外,细胞分裂和 DNA 复制似乎也是必需的。在某些植物物种中,春化会导致分生组织形成花序的能力发生稳定变化。春化如何稳定地影响能力的一种解释是,在冷处理后,分生组织中的基因表达模式会发生变化,这种变化会持续到春季和整个生命周期的剩余时间。基因表达的稳定变化不涉及 DNA 序列的改变,并且可以通过有丝分裂或减数分裂传递给后代细胞,这被称为表观遗传变化。因此,即使在诱导变化的信号(在这种情况下是寒冷)不再存在后,基因表达的表观遗传变化仍然是稳定的。基因表达的表观遗传变化发生在许多生物体中,从酵母到哺乳动物,并且通常需要细胞分裂和 DNA 复制,就像春化一样。在 LDP 拟南芥中,已证实特定靶基因的表观遗传调控参与了春化过程。在需要春化和长日照来加速开花的冬季一年生拟南芥中,已鉴定出一种作为开花抑制剂的基因:开花位点 C (FLC)。FLC 在非春化茎尖区域高度表达。春化后,该基因在植物生命周期的剩余时间内被表观遗传关闭,允许响应长日照而开花(图 20.19)。在下一代中,
20_Taiz7e-Ch20.indd 611
照片由 Richard Amasino 提供
冬季一年生植物
没有寒冷,但
具有 FLC 突变
图 20.19 具有春化要求的植物要么开花相当延迟,要么除非经历一段长时间的寒冷期,否则不会开花。 (左) 春化阻断了拟南芥需要寒冷的冬季一年生生态型中 FLOWERING LOCUS C (FLC) 基因的表达。 (右) FLC 基因中发生抑制突变的冬季一年生植物在没有冷处理的情况下表现出快速开花。
4/29/22 10:24 AM
612 第 20 章
然而,该基因再次被打开,恢复了对寒冷的要求。因此,在拟南芥中,FLC 基因的表达状态是决定分生组织能力的主要因素。在拟南芥中,已证明 FLC 通过直接抑制叶片中关键花信号 FT 以及茎尖分生组织中转录因子基因 SOC1 和 FD 的表达来发挥作用(见图 20.16)。
FLC 的表观遗传调控涉及染色质重塑导致的染色质结构稳定变化(见第 3 章)。春化导致 FLC 基因的染色质失去真染色质(转录活性 DNA)特有的组蛋白修饰,并获得异染色质(转录无活性 DNA)特有的修饰,例如特定赖氨酸残基的甲基化。冷诱导 FLC 从真染色质转变为异染色质,有效地沉默了该基因。
可能已经进化出一系列春化途径
许多需要春化的植物在秋季发芽,利用最适合其生长的凉爽潮湿条件。这些植物的春化要求确保开花直到春天才会发生,从而使植物能够以营养方式度过冬天(花朵对霜冻特别敏感)。春化植物不仅必须感知寒冷暴露,而且还必须具有测量寒冷暴露持续时间的机制。例如,如果植物在秋季初暴露于短暂的寒冷中,然后在秋季晚些时候恢复温暖的温度,那么重要的是植物不要将短暂的寒冷暴露视为冬天,而将随后的温暖天气视为春天。因此,春化作用只有在暴露于足以表明整个冬季已经过去的寒冷天气后才会发生。在芽可以从休眠中释放,这在许多生长在温带气候中的多年生植物中起作用。植物进化来测量寒冷持续时间的机制尚不清楚,但在拟南芥中,有些基因只有在长时间暴露于寒冷后才会被诱导,这些基因对春化过程至关重要。似乎没有一种特定的春化途径在所有开花植物中都得到保留。如前所述,FLC 是负责拟南芥春化要求的开花抑制因子。FLC 编码一种 MADS 盒蛋白,该蛋白与我们在本章后面讨论的调节蛋白有关,例如 DEFICIENS 和 AGAMOUS,它们参与了花的发育。在谷类植物中,一种编码不同类型蛋白质的基因,一种含锌指的蛋白质,称为 VRN2(春化 2),充当开花抑制因子,产生春化要求。
看来,开花植物的主要群体是在温暖的气候中进化的,因此没有进化出一种测量冬季持续时间的机制。在地质时期内,由于大陆漂移和其他因素,地球的某些地区逐渐形成了温带气候。许多植物群体的成员适应了这些新的温带生态位,并发展出了春化和芽休眠等反应,因此这些反应很可能在不同的植物群体中独立进化。
20.8 参与开花的多种途径
很明显,向开花的过渡涉及一个复杂的相互作用因素系统。叶片产生的可传递信号(包括植物激素)是决定自主调节和光周期物种的茎尖所必需的。
赤霉素和乙烯可诱导开花
在天然生长激素中,赤霉素(见第 15 章)可对开花产生强烈影响(见 WEB 主题 20.11)。外源赤霉素可引发开花,无论是应用于莲座丛 LDP(如拟南芥)还是在短日照下生长的双日照植物(如落地生根)。
赤霉素似乎在长日照下对拟南芥开花的促进作用较弱,在短日照下则较强。
赤霉素信号传导的中心抑制因子 DELLA 蛋白下调 FT、LFY 和 SOC1 基因的表达。 DELLA 蛋白还与 FT 的转录调节因子相互作用,例如 CO、FLC 和 PHYTOCHROME 相互作用因子 4 (PIF4)(见第 4 章)。赤霉素刺激 DELLA 的蛋白酶体降解,导致 FT、LFY 和 SOC1 上调,从而促进开花(见图 20.16)。外源施用的赤霉素也可以在非诱导条件下和未经春化的需冷植物中引起少数 SDP 开花。如第 20.2 节中关于相变的讨论所述,通过添加赤霉素,还可以促进几种裸子植物科的幼苗中球果的形成。因此,在某些植物中,外源赤霉素可以绕过自主开花的内源性触发因素,以及日照长度和温度的主要环境信号。如第 4 章所述,植物含有许多赤霉素类化合物。这些化合物中的大多数要么是赤霉素活性形式的前体,要么是其无活性代谢物。
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 612
开花和花卉发育的控制 613
植物中的赤霉素代谢受日照长度的强烈影响。例如,在 LDP 菠菜 (Spinacia oleracea) 中,赤霉素水平在短日照下相对较低,植物保持莲座状。当植物转入长日照环境后,13-羟基化途径(GA53 → GA44 → GA19 → GA20 → GA1;参见网络附录 3)的所有赤霉素水平都会增加。然而,生理活性赤霉素 GA1 增加了五倍,这是导致伴随开花的茎明显伸长的原因。
除了赤霉素,其他生长激素也可以抑制或促进开花。一个具有商业重要性的例子是乙烯和释放乙烯的化合物显著促进菠萝(Ananas comosus)开花——这种反应似乎仅限于菠萝科(Bromeliaceae)的成员。
开花的转变涉及多种因素和途径
遗传学研究已确定,有四种不同的发育途径控制LDP拟南芥的开花(见图20.16):
● 光周期途径始于叶片,涉及多种光感受器。在长日照条件下的LDP中,这些光感受器之间的复杂关系导致CO蛋白在叶片韧皮部伴生细胞中积累。CO激活其下游靶基因 FT 在韧皮部中表达。FT 蛋白(“成花素”)进入筛管分子,并转移到顶端分生组织,在那里刺激开花。如图 20.16 中分生组织的放大图所示,FT 蛋白与转录因子 FD 形成复合物。然后,FD-FT 复合物激活下游靶基因,如 SOC1、AP1 和 LFY,这些基因会打开花序分生组织侧面的花同源基因。● 在自主和春化途径中,开花要么是对内部信号(产生固定数量的叶子)的反应,要么是对长时间低温的反应。在拟南芥的自主途径中,与该途径相关的所有基因都在分生组织中表达。自主途径通过减少开花抑制基因 FLOWERING LOCUS C (FLC) 的表达起作用,FLC 是 SOC1 表达的抑制剂。春化作用也会抑制 FLC,但通过不同的机制(表观遗传开关)。由于 FLC 基因是共同的靶标,因此自主途径和春化途径被归为一组。
20_Taiz7e-Ch20.indd 613
● 赤霉素途径主要在非诱导短日照下开花,在长日照下也略有需要。外源赤霉素可以通过促进 FT、SOC1 和 LFY 的表达来促进这些非诱导条件下的开花。
所有四种途径主要集中在关键花卉调节剂 FT 在维管系统中的表达上。
然后,FT 蛋白传递诱导信号,使 SOC1、LFY 和 AP1 在分生组织中表达(见图 20.16),进而激活花器官发育所需的下游基因,如 AP3、PIS
TILLATA (PI) 和 AGAMOUS (AG),我们将在下一节中看到。
20.9 花分生组织和花器官发育
一旦开花,花朵的形成就开始了。花朵的形状极其多样,反映了保护发育中的配子体、吸引传粉者、促进自花授粉或异花授粉以及产生和散播果实和种子的适应性。尽管存在这种多样性,但遗传和分子研究现已确定了一个基因网络,这些基因控制着与拟南芥和金鱼草 (Antirrhinum majus) 的花朵不同的花朵的花形态发生。这种调控网络的变化现在似乎也能解释其他物种的花形态发生。
在本节中,我们将重点介绍拟南芥的花发育,该植物已被广泛研究。首先,我们概述了从营养期到生殖期的过渡过程中发生的基本形态变化。然后,我们考虑分生组织上四轮花器官的排列,以及控制正常花发育模式的基因类型。
拟南芥的茎尖分生组织随着发育而变化。花分生组织通常可以通过其较大的尺寸与营养分生组织区分开来。在营养分生组织中,中心区域的细胞缓慢地完成其分裂周期。从营养发育到生殖发育的转变以茎尖分生组织中心区域内细胞分裂频率的增加为标志(见第 18 章)。分生组织大小的增加主要是由于这些中心细胞分裂率的增加。在营养生长阶段,拟南芥顶端分生组织产生节间非常短的叶片,从而形成叶基莲座丛(图 20.20)。当生殖发育开始时,营养分生组织转变为初生花序 4/29/22 10:24 AM
614 第 20 章
茎生叶
图 20.20 拟南芥花序结构。 (A) 拟南芥的茎尖分生组织在不同的发育阶段产生不同的器官。在发育早期,茎尖分生组织形成基生叶莲座丛。当植物过渡到开花时,茎尖分生组织转变为初级花序分生组织,最终产生细长的茎生花。在花转变之前开始的叶原基在茎上发育(茎生叶),次级花序在这些茎生叶的叶腋中发育。
(B) 开花的拟南芥植物的照片。
TZ7E 20.20
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
花序分生组织。主花序分生组织产生细长的花序轴,花序轴上长有两类侧生器官:茎生叶(或花序内叶)和花。茎生叶的腋芽发育成次级花序分生组织,其活动重复了主花序分生组织的发育模式。拟南芥花序分生组织tem 具有无限生长的潜力,因此表现出不确定的生长。
在花序中
由 Richard Amasino 提供
A 和 B 由 V. Grbic 和 M. Nelson 提供
正在发育的花朵
花分生组织
正在发育的
茎尖
在花序中
图 20.21 拟南芥营养期(A)和生殖期(B)茎尖区域的纵向切片。
花从花序分生组织侧面形成的花分生组织中产生(图 20.21)。
与花序分生组织相反,花分生茎是确定的。
四种不同类型的花器官以单独的轮生开始
TZ7E 20.21
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
花分生组织产生四种不同类型的花器官:萼片、花瓣、雄蕊和心皮。这些器官组以同心环的形式开始,称为轮生,围绕分生组织的侧面(图 20.22)。最内层器官心皮的开始消耗了顶端圆顶中的所有分生细胞,并且只有花器官原基(细胞分裂的局部区域)在花芽发育时存在。在拟南芥中,轮生花的排列如下:
● 第一轮(最外层)由四个萼片组成,
成熟时为绿色。
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 614
开花和花发育的控制 615
(A)发育中的花的纵向剖面
(B)发育中的花的横截面,显示口轮
图 20.22 拟南芥的花分生组织依次启动花器官。(A 和 B)花器官以连续的轮生(同心圆)形式产生,
从萼片开始向内发展。 (C) 根据组合模型,每个轮生的功能为
轮生 1:萼片
轮生 2:花瓣
轮生 3:雄蕊
轮生 4:心皮
(C) 由三个重叠的发育域确定的发育域示意图。这些发育域对应于特定花器官身份基因的表达模式。(J. D. Bewley 等人,2000 年。《植物生物化学和分子生物学》,B. B. Buchanan 等人,[编],马里兰州罗克维尔:美国植物生物学家协会。)
● 第二轮生由四片花瓣组成,成熟时为白色。
● 第三轮生包含六个雄蕊(雄性生殖结构),其中两个比其他四个短。
● 第四轮(最内轮)是一个单一的复杂器官,即雌蕊或雌蕊(雌性生殖结构),由一个子房和两个融合的心皮组成,每个心皮包含许多胚珠,以及一个顶部有柱头的短花柱。
两大类基因调节花发育
TZ7E 20.22
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-7-22
突变研究使我们能够识别出两类调节花发育的关键基因:花分生组织身份基因和花器官身份基因。
1. 花分生组织身份基因编码转录因子,这些因子对于花器官身份基因的初始诱导必不可少。它们是发育中的花分生组织中花器官身份的正调节剂。
2. 花器官身份基因直接控制花器官身份。这些基因编码的蛋白质是转录因子,它们与其他蛋白质辅因子相互作用,控制下游基因的表达,这些基因的产物参与花器官的形成或功能。虽然某些基因恰好适合这两大类,但重要的是要记住,花卉发育涉及复杂的非线性基因网络。在这些网络中,单个基因通常发挥多种作用。例如,进化已经招募了相同的转录因子 APETALA2,首先调节花分生组织身份,然后调节花器官身份(表 20.3)。花分生组织身份基因调节
分生组织功能
花分生组织身份基因必须处于活性状态,才能使在茎端分生组织或花序分生组织侧面形成的
未成熟原基成为
花分生组织。(回想一下,在其侧面形成花分生组织的
顶端分生组织被称为
花序分生组织;见图 20.21。)例如,花分生组织身份基因 FLORICAULA (FLO) 缺陷的金鱼草 (Antirrhinum) 突变体会形成不产生花的花序。
flo 突变体不会在苞片腋中发育花分生组织,而是在苞片腋中发育额外的花序分生组织。因此,野生型 FLO 基因控制确定花分生组织身份的决定步骤。
在拟南芥中,LEAFY(LFY)、FLOWERING D(FD)、
CONSTANS1 过度表达的抑制因子(SOC1)和 APETALA1(AP1)是遗传途径中必须激活才能建立花分生组织身份的关键基因(见表 20.3)。LFY 是金鱼草 FLO 基因的拟南芥版本。正如我们在图 20.16 中看到的,LFY、FD 和 SOC1 通过整合来自涉及环境和内部线索的几种不同途径的信号,在花的诱发中发挥核心作用。lfy 和 fd 双突变体无法形成花,突出了 LFY 和 FD 作为花分生组织身份基因的作用,它们是花发育起始的主要调节器。 4/29/22 10:24 AM
616 第 20 章
同源异型突变导致花器官身份基因的鉴定
决定花器官身份的基因被发现为花同源异型突变体。果蝇 (Drosophila) 的突变导致鉴定出一组编码转录因子的同源异型基因,这些转录因子决定特定结构发育的位置。同源异型基因充当主要发育开关,可激活特定结构的整个遗传程序。因此,同源异型基因的表达赋予器官身份。
花器官身份基因首先被鉴定为单基因同源异型突变,它改变了花器官身份,导致一些花器官出现在错误的位置。最初在拟南芥中发现了决定花器官身份的五个关键基因:APETALA1 (AP1)、APETALA2 (AP2)、APETALA3 (AP3)、PISTILLATA (PI) 和 AGAMOUS (AG)。这些基因的突变极大地改变了两个相邻轮生花器官的结构,从而改变了其身份(图 20.23)。例如,具有 ap2 突变的植物缺乏萼片和花瓣(见图 20.23B)。具有 ap3 或 pi 突变的植物在第二轮中产生萼片而不是花瓣,在第三轮中产生心皮而不是雄蕊(见图 20.23C)。缺乏 ag 突变纯合子的植物
表 20.3 调节开花的基因
转录
因子家族功能
表达
域直系同源物
常数 (CO) 锌指激活开花
以响应长
光周期
在长
光周期下的叶子中
AtCO(马铃薯);
Hd1 (水稻)
开花 D (FD) bZIP 成花素受体,
激活开花
在茎尖 OsFD1 (水稻)
抑制因子
过表达
恒河猴1 (SOC1)
MADS 激活下游开花
叶子和顶端
光敏色素
相互作用因子4
bHLH 激活响应高温的成花素
叶子和顶端
开花位点C MADS 花卉抑制因子 叶子和顶端
短营养期
MADS 抑制低温开花
叶子和顶端
开花位点M
MADS 抑制开花 叶子和顶端
多叶 (LFY) LFY 花分生组织身份
茎尖 RLF (水稻); FLORICAULA
(金鱼草)
APETALA1 (AP1) MADS A 类同源异型基因,
分生组织身份
花分生组织,
(金鱼草);ZAP1,
GLOSSY15(玉米
[corn, Zea mays])
APETALA2 (AP2) AP2/EREBP A 类同源异型基因,
花分生组织身份
花分生组织,
FLORETLESS1(玉米)
PISTILLATA (PI) MADS B 类同源异型基因轮生 2 和 3 GLOBOSA(金鱼草)
AGAMOUS (AG) MADS C 类同源异型基因轮生 3 和 4 PLENA 和 FARINELLI
(金鱼草);扎格1
和 ZMM2(玉米)
SEPALLATA (SEP) 1, 2, 3, 4 MADS E 类同源异型基因 轮生 1–4 DEFH49、DEFH200、
DEFH72、AmSEP3B
(金鱼草); ZMM3, 8, 14 (玉米)
花椰菜 (CAL) MADS 分生组织身份 花分生组织
FRUITFULL (FUL) MADS 花分生组织身份 花分生组织和
茎生叶
20_Taiz7e-Ch20.indd 616 20_Taiz7e-Ch20.indd 616 4/29/22 10:24 AM 4/29/22 10:24 AM
开花和花发育的控制 617
图 20.23 花器官身份基因突变会显著改变花的结构。(A) 野生型拟南芥的四个花部结构均正常。
(B) apetala2-2 突变体缺乏萼片和花瓣。 (C) pistillata2 突变体
缺少花瓣和雄蕊。 (D) aga
mous1 突变体
缺少雄蕊
和心皮。 (J. D. Bewley
等人,2000 年。在:植物生物化学和分子生物学,B.B.
Buchanan 等人 [编辑],马里兰州罗克维尔:美国植物生物学家协会。)
照片来自 J. L. Riechmann
和 E. M. Meyerowitz。1997 年。
Biol. Chem. 378: 1079–1118;
由 J. L. Riechmann
和 E. Meyerowitz 提供
apetala2-2
pistillata2
雄蕊和心皮(见图 20.23D)。因为这些基因的突变会改变花器官的身份,而不会影响花的形成,所以根据定义,它们是同源异型基因。器官身份基因在花发育中的作用通过实验得到了生动的说明,在这些实验中,两种或三种活性因功能丧失突变而消失。在四重突变的拟南芥植物(ap1、ap2、ap3/pi 和 ag)中,花分生组织不再产生花器官,而是产生绿色的叶状结构;这些叶状器官的产生具有轮生叶序,这是正常花朵的典型特征(图 20.24)。
该实验结果表明,叶子是茎分生组织产生的器官的“基态”,而 AP1 和 AP2 等其他基因的活性是将叶状“基态”器官转化为花瓣、萼片、雄蕊和雌蕊所必需的。这一结果支持了 18 世纪德国诗人和自然科学家约翰·沃尔夫冈·冯·歌德 (1749-1832) 的观点,他推测花器官是高度改良的叶子。
TZ7E 20.23
ABC 模型部分解释了
花器官身份的确定
我们刚刚描述的五个花器官身份基因分为三类 - A,B 和 C - 定义了由三种不同类型的基因编码的三种不同类型的活动(图 20.25):
● 由 AP1 和 AP2 编码的 A 类活动控制第一和第二轮中的器官身份。
A 类活动的丧失导致第一轮中形成心皮而不是萼片,第二轮中形成雄蕊而不是花瓣。
● 由 AP3 和 PI 编码的 B 类活动控制第二和第三轮中的器官决定。
B 类活动的丧失导致第二轮中形成萼片而不是花瓣,第三轮中形成心皮而不是雄蕊。
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
图 20.24 拟南芥的四重突变体 (ap1、ap2、ap3/pi、ag) 产生叶状结构来代替花器官。
20_Taiz7e-Ch20.indd 617
● 由 AG 编码的 C 类活性控制第三和第四轮中的事件。C 类活性的丧失导致第三轮中形成花瓣而不是雄蕊。此外,在没有 C 类活性的情况下,第四轮(通常是心皮)被新花取代。因此,ag 突变体花的第四轮被萼片占据。花分生组织不再是确定的。
花在花内继续形成,器官的模式(从外到内)为:萼片、花瓣、花瓣;萼片、花瓣、花瓣;等等。
John Bowman 供图
ABC 模型解释了两个远亲真双子叶植物(金鱼草和拟南芥)的许多观察结果,并提供了一种理解相对较少的关键调节器如何组合提供复杂结果的方法。ABC 模型假定每个轮生器官的身份由三种器官身份基因活动的独特组合决定(见图 20.25):
● A 类活动单独指定萼片。
● A 类和 B 类活动是花瓣形成所必需的。
4/29/22 10:24 AM
618 第 20 章
● B 类和 C 类活动形成雄蕊。
● 仅 C 类活性决定心皮。
该模型进一步提出,A 类和 C 类活性相互抑制;也就是说,除了在确定器官身份方面发挥作用外,A 类和 C 类基因还相互排斥在表达域之外。
虽然该模型预测并解释了野生型花和大多数突变体器官形成的模式,但并非所有观察结果都可以仅用 ABC 基因来解释。例如,整个植物中 ABC 基因的表达不会将营养叶转化为花器官。因此,ABC 基因虽然是必需的,但不足以将花器官身份强加到叶子发育程序上。
正如我们接下来讨论的那样,花分生组织身份基因编码的转录因子也是花瓣、雄蕊和心皮形成所必需的。
拟南芥 E 类基因是 A、B 和 C 基因活动所必需的
自从 A、B 和 C 基因被鉴定以来,另一类花同源基因,即 E 类基因被发现。在花同源突变体的突变体筛选中鉴定的其他三个基因 AGAMOUS-LIKE1-3 (AGL1-3) 的突变在单独突变时仅产生细微表型。然而,agl1/agl2/agl3 三重突变体的花仅由萼片状结构组成,这表明先前在三个单独突变的 AGL 基因中观察到的细微表型是由于功能冗余造成的。由于三重突变体具有富含萼片的表型,因此三个 AGL 基因被重新命名为 SEPALLATA1-3 (SEP1-3),并作为 E 类基因添加到 ABC 模型中(图 20.26)。 (D 类基因是胚珠形成所必需的,将在本节后面描述。) 萼片 花 结构 花瓣 雄蕊 心皮 sepallata1-4 摘自 B. A. Krizek 和 J. C. Fletcher。2005 年。自然评论
Genet。6:688–698
图 20.26 花发育的 ABCE 模型。 (A) 在 sepallata1–4 突变体中,所有花器官都类似于营养叶,这表明 SEP 基因是花分生组织身份所必需的。 (B) 花发育的 ABCE 模型器官决定,其中 SEP 充当花器官识别所需的 E 类基因。(来自 B. A. Krizek 和 J. C. Fletcher。
2005. Nat. Rev. Genet. 6: 688–698。)
TZ7E 20.25
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-7-22
萼片结构 花瓣 雄蕊 心皮
萼片结构 花瓣 花瓣 萼片
心皮结构 雄蕊 雄蕊 心皮
萼片结构 萼片 心皮
(A) 野生型
(B) C 类活性丧失
(C) A 类活性丧失
(D) B 类活性丧失
图 20.25 基于 ABC 模型对花同源突变体表型的解释。 (A) 所有三种活性
类在野生型中均有功能。 (B) C 类活性的丧失
导致 A 类活性在整个花分生组织中扩展。
(C) A 类活性的丧失导致 C 类活性在整个分生组织中扩散。 (D) B 类活性的丧失导致仅表达 A 类和 C 类活性。 (J. D. Bewley 等人 2000 年版。在:植物生物化学和分子生物学,B.B. Buchanan 等人 [编辑],马里兰州罗克维尔:美国植物生物学家协会。)20_Taiz7e-Ch20.indd 618 20_Taiz7e-Ch20.indd 618 4/29/22 10:24 AM 4/29/22 10:24 AM 开花和花卉发育的控制 619 莲座叶子叶 A 和 B 来自 S. Pelaz 等人 2001 年。Curr. Biol. 11: 182–184
图 20.27 通过异位表达 E 类基因与 A 类和 B 类基因,将子叶和营养叶转化为花瓣。过表达 SEP3/AP1/AP3/PI (A) 或 AP1/AP3/PI/
SEP2/SEP3 (B) 转基因的拟南芥植物。
另一个 SEPALLATA 基因 SEP4 与其他三个 SEP 基因重复,赋予萼片身份,并有助于其他三种器官类型的发育。sep 四重突变体显示所有四种花器官类型都转化为叶状结构,类似于 ap1、ap2、ap3/pi 和 ag 四重突变体(见图 20.24 和 20.26)。值得注意的是,通过表达 E 类基因与 A 类和 B 类基因的组合,可以将子叶和营养叶转化为花瓣(图 20.27)。 ABCE 模型是基于拟南芥和金鱼草的遗传实验而制定的。不同物种的花通过修改 ABCE 模型描述的调控网络而进化出不同的结构(参见 WEB 主题 20.12)。 TZ7E 20.27 根据四重奏模型,花器官身份受 ABCE 蛋白四聚体复合物的调控。 植物生理学 7/E Taiz/Zeiger OUP/Sinauer Associates Morales Studio 日期 4-19-22 迄今为止在植物和动物中已鉴定的所有同源异型基因都编码转录因子。然而,与包含同源框序列的动物同源基因不同,大多数植物同源基因属于一类称为 MADS 框基因的相关序列。首字母缩略词 MADS 基于一个大基因家族的四个创始成员(微染色体维护 1 [MCM1]、AGAMOUS、DEFICIENS 和血清反应因子 [SRF])。决定花器官身份的许多基因都是 MADS 框基因,包括金鱼草的 DEFICIENS 基因和拟南芥的 AGAMOUS (AG)、PISTIL LATA (PI) 和 APETALA3 (AP3) 基因(见表 20.3)。MADS 框基因具有一个称为 MADS 框的特征保守核苷酸序列,该序列编码称为 MADS 结构域的蛋白质结构(图 20.28A)。与 MADS 结构域相邻的是中间区域,其后是 K 结构域,K 结构域是主要参与蛋白质-蛋白质相互作用的卷曲螺旋区域。MADS
20_Taiz7e-Ch20.indd 619
中间区域 (I)
结构域 (MADS)
卷曲螺旋
结构域 (K)
非保守
羧基末端
结构域 (C)
蛋白质-蛋白质相互作用
图 20.28 MADS 盒结构域与靶基因相互作用的模型。(A) MADS 盒转录因子的结构域结构。 (B) MADS 盒转录因子的四聚体与其靶基因调控区中的一对 CArG 盒基序结合,从而导致 DNA 弯曲。
DNA 弯曲可以激活或抑制靶基因。
TZ7E 20.28
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-7-22
盒基因转录因子形成四聚体,与 CC(A/T)6GG 序列(即所谓的 CArG-box)结合,位于其靶基因的调控区。当四聚体与同一靶基因上的两个不同 CArG-box 结合时,这些盒子会靠近,从而导致 DNA 弯曲(图 20.28B)。
并非所有同源基因都是 MADS 盒基因,也并非所有包含 MADS 盒域的基因都是同源基因。例如,同源基因 AP2 是 AP2/ERF(乙烯反应元件结合因子)转录因子家族的成员,而花分生组织身份基因 SOC1 是 MADS 盒基因。
为了更机械地理解ABCE 模型是一种生化相互作用模型,称为四重奏模型,已被提出(图 20.29)。在四重奏模型中,ABCE 基因组合的四聚体直接结合 DNA 并指定花器官。该模型基于以下观察:MADS 盒基因二聚化,两个二聚体可以结合在一起形成四聚体。这些四聚体被假设结合靶基因上的 CArG 盒并修改其表达(见图 20.28B)。虽然所有 MADS 盒蛋白都可以形成高阶复合物,但并非所有这些蛋白都能结合 DNA。例如,B 类因子(AP3 和 PI)仅作为异二聚体结合 DNA,而 A、C 和 E 类的同二聚体和异二聚体都可以结合 DNA。根据该模型,由不同的同源二聚体和异源二聚体组成的四聚体
MADS 结构域蛋白可以发挥组合控制作用
4/29/22 10:24 AM
620 第 20 章
拟南芥
APETALA3/PISTILLATA
APETALA1 & 2 AGAMOUS
SEPALLATA1-4
雄蕊心皮
蛋白质相互作用四重奏模型
对花器官身份。例如,AP3-PI 异源二聚体直接与 AP1 和 SEP3 相互作用以促进花瓣形成,并在 SEP3 作为支架的帮助下间接与 AG 相互作用。一般来说,SEP 蛋白似乎充当辅助因子,通过与其产物形成复合物为 ABC 基因提供花特异性活性,并且似乎是激活 ABC 基因表达所必需的。 D 类基因是胚珠形成所必需的
TZ7E 20.29
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 2-7-22
根据 ABCE 模型,心皮形成需要 C 类和 E 类基因的活性。然而,似乎与 C 类基因密切相关的第三组 MADS 盒基因是胚珠形成所必需的。
这些胚珠特异性基因被称为 D 类基因。
由于胚珠是心皮内的结构,因此 D 类基因严格来说不是“器官身份基因”,尽管它们在指定胚珠方面以大致相同的方式发挥作用。D 类活动最早是在矮牵牛中发现的。
沉默已知参与矮牵牛花发育的两个 MADS 盒基因 FLORAL-BINDING
PROTEIN7/11 (FBP7/11) 会导致花柱和柱头在胚珠正常占据的位置生长。
当 FBP11 在矮牵牛中过表达时,胚珠原基在萼片和花瓣上形成。
在拟南芥中,SHAT
TERPROOF1 或 SHATTERPROOF2 (SHP1、SHP2) 或
SEEDSTICK (STK) 的异位表达足以诱导萼片转化为带有胚珠的心皮器官。此外,stk/shp1/shp2 三重突变体缺乏正常的胚珠。
因此,除了 C 类和 E 类基因外,D 类基因也是正常胚珠发育所必需的。
图 20.29 拟南芥花器官特化的四重奏模型。在轮状体 1 中,A 类 (AP1 和
AP2) 和 E 类 (SEP) 基因的表达导致萼片的形成。在轮状体 2 中,A 类 (AP1、AP2)、B 类 (AP3、PI) 和 E 类 (SEP) 基因的表达导致花瓣的形成。在轮状体 3 中,B 类 (AP3、PI)、C 类 (AG) 和 E 类 (SEP) 基因的表达导致雄蕊的形成。在轮状体 4 中,C 类 (AG) 和 E 类 (SEP) 基因指定心皮。此外,A 类活性
(AP1 和 AP2)抑制轮 1 和
2 中的 C 类活性(AG),而 C 类活性抑制轮 3 和
4 中的 A 类活性。根据四重奏模型,每个花器官的身份由四种花同源异型蛋白(称为 MADS 盒蛋白)组合决定。
每个四聚体的两个二聚体识别同一 DNA 链上的两个不同 DNA 位点(称为 CArG 盒,此处显示为紫色),它们通过 DNA 弯曲而紧密接近。请注意,SEPALLATA 蛋白存在于所有四个复合体中,用于将其他蛋白质招募到复合体中。多聚体复合体的确切结构是假设的。花朵的花不对称性受基因表达调控
虽然许多花朵(如拟南芥的花朵)是径向对称的,但许多植物已经进化出具有双侧对称性的花朵,这使得它们能够形成专门的结构来吸引传粉者。例如,金鱼草花朵的近轴(背部)花瓣的形状与远轴(腹部)花瓣的形状有明显差异(图 20.30)。这是如何发生的?同样,与 ABCE 模型一样,遗传学提供了答案。自 18 世纪以来,人们就知道了破坏左右对称花朵发育的突变。Carl Linnaeus 是第一个描述亚麻花(Linaria vulgaris)自然发生的突变体的人,该突变体将双侧对称的花朵转变为径向对称的形式(图 20.31)。柳叶菜属的花通常有
花冠,有四个雄蕊和一个蜜距。
林奈描述的这个奇异的标本有五雄蕊和五条蜜距。林奈将这种异常的径向对称状态称为 peloria,源于希腊语“怪物”一词。
最近,Antirrhinum majus 中的类似(“peloric”)突变体使人们能够从遗传上剖析花对称性指定的分子机制。突变基因 RADIALIS (RAD) 的克隆揭示了 RAD 控制花不对称的调控机制(见图 20.30)。RAD 编码 MYB 家族的转录因子,该转录因子抑制另一个称为 DIVARICATA (DIV) 的关键基因。当 DIV 发生突变时,它会导致花朵的所有花瓣看起来像近轴花瓣。因此,DIV 决定了花朵的远轴花瓣身份。其他突变体的分析
4/29/22 10:24 AM
20_Taiz7e-Ch20.indd 620
开花和花发育的控制 621
© Artex67/iStock
图 20.30 金鱼草的花不对称。
(A 和 B) 金鱼草花表现出双侧对称性。
(C) DIVARICATA (DIV) 基因编码 MYB 转录因子,该因子促进整个花朵的远轴身份。
CYCLOIDEA (CYC) 和 DICHOTOMA (DICH) 编码相关
表明 RAD 决定近轴花瓣身份。
RAD 转录因子由另外两个基因 CYCLOIDEA 和 DICHOTOMA 激活,这两个基因在近轴花瓣中表达。因此,RAD 的表达使得 DIV 在花的近轴部分受到抑制。当 RAD 不在花的底部表达时,DIV 会表达并决定花的远轴命运。
到目前为止,我们对花发育的理解主要基于三种模式物种,即拟南芥、金鱼草和水稻。未来的挑战之一是探索在更广泛的开花植物中调节花发育的基因网络的变化。第二个挑战是尝试了解花发育途径是如何从非开花祖先进化而来的。这类研究有朝一日可能会解开达尔文的“可恶之谜”——被子植物的进化。
TZ7E 20.30
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-19-22
Staminodium
转录因子激活 RADIALIS (RAD) 基因。RAD 蛋白拮抗花近轴部分的 DIV,并将其活性限制在侧向和远轴域。(B 和 C 源自 B. A. Krizek 和 J. C. Fletcher。2005 年。
Nat. Rev. Genet. 6: 688–698。)
图 20.31 柳穿鱼 (Linaria
vulgaris) 的 peloria 突变体。左侧显示具有双侧对称性的 Linaria 正常花朵,右侧显示径向对称的 peloria 突变体。目前已知,亚麻花的形成是由于 Linaria CYCLOIDEA 基因通过 DNA 甲基化失活所致。
花器官(萼片、花瓣、雄蕊和心皮)的形成发生在茎尖分生组织,与内部(自主)和外部(环境)信号有关。已在多个物种中发现了控制花形态发生的基因网络。
20.1 花的唤起:整合环境线索
■ 内部(自主)和外部(环境感应)控制系统使植物能够精确地调节和安排开花时间,以实现繁殖成功。
(对日照长度变化的反应)和春化(对长期寒冷的反应)。
■ 同步开花有利于异花授粉,并有助于确保在有利条件下种子生产。
20.2 茎尖和阶段变化
TZ7E 20.31
■ 在植物中,从幼年到成年的转变
通常伴随着营养特征的变化(图 20.1)。
■ 影响花朵发育的两个最重要的季节性反应是光周期
20_Taiz7e-Ch20.indd 621
植物生理学 7/E Taiz/Zeiger
OUP/Sinauer Associates
Morales Studio 日期 4-18-22
(续)
来自 A. Busch 和 S. Zachgo。 2009.
BioEssays 31: 1181–1190
4/29/22 10:24 AM
622 第 20 章
总结(续)
20.3 昼夜节律:内在的时钟
■ 昼夜节律基于由相互作用的转录因子组成的内源性振荡器,而不是光的存在或不存在(图 20.3)。
■ 昼夜节律由三个参数定义:周期、相位和振幅(图 20.4A)。
■ 温度补偿可防止温度变化影响昼夜节律时钟的周期。
■ 植物色素和隐花色素会调节昼夜节律时钟。
20.4 光周期:监测日照长度
■ 植物可以在远离赤道的纬度地区检测到日照长度的季节性变化(图 20.5)。
■ 长日照植物开花需要日照长度超过一定时间,称为临界日照长度。长日照植物开花需要日照长度小于临界日照长度(图 20.7)。
■ 长日照植物和短日照植物的叶片都能感知光周期刺激。
■ 测量日照长度ht 对于监测日照长度的变化很重要;SDP 和 LDP 的开花都可以通过黑暗持续时间来确定(图 20.8)。
■ 对于 LDP 和 SDP,可以通过短暂的光照(夜间休息)中断黑暗期而使其无效(图 20.9)。
■ 开花对夜间休息的反应表现出昼夜节律,支持时钟假说(图 20.10)。
■ 在外部巧合模型中,当光照与振荡器的适当相位一致时,SDP 和 LDP 都会诱导开花。
■ CO(在拟南芥中)和 Hd1(在水稻中)通过控制花刺激基因的转录来调节开花(图 20.11)。
■ CO 蛋白在光照和黑暗中的降解速率不同。光照增强了 CO 的稳定性,使其能够在白天积累;而在黑暗中,CO 会迅速降解。
■ 红光和远红光夜间休息的影响表明,光敏色素在 SDP 和 LDP 中控制开花(图 20.12、20.13)。
■ 当诱导光处理与光敏性峰值相吻合时,LDP 中的开花得到促进,而光敏性峰值遵循昼夜节律(图 20.14)。
20.5 与开花有关的长距离信号传导
■ 在光周期植物中,长距离信号从叶片传输到顶端的韧皮部,从而允许花的产生(图 20.15)。
20.6 成花素的鉴定
■在诱导光周期下,FT 蛋白通过韧皮部从叶片移动到茎尖分生组织。在分生组织中,FT 与转录因子 FD 形成复合物,激活花身份基因(图 20.16)。
20.7 春化:促进开花
■在敏感植物中,需要冷处理才能使植物对诱导光周期等花信号作出反应(图 20.17、20.18)。
■要发生春化,冷处理期间需要主动代谢。
■春化后,FLC 基因在植物生命周期的剩余时间内被表观遗传关闭,允许拟南芥在长日照下开花(图 20.19)。
■ FLC 的表观遗传调控涉及染色质结构的稳定变化。
■ 在开花植物中,已经进化出各种春化途径。
20.8 参与开花的多种途径
■ 控制开花的四种不同途径汇聚在一起,增加关键花卉调节剂的表达:维管系统中的 FT 和分生组织中的 SOC1、LFY 和 AP1(图 20.16)。
20.9 花分生组织和花器官发育
■ 四种不同类型的花器官在单独的同心轮中按顺序启动(图 20.22)。
■ 同源异型花卉身份基因的突变会改变每个轮中产生的器官类型(图 20.23、20.24)。
■ ABC 模型表明,每个轮生器官的身份由三个器官身份基因的联合活性决定(图 20.25)。
■ E 类花分生组织身份基因(例如 SEPALLATA)的表达是 A、B 和 C 类基因表达所必需的(图 20.26)。
■ 许多花器官身份基因编码含有 MADS 结构域的转录因子,这些转录因子可作为异四聚体发挥作用(图 20.28,表 20.3)。四重奏模型描述了这些转录因子如何共同作用以指定花器官(图 20.29)。
■ ABCE 模型的变化可以解释被子植物花结构的多样性(图 20.30、20.31)。
网络资料
■网络主题 20.1 气候变化导致野生植物开花时间发生可测量的变化 植物能够感知到少至 1ºC 的温度差异,环境温度升高会加速许多物种的开花。
■网络主题 20.2 对比英国常春藤 (Hedera helix) 和玉米 (Zea mays) 的幼年和成年阶段的特征 下面列出了幼年和成年形态特征的表格。
■WEB 主题 20.3 嫁接到成年植物上的幼年分生组织的开花 可以在嫁接实验中测试幼年分生组织的开花能力。
■WEB 主题 20.4 能力和决定是花诱导的两个阶段 已经进行了实验来确定花诱导过程中的能力和决定。
■WEB 主题 20.5 昼夜节律中相移反应的特征 伽蓝菜的花瓣运动已被用于研究昼夜节律。
■WEB 主题 20.6 光敏色素 A 和 B 对开花的对比作用 PhyA 和 phyB 影响拟南芥和其它物种的开花。
■WEB 主题 20.7 支持蓝光调节昼夜节律的作用 ELF3
在介导蓝光对开花时间的影响方面发挥作用。
■WEB 主题 20.8 控制开花的基因
Ti我 讨论了控制开花时间不同方面的基因。
■网络主题 20.9 花刺激的自繁殖性质 在某些物种中,诱导状态可以通过嫁接几乎无限期地转移。
■网络主题 20.10 光周期和春化作用对坎特伯雷钟形花的调节 作用于叶片的短日照可以代替坎特伯雷钟形花茎尖的春化作用。
■网络主题 20.11 赤霉素对具有不同开花环境要求的植物进行花诱导的例子 表格中列出了赤霉素对具有不同光周期要求的植物的影响。
■WEB 主题 20.12 单子叶植物的花器官身份基因 ABCE 模型的变化与不同单子叶植物和真双子叶植物的对比花形态有关。
有关更多学习辅助工具,请访问 oup.com/he/taiz7e。
摘要(续)
推荐阅读
Ali, Z., Raza, Q., Atif, R. M., Aslam, U., Ajmal, M., 和 Chung, G.
(2019)谷物花器官身份的遗传和分子控制。国际分子科学杂志 20:2743。
Amasino, R.(2010)开花的季节和发育时间。植物杂志 61:1001–1013。
Andrés, F. 和 Coupland, G. (2012) 开花对季节性线索反应的遗传基础。自然遗传学评论
13: 627–639。
Busch, A. 和 Zachgo, S. (2009) 花对称性进化:了解被子植物辐射的可怕奥秘。生物论文集 31: 1181–1190。
Causiera, B.、Schwarz-Sommerb, Z. 和 Davies, B. (2010) 花器官身份:20 年的 ABC。细胞发育生物学研讨会
21: 73–79。
Huijser, P. 和 Schmid, M. (2011) 植物发育阶段转变的控制。 Development 138:4117–4129。
Jaeger, E.、Pullen, N.、Lamzin, S.、Morris, R. J. 和 Wigge, P. A.
(2013) 互锁反馈回路控制拟南芥花期转变的动态
行为。Plant Cell
25:820–833。
Krizek, B. A. 和 Fletcher, J. C. (2005) 花发育的分子机制:扶手椅指南。Nat. Rev. Genet.
6:688–698。
Lee, J. 和 Lee, I. (2010) 开花途径整合子 SOC1 的调节和功能。J. Exp. Bot. 61:2247–2254。
]]
尽管顶端分生组织和形成层分生组织之间存在广泛的相似性,但也存在显着差异。例如,两个激酶受体家族 PXY 和 ERECTA 在遗传上相互作用以指导次生维管发育。然而,这两个基因家族之间的相互作用在茎和下胚轴中的连接方式不同,导致每个器官的表型不同。
Liu, L., Liu, C., Hou, X., Xi, W., Shen, L., Tao, Z., Wang, Y., 和 Yu,
=== 几种植物激素调节维管形成层活动和次生木质部和韧皮部的分化 ===
与植物中的许多其他过程一样,激素在调节次生生长方面发挥着重要作用。几种激素为不同细胞类型和组织的生长和分化提供位置提示和信号(图 19 .19)。这里我们重点关注四种激素,因为大量的实验证据支持它们在调节次生生长中的作用。
H. (2012) FTIP1 是成花素运输所必需的调节因子。PLOS Biol. 10(4): e1001313。
虽然树木中的生长素运动尚未得到广泛研究,但据推测生长素是在叶子和顶端分生组织中产生的,并通过极性生长素运输到茎和维管形成层。在被子植物和裸子植物的维管形成层和分化木质部和韧皮部中,都测量了生长素浓度。'''与最近确定的指定拟南芥形成层组织者的生长素反应最大值类似,树木中的生长素浓度峰值出现在形成层的木质部表面,并朝着分化木质部和韧皮部的方向降低。朝向韧皮部的下降幅度更大,而朝向木质部的下降幅度则要平缓得多。这种跨越形成层带的生长素浓度梯度导致人们推测,生长素在木质部和韧皮部分化中的作用是基于径向形态发生素梯度的。'''
Liu, L., Zhu, Y., Shen, L., 和 Yu, H. (2013) 对成花素运输的新见解。Curr. Opin. Plant Biol. 16: 607–613。
外源处理也支持了生长素的关键作用,表明在去顶树中施用生长素会诱导形成层的重新激活,而这棵去顶树的维管形成层本来已经失去活性。最近,直接操纵转基因杨树中生长素的反应表明,生长素敏感性对于形成层的平周分裂和垂周分裂都至关重要,并影响木质部细胞的生长和分化。
20_Taiz7e-Ch20.indd 623 20_Taiz7e-Ch20.indd 623 4/29/22 10:24 AM 4/29/22 10:24 AM
赤霉素在次生生长中也发挥着重要而独特的作用。'''与生长素一样,生物活性赤霉素在木材形成区表现出浓度梯度,但与生长素不同的是,峰值移动至发育中的木质部中。用赤霉素对缺乏生长素的去顶幼苗进行外源处理可激活形成层细胞分裂。然而,分裂细胞失去了其典型形状,无法分化成木质部。同时施用生长素和赤霉素可防止在单独使用赤霉素处理时观察到的异常,并刺激形成层分裂,其程度是单独使用赤霉素或生长素处理时未观察到的,这表明两种激素具有协同作用(见图 19 .19)'''。 赤霉素生物合成途径中几种基因的代谢谱和表达表明,木材形成组织中的赤霉素代谢还涉及赤霉素前体从韧皮部横向通过射线运输到分化木质部,然后在那里转化为生物活性形式。外源处理和转基因操作均表明赤霉素对纤维细胞的伸长有积极影响,纤维细胞在植物中具有结构功能,具有厚的细胞壁和高的长径比(见第 1 章)。这表明赤霉素在木质部细胞分化和生长中起着作用。
624 第 20 章
细胞分裂素也与调节次生生长有关(见图 19.19)。转基因杨树形成层区细胞分裂素浓度的特定降低导致严重损害径向生长和形成层的细胞分裂。'''该结果与细胞分裂素浓度在形成层的韧皮部侧达到峰值以及编码细胞分裂素受体和参与细胞分裂素信号传导的主要反应调节剂的基因在形成层区的表达有关。'''这表明细胞分裂素是形成层细胞增殖的重要调节剂。
Rijpkemaa, A. S., Vandenbusscheb, M., Koesc, R., Heijmansd, K.,
乙烯是另一种激素,它被强烈地暗示为次生生长的调节剂。'''发现乙烯前体 1-氨基环丙烷-1-羧酸 (ACC) 的浓度在形成层区很高,但与生长素和赤霉素不同,没有检测到梯度'''。'''乙烯处理和 ACC 喂养实验表明乙烯是形成层活动、径向生长和次生木质部形成的正调节剂。'''这些结果也与转基因操作杨树乙烯生物合成和响应的结果一致。'''乙烯在应拉木的形成中起着重要作用,'''应拉木是被子植物中一种特殊的反应木,在茎弯曲或倾斜引起的组织中形成(参见 WEB主题 19 .7)。'''乙烯生物合成和信号基因的表达在应拉木形成区均升高,对乙烯不敏感的转基因杨树无法产生应拉木。'''
and Gerats, T. (2010) 主题变奏:被子植物花序 ABC 的变化。Semin. Cell Dev. Biol. 21: 100–107。
=== 木栓形成层产生称为周皮的外层木栓层 ===
大多数木本真双子叶植物和裸子植物都会形成一种称为木栓形成层的次生形成层,从而产生周皮。周皮在次生生长过程中取代了表皮的保护功能。周皮由木栓形成层、木栓层和木栓内皮组成(图 19.20A)。木栓层( Phellem , or cork)是具有木栓化壁的死细胞的多层保护组织,由木栓形成层向外形成。栓内层phelloderm是向内形成的活薄壁组织。
Song, Y. H., Shim, J. S., Kinmonth-Schultz, H. A., and Imaizumi, T.
木栓形成层产生的木栓量因树种而异,栓皮栎 (Quercus suber) 代表了一个极端的例子,它包含一个永久的木栓形成层,可以无限期地产生软木或木栓。由此产生的厚厚的软木层可能保护栓皮栎的主干免于在炎热干燥的地中海气候中脱水。它也是一种极好的绝缘体,密度低,渗透性好,用于建筑、服装和葡萄酒保存。软木塞可防止葡萄酒污染,并允许少量氧气渗透,刚好足以保持葡萄酒的发酵,同时避免氧化。周皮还可以防止病原体渗透,方法是简单地用额外的层加厚表面屏障,或通过增加栓化作用(如凯氏带的情况;见第 4 章)或其他活性代谢物的含量。
(2015) 光周期开花:叶片中的时间测量机制。Annu.植物生物学Rev。 66:441-464。
虽然周皮在枝条中直接起源于表皮下,但在根中,它的起源更深,来自中柱鞘,中柱鞘被三个同心组织层(内皮层、皮层和表皮层)包围。'''通过谱系追踪实验,可以确认所有中柱鞘细胞都对木栓形成层谱系有贡献(图 19 .20B),这意味着木质部极中柱鞘细胞既是维管形成层又是木栓形成层的初始细胞。木质部极中柱鞘细胞的可塑性非常显著,因为除了对两种次生分生组织有贡献外,它们还在植物组织培养中产生再生愈伤组织,并在某些物种中产生侧根(尽管侧根有时可以从其他中柱鞘细胞衍生)'''。
宋 Y. H.、久保田 A.、权 M. S.、卡温顿 M. F.、李,
当根部木质部极中柱鞘细胞平周分裂,层数增加时,内皮层细胞开始变平(见图 19 .20A,第 1 阶段)。在韧皮部极中柱鞘侧,内皮层细胞在第 2 阶段启动程序性细胞死亡,然后随着新分生组织的进展逐渐死亡。在内皮层已经消失且存在木栓化(分化)木栓的区域,皮层和表皮细胞开始脱落,可能是通过'''abscission''',因为这些细胞仍然活着(第 3 和第 4 阶段),导致以前的保护层逐渐消失。第 5 阶段最终形成完整的分化木栓层,表皮完全消失,而任何剩余的皮层和内皮层在第 6 阶段被消除。有趣的是,侧根的出现也涉及程序性细胞死亡和abscission的结合(见第 18 章)。现在正在揭示周皮形成背后的调控网络,这将表明分子机制是否也得到了保留。
N.,Taagen,E.R.,Cintrón,D.L.,Hwang,D.W.,Akiyama,R.,
=== 树皮具有多种保护和储存功能 ===
树木的外部保护层通常被称为'''树皮bark'''。这个术语经常被错误地单独用于周皮,'''实际上包括维管形成层以外的所有组织,包括功能性次生韧皮部、破碎的非功能性次生韧皮部、破碎的初生韧皮部和周皮。'''因此,'''树皮起源于两种不同的分生组织,即木栓形成层和维管形成层。'''树皮往往很容易从树上剥落,因为维管形成层及其分裂细胞层比两侧的次生组织脆弱得多。尽管这种组织阵列对于保护韧皮部和保护木本植物免受生物和非生物威胁非常重要,但树皮的组成和控制其形成的遗传途径尚不明确,主要是因为不同物种之间的树皮高度多样化。例如,在某些树木中,如橡树,树皮厚而有裂纹,而在其他树木中,如樱桃树和桦树,树皮则光滑。树皮也可能有不同的颜色,即使是在密切相关的树种之间也是如此。
霍奇,S.K.,黄,H.,阮,N.H.,努西诺,D.A.,
树皮所含的次生代谢物的种类和数量也各不相同。虽然植物产生这些物质是为了防御机制,但人类也发现它们很有用。树皮衍生药物的经典例子是防腐和抗炎'''水杨酸(来自柳树)'''、抗疟药'''奎宁(来自金鸡纳树)'''和化疗药物'''紫杉醇(来自太平洋红豆杉)'''。最近的一项研究分析了桦木科不同物种树皮中的基因表达和代谢物,发现'''桦木醇(造成白桦树呈白色的三萜)'''在该科的其他物种(如黑桤木)中含量要少得多。该研究还强调了木栓层在产生植物防御的次生代谢产物方面的重要性,因为许多相关的代谢途径都在这种组织的形成中发挥作用。
Millar, A. J.、Shimizu, K. K. 和 Imaizumi, T. (2018) 分子
树皮还可以作为储存器官。生长季节性对多年生植物在养分利用、储存和循环利用方面提出了重大挑战。尽管所有植物物种在生长季节都有循环、储存和重新动员养分的机制,但氮(最丰富的常量营养素)的季节性循环是多年生生命习性的标志。例如,'''衰老叶片中的氮以树皮储存蛋白( bark storage proteins ,BSP)的形式储存在韧皮部薄壁组织 (inner bark )的小液泡中。'''这些蛋白质在秋季初合成,但在春季随着生长重新开始而迅速动员。
自然长日照条件下开花的基础
=== 树皮覆盖的嫩芽可以在森林火灾后发芽 ===
在第 19.2 节中,我们区分了 branch roots(在中柱鞘内部出现)和branch shoots(从叶腋的外部芽出现)。然而,有些类型的分枝可以从位于树干树皮下的epicormic buds产生。'''epicormic buds''' ,来自希腊语,意为“在树干上”。在老树的树干和树桩上,长出嫩枝和“茎芽”(没有顶芽时产生的侧芽),这种现象在被子植物和针叶树中很普遍,在塑造树木结构方面发挥着重要作用。对于适应易发生火灾的生态系统的树木来说尤其如此,例如生长在澳大利亚草原和森林中的桉树。桉树有能力在严重烧伤后长出大量嫩芽(图 19.21A)。与腋芽不同,嫩芽通常能在火灾中存活下来,因为它们被树的厚厚的树皮层与高温隔绝(图 19.21B)。
拟南芥。纳特。植物 4:824–835。
Epicormic branches可由两种epicormic buds产生:预防芽preventitious buds,即在次生生长期间保持休眠状态并被树皮覆盖的腋芽;不定芽adventitious buds,即从成熟茎组织或伤口处的愈伤组织中新生的芽。后者的一个例子是红木树瘤redwood burls,它在树干地上部分因受伤而形成。相反,在树根处形成的红木树瘤是由大簇腋芽产生的,这些腋芽开始在子叶腋中形成,然后蔓延到上方的叶腋。这会引起肿胀和次生生长,从而形成基节。这些基节充满了预防外生芽簇,它们可以在火灾后或主干被砍伐后再生出新树。
Taoka, K.-I.、Ohki, I.、Tsuji, H.、Kojima, C. 和 Shimamoto, K.
{{:Plant Physiology and Development , Seventh Edition (Lincoln Taiz)}}
(2013) 成花素和受体复合物的结构和功能。Trends Plant Sci. 18: 287–294。
{{学科分类}}
4/29/22 10:24 AM
[[Category :植物生理学]]
幼苗和幼年植物倾向于将更多的光合产物分配给垂直生长而不是横向生长,因为这有助于它们更有效地争夺地上的阳光和地下的水。随着植物生物量的增加,不确定的生长通过额外的芽轴和根轴(shoot and root axes)的出现来维持,这一过程称为分枝。在枝条中,分枝从位于叶腋(腋芽)的芽表面长出,而在根中,分枝则在位于内皮层内侧的一层细胞(称为中柱鞘)中内部开始(见第 1 章)。
分枝的空间排列、角度和形态的变化产生了枝条和根系的结构。枝条结构是一种复杂的适应性特征,它取决于确定性侧生器官(如叶子)的受控生产,以及不确定分枝系统的受控形成和生长。20 世纪中叶的“绿色革命”是全球农业产量急剧增加的时期,这是由于引进高产品种而发生的,部分原因是对主要谷类作物的枝条结构的有意修改(见 WEB TOPIC 19.1)。根拱结构具有类似的复杂程度,这些复杂程度源于不确定侧根的受控形成和生长。这些包括从主根分支出来的侧根,以及从先前形成的侧根分支出来的侧根。一些根系还包括不定根,它们形成于根以外的结构中——例如,单子叶植物和真双子叶植物的地下茎节,以及附生植物的地上茎或枝。
初生生长的一个决定性特征是,除了木质部传导元件之外,初生组织中几乎没有木质化细胞壁。草本植物相对缺乏木质素,限制了它们长得很高或支撑大枝的能力。对于一年生草本植物、二年生草本植物,甚至一些体型较小或依赖其他植物支撑的攀缘植物的多年生植物而言,营养生长阶段完全由初生生长组成。然而,在多年生植物(树木和灌木)中,初生生长很快会接着是次生生长——周长增长。次生生长源于两个形成层的活动:维管形成层,产生次生木质部和韧皮部;木栓形成层,产生周皮,即取代表皮作为茎和根的外部保护层的木栓层(见第 1 章)。另一种类型的次生生长见于乔木型单子叶植物,如棕榈树。棕榈树没有由维管形成层产生的次生木质部(即木材)和韧皮部环,而是在皮层中具有专门的初始细胞,这些细胞产生次生维管束。这些额外的维管束含有木质化木质部,可提供足够的结构加固,使棕榈树长到很高的高度。
在本章中,我们继续第 18 章开始的营养生长调查,研究分枝和次生生长的机制。尽管枝条和根的分枝来自非常不同的结构(分别是腋芽和中柱鞘),但这两种发育途径都汇聚在一个共同的终点:产生新的顶端分生组织,这大大提高了植物生物量的增长率。我们将看到,这两条途径在激素反应和遗传控制机制方面也有关键的相似之处。
我们通过描述一些次生木质部和韧皮部产生的调控途径来结束对营养生长的讨论。次生生长通过大大扩展高度限制,使植物生物量进一步增加。即使在达到物种的高度极限后,树木生物量仍会继续在横向增加,因为维管形成层的活动会持续到树木死亡(见第 23 章)。
开花植物的枝条和花序结构在很大程度上取决于胚后发育期间建立的分枝模式。最原始的分枝类型是二分枝,通常仅存在于非维管植物和非种子植物中,但也出现在仙人掌等几种种子植物类群中。在二分枝过程中,茎尖分生组织 (SAM) 扩大并一分为二,产生两个相等的茎(参见 WEB TOPIC 19.2)。
相反,种子植物的茎结构以称为phytomer[ 1] gravitropic setpoint angle ,即重力器官相对于重力保持的角度 。枝gravitropic setpoint angle的变化会导致各种各样的枝条结构 (图 19.2)。正如我们在第 19.2 节中讨论的那样,树枝生长的角度由遗传和环境因素决定。
图19.3 调节枝条分枝的三种激素的长距离运输:生长素、细胞分裂素和独脚金内酯。生长素主要在幼嫩的展开叶中产生,并通过 PIN1 介导的极性生长素运输向基部运输。独脚金内酯和细胞分裂素主要在根部合成,并可在木质部中向枝条顶端转移。这两种激素也可以在腋芽附近的枝条组织中合成。 一旦腋生分生组织形成,它们可能会进入高度受限的生长阶段(休眠),或者它们可能会被释放以长成腋生分枝。“继续或不继续”的决定取决于发育程序和环境反应,这些反应由充当局部和长距离信号的植物激素介导。激素信号通路的相互作用协调不同分枝和茎尖的相对生长率,最终决定茎的结构。涉及的主要激素是生长素、细胞分裂素和独脚金内酯 (见第 15 章)。这三种激素在根和芽中以不同数量产生,但它们的易位使它们能够在远离合成部位的地方发挥作用(图19.3)。
生长素主要在幼叶和茎尖合成,并通过维管柱和淀粉鞘或内皮层中的 ABCB 和PIN蛋白在专门的极性生长素运输流中向下运输(即在茎中向基部运输,在根中向顶端运输) (参见第 4、17 和 18 章)。生长素也可以在韧皮部中运输,在那里它通过集流从源移动到汇(参见第 11 章)。
独脚金内酯通过质膜 ABC 转运体从合成位点运输出来,并被证明从根部向上移动到茎部。细胞分裂素也通过 ABC 转运体从合成位点运输到木质部,它们也可以在韧皮部中移动。 因此,通过这些激素进行长距离通信的范围相当大。
生长素在调节腋芽生长中的作用最容易在顶端优势实验中得到证明。顶端优势是茎尖对腋芽和下方枝条的控制。具有强顶端优势的植物通常分枝较弱,对去顶的响应强烈。顶端优势弱的植物则具有较多的分支,对去顶的响应弱或无。
一个多世纪的实验证据表明,在顶端优势较强的植物中,茎尖产生的生长素会抑制腋芽的生长。在此类植物中,向根部生长素运输减少的突变体表现出分枝增加,而用生长素运输抑制剂处理茎尖会导致分枝增加。在顶端切除点向枝条添加生长素会抑制其向外生长,而向茎部施用生长素运输抑制剂会使下方的腋芽脱离顶端优势(图 19.4A)。园丁利用这种现象“掐掉”具有强顶端优势的菊花,从而形成密集的圆顶状花丛。
激活侧枝的一个关键要求是其与现有脉管系统的连接。枝条的生长需要从芽中正在发育的叶子中输出生长素。因此,正在生长的芽充当生长素源,将生长素输出到主茎的生长素运输流中,主茎本身由于其运输生长素的能力而成为生长素库。 已经提出了一个理论模型来描述生长素在调节芽生长中的作用(参见 WEB TOPIC 19.3)。也有证据表明蔗糖在此过程中发挥了作用。
图 19.4 生长素和独脚内酯抑制腋芽生长。(A) 经典的生理实验证明了生长素在顶端优势中的作用。在去尖的芽中,腋芽从顶端优势中释放出来。用生长素(吲哚-3-乙酸,或 IAA)替换缺失的芽尖可防止腋芽生长。将极性生长素转运抑制剂 (PAT) 涂抹在茎上会导致芽在施用部位下方生长。(B) 使用在独脚金内酯生物合成或信号传导方面有缺陷的突变体进行嫁接实验,这些突变体的分枝有所增加。将独脚金内酯生物合成突变体 (max1、max3 或 max4) 的枝条嫁接到野生型根上,可将突变体的枝条分枝恢复到野生型水平。将独脚金内酯信号传导突变体 max2 的根嫁接到野生型和合成突变体 max1、max3 或 max4 的枝条上,也可以防止芽的生长,这表明 max2 可以在根部产生信号,即使它无法对其作出反应。分枝抑制激素也可以在枝条中产生,因为将野生型枝条嫁接到缺乏独脚金内酯的根 (max1、max3 或 max4) 上不会增加分枝数量。
独脚金内酯被认为在顶端优势期间与生长素一起起作用。独脚金内酯生物合成缺陷(max1[更多腋芽生长 more axillary growth1]、max3 或 max4)或信号传导缺陷(max2)的拟南芥突变体表现出在没有去顶的情况下的分枝增加(图 19.4B)。将生物合成突变体的芽嫁接到野生型根上可恢复顶端优势,这表明独脚金内酯可以从根部移动到芽部。然而,根衍生的独脚金内酯不是芽抑制所必需的,因为嫁接到缺乏独脚金内酯的根上的野生型芽具有正常的顶端优势。
直接将细胞分裂素应用于腋芽可刺激其生长,这表明细胞分裂素参与了打破顶端优势的作用。与此假设一致,豌豆去顶后,两种细胞分裂素生物合成基因(异戊烯基转移酶 1 和 2 [IPT1 和IPT2]的表达增加,表明来自茎尖的生长素通常会抑制这些基因。通过在有和没有生长素的情况下孵育切除的茎段证实了这一点;IPT1 和 IPT2 表达仅在没有生长素孵育的节段中持续存在。此外,在节间周围施用生长素转运抑制剂 2,3,5-三碘苯甲酸 (TIBA) 导致施用部位以下的 IPT1 和 IPT2 表达增加,表明这些基因通常受到从茎尖向下运输的生长素的抑制。因此,似乎参与打破顶端优势的细胞分裂素是在节点局部合成的。
图 19.5 调节顶端优势的激素网络。来自茎尖的生长素通过 max4 基因促进节区独脚金内酯的合成。在真双子叶植物中,生长素上调 BRANCHED 1 (BRC1) 基因并下调 IPT 基因。BRC1 抑制腋芽生长。独脚金内酯还抑制细胞分裂素的生物合成,否则细胞分裂素会阻止 BRC1 的产生。 图 19.5 显示了细胞分裂素和独脚金内酯之间的拮抗相互作用的简化方案。生长素通过刺激独脚金内酯的合成来维持顶端优势。 在真双子叶植物中,独脚金内酯随后激活 BRANCHED 1 (BRC1) 基因,这是一种抑制腋芽生长的转录因子 。除了激活 BRC1 之外,独脚金内酯还通过负向调节 IPT 基因来抑制细胞分裂素的生物合成 。相反,细胞分裂素抑制 BRC1 的作用,并阻止生长素诱导的独脚金内酯生物合成。水稻中的 BRC1 同源物FINE CULM 1 (FC1) 和玉米中的 TEOSINTE BRANCHED 1 (TB1) 是调控这些作物分枝的主要基因。 TB1 还负责玉米驯化中涉及的一个主要性状,将高度分枝的玉米祖先 teosinte大刍草 转化为更理想的现代玉米分枝减少表型 (图 19.6)。
在某些情况下,植物可以根据环境条件调整其默认的枝条分枝模式。两个典型的例子是避荫反应和营养缺乏反应 。这两种反应都涉及前面描述的调节途径。
植物通过增强枝条伸长和抑制分枝来避免遮荫。避荫涉及光敏色素 B 信号传导 ,以响应当阳光穿过含有叶绿素的绿叶时导致的 R:FR 光比降低。拟南芥的遗传研究表明,光敏色素 B 需要生长素和独脚金内酯信号传导途径和芽特异性 BRC1 和 BRC2 基因来抑制遮荫条件下腋芽的生长。
对营养缺乏的反应由独脚金内酯介导 。营养充足的植物茂密,而在营养贫乏的条件下生长的植物往往分枝较弱。 从进化的角度来说,独脚金内酯参与这种分枝反应可能与这些激素在增强营养吸收方面的作用有关。菌根植物物种将独脚金内酯分泌到根际以促进菌根共生,从而增强营养吸收。 不同物种之间的细节各不相同,但即使在非菌根植物物种中,在低营养条件下,枝条中的独脚金内酯浓度也会升高 。独脚金内酯浓度的增加会抑制腋芽的生长。由于营养不足而减少分枝是一种适应性行为,因为植物能够将其资源集中在主枝和现有枝条的发育上,而不是促进营养供应无法支持的额外枝条的生长。在促进分枝的高氮条件下,根部细胞分裂素的合成上调。多个细胞分裂素生物合成基因发生突变的植物无法在高氮条件下增加分枝,这表明存在功能性联系。
温带地区的许多木本多年生植物在冬季停止生长,并产生休眠的顶芽和腋芽,这些芽受到厚而坚韧的芽鳞的保护(图 19.7A)。 这些芽通常在整个冬季都处于休眠状态。影响芽休眠的主要环境因素包括温度、光照、光周期、水和养分。芽的位置和植物年龄也是重要因素。昼夜节律基因和开花基因(见第 20 章)以及光敏色素 A 参与控制落叶乔木的休眠与光周期和温度的关系。例如,在白杨树中,该系统调节芽中的细胞周期。即使在草本植物中,调节响应光周期而开花的途径也会与调节腋芽生长的途径相互作用。例如,豌豆 (Pisum sativum ) 的独脚金内酯相关分枝突变体在不同光周期下生长时,腋生分枝的位置和数量会发生显著变化,而开花基因会影响拟南芥茎节的分枝。
除了由茎尖分生组织形成的顶芽和腋芽(也称为sequential buds )外,许多树木还会产生附芽accessory buds ,即在正常(即sequential )腋芽附近和额外形成的芽(图 19.7B)。附芽可能形成在连续腋芽的疤痕上或芽鳞的腋窝中。腋芽和附芽可能在次生生长开始后被埋在树皮下。正如我们在第 19.3 节中讨论的那样,这些埋藏的休眠芽可能会在火灾和其他刺激下被激活。
大多数现存维管植物都有根系,可以将它们固定在土壤上并吸收生长所需的水分和养分。通过自然选择,植物根系已经进化出适应土壤成分变化、与其他根系竞争、非生物胁迫和根际生物相互作用的能力。因此,多样性和表型可塑性是根系结构的关键特征,对植物的生存至关重要。最近对根系结构的研究受到根系表型研究进展的推动(参见 WEB TOPIC 19.4)。这些研究和其他研究表明,植物已经进化出复杂的控制机制来调节根系结构。根系结构是整个根系在土壤中的空间配置。更具体地说,根系结构是指植物根系在三维土壤空间中单个根的几何排列。根系由不同的根类型组成,不同的植物物种能够控制它们产生的根的类型以及它们的生长速度、分枝程度和生长角度。
从现有根中长出的胚后根称为 lateral or branch roots ,而从非根组织中长出的根称为不定根adventitious roots 。一般来说,单子叶植物(如禾本科)具有主要由不定根组成的纤维根系,而不定根又会产生丰富的侧根。相比之下,拟南芥等真双子叶植物通常只产生一个显性主根或主根,从而产生所有侧根及其分支。
在枝条中,叶原基和腋芽原基周期性地在顶端分生组织的侧面以螺旋排列或其他精确模式开始 - 这种现象称为叶序(见第 18 章)。侧根原基在生长根的分化区开始(见第 18 章)。侧根沿根表面的排列称为根系趋向,由内源性和环境因素共同决定。
在根生长过程中,发育区(分生 [细胞分裂]、伸长和成熟 [分化])通过在生长尖端添加新细胞而向上移动(见图 19.9A)。因此,发育中的侧根通过成熟区向根的完全成熟区域移动。(请注意,发育中的侧根不会改变其相对于根基的位置。)此过程在生长尖端附近最年轻的侧根原基和根基附近最老的侧根之间产生发育梯度。
图19.8 不同类型的初生木质部、初生韧皮部在根中的排列。 在包括拟南芥在内的大多数植物中,侧根仅在柱鞘中开始,柱鞘是位于内皮层内的组织(见第 1 章)。根部维管组织的排列方式可分为二元(拟南芥)、三元、四元等,具体取决于木质部臂(xylem arms)的数量,而木质部臂的数量与原生木质部束的数量相对应(图 19.8)。韧皮部极中柱鞘细胞phloem pole pericycle 是位于韧皮部束附近的中柱鞘细胞,而木质部极中柱鞘细胞xylem pole pericycle 则位于木质部臂的尖端附近。在拟南芥和大多数其他真双子叶植物和非禾本科单子叶植物中,侧根起始仅发生在木质部极中柱鞘细胞中,而在禾本科植物(例如玉米和大麦)中,侧根起始仅限于韧皮部极中柱鞘细胞 。 这种差异提出了一个重要的问题:木质部极(大多数被子植物)或韧皮部极(某些单子叶植物)的中柱鞘细胞是如何与其他中柱鞘细胞区分开来的。由于该领域的大部分研究都是在拟南芥上进行的,因此我们将重点研究木质部极中柱鞘细胞发育成侧根的过程。
侧根原基在中柱鞘中从侧根创始细胞( lateral root founder cell,木质部极中柱鞘细胞的一个子集)中产生 。在创始细胞特化之前,侧根发育涉及不可见的细胞变化,这些变化使木质部极中柱鞘细胞成为创始细胞。这些不可见的变化可能在细胞从分生区进入伸长区时分阶段发生。例如,有证据表明,当木质部极中柱鞘细胞和韧皮部极中柱鞘细胞仍处于根尖分生区时,它们的基因表达模式开始类似于它们各自的维管组织。然而,无论分生区发生什么变化,木质部极中柱鞘细胞在到达伸长区之前都无法完全分化为侧根创始细胞。
图 19.9 拟南芥的侧根发育。(A) 主根的纵切面,显示其发育区域。前分支位点在振荡区内生长素反应基因表达的振荡阶段之后形成,如果给予适当的信号,侧根将在这里形成。振荡区赋予木质部极周细胞分化为侧根创始细胞(浅蓝色)的能力。(B) 主根的横截面。振荡生长素反应发生在原生木质部(红色);然而,由于侧根起始发生在相邻的木质部极周周期细胞(橙色)中,因此可能需要这两种细胞类型之间的信号传导才能规范落叶根起始细胞。(C) 根的一小部分的纵切面,显示侧根的起始和发展。特定的木质部极周细胞(橙色)被指定为侧根创始细胞(LRFC;浅蓝色),然后被激活以进行细胞分裂(深蓝色)。活动导致一对垂直堆叠的 LRFC 的细胞核向它们共享的细胞壁迁移。然后这些细胞经历不对称的背斜分裂,产生几个较小的细胞(深蓝色)。持续的背斜和周围分裂产生侧根原基 (LRP)。LRP 生长,穿过外侧的细胞层,直到它从表皮中出现。根部中木质部极柱中柱鞘细胞完全有能力成为创始细胞的位置称为分枝前位点 prebranch site ,大致对应于成熟区的开始(图 19.9A)。正是在这里,一些木质部极柱中柱鞘细胞(图 19.9B)经历了启动(priming) ,这使它们成为侧根创始细胞(图 19.9C)。当新的侧根原基在分支前位点进行启动时, it is being displaced in the shootward direction. 。新的侧根创始细胞会定期分化形成新的分支前位点,只要主根继续生长,这个过程就会重复。
侧根的形成可以分为四个不同的阶段:
I. 侧根创始细胞的分化 ,它决定了分支前位点沿根部的位置
II.侧根起始 ,涉及侧根创始细胞中的核迁移和不对称及垂周细胞分裂
III. 侧根原基形成 ,产生垂直于亲本根的新根顶端分生组织
IV. 侧根冒出表面 ,涉及侧根原基与周围组织之间的相互作用,从而允许穿过上覆细胞层并出现新的侧根
鉴于其对根系结构的重要性,创建前分支位点所涉及的机制已受到广泛关注。例如,现在有大量证据表明,前分支位点的指定需要生长素,并且主要发生在振荡区oscillation zone 。已经提出了一种生长素时钟模型来解释前分支位点的间距。简而言之,该模型提出,分枝前位点的间距由振荡区中生长素活性或生长素浓度的周期性振荡调节,振荡区大致从分生区中部延伸到 紧接着成熟区下方。根据该模型,只有暴露于生长素最大值(活性或浓度)的细胞才有能力形成前分支位点(参见 WEB TOPIC 19.5)。
在拟南芥中,几个垂直的创始细胞 files参与侧根生长的起始阶段。侧根创始细胞激活的第一个可见迹象是核向files中两个相邻的侧根创始细胞之间的细胞壁迁移,随后两个细胞中都发生 formative细胞分裂 (参见图 19.9C)。 formative分裂是一种不对称的细胞分裂,其中两个子细胞获得不同的细胞命运。 侧根起始定义为第一次 formative分裂完成并且子细胞命运已确定时完成。侧根发育的这个阶段称为第二阶段。第二阶段还包括激活特定转录因子基因,这些基因是原基形成各个阶段协调所必需的。例如,PLETHORA (PLT) 转录因子家族的成员对于调节侧根形成的所有起始后步骤至关重要(见第 18 章)。
侧根原基的形成标志着侧根开始生长。细胞生长和几轮增殖(垂向、周向和切向)细胞分裂相结合,产生了一个圆顶状的原基,在侧根生长的最后阶段,原基作为侧根出现。新生原基上方的皮质和表皮组织会产生细胞壁软化酶,使其朝着根表和土壤的移动变得容易 。一旦新的分生组织完全形成,它就获得了合成自身生长素的能力。因此,出现的侧根具有功能性的根尖分生组织(RAM),包括一个静止中心和周围的初始细胞,这些细胞会产生生长侧根的所有组织。
单子叶植物和真双子叶植物的根系结构大致相似,由胚根衍生的初生根(胚根)、侧根和从茎节衍生的不定根组成。然而,它们的根系也存在显著差异。单子叶植物的根系,尤其是谷类植物的根系,通常比真双子叶植物的根系更复杂。例如,玉米幼苗根系由从胚根radicle 发育而来的初生根primary root 、从盾片节分支的种子根seminal roots 和从茎的最下部节点分支的胚后衍生的冠根 crown roots 组成,冠根也称为不定根(图 19.11)。主根和种子根形成纤维根系统,高度分枝的系统,具有许多细侧根。冠根在幼苗中相对不重要,相比之下初生根和种子根持续在营养生长期间形成,发展和分支。
(A)Root system of a 14-day-old maize seedling composed of primary root derived from the embryonic radicle, seminal roots derived from the scutellar node, postembryonically formed crown roots that arise at nodes above the mesocotyl, and lateral roots. (B) Mature maize root system 一种特殊的冠根,即支柱根,从土壤表面上方的节点出现 。 支柱根具有独特的形态,被认为可以为较大的植物提供结构支撑。冠根系统占成年玉米植株根系的绝大部分(见图 19.11B)。
幼年真双子叶植物的根系由 primary root (or taproot)及其分枝根组成。随着根系的成熟,基根 basal roots 从主根最老的部分(靠近与芽的连接处)产生。此外,不定根可以从地下茎或下胚轴产生;这些根与谷物中的不定冠根大致类似。图 19.12 显示了作为代表性真双子叶植物的大豆植物的根系,其中可以看到主根、分枝根、基根和不定根。
如第 19.1 节所述,芽系统和根系统的各种组成部分往往以特征性的重力设定点角度生长。按照惯例,垂直向下生长的主根的重力设定点角度为 0˚,而垂直向上生长的主枝的重力设定点角度为 180˚。侧枝和根的设定点角度往往偏离垂直方向。
在出现后,侧根尚未形成伸长区,这意味着它们无法进行重力弯曲。因此,新出现的侧根最初会以垂直于重力的角度远离主轴生长 。这种水平生长有助于沿径向扩展根系,增加营养物质的获取并稳定植物。一旦侧根形成了伸长区,它们就会以预定的重力设定点角度弯曲,并以相同的角度继续生长一段时间,这段时间称为平台期。一般来说,早期侧根的生长平台期比晚期侧根长。最终,另一种重力反应开始起作用,导致第二次弯曲,向下生长更加明显,角度在 0˚ 到 30˚ 之间。
一般来说,如果重力反应枝(根或枝)从其重力设定点角度被向上或向下机械位移,它将经历向性生长,使其回到重力设定点角度。这意味着具有非垂直重力设定点角度的侧根可以呈负重力性,即逆重力矢量生长。相反,非垂直枝条可以呈正重力性,向下生长 。这一观察结果简单地证明了维持重力响应非垂直生长的机制基础不能仅仅在于初级器官和侧生器官之间向重力性能力的差异。一定还有另一种未知的机制可以驱动侧根向上生长和侧芽向下生长。
已经确定了几种调节因子,它们影响侧生器官在芽和根以及不同植物门中的重力设定点角度。这些蛋白质属于 IGT 家族,以高度保守的 IGT 氨基酸基序命名 。该家族有三个不同的分支,LAZY、DEEPER ROOT-ING (DRO) 和 TILLER ANGLE CONTROL (TAC), 它们以不同的方式增加或减少根和芽侧生器官的生长角度(图 19.13)。破译这些转录因子的功能应该有助于揭示控制重力设定点角度的机制。操纵这些机制可能对提高作物产量和恢复力很有价值。例如,在水稻中,几种 IGT 转录因子基因座的遗传变异与重要的农艺性状有关:DRO1 可使根系更深,从而提高耐旱性;DRO1-LIKE 1 可增强土壤表面根系,从而提高耐旱性nce 适合盐渍土和涝渍土;TAC1 适合最佳枝条分枝角度,从而促进密集种植田地的光合作用。
根系结构在物种内具有高度可塑性,因为植物可以调节根系发育以优化水和养分吸收(见第 7 章)。例如,土壤中的水分异质性可能是由气穴或土壤水势变化引起的,就像在部分干燥期间或响应盐度梯度时发生的那样。这种异质性可以刺激根系定向生长到湿度较高或水分充足的区域,这种行为称为向水性(见第 17 章)。如第 7 章所述,植物根部通常会形成菌根共生体,可以增强养分吸收,尤其是在磷酸根离子的情况下。这种关联通常涉及解剖学和形态学变化,以促进根系与其真菌共生体之间的营养交换。植物根系也可以与固氮细菌形成共生关系,如第 14 章所述。
所有裸子植物和大多数真双子叶植物(包括木本灌木和树木以及大型草本植物)都会发育出侧生分生组织,导致茎和根的径向生长(宽度增长)。侧生分生组织引起的周长增长称为次生生长(图 19.14),它有助于木本植物的不断增大,使其变得更厚实、更健壮。据估计,木材占世界生物量的一半以上,森林生物群落为世界约 80% 的生物多样性提供了家园。
负责次生生长的维管形成层的发育在维管植物的进化过程中反复发生(参见 WEB TOPIC 19.6) 。木材由具有增厚的次生细胞壁的次生木质部组织组成,其形成是动态和连续的。从生理学上讲,木材具有运输、储存和机械功能,木材对各种环境因素的反应反映了促进这些功能的变化。 (有关适应性次生生长对环境压力的反应的讨论,请参阅 WEB TOPIC 19.7。)
次生生长由两种类型的侧生分生组织的活动产生:维管形成层,产生次生维管组织,以及木栓形成层,产生次生植物体的外部保护层,称为周皮(图 19.15A)。维管形成层和木栓形成层通常排列成同心圆柱体。然而,其他形式的次生木质部生长已经进化,产生了各种其他形状。这些形状可能具有适应性,如藤本植物参见 WEB TOPIC 19.8)。
由维管形成层产生的次生木质部和韧皮部使植物能够调节长距离运输能力,并适应不同的生态位和环境变化。由木栓形成层产生的周皮更浅,可保护植物免受生物和非生物胁迫并防止水分流失。这两种组织都增加了机械支撑,被认为是高大、健壮植物进化的关键解剖学创新。这样的植物可以活得更长,并且可以选择较少地繁殖,只有在条件最佳时才会这样做。
裸子植物和真双子叶植物从初生生长到次生生长的转变在枝条轴线上清晰可见。杨树(Populus spp.),初次生长发生在顶部八个节间,距离茎尖分生组织 (SAM) 约 15 厘米。初次生长随后让位于次生 (木质) 生长,产生次生木质部和次生韧皮部(见图 19.15A)。初次和次生生长区在空间和时间上都是分开的,很容易辨别,并且在杨树等速生树种中发育迅速(1-2 个月内)。
与末端定位的 SAM 和 RAM 相反,维管形成层呈现出非常独特的分生组织组织,该组织几乎沿着植物顶端-基轴的整个长度延伸,并起到沿径向轴产生维管组织的作用。维管形成层由初始细胞(形成层初始细胞)组成,这些细胞以径向排列,形成围绕茎的连续圆柱体。形成层初始细胞分裂产生木质部、韧皮部和射线(稍后讨论)的母细胞,这些母细胞又经过几轮分裂形成形成层区,这是一个相对未分化的细胞区,每个径向细胞列的细胞数量不等。这些细胞在离开形成层区时分化成几种不同的细胞类型。
维管形成层显示两种主要分裂模式 - 垂周anticlinal (垂直于茎表面)和平周periclinal (平行于茎表面)(见图 19.15B)。垂周分裂向形成层添加了更多细胞,以适应茎的不断增加的周长,并被认为表明了形成层初始细胞的位置 ,否则从形态上讲,形成层初始细胞与形成层区中的其他细胞难以区分。垂向分裂的峰值通常位于靠近韧皮部的第一或第二个细胞列内,通常用于确定维管束形成层的大致位置。虽然其他分生组织只在一侧产生细胞,但参与次生生长的两个侧生分生组织都是bifacial的,在两侧都形成新细胞 。维管形成层向内产生木质部,向外产生韧皮部(见图 1.5),而正如我们在本节后面讨论的那样,木栓形成层向外产生木栓层,向内产生栓内层。
除了韧皮部和木质部细胞外,维管形成层还产生射线细胞,这些薄壁细胞充当茎内横向运输的管道,并在冬季休眠等不利条件下储存。射线细胞可以排列成一列(单列)或多列(多列),形成一种称为射线的组织,它穿过韧皮部、形成层和木质部(见图 19.14)。
树木面临的一个独特挑战是气候季节性,这会对树木在长期(季节性)不利或潜在致命条件下的生存构成风险,例如温带和寒带地区冬季遇到的条件。为了在冬季忍受脱水和冰冻压力,树木进入休眠期。维管形成层每年在活跃生长和休眠之间交替,形成年轮,记录树木每年的横向生长量。控制生长-休眠周期中维管形成层生长的分子机制尚不明确,但植物激素如生长素和赤霉素被认为起着主要作用。
虽然维管形成层负责木本植物的多年生生长模式,但许多草本植物也有维管形成层,尽管其形成通常是有条件的(例如,对压力的反应)或非常短暂。拟南芥虽然体型较小且为草本植物,但在several器官中表现出显着的次生生长,并且已被证明对于研究形成层发育和木材形成的分子基础非常有用。
在二次发育开始之前,年轻的拟南芥根具有形成层的前体细胞(原形成层 procambium),位于原生韧皮部和原生木质部之间 (图 19.16A)。产生原形成层细胞的分裂由移动的PHLOEM EARLY DOF(PEAR)蛋白——在 protophloem sieve element precursor细胞中表达的转录因子——通过细胞分裂素介导。PEAR蛋白随后移动到围绕着筛分子前体的细胞中,激活其分裂潜能,在 inner vascular cylinder中产生原形成层细胞。
(A)在幼根中,原形成层细胞将原生韧皮部和原生木质部分开,形成维管柱。在老根中,维管形成层被启动以产生新的韧皮部和木质部。 (B) 在较老的根中,生长素浓度较高的木质部细胞充当维管形成层的组织者,而 HD-ZIP III 蛋白使它们保持静止状态。未知信号从初始细胞组织者传递到相邻细胞,以指定它们为初始细胞,这些细胞表达 ANT 并分裂以在内侧产生木质部,在外侧产生韧皮部。模型中仅描绘了导致木质部产生的事件:从分裂区静止区 HD-ZIP III 双面干细胞产生韧皮部的机制未知,因此未在图中显示。 (C) 在较年轻的根中,PEAR 转录因子从具有高浓度细胞分裂素的原韧皮部筛管元素前体细胞传递到相邻细胞,其中 PEAR 促进细胞分裂,形成原形成层细胞并导致径向生长。正在发育的维管柱的更多中心细胞中生长素的高浓度和 PEAR 蛋白的存在激活了 HD-ZIP III 转录因子的转录,这些转录因子阻止了 PEAR 向相邻细胞移动,从而限制了分裂区。 原形成层细胞中的生长素和 class III homeodomain-leucine zipper transcription factors (HD-ZIP) 阻止了 PEAR 的进一步移动,从而形成了一个细胞分裂较少的静止区,与原生木质部相对应。因此,根尖中的原生韧皮部筛管分子前体细胞充当侧生分生组织的组织者,侧生分生组织通过平周细胞分裂产生原形成层细胞,在次生生长被激活之前预先形成径向生长。
次生生长发生在根部较成熟的部分,靠近根-下胚轴连接处(见图 19.16A)。谱系追踪实验已确定成熟根维管形成层的初始细胞组织者是原生木质部细胞(图 19.16B) ,而不是幼根中的原生韧皮部细胞。 与根尖一样,组织者细胞是静止的,由生长素反应最大值定义 。 HD-ZIP III 转录因子参与指定木质部身份,也负责组织者的静止,但这些转录因子的存在不足以自行建立形成层。相反,维管组织内生长素信号的局部峰值足以重新指定新的形成层组织者(见图 19.16B)。这是一个重要的特征,因为与其他分生组织中的组织者相反,形成层组织者是动态的。当木质部细胞经历程序性细胞死亡以分化为木质部导管时,先前的组织者被获得组织者身份的初始细胞取代,从而确保维管形成层的维持(参见 WEB TOPIC 19.9)。组织者在韧皮部细胞形成中的作用仍不太清楚。
充当组织者的木质部细胞向相邻细胞发送移动信号(见图 19.16B,虚线箭头),使它们具有干细胞能力。所有与木质部有物理接触的细胞(木质部原形成层细胞和木质部极柱中柱细胞)都可以成为初始细胞并产生维管形成层。与木质部直接接触的要求表明,作为初始细胞发挥作用的能力取决于细胞位置和在二次分化期间从组织者接收到的信号二次发育。谱系追踪实验已证实,每个径向细胞files中的单个双面初始细胞(以转录因子AINTEGUMENTA(ANT)的表达为标志)能够分裂,交替产生韧皮部和木质部前体。
次生生长期间的生长和发育模式受与调节SAM和RAM发育的过程和基因相似的过程和基因控制(见第18章)。这种相似性有助于从分子上解析控制次生生长的机制。
图 19.17 利用小肽和 WOX 类转录因子之间的调节相互作用的三种不同模式化过程的比较。(A) WUS 促进 SAM 中的顶端初始。 (B) WOX5 促进 RAM 中的初始。 (C) WOX4 促进维管形成层中的初始。 正如我们在第 18 章中看到的,SAM 和 RAM 中原始细胞的活动都依赖于 WOXs的活动:WUSCHEL (WUS) 促进 SAM 中初始基因的活动(图 19.17A),而 WOX5 有助于 RAM 中初始基因的功能(图 19.17B) 。维管形成层似乎依赖于类似的机制,即形成层的维持取决于 WOX4 的活性(图 19.17C) 。WOX4 的激活促进原形成层和形成层细胞分裂,并且是形成层分生活动所必需的(图 19.18A)。在具有广泛次生生长的植物中,例如杨树,缺乏 WOX4 表达的植物具有较窄的形成层和减小的茎周长。与 WUS 和 WOX5 一样,WOX4 也通过小肽与受体激酶的相互作用进行调节。在这种情况下,受体激酶是PHLOEM INTERCALATED WITH XYLEM/TDIF RECEPTOR (PXY/TDR)(见图 19.18A),优先在原形成层和维管形成层中表达,而 CLAVATA3/胚胎周围区域相关 (Embryo Surrounding Region-Related,CLE) 肽在韧皮部中表达。 然而,与顶端分生组织不同,CLE 肽的表达促进了 WOX4 活性,而不是抑制它。
初始细胞维持、增殖和分化也需要空间分离,这是通过定义发育边界的转录因子实现的。在 SAM 中,具有此功能的一类转录因子是侧器官边界 (LBD) 家族。LBD 基因有助于在 SAM 中未分化细胞与叶原基分化组织之间建立边界。LBD 家族成员通过将形成层区与分化的次生韧皮部和木质部分开,在次生生长中发挥类似作用。pxy 突变体的一种表型是韧皮部和木质部层相互插入(即,一层韧皮部可以插入两层木质部之间,反之亦然)。 PXY 调控的基因之一是 LBD4,它也受 WOX14 和 TARGET OF MONOPTEROS6 (TMO6) 控制,并促进韧皮部的形成(见图 19.18A)。LBD4 在韧皮部-原形成层边界表达,可能参与定义此边界。同样,主要在韧皮部和形成层中表达的 LBD1 被发现可促进杨树中次生韧皮部的形成。
包括 WOX4、SHORTVEGETATIVE PHASE (SVP) 和 PETAL LOSS (PTL) 在内的几种转录因子在调节形成层细胞增殖和木质部分化方面具有双重功能。当形成层激活剂 WOX4 的过度表达与 PTL 形成层抑制剂的去除相结合时,产生的双突变体表现出增强的径向生长(图 19.18B)。
图 19.18 可以通过修改关键转录因子的表达来增强径向生长。 (A) WOX4 和 BP 促进形成层增殖 和木材生产,这种刺激在 PETAL LOSS (PTL) 发生突变的植物中可以进一步增强,PTL 编码一种 MYB 样转录因子 ,可作为径向生长的负调节剂。LBD4 有利于韧皮部的形成。 (B) 钌野生型 (WT) 植物和在野生型 (WOX4-OE) 和 ptl (WOX4-OE/ptl) 背景中过表达 WOX4 的植物的红染拟南芥根部横截面。在此发育阶段,表皮和皮层已被周皮和次生维管组织取代。请注意 WOX4-OE/ptl 根部的径向生长要大得多。19_Taiz7e-Ch19.indd 5834/4/29/22 10:22 AM584 尽管顶端分生组织和形成层分生组织之间存在广泛的相似性,但也存在显着差异。例如,两个激酶受体家族 PXY 和 ERECTA 在遗传上相互作用以指导次生维管发育。然而,这两个基因家族之间的相互作用在茎和下胚轴中的连接方式不同,导致每个器官的表型不同。
与植物中的许多其他过程一样,激素在调节次生生长方面发挥着重要作用。几种激素为不同细胞类型和组织的生长和分化提供位置提示和信号(图 19.19)。这里我们重点关注四种激素,因为大量的实验证据支持它们在调节次生生长中的作用。
虽然树木中的生长素运动尚未得到广泛研究,但据推测生长素是在叶子和顶端分生组织中产生的,并通过极性生长素运输到茎和维管形成层。在被子植物和裸子植物的维管形成层和分化木质部和韧皮部中,都测量了生长素浓度。与最近确定的指定拟南芥形成层组织者的生长素反应最大值类似,树木中的生长素浓度峰值出现在形成层的木质部表面,并朝着分化木质部和韧皮部的方向降低。朝向韧皮部的下降幅度更大,而朝向木质部的下降幅度则要平缓得多。这种跨越形成层带的生长素浓度梯度导致人们推测,生长素在木质部和韧皮部分化中的作用是基于径向形态发生素梯度的。
外源处理也支持了生长素的关键作用,表明在去顶树中施用生长素会诱导形成层的重新激活,而这棵去顶树的维管形成层本来已经失去活性。最近,直接操纵转基因杨树中生长素的反应表明,生长素敏感性对于形成层的平周分裂和垂周分裂都至关重要,并影响木质部细胞的生长和分化。
赤霉素在次生生长中也发挥着重要而独特的作用。与生长素一样,生物活性赤霉素在木材形成区表现出浓度梯度,但与生长素不同的是,峰值移动至发育中的木质部中。用赤霉素对缺乏生长素的去顶幼苗进行外源处理可激活形成层细胞分裂。然而,分裂细胞失去了其典型形状,无法分化成木质部。同时施用生长素和赤霉素可防止在单独使用赤霉素处理时观察到的异常,并刺激形成层分裂,其程度是单独使用赤霉素或生长素处理时未观察到的,这表明两种激素具有协同作用(见图 19.19) 。 赤霉素生物合成途径中几种基因的代谢谱和表达表明,木材形成组织中的赤霉素代谢还涉及赤霉素前体从韧皮部横向通过射线运输到分化木质部,然后在那里转化为生物活性形式。外源处理和转基因操作均表明赤霉素对纤维细胞的伸长有积极影响,纤维细胞在植物中具有结构功能,具有厚的细胞壁和高的长径比(见第 1 章)。这表明赤霉素在木质部细胞分化和生长中起着作用。
细胞分裂素也与调节次生生长有关(见图 19.19)。转基因杨树形成层区细胞分裂素浓度的特定降低导致严重损害径向生长和形成层的细胞分裂。该结果与细胞分裂素浓度在形成层的韧皮部侧达到峰值以及编码细胞分裂素受体和参与细胞分裂素信号传导的主要反应调节剂的基因在形成层区的表达有关。 这表明细胞分裂素是形成层细胞增殖的重要调节剂。
乙烯是另一种激素,它被强烈地暗示为次生生长的调节剂。发现乙烯前体 1-氨基环丙烷-1-羧酸 (ACC) 的浓度在形成层区很高,但与生长素和赤霉素不同,没有检测到梯度 。乙烯处理和 ACC 喂养实验表明乙烯是形成层活动、径向生长和次生木质部形成的正调节剂。 这些结果也与转基因操作杨树乙烯生物合成和响应的结果一致。乙烯在应拉木的形成中起着重要作用, 应拉木是被子植物中一种特殊的反应木,在茎弯曲或倾斜引起的组织中形成(参见 WEB主题 19.7)。乙烯生物合成和信号基因的表达在应拉木形成区均升高,对乙烯不敏感的转基因杨树无法产生应拉木。
大多数木本真双子叶植物和裸子植物都会形成一种称为木栓形成层的次生形成层,从而产生周皮。周皮在次生生长过程中取代了表皮的保护功能。周皮由木栓形成层、木栓层和木栓内皮组成(图 19.20A)。木栓层( Phellem, or cork)是具有木栓化壁的死细胞的多层保护组织,由木栓形成层向外形成。栓内层phelloderm是向内形成的活薄壁组织。
木栓形成层产生的木栓量因树种而异,栓皮栎 (Quercus suber) 代表了一个极端的例子,它包含一个永久的木栓形成层,可以无限期地产生软木或木栓。由此产生的厚厚的软木层可能保护栓皮栎的主干免于在炎热干燥的地中海气候中脱水。它也是一种极好的绝缘体,密度低,渗透性好,用于建筑、服装和葡萄酒保存。软木塞可防止葡萄酒污染,并允许少量氧气渗透,刚好足以保持葡萄酒的发酵,同时避免氧化。周皮还可以防止病原体渗透,方法是简单地用额外的层加厚表面屏障,或通过增加栓化作用(如凯氏带的情况;见第 4 章)或其他活性代谢物的含量。
虽然周皮在枝条中直接起源于表皮下,但在根中,它的起源更深,来自中柱鞘,中柱鞘被三个同心组织层(内皮层、皮层和表皮层)包围。通过谱系追踪实验,可以确认所有中柱鞘细胞都对木栓形成层谱系有贡献(图 19.20B),这意味着木质部极中柱鞘细胞既是维管形成层又是木栓形成层的初始细胞。木质部极中柱鞘细胞的可塑性非常显著,因为除了对两种次生分生组织有贡献外,它们还在植物组织培养中产生再生愈伤组织,并在某些物种中产生侧根(尽管侧根有时可以从其他中柱鞘细胞衍生) 。
当根部木质部极中柱鞘细胞平周分裂,层数增加时,内皮层细胞开始变平(见图 19.20A,第 1 阶段)。在韧皮部极中柱鞘侧,内皮层细胞在第 2 阶段启动程序性细胞死亡,然后随着新分生组织的进展逐渐死亡。在内皮层已经消失且存在木栓化(分化)木栓的区域,皮层和表皮细胞开始脱落,可能是通过abscission ,因为这些细胞仍然活着(第 3 和第 4 阶段),导致以前的保护层逐渐消失。第 5 阶段最终形成完整的分化木栓层,表皮完全消失,而任何剩余的皮层和内皮层在第 6 阶段被消除。有趣的是,侧根的出现也涉及程序性细胞死亡和abscission的结合(见第 18 章)。现在正在揭示周皮形成背后的调控网络,这将表明分子机制是否也得到了保留。
树木的外部保护层通常被称为树皮bark 。这个术语经常被错误地单独用于周皮,实际上包括维管形成层以外的所有组织,包括功能性次生韧皮部、破碎的非功能性次生韧皮部、破碎的初生韧皮部和周皮。 因此,树皮起源于两种不同的分生组织,即木栓形成层和维管形成层。 树皮往往很容易从树上剥落,因为维管形成层及其分裂细胞层比两侧的次生组织脆弱得多。尽管这种组织阵列对于保护韧皮部和保护木本植物免受生物和非生物威胁非常重要,但树皮的组成和控制其形成的遗传途径尚不明确,主要是因为不同物种之间的树皮高度多样化。例如,在某些树木中,如橡树,树皮厚而有裂纹,而在其他树木中,如樱桃树和桦树,树皮则光滑。树皮也可能有不同的颜色,即使是在密切相关的树种之间也是如此。
树皮所含的次生代谢物的种类和数量也各不相同。虽然植物产生这些物质是为了防御机制,但人类也发现它们很有用。树皮衍生药物的经典例子是防腐和抗炎水杨酸(来自柳树) 、抗疟药奎宁(来自金鸡纳树) 和化疗药物紫杉醇(来自太平洋红豆杉) 。最近的一项研究分析了桦木科不同物种树皮中的基因表达和代谢物,发现桦木醇(造成白桦树呈白色的三萜) 在该科的其他物种(如黑桤木)中含量要少得多。该研究还强调了木栓层在产生植物防御的次生代谢产物方面的重要性,因为许多相关的代谢途径都在这种组织的形成中发挥作用。
树皮还可以作为储存器官。生长季节性对多年生植物在养分利用、储存和循环利用方面提出了重大挑战。尽管所有植物物种在生长季节都有循环、储存和重新动员养分的机制,但氮(最丰富的常量营养素)的季节性循环是多年生生命习性的标志。例如,衰老叶片中的氮以树皮储存蛋白( bark storage proteins ,BSP)的形式储存在韧皮部薄壁组织(inner bark)的小液泡中。 这些蛋白质在秋季初合成,但在春季随着生长重新开始而迅速动员。
在第 19.2 节中,我们区分了 branch roots(在中柱鞘内部出现)和branch shoots(从叶腋的外部芽出现)。然而,有些类型的分枝可以从位于树干树皮下的epicormic buds产生。epicormic buds ,来自希腊语,意为“在树干上”。在老树的树干和树桩上,长出嫩枝和“茎芽”(没有顶芽时产生的侧芽),这种现象在被子植物和针叶树中很普遍,在塑造树木结构方面发挥着重要作用。对于适应易发生火灾的生态系统的树木来说尤其如此,例如生长在澳大利亚草原和森林中的桉树。桉树有能力在严重烧伤后长出大量嫩芽(图 19.21A)。与腋芽不同,嫩芽通常能在火灾中存活下来,因为它们被树的厚厚的树皮层与高温隔绝(图 19.21B)。
Epicormic branches可由两种epicormic buds产生:预防芽preventitious buds,即在次生生长期间保持休眠状态并被树皮覆盖的腋芽;不定芽adventitious buds,即从成熟茎组织或伤口处的愈伤组织中新生的芽。后者的一个例子是红木树瘤redwood burls,它在树干地上部分因受伤而形成。相反,在树根处形成的红木树瘤是由大簇腋芽产生的,这些腋芽开始在子叶腋中形成,然后蔓延到上方的叶腋。这会引起肿胀和次生生长,从而形成基节。这些基节充满了预防外生芽簇,它们可以在火灾后或主干被砍伐后再生出新树。
第二章 细胞壁:结构,功能和其扩张
第四章 信号和信号转导
第九章 光合作用:光反应
第十章 细胞膜的结构
第十二章 韧皮部中的运输
第十四章 无机营养的吸收
第十六章 阳光带来的信号
第十八章 营养生长和器官形成:植物轴向的初生生长
第十九章 营养生长和器官形成:分支和次生生长
第二十章 成花和花部发育的调控
第二十一章 有性生殖:从配子到果实
第二十二章 胚胎形成:植物结构的起源
第二十四章 生物相互作用
↑ Some authors use the alternative term metamer.